Co by měl kardiolog vědět o léčbě psychofarmaky
Funkce kardiovaskulární a centrálně nervové jsou regulovány stejnými působky: monoaminy, acetylcholinem, některými hormony a imunitními cytokiny (interleukiny). Jde o oblast, která ukazuje, jak je separátní studium centrálních regulací v rámci historicky vzniklých oborů (neurofyziologie, endokrinologie a imunologie) dnes kontraproduktivní a jak je potřebná integrace, ke které dochází teprve v poslední době. Článek poukazuje na jistou protichůdnost administrativních důsledků medicíny založené na důkazech (vycházející zpravidla ze statistického zpracování velkých souborů nemocných) na jedné straně a personalizované lékařské péče na straně druhé. Stručně jsou probrány prakticky nejdůležitější interakce mezi psychofarmaky a léky užívanými v kardiologii. Nejznámějším léčebným problémem, který vyvstává jak před kardiologem, tak před psychiatrem a ohrožuje především ženy vyššího věku, jsou tachyarytmie typu torsades de pointes vzniklé po léčbě antidepresivy či antipsychotiky.
Úvod
Každé vážné onemocnění je onemocněním celého člověka i jeho společenského prostředí. Můžeme to ilustrovat na následujícím příkladu: infarkt myokardu i depresivní porucha patří mezi onemocnění, která zpravidla změní homeostázu interpersonálních vztahů v rodině i na pracovišti. Legitimní je sice zkoumat, zda infarkt myokardu byl příčinou deprese, nebo zda deprese byla příčinou infarktu (infarkt myokardu se častěji vyskytuje u depresivních nemocných než u kontrolní populace), a nevyhneme se uvažování typu post hoc, ergo propter hoc, ale naše rozhodování o léčbě to nijak neusnadní. Především bychom neměli ztrácet čas: při splnění diagnostických kritérií středně těžké nebo těžké depresivní poruchy je třeba začít podávat antidepresivum (zpravidla selektivní inhibitor zpětného vychytávání serotoninu, SSRI) co nejdříve.
Společným jmenovatelem účinku léčiv působících na kardiovaskulární systém a psychofarmak je ovlivnění regulací na úrovni vazby ligandu na vazebné místo receptoru, bez ohledu na to, zda je ligandem neurotransmiter, hormon, nebo cytokin. Dělení lékařských oborů na psychiatrii, neurologii, neurofyziologii, endokrinologii a imunologii si vynutila praxe a mohlo být z jistých hledisek užitečné, dnes však – alespoň ve výzkumu – patří historii.
Pokud jde o vlastní působení, léčiva užívaná v kardiologii a psychofarmaka mají řadu společných principů. Vyplývají z toho jak interakce farmakodynamické (metabolický syndrom, k jehož rozvoji velmi pravděpodobně přispívá druhá generace antipsychotik více než generace první, patří mezi aktuální problémy), tak interakce farmakokinetické; ty se dnes řeší v praxi na pozadí polypragmazie, která se netýká jen seniorů a zdaleka nemusí být automaticky chybná. Teoretické poznatky souvisejí s nejrychleji se rozvíjejícím vědeckým odvětvím, kterým je farmakogenetika a epigenetika.
Vlastní lékové interakce mezi antihypertenzivy a antipsychotiky či antidepresivy se mnohdy odehrávají za současného vlivu kouření, pití kávy, užívání benzodiazepinů, kannabinoidů, kontraceptiv, oxazepamu a antibiotik v pitné vodě a také bylin, z nichž některé mají významné farmakodynamické účinky (např. třezalka).
Speciálním problémem jsou změny a poruchy srdečního rytmu související s podáváním psychofarmak, především antipsychotik a antidepresiv, a kardiologických léků, z nichž prakticky nejdůležitější skupinou jsou betablokátory a antiarytmika a jejich interakce. Nejvíce pozornosti je třeba věnovat prodloužení intervalu QT a hrozbě výskytu tachyarytmie typu torsades de pointes. Riziko vážných komplikací, které mohou vzniknout z těchto příčin, hrozí ženám vyššího věku.
Málo se přihlíží k tomu, že délka lidského života se za posledních sto let téměř zdvojnásobila a že nové neurony mohou růst i v dospělosti. K jejich růstu vede aktivita mozku (především učení se něčemu novému) a přispívají k tomu i antidepresiva. Nejenže funkce vytváří orgán, ale aktivita a samotné fungování udržuje orgán v dobré kondici. Malá aktivita mozku „přivolává“ změny patřící k Alzheimerově nemoci. Ke snížení náročné aktivity mozku dochází zpravidla při odchodu do důchodu a také při depresivní poruše.
Souvislosti duševních a kardiovaskulárních onemocnění
Jak již bylo řečeno v úvodu, duševní porucha je zpravidla „nemocí celého člověka i s jeho společenským prostředím“. Totéž nakonec platí i o nemocech kardiovaskulárních. Příkladem může být infarkt myokardu u dosud zdravého čtyřicetiletého otce rodiny. Pacient postižený tímto onemocněním často ztrácí dosavadní dominantní roli v rodině a starost o ekonomické záležitosti musí převzít manželka sama bez významné pomoci muže. Nemoc ve svém důsledku pak poznamená nejen další psychický vývoj pacienta, ale i rovnováhu interpersonálních vztahů jeho rodiny.
Funkce mozku i srdce jsou regulovány stejnými neurotransmitery, především monoaminy, acetylcholinem a glutamátem. Dojde-li k poruše těchto regulací, má to odezvu jak v činnosti mozku, tak ve fungování kardiovaskulárního systému. Důkazem vzájemné provázanosti obou soustav může být fakt, že onemocnění depresivní poruchou radikálně zvyšuje pravděpodobnost výskytu onemocnění ischemickou chorobou srdeční a infarktu a zhoršuje jejich prognózu [1, 2].
Nejen infarkt, nýbrž každé vážnější somatické onemocnění je spojeno s rizikem vzniku depresivní poruchy. Prevalence depresivní poruchy při karcinomu pankreatu je 50 %. Lehkou depresivní poruchou onemocní v prvních deseti dnech po infarktu 27 % pacientů, prevalence výskytu střední nebo těžké depresivní poruchy dosahuje 18 % a do tří měsíců po infarktu onemocní depresivní poruchou 33 % nemocných. Po cévní mozkové příhodě onemocní depresí polovina nemocných. Nejčastější chybou je mínění, že deprese je pochopitelnou a „přirozenou“ reakcí na „katastrofickou událost“, se kterou se člověk musí vypořádat. Nejen kardiolog, ale i specialisté jiných somatických oborů se často spokojují s tím, že se o pacientovo duševní zdraví stará klinický psycholog a že jde vlastně jen o problém adaptace na novou životní situaci. Psychiatr se pak třeba i po létech průběhu periodické depresivní poruchy dozvídá, že rozvoji tohoto onemocnění bezprostředně předcházel infarkt a nebyla zahájena léčba antidepresivy. Invalidita se pak přiznává pro duševní poruchu, které se dalo předejít.
Na druhé straně samotná časová posloupnost vzniku somatického onemocnění a duševní poruchy obecně ještě neznamená kauzální souvislost, tedy ono post hoc, ergo propter hoc, jejíž vyvozování může svádět k argumentačnímu klamu. Pro rozhodnutí o léčbě není třeba dlouho zkoumat, co je příčinou, co následkem. Stačí, když pacient splňuje kritéria depresivní poruchy. K nim patří alespoň dva z následujících příznaků:
- abnormální depresivní nálada trvající aspoň dva týdny;
- pacienta nic nebaví a nic mu nepůsobí potěšení;
- je bez energie a cítí se unaven.
Navíc se u nemocného vyskytují alespoň dva z dalších příznaků: ztráta sebedůvěry, pocity viny a neodůvodněné výčitky, zhoršená koncentrace při pracovní činnosti, může se objevit změněná chuť k jídlu, prohlubuje se pocit beznaděje a často se objevují myšlenky na smrt. Rozpoznáváme tedy „depresi“ jako symptom (špatná nálada, když jsme se špatně vyspali, zklamání, že se něco nedaří, starosti), který patří ke zkušenostem všedních dní, a nezáleží na tom, zda vysvětlení pro depresivní poruchu máme, nebo nemáme. Neplatí již rozlišování psychogenní, somatogenní a endogenní deprese, kde žádné vysvětlení nenajdeme – kromě předpokládané genetické vlohy. Ovdovění stejně jako úmrtí někoho blízkého je provázeno stejnými neuroendokrinními a imunologickými změnami jako ostatní depresivní poruchy [3].
Biorytmy a chronobiologie se uplatňují jak v psychiatrii, tak v kardiologii, a jistou sezonnost vyššího výskytu anginy pectoris v podzimních měsících u mužů se daří prokazovat. Sezonní deprese se často s úspěchem léčí jasným světlem. Zajímavý článek kauzálního řetězce byl doložen během rozsáhlého šetření u kohorty 2282 obyvatel Amsterodamu ve věku od 65 do 95 let [4]. U lidí, kteří trpěli depresivní poruchou, se vyskytovala nižší koncentrace vitaminu D a vyšší koncentrace parathormonu. Prakticky toho bylo využito ve studii [5], která prokázala, že přidání vitaminu D k fluoxetinu mělo vyšší terapeutické účinky než léčba fluoxetinem samotným. Klíčový je poznatek, že serotonin se v mozku tvoří z tryptofanu za působení světla, avšak za tmy se z něho tvoří melatonin. Ultrafialové záření je součástí světelného spektra a vitamin D ho může alespoň zčásti nahrazovat.
Přístup respektující doporučené postupy a populační data
Lékař, který rozhoduje o medikamentózní léčbě, je dnes vystaven dvěma do značné míry protichůdným tendencím. První trend prosazuje léčbu založenou na vědeckých důkazech. Výzkumné klinické studie poskytují data, ze kterých pak vycházejí početné doporučené terapeutické postupy (tzv. guidelines) [6]. Jsou formulovány a podpořeny autoritami, jež představují většinou přednostové univerzitních klinik a předsedové nebo významní členové výborů odborných společností ČLS J. E. Purkyně. Objevují se snahy pokládat taková doporučení za závazná pro praxi a činit rovnítko mezi nimi a postupem lege artis. Mlčky se předpokládá, že tato doporučení jsou v souladu s indikacemi léčiv schválenými při jejich registraci. V praxi se to pak projevuje tím, že lékař si ověřuje správnost svého postupu v informacích v SPC (souhrn údajů o přípravku) [7]. V doporučených terapeutických postupech totiž nemusí být zmíněna všechna léčiva, která jsou v České republice v distribuci.
Duševní poruchy dnes diagnostikujeme s jakousi úřední přesností. Velká část lékařů „nepsychiatrů“ má v dobré paměti klasifikaci založenou na předpokládané etiologii onemocnění. Duševní poruchy se rozdělovaly na organické, kde příčina byla zjevná podle stavu mozku (např. arteriosklerotická demence nebo Alzheimerova nemoc), psychogenní (neurózy) a endogenní (schizofrenie a maniodepresivní psychóza), kde se předpokládala hereditární vloha a hypotetický toxický činitel, nejspíše související s patologií stresu. Dnes víme, že taková klasifikace neobstojí, protože v podstatě u každé duševní poruchy lze najít „organickou“ patologii, zpravidla určitý deficit neuronů anebo přestavbu jejich spojů (rewiring – „předrátování“) nebo diskonekci ve spojení mezi některými korovými oblastmi a subkortexem. Tyto změny nejsou ireverzibilní a nové neurony mohou nahrazovat zaniklé, což je zajištěno podáváním psychofarmak, která doslova hojí mozek.
Poučný je mechanismus účinku antidepresiv. Na jeho začátku dochází ke zlepšení neurotransmise noradrenalinu, dopaminu a serotoninu, přičemž prakticky nejvýznamnějším neuromediátorem je zde serotonin; proto se dnes nejčastěji užívají SSRI. Nejselektivněji z této skupiny působí escitalopram. Dostatečná přítomnost ligandu (molekuly serotoninu) na vazebných místech receptoru spouští aktivaci dějů postreceptorových, jejímž důsledkem je zvýšená syntéza a uvolňování růstového faktoru BDNF (brain derived neurotrophic factor). Tím je iniciován růst nových buněk a vláken, jež byly zničeny distresem provázejícím depresivní poruchu.
Nezastupitelnou roli při takové farmakoterapii hraje psychoterapie. Kontrolované studie prokázaly, že kombinace léčby medikamentózní s psychoterapií má vyšší terapeutické účinky než součet prokázaných účinků psychofarmaka na jedné a psychoterapie na druhé straně. Lidský mozek má totiž neuvěřitelnou plasticitu: každé slovo mění jeho strukturu, vznikají nové spoje a rostou nové neurony. Aktivace struktur vyvolaná psychoterapií jim pomůže získat dostatek BDNF, tak jako cvičení zajistí svalu nejen dostatek glukózy a kyslíku, ale podporuje i celkovou aktivaci růstových faktorů, např. IGF-1 (insulin-like growth factor).
Vedle neurofyziologických mechanismů se na patogenezi a léčbě depresí podílejí mechanismy imunologické. U pacientů s depresivní poruchou zjišťujeme přítomnost některých patogenních cytokinů, přičemž se objevuje marker zánětu: zvýšení koncentrace C-reaktivního proteinu. Příznaky deprese lze v průběhu několika hodin likvidovat intrathekálním podáním etanerceptu (inhibitoru pro tumor nekrotizující faktor alfa, TNF-α), který je významným regulátorem zánětlivých a imunitních pochodů. V současné fázi se jedná o experimentální léčbu, která ukazuje cestu pro hledání nových rychle působících antidepresiv. Těmito poznatky je prozatím možné vysvětlit augmentační antidepresivní účinek kyseliny acetylsalicylové přidané k léčbě antidepresivy.
V běžné praxi musíme počítat se strastiplným čekáním na antidepresivní účinek po zahájení léčby antidepresivy. I když určité zlepšení může být patrné po deseti dnech, k odeznění závažných symptomů dochází zpravidla až po třech týdnech. V léčbě se však musí pokračovat minimálně rok a při opakovaných epizodách depresivní poruchy celá léta. Došlo-li u pacienta k první epizodě po 65 letech věku, musíme počítat s doživotním užíváním antidepresiva. Není to nic výjimečného. Naprostá většina jakékoliv dlouhodobé farmakoterapie je vlastně udržovací léčbou, a to nejen u duševních poruch. Antihypertenziva také nepodáváme dlouhodobě, abychom – ještě víc – krevní tlak snížili, ale abychom předešli jeho vzestupu při přerušení léčby.
Vedle „organického“ deficitu, který je dnes prokazován i u pacientů s poruchami psychogenními, jako je posttraumatická stresová porucha nebo panická úzkostná porucha, lze vystopovat u všech duševních poruch účast genetických faktorů.
Jestliže jsme rezignovali na klasifikaci vycházející z etiologie, protože všechno je zčásti organické, zčásti psychogenní a zčásti hereditární, jaké diagnózy duševních poruch dnes stanovíme? Odpovědí je Mezinárodní klasifikace nemocí a souvisejících zdravotních problémů (v češtině označovaná zkratkou MKN-10) a klasifikace podle Diagnostického a statistického manuálu (DSM-IV) vytvořeného Americkou psychiatrickou asociací, užívaná hlavně v USA. V těchto publikacích jsou jednotky vyhýbající se hierarchii založené na dělení neuróza – psychóza. Proto je všechno hodnoceno jako „porucha“ (disorder). Důraz je kladen na důkladný popis a spolehlivost kritérií. Cílem je, aby psychiatr ve Finsku věděl, že psychiatr ve Vancouveru nebo v Singapuru by u svého pacienta stanovil stejnou diagnózu. Jde tedy o zajištění vysoké míry reliability, přičemž snaha o potvrzení diagnózy nějakým externím kritériem zůstává úkolem pro výzkum. Takové externí kritérium do jisté míry supluje výsledek léčby psychofarmakem, jehož mechanismus terapeutického účinku známe.
Přístup respektující interindividuální odlišnosti jednotlivců
Velmi živý je však druhý trend, který prosazuje personalizovanou medicínu. Ta argumentuje vysokou genetickou variabilitou a epigenetickými změnami probíhajícími v závislosti na prostředí. Tak vzniká fenotyp, jehož vlastnosti jsou výsledkem exprese genů, k níž dochází vlivem podnětů z prostředí. Exprese vede k syntéze proteinů, tedy látek, na něž se dnes soustřeďuje nejvíc pozornosti ve výzkumu. Z proteinů je vystavěn např. transportér serotoninu, s jehož pomocí se tento mediátor dostává přes synaptickou štěrbinu k vazebnému místu receptoru. Také enzymy jsou tvořeny proteiny. Mezi vlivy prostředí formujícími fenotyp člověka začíná převažovat význam faktorů civilizačních a kulturních nad vlivy přírody.
Personalizace farmakoterapie se často ilustruje rozdíly v genetické predispozici, která rozhoduje o tom, jak rychle jsou metabolizovány léky, a podle toho rozděluje pacienty na rychlé a pomalé metabolizátory. Vysoká rychlost degradace může vést k farmakorezistenci, extrémní pomalost ke kumulaci účinné látky a její toxicitě. K rozmanitosti fenotypů přispívají izoenzymy cytochromového systému P 450.
Psychofarmaka nepůsobí na nozologické jednotky. Jsou to chemické látky a jako takové mohou působit jen na jiné chemické látky, především na ty, které tvoří mozek. Personalizaci medicíny lze spatřovat v tom, že respektujeme individuální zvláštnosti každého nemocného. Setřídění konkrétních nemocných do přesně definovaných přihrádek MKN nebo DSM je obtížné a většinou násilné. Přesto se to administrativně nakonec daří. S nedostatečným úspěchem se však daří dodržovat indikace jednotlivých psychofarmak podle jejich registrační dokumentace. Výsledkem je skutečnost, že přibližně polovinu nemocných léčíme jinak než podle indikací uvedených v SPC, tedy off-label. Ukazuje se, že psychiatr ví, čím pacienta léčit, a teprve pak se stará o jeho diagnózu. Lékař má tendenci stanovit diagnózu ex juvantibus. Velmi živě a otevřeně se tento problém diskutuje zvláště v USA při tvorbě páté revize současné klasifikace podle DSM-IV.
O těchto zvláštnostech psychiatrické diagnostiky by měl vědět kardiolog, setká-li se s depresivním pacientem, který je léčen antipsychotikem, nebo s pacientem trpícím schizofrenií, který je léčen jen benzodiazepiny nebo přípravky ze skupiny SSRI. Názvy lékových skupin nejsou v souladu s diagnózami nemocí (poruch), které jsou jimi léčeny.
S druhým trendem, zdůrazňujícím personalizovanou medicínu, souvisí problematika interakcí, a to především problematika interakcí farmakokinetických.
Lékové a další interakce – vliv léků, potravin a kouření
Málo se doceňuje skutečnost, že za posledních sto let došlo k revolučnímu prodloužení lidského života téměř na dvojnásobek. Praktickým důsledkem strohého statistického údaje je fakt, že přibývá rodin, kde spolu žijí čtyři generace, a sociologové studují problematiku soužití praprarodičů s pravnoučaty. K vlivům prostředí patří nakonec i působení léčiv; už koncem minulého století se předvídalo, že stejně jako se mluvilo o společnosti doby kamenné, bude se jednou mluvit o nás jako o společnosti pojídající pilulky. Antihypertenziva, antidiabetika, analgetika a psychofarmaka „zamořují“ nejen vnitřní prostředí organismu, ale společně s antibiotiky, oxazepamem a kontraceptivy také řeky a pitnou vodu.
Civilizační pozadí, kde vše se vším souvisí, bychom neměli ztrácet ze zřetele, když uvažujeme o lékových interakcích. Kardiolog při ordinaci psychofarmaka zvažuje riziko interakcí mezi psychofarmakem a léky podávanými pro somatické onemocnění. K těmto interakcím však patří i vliv potravy a psychotropních látek, jejichž požívání je součástí stravovacích návyků: význam alkoholu a kofeinu bývá větší než dopad vlastních interakcí mezi předepisovanými léky.
Kardiologa nepřekvapí dosah zamoření vnitřního i vnějšího prostředí kouřením cigaret. Kouření vede k výrazné indukci enzymů systému cytochromu P 450. Antipsychotika mají antidopaminový účinek, který u nemocných vede ke snížení asertivity a spontaneity, či dokonce i k parkinsonskému syndromu. Nemocní se to snaží překonat kouřením. Je to bludný kruh, který nakonec vede k tomu, že terapeutické dávky antipsychotik (především první generace) bývají u kuřáků až dvojnásobné oproti běžným dávkám, které jsou předepisovány těm, kteří nekouří [8]. Je-li takový pacient upoután na lůžko na interně a nemá přístup k cigaretám, bývá nutností dávky antipsychotik po dohodě s psychiatrem snížit.
P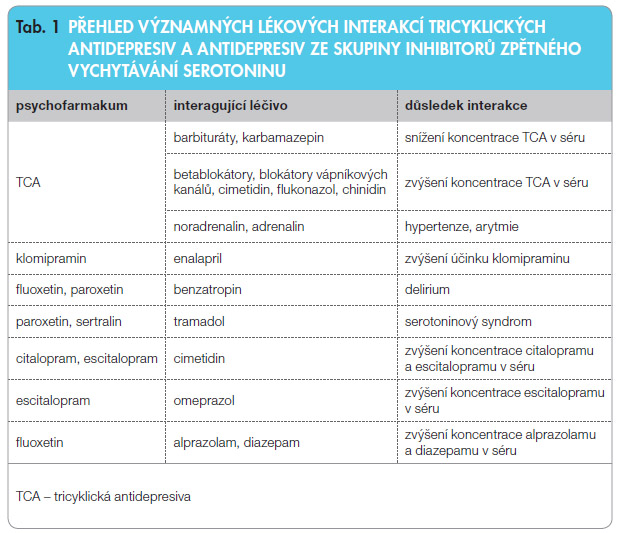 rakticky nejdůležitější farmakodynamické a farmakokinetické interakce mezi některými kardiologickými a psychotropními léky jsou uvedeny v tab. 1. Komplikováno je to tím, že většina pacientů trpících metabolickým syndromem užívá ne jeden, nýbrž tři až pět léčiv a něco podobného platí pro pacienta trpícího anxiózně depresivními příznaky. Počty takových nemocných zřejmě zvyšuje hrozivé procento nemocných hospitalizovaných pro nežádoucí účinky léků. Otevřeným problémem zůstává otázka, zda a jak je interakce léku A s lékem B ovlivněna současně podávaným lékem C, atd.
rakticky nejdůležitější farmakodynamické a farmakokinetické interakce mezi některými kardiologickými a psychotropními léky jsou uvedeny v tab. 1. Komplikováno je to tím, že většina pacientů trpících metabolickým syndromem užívá ne jeden, nýbrž tři až pět léčiv a něco podobného platí pro pacienta trpícího anxiózně depresivními příznaky. Počty takových nemocných zřejmě zvyšuje hrozivé procento nemocných hospitalizovaných pro nežádoucí účinky léků. Otevřeným problémem zůstává otázka, zda a jak je interakce léku A s lékem B ovlivněna současně podávaným lékem C, atd.
K farmakodynamickým interakcím dochází mezi tricyklickými antidepresivy, antipsychotiky a antiarytmiky. Nejnebezpečnějším důsledkem je vznik tachyarytmií typu torsades de pointes, ke kterým dochází následkem inhibice rychlé složky draslíkového kanálu. Následné prodloužení trvání akčního potenciálu je registrováno na EKG jako prodloužení intervalu QT. Nejvýrazněji prodlužují interval QT antiarytmika III. třídy (sotalol, eventuálně dofetilid, ibutilid a azimilid) nebo některá starší, dnes již nepoužívaná antiarytmika I. třídy (např. chinidin). Méně výrazně prodlužují interval QT amiodaron, dronedaron, prokainamid a flekainid. Z pohledu rizika potenciace proarytmogenního účinku antiarytmik je nejvýznamnější jejich interakce s tricyklickými antidepresivy, dále pak s fluoxetinem a s antipsychotiky chlorpromazinem a haloperidolem. Tachyarytmie typu torsades de pointes mohou mít fatální následky zejména u starších žen s organickým kardiovaskulárním onemocněním při současném výskytu bradykardie, polypragmazie a kongenitálního syndromu dlouhého QT.
Farmakokinetické interakce mezi psychofarmaky a kardiologickými léky nastávají na úrovni izoenzymu CYP2D6. Lipofilní betablokátory (metoprolol, karvedilol a nebivolol) nebo antiarytmika (amiodaron, dronedaron, propafenon a flekainid) jsou substráty této oxidázy. Fluoxetin a paroxetin silně inhibují izoenzym CYP2D6, slabší inhibici působí chlorpromazin, citalopram, escitalopram a duloxetin. Následný vzestup koncentrace betablokátorů představuje několikanásobné zvýšení výskytu bradykardie nebo síňokomorové blokády. Interakce fluoxetinu s betablokátory mívá toxické důsledky.
Působení kofeinu
Psychofarmakem užívaným přibližně 80 % populace je kofein. Kofein blokuje účinek adenosinu, který je jakýmsi endogenním anxiolytikem. Adenosin tlumí psychomotoriku, má antikonvulzivní, hypnotické, analgetické a antidiuretické účinky. Dilatuje velké cévy, inhibuje žaludeční sekreci a tlumí dýchání. Kofein má opačné farmakodynamické účinky, a je tedy látkou s anxiogenním efektem.
Odhaduje se, že přibližně 20 % obyvatelstva užívá aspoň občas benzodiazepinová anxiolytika. Podaří-li se přesvědčit pacienta, aby přestal pít kávu a čaj, nebo alespoň omezil jejich konzumaci, je snadné snížit dávky benzodiazepinů nebo ukončit léčbu těmito přípravky. Obavy z jejich předpisu při ischemii nebo infarktu myokardu nejsou namístě, protože lidé, kteří benzodiazepiny užívají, jen poměrně vzácně splňují kritéria závislosti. Na druhé straně abúzus benzodiazepinů definovaný jako jejich neodůvodněné užívání je častý a je třeba mu při každé preskripci těchto látek předcházet upozorněním, že je třeba dodržet předepsanou dávku a délku
užívání.
Známý český psychiatr profesor Vladimír Vondráček hovořil o kofeinu jako o „ušlechtilé droze“. O drogu skutečně jde. Přibližně tři procenta pravidelných konzumentů vysokých dávek kofeinu se stávají závislými. Bývají to lidé s přístupem k substanci kofeinu v prášku, kteří ho jsou schopni užívat po lžičkách. Každá závislost zpravidla vzniká na terénu genetické dispozice. Jestliže se například otci závislému na alkoholu narodí v Argentině jednovaječná dvojčata a jedno z nich je hned po porodu adoptováno do Norska, je zde 95% pravděpodobnost, že až jim bude 23 let, budou obě dvojčata alkoholiky, ačkoliv vyrůstala v úplně rozdílném prostředí.
Psychofarmaka a jejich vliv na interval QT
Společným problémem psychiatra a kardiologa je vliv psychofarmak na krevní tlak a na srdeční frekvenci (včetně arytmie). Rozsáhlé šetření [9], které využilo údaje z elektronické databáze chorobopisů 38 397 pacientů, se zaměřilo na přípravky ze skupiny SSRI a vyhodnotilo jako relevantní ta antidepresiva, po jejichž podání prodloužení intervalu QT pozitivně korelovalo s dávkou. Touto klasickou farmakologickou metodou bylo možno prokázat souvislost mezi velikostí dávky a účinkem (prodloužením intervalu QT) pro citalopram, escitalopram a amitriptylin. Bupropion podle tohoto kritéria interval QT zkracoval. Americká FDA (Food and Drugs Administration) tento nález hodnotí jako nerelevantní pro praxi, pokud nejsou přítomny další rizikové faktory, jimiž jsou vyšší věk a ženské pohlaví [10].
Z antipsychotik prodlužuje interval QT nejvíce thioridazin, který byl z tohoto důvodu v Evropě stažen z distribuce. Dočasně byl z distribuce stažen také sertindol, který však obstál v důkladnější studii a na trh se vrátil. Zhruba platí [11], že léčba druhou generací antipsychotik (risperidon, ziprasidon, olanzapin, quetiapin a další) má na délku intervalu QT mnohem menší vliv než léčba klasickými antipsychotiky (chlorpromazin, levopromazin, chlorprothixen, klopenthixol a další).
Kritické přehledové práce končívají radou, aby psychiatr konzultoval postup léčby pacienta s prodlouženým intervalem QT (více než 430 msec u mužů a více než 450 msec u žen) s kardiologem.
Další aspekty propojení centrálního nervového systému a kardiovaskulárního aparátu
Po dlouhou dobu vyvolávala mnoho zájmu tzv. tyraminová reakce („sýrový efekt“), pojmenovaná podle několika popsaných úmrtí, k nimž došlo následkem náhlého a výrazného zvýšení systolického i diastolického krevního tlaku při léčbě ireverzibilními inhibitory MAO. Aromatické sýry typu camembert, někdy i jogurt nebo kuřecí játra, mohou přispět ke zvýšení koncentrace tyraminu, který není odbouráván následkem inhibice MAO (monoaminooxidázy). Podobnou komplikaci může vyvolat současné podání inhibitorů MAO a inhibitorů zpětného vychytávání monoaminů (RUI, reuptake inhibitors), ke kterým patří tricyklická antidepresiva (imipramin, amitriptylin, dosulepin) a dnes nejaktuálnější a nejčastěji užívaná antidepresiva typu SSRI.
Nejen antidepresiva, nýbrž také antipsychotika zasahují do neurotransmise monoaminů a acetylcholinu, jejichž cílovým orgánem je vedle centrálního nervového systému také kardiovaskulární aparát. Většinou poněkud snižují krevní tlak, dramaticky však mohou zasáhnout do všedního života pacienta a jeho blízkých, když vyvolají ortostatický kolaps. Důkladné poučení o tomto riziku je prevencí úrazů, zvláště u starších lidí. Rizikovou situací je opouštění vany po koupeli v horké vodě. Nebezpečná je také zpomalená akomodace zraková při užívání léků s anticholinergními účinky při řízení auta. V důsledku farmakodynamické interakce se zde může potencovat anticholinergní účinek některých antiarytmik s účinkem řady antidepresiv (amitriptylin, dosulepin, klomipramin).
Zvláštní kapitolou jsou pacienti – pečliví čtenáři příbalových informací, kteří se dozvědí, že jedním z nežádoucích účinků léku předepsaného pro bolest hlavy je i bolest hlavy. Velmi častým příznakem depresivní poruchy je nespavost nereagující na hypnotika. Potíž bývá s takovým nemocnými, když dostanou předpis na antidepresivum a v příbalové informaci se dočtou, že nespavost je na významném místě seznamu nežádoucích účinků. Jen nemnozí si všimnou, že ospalost je hned na dalším místě.
Mnozí nemocní řeší svůj problém tím, že předepsaný lék neužívají, bojí se to však lékaři říci, a ten pak hodnotí účinek něčeho, co nebylo užito. Poměrně častý je útěk od „chemické medicíny“ k medicíně alternativní a k bylinám. Lékař se někdy dozví, že pacient pil čaj z třezalky až tehdy, když pacient přijde se svědivým erytémem v obličeji po oslunění. Hypericin obsažený v třezalce (Hypericum perforatum) má přitom stejný mechanismus účinku jako SSRI a může být skryt i ve zdánlivě obyčejné Žaludeční směsi.
Seznam použité literatury
- [1] Lane RM, Sweeney M, Henry JA. Pharmacotherapy of the depressed patient with cardiovascular and/or cerebrovascular illness. Br J Clin Pract 1994; 48: 256–262.
- [2] Markowitch JH, Matthews KA, Kannel WB. Psychological predictors of hypertension in the Frammingham study. Is there tension in hypertension? JAMA 1993; 270: 2439–2443.
- [3] Irwin M, Daniels M, Weiner H. Immune and neuroendocrine changes during bereavement. Psychiat Clin North Amer 1987; 10: 449–465.
- [4] Hoogendijk WJG, Lips P, Dik MG, et al. Depression is associated with decreased 25-hydroxyvitamin D and increased parathyroid hormone level in older adults. Arch Gen Psychiat 2008; 65: 508–512.
- [5] Khoraminya N, Tehrani-Doost M, Jazayeri S, et al. Therapeutic effects of vitamin D as adjunctive therapy to fluoxetine in patients with major depressive disorder. Aust N Z J Psychiat 2012.
- [6] Seifertová D, Praško J, Horáček J, Höschl C. Postupy v léčbě psychických poruch. Medical Tribune CZ, Praha 2008. 615s.
- [7] Brevíř (autorský kolektiv, informace připravily Kašparová, L., Novotná, H.). Medical Tribune CZ 2012.
- [8] Vinařová E, Vinař O. Smokers need higher doses of neuroleptic drugs. Biol Psychiat 1984; 19: 1265–1268.
- [9] Castro VM, Clements CC, Murphy SN, et al. QT interval and antidepressant use: a cross sectional study of electronic health records. B M J 2013; 346: 1288.
- [10] Wenzel-Seifert K, Wittmann M, Haen E. QTc prolongation by psychotropic drugs and the risk of torsades de pointes. Dstch Arztebl Int 2011; 108: 687–693.
- [11] Vieweg WVR. New generation of antipsychotic drugs and QTc interval prolongation. J Clin Psychiat 2003; 5: 205–215.