Monoklonální protilátky mění situaci pacientů s migrénou
Prakticky zaměřené sympozium organizované společností Solen a časopisem Neurologie pro praxi navštívili zájemci z řad neurologů v letošním červnu v Brně už pošestnácté. Tématy odborné akce, nad níž převzala záštitu I. neurologická klinika LF MU a FN u sv. Anny a Centrum neurověd LF MU v Brně, byly roztroušená skleróza, epilepsie, neurodegenerativní onemocnění a v neposlední řadě samozřejmě také bolesti hlavy.
Jak přednášející uvedeného tematického bloku nejednou
zdůrazňovali, patří migréna k častým neurologickým onemocněním ‒ jen
v České republice žije přibližně milion postižených, z nichž asi 300 000 má více než čtyři dny
s migrénou za měsíc a zhruba 50 000
z nich trpí chronickou migrénou. Tato choroba významně ovlivňuje kvalitu
života pacientů v produktivním věku a je celosvětově třetí
nejčastější příčinou invalidizace a disability u mužů a žen
ve věku do padesáti let. Donedávna nebylo možné části nemocných
účinně pomoci, tato situace se však mění s postupným příchodem
monoklonálních protilátek proti CGRP (calcitonin gene‑related peptide), tedy
proti klíčovému
neuropeptidu v patofyziologii migrény, nebo proti jeho receptoru.
Migréna na urgentním oddělení
Doktorka Zuzana Dean z Neurologické kliniky FN Nitra se
ve své přednášce zaměřila na problematiku akutní léčby migrény
na urgentním oddělení. Připomněla, že v našich zemích bývá
na oddělení urgentního příjmu přivoláván neurolog, aby provedl
diferenciální diagnostiku bolestí hlavy a stanovil léčebný postup, zatímco
na západ od našich hranic provádějí management akutních atak bolestí
hlavy lékaři urgentní medicíny. Prvním krokem je potvrzení diagnózy migrény
a vyloučení těhotenství u žen v reprodukčním věku, což je
důležité pro volbu farmakoterapie. U migreniků je také třeba počítat
s tím, že již nějakou medikaci užili doma. „Neexistuje standardní postup
pro léčbu akutní migrény, každý lékař má svoji osvědčenou strategii. Lze říci,
že na základě klinických studií se jako nejúčinnější jeví neuroleptika
nebo kombinace ergotaminového přípravku s neuroleptikem. Doporučuji však
zahájit léčbu parenterálním podáním nesteroidního antirevmatika
v kombinaci s metoklopramidem a magneziem, protože nemívají
nežádoucí účinky, a současně ‒ což je zásadní ‒ věnovat pozornost
rehydrataci pacienta. Pokud je dostupný triptan, podává se subkutánně,“ uvedla
MUDr. Dean a doplnila, že neuroleptika patří do druhé linie
léčby, stejně jako ergotaminy a opiáty. Podle přednášející nemají ve zvládání
akutních atak migrény místo valproát a kortikosteroidy – ty lze
nicméně podat jednorázově ve specifických případech jako prevenci
recidivy.
Nároky na diferenciální diagnostiku
Doktor Marek Krivošík z II. neurologické kliniky
LF UK a UN Bratislava navázal sdělením o diferenciální diagnostice
migrény. „Abychom mohli migrénu diagnostikovat, je nutné provést diferenciálně
diagnostickou rozvahu především při prvním záchvatu. Rozlišit primární
a sekundární bolesti hlavy je nutné rovněž z toho důvodu, že primární
bolest může často imitovat migrénu,“ zdůraznil MUDr. Krivošík
v úvodu příspěvku a poté se už věnoval jednotlivým krokům
diferenciální diagnózy. V první fázi je důležitá anamnéza, která by měla
zahrnout popis chronologie bolestí hlavy, rodinnou a lékovou anamnézu. Zde
je možno použít mnemotechnickou pomůcku PQRST, tzv. abecedu bolesti,
s jejíž pomocí zjišťujeme, co bolest vyvolává, zhoršuje nebo zmírňuje,
její kvantitu a kvalitu, lokalizaci, sílu a intenzitu a délku
trvání bolesti. Druhý krok představuje objektivní nález, který nás může
nasměrovat na sekundaritu bolestí hlavy – například při zvýšené
teplotě je nutno vyloučit infekční příčinu či temporální arteritidu, při
zvýšeném tlaku krve PRES syndrom či kardiovaskulární onemocnění, při
tachykardii ortostatickou hypotenzi atp. „V diferenciální diagnostice nám
může pomoci také samotná palpace v hlavové oblasti, která nás může navést
například na podezření na sinusitidu,“ doplnil přednášející.
Ve třetím kroku se lékař soustředí na tzv. red flags, tedy varovné
příznaky, kde opět pomáhá mnemotechnická pomůcka pod zkratkou SNOOP:
S = systémové příznaky a onemocnění; N = neurologické
symptomy; O = výskyt nové bolesti nebo změna charakteru bolesti,
výskyt bolesti po 50. roce života, výskyt tzv. thunderclap bolesti
hlavy; P = papiloedém, pulzační tinitus, provokace bolesti pozicí
nebo cvičením. Ve čtvrtém kroku přicházejí na řadu zobrazovací
a pomocná vyšetření, která zahrnují CT mozku, likvorologické vyšetření, MR
mozku (preferované před CT), MR páteře a obličeje, ultrasonografii nervus opticus, fundoskopii a laboratorní vyšetření.
„Pátým krokem je pak vyloučení primární bolesti hlavy, neboť
migréna je záludná v tom, že může mít různé podoby – může být
bilaterální nebo se mění, může být mírná a nemusí být pulzující, může být
kontinuální, trvat méně než čtyři hodiny nebo více než 72 hodin, nemusejí se
při ní vyskytovat přidružené symptomy, může se objevit aura bez bolestí hlavy
či interiktální hypersenzitivita,“ vysvětlil doktor Krivošík. V případě
primárních bolestí hlavy může být migréna zaměněna za tenzní typ bolestí
hlavy, hemicrania continua, cluster headache nebo také za novou denní
perzistující bolest hlavy. Tenzní bolest bývá nezřídka kombinovaná (např.
tenzní a migrenózní bolest hlavy), problematické je rovněž její odlišení
od migrény bez aury. U hemicrania continua dochází často
k poddiagnostikování, v diferenciální diagnóze tedy může pomoci
poznatek, že se nejčastěji vyskytuje okolo třetí dekády věku s převahou
u žen, je vždy unilaterální, kraniální autonomní příznaky jsou přítomny
ve více než 75 % případů
(u migreniků přibližně v 56 %)
a je doprovázena autonomními příznaky jako fotofobie, fonofobie, nauzea
nebo zvracení. Cluster headache může být s migrénou zaměněna především při
delším trvání a při kombinaci několika typů bolesti. Nová denní
perzistující bolest hlavy (new daily persistent headache, NDPH) se projevuje
denními bolestmi hlavy, které vznikají náhle a mohou mít rysy migrény,
tenzních bolestí hlavy nebo obou typů. Zhruba 20 %
takto postižených pacientů má předchozí historii migrény a nemoc je často
diagnostikována jako chronická migréna.
Příčinou sekundárních bolestí hlavy, které mohou imitovat
migrénu, jsou zejména cerebrovaskulární nebo vaskulární postižení (např.
arteriální hypertenze), nádory, tzv. SMART syndrom (stroke like migraine
attacks after radiation therapy), infekce, intrakraniální
hypotenze/hypertenze, epilepsie, glaukom nebo Alice in Wonderland syndrom
(AIWS). Bolestí hlavy podobnou migréně se mohou manifestovat arteriovenózní
malformace (se zrakovou aurou jsou popisovány u arteriovenózních
malformací v okcipitálním laloku), jejich charakteristika však zpravidla
nesplňuje kritéria migrény, bolest hlavy se ve více než 95 % vyskytuje na jedné
straně a u pacientů je zaznamenávána dobrá odpověď na léčbu
analgetiky. Reverzibilní cerebrální vazokonstrikční syndrom je spojen
s tzv. thunderclap bolestí hlavy s nauzeou/vomitem a fotofobií,
která vzniká spontánně nebo po kašli, cvičení a podobně. Jedná se
o přechodnou mozkovou vazokonstrikci, jež se obvykle sama upraví
po 1‒3 měsících.
K sekundárním bolestem patří dále bolest hlavy
asociovaná s neurologickým deficitem a cerebrospinální fluidní
lymfocytózou. Bývá většinou střední až silné intenzity, s výskytem
unilaterálně nebo bilaterálně, trvá zpravidla několik hodin, je často spojena
s nauzeou a vomitem, následuje převážně po přechodném
neurologickém deficitu (hemiparéza, afázie atp.) a nezřídka recidivuje.
V rámci diferenciální diagnózy migrény je dále nutno vyloučit tzv. bolest
z nadužívání léků (medication overuse headache, MOH), jež se vyskytuje
pouze u pacientů (s převahou žen) s preexistující chronickou
bolestí hlavy. Nemoc spočívá v akutní eskalaci bolestí hlavy
po odnětí léčby, bolest se objevuje denně, nejčastěji v ranních
hodinách při probuzení, a nemá žádný specifický příznak.
Iktální epileptická bolest hlavy je zřídkavým onemocněním,
kdy migréna nebo tenzní typ bolesti hlavy představuje jedinou manifestaci
záchvatu. Od migrény je epilepsii možné odlišit také na základě
charakteristiky zrakových halucinací ‒ epileptické začínají v prvních
vteřinách záchvatu, trvají několik minut a jsou zpravidla barevné
a cirkulární, migrenózní zrakové aury se rozvíjejí několik minut, trvají
5‒60 minut a jsou zpravidla černobílé a lineární.
Alice in Wonderland syndrom se projevuje jako zřídkavá forma
migrenózní aury, která je popisována jako paroxysmální zkušenost
s iluzivním obrazem vlastního těla, častěji se vyskytuje u dětí.
Diagnóza migrény tedy představuje velmi náročný proces, lze
ji stanovit jen při opakování záchvatu a je založena na klinických
kritériích. Často může dojít k překrývání několika typů bolestí hlavy,
z tohoto důvodu je v Mezinárodní klasifikaci bolestí hlavy
(International Classification of Headache Disorders, ICHD‑3) užíván termín
„pravděpodobná migréna“, „pravděpodobná tenzní bolest hlavy“. „Pokud nemocný
splňuje kritéria pro více než jeden typ, podtyp nebo podformu migrény, měly by
být diagnostikovány všechny. Jestliže se preexistující migréna u pacienta
zhorší, je opět nutné vyloučit sekundaritu,“ shrnul doktor Krivošík.
Charakteristika monoklonálních protilátek
Přehledu anti‑CGRP monoklonálních protilátek věnoval svoji
prezentaci MUDr. David Doležil, Ph.D., MBA, z Headache
centrum Praha, DADO MEDICAL, s.r.o., a Městské polikliniky Praha.
Přednášející zprvu připomněl patofyziologii migrény, kdy se
na trigeminovaskulárním systému začnou uvolňovat substance P nebo
neurokinin A, a zejména CGRP, jež následně umožní uvolnění zánětlivých
cytokinů a ostatních látek. Při mechanismu, který vede ke vzniku
sterilního zánětu, pacient vnímá všechny příznaky bolesti. Znalost těchto
patofyziologických mechanismů lékaři zároveň umožňuje zasahovat léčebně. Jediný
akutní specifický lék pro migrénu představují triptany, pro profylaxi máme
v současné době k dispozici právě monoklonální protilátky, které
mohou zasahovat cíleně do patofyziologie migrény. K anti‑CGRP
protilátkám se řadí eptinezumab, který čeká na schválení americkým Úřadem
pro kontrolu potravin a léčiv (Food and Drug Administration, FDA), erenumab,
fremanezumab a galkanezumab jsou již registrovány Evropskou lékovou
agenturou (European Medicines Agency, EMA). Uvedené čtyři molekuly se liší svým
typem, podtřídou imunoglobulinů, místem působení, biologickou dostupností,
biologickým poločasem, způsobem podání a dávkou (tab. 1).
„Monoklonální protilátky vznikaly z potřeby najít specifickou
profylaktickou léčbu. Tomu napomohly malé molekuly (gepanty), které byly
zkoušeny jako antagonisté CGRP, při vývoji se však u řady z nich
objevila velká hepatotoxicita, a většina tedy byla z tohoto důvodu
z klinických studií vyňata. Aktuálně se testují dvě malé molekuly, jež by
mohly být používány v akutní léčbě migrény,“ doplnil doktor Doležil.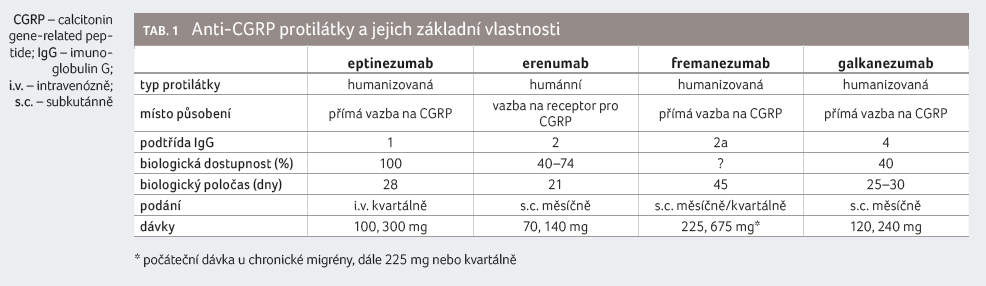
Všechny čtyři molekuly byly zkoušeny pro léčbu epizodické
i chronické migrény nejprve v klinických studiích fáze II. Účinnost
a bezpečnost monoklonálních protilátek byla definitivně potvrzena
klinickými hodnoceními fáze III, na jejichž základě došlo take
ke schválení FDA a EMA. Přednášející dále zdůraznil, že důležitým
faktorem nové terapie anti‑CGRP monoklonálními protilátkami je skutečnost, že
tato léčba prokazuje efekt u pacientů, u nichž již dříve selhaly jiné
profylaktické terapie. Monoklonální protilátky rovněž žádným způsobem
neovlivňují imunitní systém.
Erenumab (plně humánní protilátka IgG2 namířená
proti receptoru pro CGRP) byl zpočátku testován v dávkách 7 mg, 21 mg a 70 mg, menší dávky nebyly
účinné, proto se posléze testovalo 70 mg
a 140 mg.
Ve všech studiích byl primárním cílovým ukazatelem, a tedy základním
kritériem pro posouzení účinnosti léčby počet dnů s migrénou v měsíci
(monthly migraine days, MMD) a redukce tohoto počtu k určitému datu,
případně podíl pacientů, kteří mají více než 50 %
MMD. V rámci sledování bezpečnosti nebyly pozorovány žádné závažné
nežádoucí účinky ani laboratorní a EKG abnormality. Tyto předběžné
výsledky byly potvrzeny v dalších studiích fáze III. Studie ARISE,
do níž bylo zařazeno celkem 577 dospělých, porovnávala erenumab podávaný
v dávce 70 mg
oproti placebu po dobu tří měsíců. Signifikantní redukce MMD byla
potvrzena u skupiny s erenumabem během 9.‒12. týdne. Mezi
nejčastější nežádoucí účinky patřila obstipace (u 2 % pacientů). Do studie fáze III
STRIVE bylo zařazeno 955 pacientů (placebo vs. erenumab 70 mg a 140 mg). Signifikantní redukce
MMD bylo dosaženo u obou dávek erenumabu, s lepšími výsledky
u dávky 140 mg.
Efektivita a bezpečnost erenumabu u pacientů s chronickou
migrénou byla nejprve hodnocena v multicentrické, placebem kontrolované,
randomizované studii fáze II. Bylo do ní zařazeno celkem 667 subjektů
ve věku 18‒65 let do větví se 70 mg
a se 140 mg
erenumabu a s placebem. Studie trvala 12 týdnů a erenumab
byl aplikován jednou měsíčně subkutánně. Signifikantní redukce MMD oproti
placebu byla prokázána v obou skupinách s erenumabem, o něco
lepší parametry byly doloženy pro dávku 140 mg.
Fremanezumab (plně humanizovaná protilátka IgG2a s vazbou na CGRP) byl hodnocen ve studii
fáze III HALO, na základě výsledků studií fáze II podobně jako
u ostatních anti‑CGRP monoklonálních protilátek, u pacientů
s chronickou migrénou. Bylo randomizováno celkem 1 130 dospělých. Pacienti byli rozděleni
do tří ramen v poměru 1 : 1 : 1
se subkutánním podáním studijní látky jednou měsíčně. V prvním rameni byl
jako první dávka podáván fremanezumab 675 mg,
jako druhá a třetí dávka placebo. Ve druhém rameni pacienti dostávali
675 mg fremanezumabu
v první dávce, 225 mg
ve druhé a třetí dávce každé čtyři týdny; třetí rameno bylo
placebové. Obě aktivní skupiny vykázaly statisticky významné zlepšení
ve všech sledovaných parametrech. Podíl pacientů s minimálně 50%
redukcí MMD činil v rameni s dávkou 675 mg
kvartálně 38 %,
v rameni s měsíční dávkou fremanezumabu 41 % a pouze 18 % v placebové skupině. Podíl nežádoucích
účinků byl v placebové skupině 64 %,
70 % v rameni
s kvartálním podáním, 71 %
v rameni s měsíčním podáním fremanezumabu, většinou se jednalo
o mírné nežádoucí účinky. Ve studii HALO EM v indikaci prevence
epizodické migrény bylo zařazeno 875 pacientů do tří ramen
v poměru 1 : 1 : 1.
V prvním rameni užívali 225 mg
fremanezumabu subkutánně jednou měsíčně, ve druhém rameni 675 mg v první dávce,
druhý a třetí měsíc placebo, ve třetím rameni placebo. Redukce
hodnoty MMD představovala pokles z 8,9 na 4,6 dne ve větvi
s měsíčním podáním, z 9,2 na 4,9 dne ve větvi
s kvartálním podáním, z 9,1 na 5,9 dne u placeba.
Podíl pacientů s více než 50% redukcí MMD během 12týdenní léčebné periody
byl 47,7 %
v rameni s měsíčním podáním fremanezumabu, 44,4 % u vysokodávkovaného
kvartálního fremanezumabu. Výskyt nežádoucích účinků činil 48 %, resp. 47 %, resp. 37 % u placeba.
Galkazenumab (plně humanizovaná protilátka IgG4 cílená na CGRP ligand) byl hodnocen ve studii
fáze III EVOLVE‑1, kam bylo randomizovaně zařazeno 1 671 dospělých
s epizodickou migrénou do tří ramen v poměru 2 : 1 : 1 s měsíčním
subkutánním podáváním studijní látky v dávce 120 mg, 240 mg
a s placebem. Předchozí preventivní terapie migrény představovala
vylučující kritérium pro zařazení. Obě ramena s aktivní látkou prokázala
signifikantní zlepšení, redukci MMD během šesti měsíců trvání studie – 4,6
dne, 4,7 dne, 2,8 dne ve srovnání s placebovou větví.
U významně více pacientů v obou ramenech s galkanezumabem byla
zaznamenána 50%, 75% a 100% redukce MMD ve srovnání s placebem.
Podobných výsledků bylo dosaženo i ve studii EVOLVE‑2.
Do dvojitě zaslepené, randomizované, placebem kontrolované studie fáze III
REGAIN u pacientů s chronickou migrénou bylo randomizováno 1 113 dospělých do tří
ramen v poměru 2 : 1 : 1
s měsíčně subkutánně podávaným galkanezumabem v dávce 120 mg, 240 mg a s placebem.
Výchozí hodnota MMD byla stejná napříč všemi skupinami (19,4 dne). Obě ramena
s galkanezumabem vykázala během tříměsíční léčebné periody signifikantní
zlepšení. U průměrného podílu pacientů s více než 50% redukcí MMD
bylo rovněž prokázáno významné zlepšení v aktivních ramenech.
Eptinezumab (humanizovaná protilátka IgG1,
která se selektivně váže k oběma izoformám CGRP – α‑CGRP a β‑CGRP)
byl testován ve studii fáze III PROMIS 1 s 888 dospělými, kteří
byli zařazeni do placebové větve a do větví s 30 mg, 100 mg a 300 mg eptinezumabu podávanými
intravenózně každých 12 týdnů. Hodnota MMD činila před zahájením terapie 8,5
dne. Výskyt nežádoucích účinků nebyl signifikantně rozdílný mezi skupinou
placeba a podáváním eptinezumabu ve všech skupinách. Po dvou
infuzích eptinezumabu 300 mg
podávaných po 12 týdnech se podíl pacientů s více než 50% redukcí MMD
zvýšil z 56,3 %
v týdnech 1‒4 na 63,1 %
v týdnech 21‒24 a s více než 75% redukcí z 31,3 % na 40,5 % (300 mg) ve srovnání
s placebem (z 20,3 na 32,4 %).
V případě 100% redukce to bylo ze 14,9 na 23,4 %, respektive
z 5,9 na 14,4 %.
Ve studii PROMISE 2 bylo randomizováno 1 072 pacientů
do větví s 300 mg
nebo se 100 mg
eptinezumabu nebo s placebem. Eptinezumab byl podáván intravenózně jednou
za 12 týdnů. Primárním cílovým ukazatelem byla průměrná změna MMD před
léčbou a ve 12. týdnu terapie. Pacienti v obou aktivních
větvích dosáhli signifikantního zlepšení oproti placebu.
Nová terapie anti‑CGRP monoklonálními protilátkami se stane
zřejmě největším přínosem pro pacienty, u nichž selhala jedna nebo více
profylaktických léčebných metod, a takových pacientů je u nás
pravděpodobně téměř 16 000,
uzavřel doktor Doležil svoje sdělení.
Jak léčit migrénu v graviditě a při laktaci,
migréna a hormonální antikoncepce
Tomuto důležitému tématu, které obsahuje řadu specifik, jež
by měl znát nejen neurolog, ale také praktický lékař, internista nebo
gynekolog, se věnovala MUDr. Ingrid Niedermayerová
z II. neurologické kliniky LF MU a FN Brno.
Ženské pohlavní hormony mají na centrální nervový
systém efekt stimulační ‒ estrogeny jsou prokonvulzivní, modulují bolest,
provokují migrenózní auru ‒ a inhibiční ‒ progesteron a jeho
metabolity stabilizují náladu, působí anxiolyticky, anesteticky, antiepilepticky.
V graviditě dochází k enormnímu nárůstu koncentrace estrogenů
a k dalším metabolickým změnám, např. ke zvýšení hodnot
endorfinů. „V případě migrény je podstatné, zda pacientky trpěly před
graviditou migrénou s aurou, nebo migrénou bez aury. U žen bez aury
je druhý a třetí trimestr obdobím s výraznou redukcí výskytu
migrenózních záchvatů nebo zcela bez nich. U žen s aurou často
dochází v průběhu gravidity k nárůstu počtu záchvatů, někdy mívají
izolované aury,“ vysvětlila doktorka Niedermayerová. Občas přichází pacientka
s nově vzniklou migrénou s aurou, přestože jí nikdy předtím
netrpěla – v tomto případě je nutné vyloučit jiné závažné cerebrální
diagnózy (cerebrální venózní trombózu, cévní mozkovou příhodu, apoplexii
hypofýzy, ale také preeklampsie). Migréna jako taková nepředstavuje riziko pro
plod.
Přednášející dále nastínila léčebné možnosti, které jsou
gravidním pacientkám nabízeny v běžné klinické praxi (akutní medikace dle
SPC platných k 31. 12. 2018 v ČR).
K dispozici jsou tři základní skupiny léků, a to 1) léky naprosto
bezpečné; 2) léky, kdy je nutné posoudit výhodu podání a riziko pro
pacientku; 3) léky nedoporučené nebo kontraindikované. Bezpečným lékem zůstává
stále paracetamol, případně jeho kombinace s kofeinem. Ve skupině
nesteroidních antiflogistik (NSA) došlo k určitým změnám – běžná NSA
je možné podat v prvním a druhém trimestru (kyselina
acetylsalicylová – ASA, ibuprofen, diklofenak, naproxen, nimesulid,
ketoprofen), ve třetím trimestru jsou však kontraindikovaná. V původních
doporučeních byl podle upozornění doktorky Niedermayerové uváděn pouze druhý
trimestr s podáním ibuprofenu. Sumatriptan lze užít v prvním
trimestru, druhý a třetí trimestr vyžaduje přísné posouzení, ostatní
triptany a ergotamin jsou kontraindikovány. Metamizol je možné podat ve druhém
trimestru. Z antiemetik je povolen metoklopramid v prvním
a druhém trimestru, naopak tietylperazin není v graviditě vůbec
doporučen. Co se týče opioidů (spíše v případě ambulantních pacientů),
tramadol, popř. oxykodon jako zástupci silných opioidů doporučovány nejsou,
za určitých okolností je možné podat kodein, avšak až od pátého
měsíce těhotenství. Pro profylaxi je zcela bezpečné magnezium,
s posouzením rizik lze podat metoprolol, ovšem s tím, že
po porodu může dojít k bradykardii novorozenců. Dále lze užívat
i některá antidepresiva (venlafaxin, citalopram, popř. cinarizin), zcela
kontraindikován je z důvodu teratogenních účinků valproát
a topiramát, pro gabapentin není dostatek údajů.
V období laktace dochází u pacientek zpravidla
k návratu migrény, který však závisí také na tom, zda kojící žena má,
či nemá ovulační cyklus. Pokud žena nekojí, zhruba po měsíci se v 50 % případů vracejí první
záchvaty. Bezpečným lékem v období laktace (opět podle SPC platných
k 31. 12. 2018 v ČR)
je ze skupiny NSA kromě paracetamolu též ibuprofen, který je
považován za lék první volby. S posouzením rizika a výhody lze
z NSA užít pouze ASA, ostatní nejsou doporučována. Pokud volíme triptany,
je potřeba ženu upozornit, že musí přerušit kojení (u sumatriptanu
na 12 hodin, u eletriptanu na 24 hodin). Jestliže je
aplikován metamizol, přerušuje se kojení na 48 hodin, v případě
podání jednotlivé dávky tramadolu se kojení nepřerušuje. V rámci
profylaktické léčby můžeme podat magnezium, avšak není příliš účinné, je tedy
možné sáhnout do skupiny antidepresiv – venlafaxin, amitriptylin,
sertralin, citalopram, popř. gabapentin. Doporučeny nejsou podobně jako
v těhotenství valproát, topiramát, cinarizin, kontraindikovány jsou
betablokátory.
Další významnou oblastí, na niž se přednášející
zaměřila a jíž lze také ovlivnit migrénu, je hormonální antikoncepce,
která při správném cílení může dokonce zmírnit výskyt onemocnění. Hormonální
antikoncepce může být kombinovaná – se složkou estrogenní (nízká dávka
etinylestradiolu 35 μg
po ultranízkou dávku 15 μg)
a progestinovou. Lékař by měl vědět, že existují různé režimy
podání – jednofázové, vícefázové (tří‑, pětifázové), režim 21 + 7 (s tzv. placebo fází), zkrácené režimy
24 + 4, 26 + 2, prodloužený režim 84 + 7
(s placebo fází nebo s velmi nízkou dávkou etinylestradiolu).
Progestinová antikoncepce je k dispozici ve formě perorální,
parenterální či nitrožilního tělíska.
Postup pro volbu antikoncepce u žen trpících migrénou
je ošetřen doporučeními Světové zdravotnické organizace (WHO), v roce 2018
byl publikován konsenzus Evropské federace bolestí hlavy (EHF) a Evropské
společnosti pro antikoncepci a reprodukční zdraví (ESCRH) a vychází
se rovněž z doporučení České gynekologicko‑porodnické společnosti ČLS JEP.
Výsledky populačních studií ukazují, že ženy bez anamnézy migrény při užívání
kombinované perorální antikoncepce (COC) nemají vyšší riziko rozvoje migrény
ve srovnání s kontrolami. Preexistující migréna při užívání COC
zůstává beze změn ve 44‒67 %
případů, zhoršení nastává ve 24‒35 %
a zlepšení v 5‒8 %,
migréna se objevuje v menstruační pauze z důvodu přerušení užívání
estrogenů.
U migrény bez aury jsou doporučeny přípravky
monofázické, protože nemění koncentrace estrogenu. „Někdy gynekologové
doporučují ultranízkodávkované přípravky, ty však nedostatečně tlumí hypotalamo‑hypofyzo‑gonadální
osu a může dojít k vyšší frekvenci rozvoje záchvatů,“ zdůraznila
MUDr. Niedermayerová. U žen s menstruační migrénou můžeme volit
dvě strategie – buď udržovat stabilně vyšší koncentraci estrogenu
(kombinovaná antikoncepce v rozšířeném cyklu), nebo naopak stabilně nízkou
koncentraci estrogenu (čistě progestinová antikoncepce). U žen
v preklimakteriu podáváme progestinovou perorální nebo parenterální
antikoncepci. Nejrizikovější skupinu tvoří pacientky s migrénou
s aurou, u nichž při užívání COC nastává až v 60 % zhoršení záchvatů (podle
údajů z USA). Může u nich dojít k novému výskytu aury,
k rozvoji migrenózního infarktu, zvláště pokud má žena další rizikové
cévní faktory. Proto je u těchto pacientek COC kontraindikována a je
možné jim podat pouze čistě gestagenní antikoncepci.
Absolutní kontraindikací užívání COC jsou podle doporučení
WHO migréna s aurou, migréna bez aury vzniklá při užívání COC u žen
ve věku nad 35 let a u kuřaček a prodělaná cévní mozková
příhoda. Relativní kontraindikace užívání COC představují migréna bez aury
u žen starších 35 let a migréna bez aury vzniklá při užívání COC
u žen mladších 35 let. Relativní kontraindikací čistě progestinové
hormonální antikoncepce je migréna s aurou vzniklá při užívání tohoto typu
antikoncepce. „Uvedená kritéria jsou velmi přísná a užívání antikoncepce
je třeba řešit individuálně, absolutní kontraindikace však platí bezesporu
a můžeme je brát jako klíčové poučení pro gynekology,“ uzavřela doktorka Niedermayerová.
Migréna v praxi, zkušenosti s fremanezumabem
Na nejčastější dotazy z řad lékařů, kteří se
migrénou nezabývají zcela běžně, i z řad pacientů se pokusila
odpovědět primářka MUDr. Jolana Marková, FEAN, z Neurologické kliniky
3. LF UK a Thomayerovy nemocnice v Praze.
Jeden z nejčastějších dotazů zní, zda postačuje, když
diagnózu migrény stanoví praktický lékař. „Pokud se jedná o migrénu bez
aury, splňuje diagnostická kritéria a vypadá typicky, záchvaty nejsou
časté a je zaznamenán spolehlivý efekt triptanů, není důvod, aby pacient
vyhledával další pomoc. Jestliže se jedná o komplikovanější průběh,
v každém případě u migrény s aurou, měl by pacient navštívit
neurologa. Pokud migrenózní proces začíná, je nutné vyloučit sekundaritu,“
uvedla primářka Marková a doplnila, že neurolog by měl zasáhnout také
u nemocných, u nichž se objevují frekventní ataky migrény nebo
u nichž nedostatečně účinkují triptany a specifická antimigrenika,
anebo v případě, že pacient tyto léky netoleruje a nahrazuje je
jinými, což často vede k nadužívání medikace. Na akutní ambulance
nemocnic se většinou dostavují pacienti s první atakou migrény,
s prolongovanou atakou nebo s prolongovanou aurou, rovněž pacienti
s první atakou hemiplegické migrény. U těchto nemocných
přednášející v návaznosti na první příspěvek znovu zdůraznila nutnost
rehydratace, protože pokud takový pacient dostane lék, a nejsou doplněny
tekutiny, není možné dosáhnout dobrého efektu.
U druhého dotazu, zda je nutné provádět u každého
pacienta s migrénou zobrazení (a zda lépe CT, nebo MR), se primářka
Marková obrátila nejprve k americkým doporučením. Subkomise pro standardy
Americké neurologické akademie (AAN) nepovažuje zobrazení za povinné
u pacientů s migrénou, která splňuje kritéria Mezinárodní organizace
pro diagnostiku a léčbu bolestí hlavy (IHS) a u níž je normální
neurologický nález. Rovněž Americká společnost pro bolesti hlavy (AHS)
doporučuje neprovádět zobrazení u pacientů se stabilními neměnnými
bolestmi hlavy, které splňují kritéria pro migrénu. „Zobrazení není nutné
u každého pacienta, ale vždy je doporučujeme například u nového
pacienta s migrénou s aurou, u anxiózního pacienta nebo při
výskytu aneuryzmatu v rodinné anamnéze pro klid pacienta
a podobně,“ uvedla na základě praktických zkušeností přednášející.
Lékaři se rovněž dotazují, k čemu jsou centra pro
diagnostiku a léčbu bolestí hlavy a k čemu by měla sloužit
plánovaná centra pro léčbu migrény. „Tato centra jsou určena pro pacienty,
u nichž se léčba nedaří. Ověřujeme v nich diagnózu, ověřujeme, proč
medikace nepomáhá, zda byla podávána v dostatečné dávce
a po dostatečně dlouhé období, zda pacient dodržuje určitá režimová
opatření. Nejdůležitější je vždy doporučení individualizovaného postupu
‚na míru‘ pro každého jednotlivého pacienta,“ vysvětlila primářka Marková.
V této souvislosti také není možné jednoznačně
odpovědět na otázku, co lze doporučit obecně pouze na profylaxi
migrény. Opět zde platí, že rozhodovat můžeme jen u konkrétního pacienta,
o němž známe další podrobnosti. Toto stanovisko podpořila přednášející
příkladem doporučení nejlepšího postupu v případě dvou odlišných
pacientek, které obě trpí migrénou bez aury s atakami
2‒3× za týden.
Ve druhé části přednášky se primářka Marková věnovala
fremanezumabu a klinické studii HALO, která prokázala účinnost
a bezpečnost této anti‑CGRP monoklonální protilátky u pacientů
s epizodickou i chronickou migrénou, a doplnila též vlastní
zkušenosti s léčbou z domovského pracoviště, které se studie
účastnilo.
Fremanezumab,
který aktuálně čeká na úhradu, byl hodnocen ve dvou studiích třetí
fáze HALO, jež prokázaly, že jak pacienti s chronickou, tak
s epizodickou migrénou dosáhli během dvanáctitýdenní léčby statisticky
významného zlepšení ve všech primárních i sekundárních cílových
ukazatelích (podrobné údaje ke studii již ve svém příspěvku uvedl
MUDr. Doležil). Bylo rovněž zjištěno, že nemocní léčení fremanezumabem
užívali signifikantně méně akutní medikaci ve srovnání s nemocnými
v placebové větvi. „Naše pracoviště se zúčastnilo také follow‑up studií HALO,
kdy kontrolní návštěva u celkem 12 žen a jednoho muže proběhla
za 7,5 měsíce po poslední dávce léku. Tito nemocní trpěli
frekventní epizodickou migrénou nebo chronickou migrénou. Všichni pacienti měli
zájem pokračovat v otevřené fázi studie a všichni také hodnocení
dokončili. Někteří nemocní, u nichž došlo během aktivní léčby
k významnému zlepšení, zůstali po osmi měsících bez terapie
na stejném počtu dnů s migrénou jako před zahájením léčby.
Na druhou stranu evidujeme i takové, kteří si zlepšení udrželi
a jejichž původně velmi nepříznivý stav se dokázal po určité době
léčby stabilizovat,“ okomentovala výsledky malého vzorku pacientů
z Thomayerovy nemocnice primářka Marková (tab. 2). 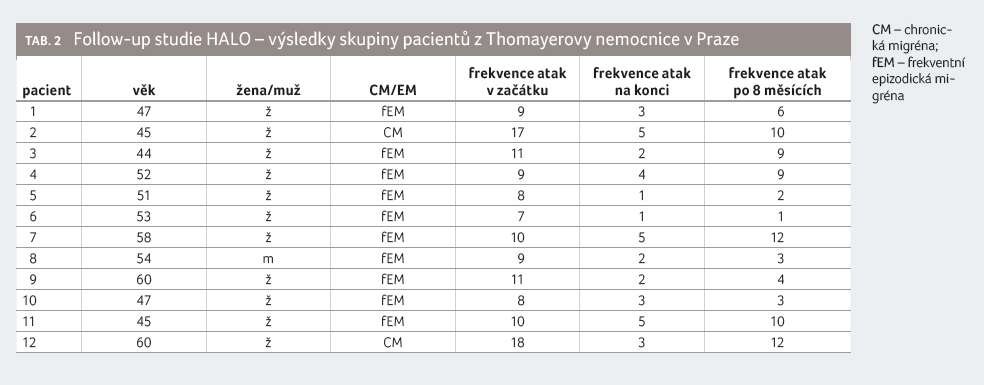
Další klinickou studií s terapií fremanezumabem byla
FOCUS (TV48125‑CNS‑30068), multicentrické, randomizované, dvojitě zaslepené
a placebem kontrolované hodnocení s otevřenou fází, které sledovalo
účinnost a bezpečnost této anti‑CGRP protilátky v profylaktické léčbě
u více než 800 pacientů trpících chronickou nebo epizodickou migrénou,
u nichž byla zaznamenána nedostatečná odpověď
na 2‒4 předcházející preventivní terapie. Studie byla členěna
na 12týdenní dvojitě zaslepenou, placebem kontrolovanou periodu
a na 12týdenní otevřenou fázi s následující bezpečnostní
kontrolou uskutečněnou za šest měsíců po poslední dávce léku.
Hodnocení prokázalo, že pacienti léčení fremanezumabem dosáhli statisticky
významného snížení MMD ve srovnání
s placebem (primární cílový ukazatel), a to o 4,1 dne při
měsíční léčbě (vs. 0,6 dne v placebové větvi) a o 3,7 dne
při kvartální léčbě (p < 0,0001), graf 1A, B. „Na výsledcích studie FOCUS mne zaujalo, že
placebo u skutečně rezistentních pacientů nefunguje, nedosahuje takového
efektu jako ve studii HALO. Fremanezumab měl oproti tomu u těchto
pacientů signifikantní účinek a opět byly srovnatelné výsledky obou režimů
podávání, tedy měsíčního a kvartálního, podobně jako ve studiích
HALO. Naše pracoviště sledovalo v rámci studie FOCUS 11 pacientů,
k významnému zlepšení došlo u sedmi z nich,
avšak u pěti podstatně zlepšených nemocných nastala po půlroce
bez léčby recidiva obtíží,“ doplnila primářka Marková a dodala, že
fremanezumab je velmi dobře tolerován, bez výskytu závažných nežádoucích účinků
a s minimem běžných nežádoucích reakcí.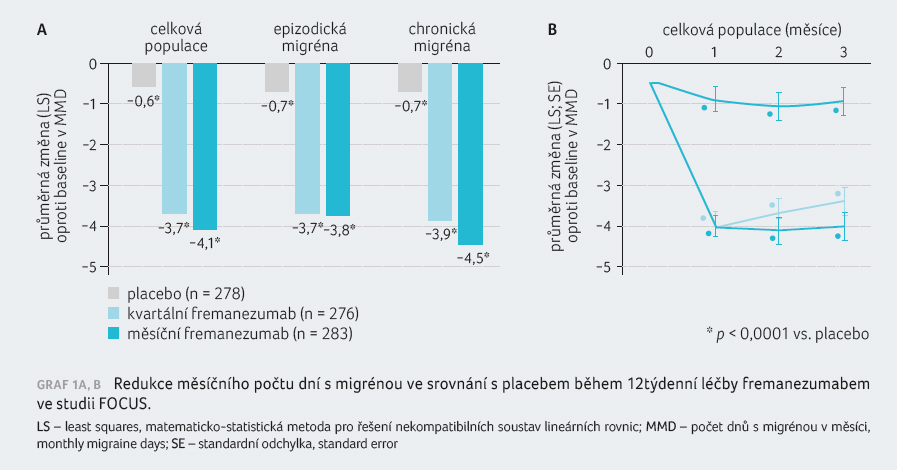
Výsledky ze sledování v Thomayerově nemocnici
i výsledky celé studie představují určitý podklad pro odhad, jak dlouho je
třeba pacienty léčit a kdy je léčbu možné ukončit. Důležité je
u jednotlivých pacientů vědět, jak závažnou formou migrény trpí a kolik
léků už u nich selhalo, shrnula přednášející.