Certolizumab pegol v léčbě revmatoidní artritidy s vysokými titry revmatoidních faktorů
Souhrn
Šenolt L. Certolizumab pegol v léčbě revmatoidní artritidy s vysokými titry revmatoidních faktorů. Remedia 2024; 34: 14–18.
Revmatoidní artritida (RA) je autoimunitní onemocnění charakterizované systémovým a progresivním synoviálním zánětem. Vysoké hladiny revmatoidních faktorů (RF) představují nepříznivý prognostický faktor spojený se závažností onemocnění a pravděpodobně také s horší léčebnou odpovědí. Tato souhrnná práce se zaměřuje na post hoc analýzu klinické studie EXXELERATE, kde byli pacienti s aktivní RA randomizováni k podávání certolizumab pegolu (CZP) nebo adalimumabu (ADA). Původně bylo prokázáno, že účinnost obou přípravků je srovnatelná, včetně případů změny na druhý inhibitor tumor nekrotizujícího faktoru (TNF), a to bez ohledu na příčinu selhání prvního přípravku. Primárním cílem této post hoc analýzy bylo posoudit rozdíly v účinnosti mezi CZP a ADA u pacientů s RA a vysokými hladinami RF. Základní údaje podle kvartilu RF byly k dispozici pro 453 pacientů léčených CZP a pro 454 pacientů, kteří dostávali ADA. Prvním zjištěním bylo, že CZP udržoval u pacientů s vysokými hodnotami RF (horní kvartil) koncentrace léčiva srovnatelné s těmi, jež byly naměřeny u pacientů s nízkým RF, zatímco koncentrace ADA byly významně nižší. Druhým zjištěním byla skutečnost, že aktivita onemocnění byla při terapii oběma biologickými léky u pacientů s nižšími hladinami RF srovnatelná, ale v případě vysokých hladin RF byla ve srovnání s ADA pozorována nižší aktivita onemocnění při podávání CZP. Na rozdílné klinické odpovědi se může podílet vliv vazby RF na Fc oblast monoklonální protilátky s následnou tvorbou imunitních komplexů a redukcí hladiny biologického léčiva. Tato studie naznačuje, že pacienti s RA a vysokými hladinami RF mohou dosáhnout lepších klinických výsledků při léčbě CZP, který jako pegylovaný inhibitor TNF bez Fc fragmentu může představovat vhodnou alternativu pro pacienty s RA a vysokými titry RF.
Klíčová slova: revmatoidní artritida – TNF inhibitor – certolizumab pegol – adalimumab – revmatoidní faktory.
Summary
Senolt L. Certolizumab pegol in the treatment of rheumatoid arthritis with high titers of rheumatoid factors. Remedia 2024; 34: 14–18.
Rheumatoid arthritis (RA) is an autoimmune disease characterized by systemic and progressive synovial inflammation. High titers of rheumatoid factors (RF) represent an unfavorable prognostic trait associated with severity of the illness and probably also with a worse therapeutic response. This article brings a post hoc analysis of the EXXELERATE clinical trial, in which patients suffering from RA were randomized either to certolizumab pegol (CZP) or adalimumab (ADA) treatment. Originally, the effectiveness of both of these drugs was proved to be comparable – including the context of switches to the other tumor‑necrosis factor (TNF) inhibitor and regardless of the cause of the first drug failure. The primary aim of this post hoc analysis was to compare the effectiveness of CZP and ADA treatment in patient with RA and high titers of RF. Basic RF quartile data were available for 453 patients treated with CZP and for 454 patient treated with ADA. First, it was found that CZP concentrations even in patients with high RF titers (upper quartile) were comparable to those with low RF titers while the concentrations of ADA were significantly lower. Second, the disease activity was similar in patients with low RF titers regardless of which biological treatment they received; as for patients with high RF titers, those treated with CZP demonstrated lower disease activity than those treated with ADA. Differences in clinical responses may be explained by the binding of RF to the Fc region of the monoclonal antibody, leading to immunocomplex formation and drug level reduction. This study thus suggests that patients with RA and high RF titers may achieve better clinical results on CZP treatment thanks to the fact that CZP is a pegylated TNF inhibitor, i.e. a TNH inhibitor without the Fc fragment, representing a suitable alternative for such patients.
Key words: rheumatoid arthritis – TNF inhibitor – certolizumab pegol – adalimumab – rheumatoid factors.
Revmatoidní artritida (RA) představuje autoimunitní onemocnění, které postihuje pohybový aparát a je provázeno výskytem řady systémových a orgánových projevů, včetně významného rizika pro rozvoj přidružených onemocnění. Biologické léky, konkrétně inhibitory tumor nekrotizujícího faktoru (TNFi), hrají klíčovou roli v léčbě RA po více než dvě desetiletí. Podávají se většinou ve druhé fázi při selhání konvenčních základních léčebných postupů, především po metotrexátu [1].
V případě, že biologickou terapií není dosaženo remise nebo nízké aktivity onemocnění, je vhodné zvážit změnu na jiný biologický lék s odlišným mechanismem účinku či inhibitor Janus kinázy. Po selhání prvního je stále možné uvažovat o dalším podání TNFi. Tento přístup je možné aplikovat také na biologickou léčbu zasahující na úrovni receptoru pro interleukin 6, pravděpodobně také na cílenou syntetickou léčbu využívající inhibitory Janus kináz [2].
Doporučení využívající změnu jednoho přípravku za druhý ze stejné skupiny se opírají o původní lékové hodnocení, konkrétně o studii GO‑AFTER s golimumabem, které potvrdilo klinickou relevanci změny z jednoho TNFi na druhý [3]. Avšak první přímé srovnání účinnosti a bezpečnosti okamžitého přechodu z jednoho TNFi na druhý bylo provedeno až ve studii EXXELERATE [4]. Pacienti byli randomizováni v poměru 1 : 1 k léčbě certolizumab pegolem (CZP) v dávce 200 mg nebo adalimumabem (ADA) v dávce 40 mg. Oba přípravky se podávaly každé dva týdny a v kombinaci s metotrexátem. Ve 12. týdnu byli pacienti klasifikováni podle léčebné odpovědi a ti, u nichž selhala léčba prvním TNFi, byli převedeni na druhý. Na základě výsledků této studie bylo zjištěno, že účinnost obou přípravků je srovnatelná, včetně případů změny na druhý TNFi, a to bez ohledu na příčinu selhání prvního TNFi.
Vysoké hodnoty revmatoidních faktorů (RF) u pacientů s RA jsou považovány za nepříznivý prognostický faktor a spojují se častěji s vyšší aktivitou onemocnění, rizikem radiografické progrese a s nižší odpovědí na léčbu TNFi [5,6]. Post hoc analýza studie EXXELERATE měla za cíl posoudit rozdíly v účinnosti mezi CZP a ADA u pacientů s RA a vysokými hladinami RF [7]. Ve 104. týdnu byly měřeny plazmatické koncentrace biologického léku, průměrná hodnota skóre DAS 28‑CRP (disease activity score‑28 for rheumatoid arthritis with C‑reactive protein) a podíl pacientů dosahujících nízké aktivity onemocnění (DAS 28‑CRP ≤ 2,7). Výsledky byly stratifikovány podle kvartilu RF na plazmatické koncentrace ≤ 204 IU/ml (≤ Q3) a hodnoty > 204 IU/ml (> Q3).
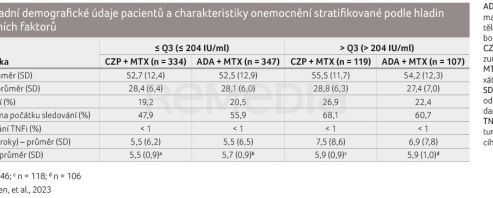 Základní údaje podle kvartilu RF byly k dispozici pro 453 pacientů randomizovaných k podávání CZP (≤ Q3: n = 334; > Q3: n = 119) a 454 pacientů randomizovaných k terapii ADA (≤ Q3: n = 347; > Q3: n = 107). Ve 12. týdnu přešlo 66 pacientů léčených CZP na ADA a 59 pacientů léčených ADA na CZP. Demografická a klinická data jsou uvedena v tabulce 1.
Základní údaje podle kvartilu RF byly k dispozici pro 453 pacientů randomizovaných k podávání CZP (≤ Q3: n = 334; > Q3: n = 119) a 454 pacientů randomizovaných k terapii ADA (≤ Q3: n = 347; > Q3: n = 107). Ve 12. týdnu přešlo 66 pacientů léčených CZP na ADA a 59 pacientů léčených ADA na CZP. Demografická a klinická data jsou uvedena v tabulce 1.
![GRAF 1A, B Průměrné plazmatické koncentrace biologických léků – certolizumab pegolu (A) a adalimumabu (B) – do 104. týdne stratifikované podle kvartilů revmatoidních faktorů; podle [7] – Smolen, et al., 2023. ADA – adalimumab; CZP – certolizumab pegol; MTX – metotrexát; Q – kvartil; RF – revmatoidní faktor; SD – směrodatná odchylka, standard deviation GRAF 1A, B Průměrné plazmatické koncentrace biologických léků – certolizumab pegolu (A) a adalimumabu (B) – do 104. týdne stratifikované podle kvartilů revmatoidních faktorů; podle [7] – Smolen, et al., 2023. ADA – adalimumab; CZP – certolizumab pegol; MTX – metotrexát; Q – kvartil; RF – revmatoidní faktor; SD – směrodatná odchylka, standard deviation](https://www.remedia.cz/photo-pg-1271---.jpg) Průměrné plazmatické koncentrace léku byly ve 104. týdnu u pacientů stratifikovaných podle hladin RF v případě léčby CZP podobné, ale v případě léčby ADA se lišily. U pacientů s vysokými hodnotami RF byly průměrné plazmatické koncentrace ADA o 22,9 % nižší ve srovnání s pacienty s nižší hodnotou RF, kdežto u pacientů léčených CZP byl tento rozdíl významně menší (13,0 %; graf 1A, B).
Průměrné plazmatické koncentrace léku byly ve 104. týdnu u pacientů stratifikovaných podle hladin RF v případě léčby CZP podobné, ale v případě léčby ADA se lišily. U pacientů s vysokými hodnotami RF byly průměrné plazmatické koncentrace ADA o 22,9 % nižší ve srovnání s pacienty s nižší hodnotou RF, kdežto u pacientů léčených CZP byl tento rozdíl významně menší (13,0 %; graf 1A, B).
![GRAF 2A–D Odpověď na léčbu přípravky certolizumab pegol a adalimumab do 104. týdne měřená podle DAS 28-CRP (A, B) a podíl pacientů, kteří dosáhli nízké aktivity onemocnění dle DAS 28-CRP (C, D), stratifikované podle kvartilů revmatoidních faktorů; podle [7] – Smolen, et al., 2023. ADA – adalimumab; CZP – certolizumab pegol; DAS 28-CRP – disease activity score-28 for rheumatoid arthritis with C-reactive protein; RF – revmatoidní faktor; SD – směrodatná odchylka, standard deviation GRAF 2A–D Odpověď na léčbu přípravky certolizumab pegol a adalimumab do 104. týdne měřená podle DAS 28-CRP (A, B) a podíl pacientů, kteří dosáhli nízké aktivity onemocnění dle DAS 28-CRP (C, D), stratifikované podle kvartilů revmatoidních faktorů; podle [7] – Smolen, et al., 2023. ADA – adalimumab; CZP – certolizumab pegol; DAS 28-CRP – disease activity score-28 for rheumatoid arthritis with C-reactive protein; RF – revmatoidní faktor; SD – směrodatná odchylka, standard deviation](https://www.remedia.cz/photo-pg-1272---.jpg) Aktivita onemocnění podle DAS 28‑CRP byla ve 104. týdnu u pacientů s nižšími hodnotami RF mezi těmi, kteří užívali CZP nebo ADA, srovnatelná. U pacientů s vysokými hodnotami RF byla na druhé straně aktivita onemocnění podle DAS 28‑CRP ve 104. týdnu nižší v případě léčby CZP ve srovnání s ADA (graf 2A–D). Podobný trend byl pozorován s ohledem na dosažení nízké aktivity onemocnění. Při stratifikaci pacientů podle úrovně hladin protilátek proti citrulinovaným proteinům (anti‑citrullinated protein antibodies, ACPA) nebyl v dosaženém skóre DAS 28‑CRP nebo dosaženém stavu nízké aktivity pozorován významný rozdíl mezi pacienty léčenými CZP nebo ADA (graf 3A, B).
Aktivita onemocnění podle DAS 28‑CRP byla ve 104. týdnu u pacientů s nižšími hodnotami RF mezi těmi, kteří užívali CZP nebo ADA, srovnatelná. U pacientů s vysokými hodnotami RF byla na druhé straně aktivita onemocnění podle DAS 28‑CRP ve 104. týdnu nižší v případě léčby CZP ve srovnání s ADA (graf 2A–D). Podobný trend byl pozorován s ohledem na dosažení nízké aktivity onemocnění. Při stratifikaci pacientů podle úrovně hladin protilátek proti citrulinovaným proteinům (anti‑citrullinated protein antibodies, ACPA) nebyl v dosaženém skóre DAS 28‑CRP nebo dosaženém stavu nízké aktivity pozorován významný rozdíl mezi pacienty léčenými CZP nebo ADA (graf 3A, B).
![GRAF 3A, B Odpověď na léčbu přípravky certolizumab pegol a adalimumab do 104. týdne měřená podle DAS 28-CRP a stratifikovaná podle kvartilu protilátek proti citrulinovaným proteinům; podle [7] – Smolen, et al., 2023. ACPA – anti-citrullinated protein antibodies; ADA – adalimumab; CZP – certolizumab pegol; DAS 28-CRP – disease activity score-28 for rheumatoid arthritis with C-reactive protein GRAF 3A, B Odpověď na léčbu přípravky certolizumab pegol a adalimumab do 104. týdne měřená podle DAS 28-CRP a stratifikovaná podle kvartilu protilátek proti citrulinovaným proteinům; podle [7] – Smolen, et al., 2023. ACPA – anti-citrullinated protein antibodies; ADA – adalimumab; CZP – certolizumab pegol; DAS 28-CRP – disease activity score-28 for rheumatoid arthritis with C-reactive protein](https://www.remedia.cz/photo-pg-1273---.jpg) Závěrem je možné předpokládat, že pacienti s RA a vysokými hladinami RF si při léčbě CZP udržovali dostatečné koncentrace léku, a měli tak lepší klinické výsledky než pacienti léčení ADA. Protože tyto výsledky nebyly pozorovány při stratifikaci podle hladiny ACPA, je možné předpokládat, že navázání RF na Fc oblast imunoglobulinu G, tedy i na biologická léčiva, jakými jsou např. TNFi, vede ke vzniku velkých imunitních komplexů s následnou redukcí hladin léku a nižší účinností [8]. Protože CZP je pegylovaný TNFi bez fragmentu Fc, může představovat vhodnou léčebnou alternativu pro pacienty s RA a vysokými hladinami RF. Toto je v souladu s rozsáhlou post hoc analýzou několika studií s CZP u časné a etablované RA, kde byl prokázán stabilní účinek CZP napříč výchozími kvartily RF [9]. Na podkladě předběžných dat z kohortové studie bylo nedávno japonskými autory prokázáno, že CZP může být u pacientů s RA a vysokými titry RF účinnější než ostatní TNFi bez Fc fragmentu [10]. Nedávno bylo navíc také zjištěno, že pokles hodnoty RF nebo úplná sérokonverze po třech měsících predikovaly dosažení léčebného cíle v období 6–24 měsíců po zahájení léčby, a to nezávisle na časném zmírnění aktivity onemocnění [11]. Potvrzení vlivu vysokých hladin RF na účinek biologické léčby a úloha CZP v této situaci si vyžádají další výzkum minimálně na úrovni dat z registrů.
Závěrem je možné předpokládat, že pacienti s RA a vysokými hladinami RF si při léčbě CZP udržovali dostatečné koncentrace léku, a měli tak lepší klinické výsledky než pacienti léčení ADA. Protože tyto výsledky nebyly pozorovány při stratifikaci podle hladiny ACPA, je možné předpokládat, že navázání RF na Fc oblast imunoglobulinu G, tedy i na biologická léčiva, jakými jsou např. TNFi, vede ke vzniku velkých imunitních komplexů s následnou redukcí hladin léku a nižší účinností [8]. Protože CZP je pegylovaný TNFi bez fragmentu Fc, může představovat vhodnou léčebnou alternativu pro pacienty s RA a vysokými hladinami RF. Toto je v souladu s rozsáhlou post hoc analýzou několika studií s CZP u časné a etablované RA, kde byl prokázán stabilní účinek CZP napříč výchozími kvartily RF [9]. Na podkladě předběžných dat z kohortové studie bylo nedávno japonskými autory prokázáno, že CZP může být u pacientů s RA a vysokými titry RF účinnější než ostatní TNFi bez Fc fragmentu [10]. Nedávno bylo navíc také zjištěno, že pokles hodnoty RF nebo úplná sérokonverze po třech měsících predikovaly dosažení léčebného cíle v období 6–24 měsíců po zahájení léčby, a to nezávisle na časném zmírnění aktivity onemocnění [11]. Potvrzení vlivu vysokých hladin RF na účinek biologické léčby a úloha CZP v této situaci si vyžádají další výzkum minimálně na úrovni dat z registrů.
Prof. MUDr. Ladislav Šenolt, Ph.D.
Revmatologický ústav
Na Slupi 450/4, 128 00 Praha 2
e-mail: senolt@revma.cz
Literatura
[1] Smolen JS, Landewé RBM, Bergstra SA, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs: 2022 update. Ann Rheum Dis 2023; 82: 3–18.
[2] Pombo‑Suarez M, Sanchez‑Piedra C, Gómez‑Reino J, et al. After JAK inhibitor failure: to cycle or to switch, that is the question – data from the JAK‑pot collaboration of registries. Ann Rheum Dis 2023; 82: 175–181.
[3] Smolen JS, Kay J, Doyle MK, et al; GO‑AFTER study investigators. Golimumab in patients with active rheumatoid arthritis after treatment with tumour necrosis factor alpha inhibitors (GO‑AFTER study): a multicentre, randomised, double‑blind, placebo‑controlled, phase III trial. Lancet 2009; 374: 210–221.
[4] Smolen JS, Burmester GR, Combe B, et al. Head‑to‑head comparison of certolizumab pegol versus adalimumab in rheumatoid arthritis: 2‑year efficacy and safety results from the randomised EXXELERATE study. Lancet 2016; 388: 2763–2774.
[5] Vastesaeger N, Xu S, Aletaha D, et al. A pilot risk model for the prediction of rapid radiographic progression in rheumatoid arthritis. Rheumatology (Oxford) 2009; 48: 1114–1121.
[6] Cuchacovich M, Bueno D, Carvajal R, et al. Clinical parameters and biomarkers for anti‑TNF treatment prognosis in rheumatoid arthritis patients. Clin Rheumatol 2014; 33: 1707–1714.
[7] Smolen J, Taylor P, Tanaka Y, et al. Do High RF Titers Impact Response to TNF Inhibitors? Comparison of Certolizumab Pegol and Adalimumab in Patients with RA and High Titers of RF: A Post Hoc Analysis of a Phase 4 Trial. ACR 2023; Abstr. Nr. 2148. Arthritis Rheumatol 2023; 75(Suppl 9).
[8] Maibom‑Thomsen SL, Trier NH, Holm BE, et al. Immunoglobulin G structure and rheumatoid factor epitopes. PLoS One 2019; 14: e0217624.
[9] Tanaka Y, Takeuchi T, Haaland D, et al. Efficacy of certolizumab pegol across baseline rheumatoid factor subgroups in patients with rheumatoid arthritis: Post‑hoc analysis of clinical trials. Int J Rheum Dis 2023; 26: 1248–1259.
[10] Nakayama Y, Watanabe R, Murakami K, et al. Differential efficacy of TNF inhibitors with or without the immunoglobulin fragment crystallizable (Fc) portion in rheumatoid arthritis: the ANSWER cohort study. Rheumatol Int 2022; 42: 1227–1234.
[11] Konzett V, Aletaha D. Early response in rheumatoid factor levels predicts subsequent clinical response to disease modifying treatment of rheumatoid arthritis. Ann Rheum Dis 2023; 82: 179.