10valentní pneumokoková vakcína konjugovaná na D-protein
Nová, 10valentní konjugovaná pneumokoková vakcína přináší širší pokrytí vakcinačních sérotypů o sérotypy 1, 5 a 7F. Většina sérotypů je navázána na unikátní proteinový nosič, díky kterému byla v rámci studie POET s kandidátní 11valentní vakcínou prokázána statisticky významná protektivita proti akutním hemofilovým zánětům středního ucha. 10valentní vakcína je indikována pro aktivní imunizaci protiinvazivním onemocněním a akutnímu zánětu středního ucha vyvolaným Streptococcus pneumoniae.
Vývoj konjugovaných pneumokokových vakcín umožnil odstranit základní nevýhodu 23valentní polysacharidové vakcíny, tedy neúčinnost u dětí mladších dvou let, kdy je břemeno pneumokokových infekcí v dětském věku zdaleka největší. Zatímco 7valentní pneumokoková vakcína Prevenar se používá celosvětově již téměř 10 let, nová, 10valentní vakcína Synflorix je k dispozici od počátku dubna 2009. Tento stav byl dlouhodobě toužebně očekáván, neboť nikdy klinické praxi neprospívá monopolní postavení jednoho přípravku na trhu. Alespoň dva srovnatelné konkurenční přípravky jednak stimulují další vývoj, jednak přispívají k regulaci ceny. Vývoj konjugovaných vakcín je nesmírně náročný. To dokumentuje i v současnosti nevídaný časový náskok jednoho výrobce před ostatními, ale i skutečnost, že není možno do vakcíny libovolně přidávat další sérotypy a předpokládat, že původní sérotypy budou automaticky generovat identickou odpověď. Bohužel dochází k vzájemné interferenci mezi jednotlivými sérotypy a tomuto problému čelí oba výrobci. Ukazuje se, že možný další vývoj konjugovaných pneumokokových vakcín může mít své limity, a není vyloučeno, že do nových kandidátních konjugovaných pneumokokových vakcín již další sérotypy přidávány nebudou [1, 2].
Co nám může nová, 10valentní vakcína nabídnout ve srovnání s vakcínou stávající? Vakcína byla původně označována jako PHiD-CV a logicky až po registraci získala svůj současný komerční název. Ten vychází z dlouholeté strategie společnosti GSK, kdy vakcíny nesou příponu „-rix“ podle belgického městečka Rixensart, kde vznikají. I zbytek názvu vakcíny má svoji logiku, neboť vyjadřuje synergické působení proti dvěma patogenům – Streptococcus pneumoniae a Haemophilus influenzae.
Vakcína obsahuje sérotypy 1, 4, 5, 6B, 7F, 9V, 14 a 23F konjugované na protein D (odvozený z kmenů netypovatelného Haemophilus influenzae), sérotyp 18C konjugovaný na tetanický toxoid jako proteinový nosič a 19F konjugovaný na difterický toxoid [3, 4]. V tomto smyslu přináší jednoznačné rozšíření stávajícího spektra o sérotypy 1, 5, 7F. Jako původci akutních zánětů středního ucha se sice tyto sérotypy uplatňují v České republice pouze sporadicky, ale jejich úloha v etiologii invazivních onemocnění je zcela nepopiratelná. Patří mezi sérotypy, jejichž výskyt „v éře“ 7valentní vakcíny v řadě zemí světa výrazně narůstá. Epidemiologická situace v ČR u invazivních onemocnění ukazuje zejména na sérotypy 1 a 7F. Sérotyp 5 se v ČR u malých dětí prakticky neuplatňuje, naopak sérotyp 1 je častým původcem atypických pneumonií s empyémem [5]. Sérotyp 19A u nás zatím zdaleka nehraje takovou roli jako v některých jiných zemích.
Indikace a očkovací schéma
 Indikací vakcíny je aktivní imunizace proti invazivním onemocněním a akutní otitis media způsobeným Streptococcus pneumoniae u kojenců a dětí ve věku od 6 týdnů do 2 let. Vakcína se podává intramuskulární injekcí, a to přednostně do anterolaterální části stehna u kojenců nebo do deltového svalu ramene u malých dětí. Očkovací schéma shrnuje tab. 1. Doporučuje se, aby jedinci, kterým je podána první dávka očkovací látky Synflorix, dokončili celé očkovací schéma tímto přípravkem. Nicméně kombinovatelnost vakcín je dle Souhrnu údajů o přípravku (SPC) umožněna. V takovém případě je však nutno počítat s nižší účinností proti hemofilovým infekcím a také proti sérotypům, které nejsou přítomny v obou vakcínách. Použití v indikaci u dětí starších dvou let zatím nebylo schváleno, neboť studie u této věkové kategorie ještě probíhají. Populace dětí starších dvou let však rozhodně není primární cílovou skupinou pro imunizaci proti pneumokokům [5]. I když údaje o účinnosti vakcíny
Indikací vakcíny je aktivní imunizace proti invazivním onemocněním a akutní otitis media způsobeným Streptococcus pneumoniae u kojenců a dětí ve věku od 6 týdnů do 2 let. Vakcína se podává intramuskulární injekcí, a to přednostně do anterolaterální části stehna u kojenců nebo do deltového svalu ramene u malých dětí. Očkovací schéma shrnuje tab. 1. Doporučuje se, aby jedinci, kterým je podána první dávka očkovací látky Synflorix, dokončili celé očkovací schéma tímto přípravkem. Nicméně kombinovatelnost vakcín je dle Souhrnu údajů o přípravku (SPC) umožněna. V takovém případě je však nutno počítat s nižší účinností proti hemofilovým infekcím a také proti sérotypům, které nejsou přítomny v obou vakcínách. Použití v indikaci u dětí starších dvou let zatím nebylo schváleno, neboť studie u této věkové kategorie ještě probíhají. Populace dětí starších dvou let však rozhodně není primární cílovou skupinou pro imunizaci proti pneumokokům [5]. I když údaje o účinnosti vakcíny ![gr1.jpgGraf 1 Účinnost kandidátní pneumokokové vakcíny (VE) proti akutní otitis media (AOM); podle [8] – Prymula, et al., 2006.](https://www.remedia.cz/photo-a-27522---.jpg) Synflorix proti akutní otitis media jednoznačně vycházejí z naší studie POET s kandidátní 11valentní vakcínou, která uvádí celkovou účinnost proti této infekci na úrovni 33,6 %, tedy několikanásobně vyšší, než bylo zjištěno při aplikaci 7valentní vakcíny [6, 7], specifická indikace na hemofilové záněty středního ucha není v SPC uvedena. Důvodem je, že studie POET byla prováděna s mírně odlišnou vakcínou [6], a přestože výsledky jsou potvrzeny i na zvířecím modelu (činčila), čeká se na potvrzení tohoto efektu v rozsáhlých studiích probíhajících v Latinské Americe a ve Finsku. Celková účinnost kandidátní vakcíny zahrnuje i otitidy virové, proti kterým vakcína nemůže chránit. Účinnost proti bakteriálním původcům přesahuje 42 % (viz graf 1).
Synflorix proti akutní otitis media jednoznačně vycházejí z naší studie POET s kandidátní 11valentní vakcínou, která uvádí celkovou účinnost proti této infekci na úrovni 33,6 %, tedy několikanásobně vyšší, než bylo zjištěno při aplikaci 7valentní vakcíny [6, 7], specifická indikace na hemofilové záněty středního ucha není v SPC uvedena. Důvodem je, že studie POET byla prováděna s mírně odlišnou vakcínou [6], a přestože výsledky jsou potvrzeny i na zvířecím modelu (činčila), čeká se na potvrzení tohoto efektu v rozsáhlých studiích probíhajících v Latinské Americe a ve Finsku. Celková účinnost kandidátní vakcíny zahrnuje i otitidy virové, proti kterým vakcína nemůže chránit. Účinnost proti bakteriálním původcům přesahuje 42 % (viz graf 1).
Příbalová informace vakcíny Prevenar uvádí pro plošné očkování v nejnižší věkové kategorii dvoudávkové schéma s následným přeočkováním (2+1). Synflorix nemá schéma 2+1 explicitně uvedeno, avšak v kontextu je toto schéma pro plošné národní programy rovněž dovoleno. Proběhlé studie paradoxně ukazují, že hladiny protilátek u dvoudávkového schématu jsou vyšší u vakcíny Synflorix po primárním schématu, po booster dávce naopak u vakcíny Prevenar.
Účinnost
Protektivní účinnost vakcíny Synflorix proti invazivním pneumokokovým onemocněním (IPD) nebyla studována. Podle doporučení WHO je hodnocení potenciální účinnosti proti IPD založeno na srovnání imunitních odpovědí na 7 sérotypů společných pro vakcínu Synflorix a pneumokokovou konjugovanou vakcínu s již prokázanou protektivní účinností (7valentní Prevenar) [2]. Také byla měřena imunitní odpověď na další tři sérotypy obsažené ve vakcíně Synflorix. Účinnost proti akutní otitis media (AOM) byla sledována ve velké randomizované dvojitě zaslepené studii Pneumococcal Otitis Media Efficacy Trial (POET), po jejímž ukončení následoval tzv. imunobridging; jedná se o metodu užívanou k přenosu výsledků účinnosti srovnatelných vakcín na základě ekvivalence imunitní odpovědi jak protilátkové, tak zjištěné měřením opsonofagocytózy (OPA). Ve studii POET byla podávána 11valentní kandidátní vakcína (11Pn-PD), která obsahovala i 10 sérotypů obsažených ve vakcíně Synflorix. Účinnost vakcíny 11Pn-PD v hodnocení výskytu první epizody AOM vyvolané sérotypem obsaženým ve vakcíně byla 52,6 % (95% CI: 35,0–65,5). Účinnost vakcíny proti jakékoli epizodě AOM způsobené jakýmkoli sérotypem pneumokoka byla 51,5 % (95% CI: 36,8–62,9). V této studii nebylo pozorováno žádné zvýšení výskytu AOM způsobené jiným bakteriálním patogenem nebo sérotypem pneumokoka, než jaký je obsažen ve vakcíně Synflorix. Odhadovaná účinnost vakcíny proti jakékoli klinické epizodě otitis media bez ohledu na etiologii byla 33,6 % (95 % CI: 20,8–44,3). Na základě imunologických překlenovacích studií funkčních odpovědí (OPA) mezi vakcínou Synflorix a 11valentní kandidátní vakcínou použitou ve studii POET se předpokládá, že Synflorix poskytne obdobnou protektivní účinnost proti pneumokokovým AOM. Je nutno zmínit, že rozdíl v účinnosti 11valentní vakcíny oproti vakcíně Prevenar nebude v konečném výsledku 33,6 % vs. 7 %. Tyto dvě studie totiž nejsou zcela srovnatelné a poměrně důležitou roli hraje epidemiologická situace (např. četnější výskyt gramnegativního koku Moraxella catarrhalis) či přítomnost náhrady (replacement) patogeny, které nejsou vakcínou pokryty. Přesto je rozdíl mezi účinností obou vakcín po odladění všech případných vlivů přibližně 2,5násobný ve prospěch vakcíny Synflorix. Na druhé straně, u dvou sérotypů vykázala vakcína Synflorix nižší protilátkovou odpověď než vakcína Prevenar. Imunobridging odpovědi OPA demonstruje non-inferioritu pro 8 z 10 sérotypů vyvolávajících AOM; hodnocením na základě srovnání středních geometrických titrů OPA byla prokázána non-inferiorita pro všechny sérotypy. Klinický význam této skutečnosti však zůstává nejasný [5, 8].
Nežádoucí účinky a zvláštní upozornění
Bezpečnostní profil 10valentní pneumokokové vakcíny Synflorix je obdobný jako u vakcíny Prevenar. Data o bezpečnosti a imunogenicitě nejsou u dětí starších dvou let zatím k dispozici. Profylaktické podání antipyretik před aplikací nebo bezprostředně po aplikaci vakcíny může snížit incidenci a intenzitu horečnatých reakcí po očkování. Údaje však naznačují, že profylaktické podání paracetamolu může snižovat imunitní odpověď vyvolanou přípravkem Synflorix. Klinický význam tohoto pozorování, stejně jako vliv jiných antipyretik na imunitní odpověď, není znám. Profylaktické podání antipyretik se doporučuje u všech dětí, kterým je Synflorix podán současně s vakcínami s celobuněčnou pertusovou složkou vzhledem k vyšší frekvenci febrilních křečí a u dětí s křečemi nebo s anamnézou febrilních křečí. Synflorix nesmí být v žádném případě aplikován intravaskulárně nebo intradermálně, údaje o subkutánním podání nejsou k dispozici [9].
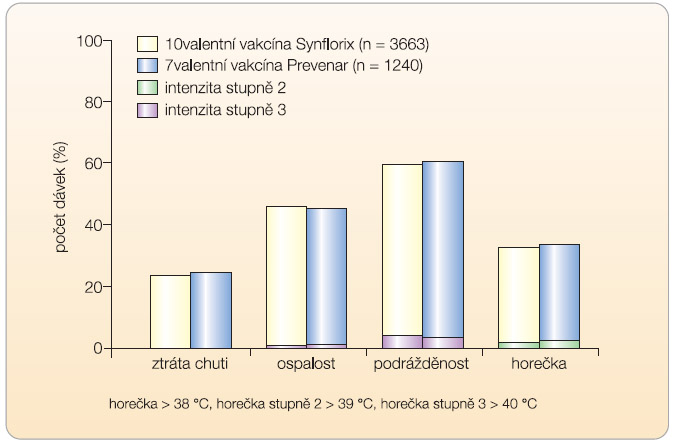 Podrobné srovnání celkových nežádoucích účinků obou registrovaných pneumokokových vakcín udává graf 2. Je zřejmé, že obě vakcíny jsou zcela srovnatelné a dobře tolerovatelné. To platí i v případě místních reakcí. Synflorix byl vyvinut ke společné aplikaci s ostatními monovalentními nebo kombinovanými vakcínami. Možná je konkomitantní aplikace s následujícími očkovacími látkami: DTaP1 + IPV2 + Hib3 + HBV4, DTaP + IPV + HBV, DTaP + IPV + Hib, MenC5/ HibMenC, DTwP6 Hep B4 Hib, DTaP, MMR7/V8, Rota9, Varicella virus (kmen OKA), IPV/OPV10. Injekce jednotlivých vakcín musí být aplikovány do různých míst.
Podrobné srovnání celkových nežádoucích účinků obou registrovaných pneumokokových vakcín udává graf 2. Je zřejmé, že obě vakcíny jsou zcela srovnatelné a dobře tolerovatelné. To platí i v případě místních reakcí. Synflorix byl vyvinut ke společné aplikaci s ostatními monovalentními nebo kombinovanými vakcínami. Možná je konkomitantní aplikace s následujícími očkovacími látkami: DTaP1 + IPV2 + Hib3 + HBV4, DTaP + IPV + HBV, DTaP + IPV + Hib, MenC5/ HibMenC, DTwP6 Hep B4 Hib, DTaP, MMR7/V8, Rota9, Varicella virus (kmen OKA), IPV/OPV10. Injekce jednotlivých vakcín musí být aplikovány do různých míst.
Vysvětlivky: 1 DTaP – difterie, tetanus, acelulární pertuse; 2 IPV – dětská obrna (inaktivovaná, injekční); 3 Hib – Haemophilus influenzae typu b; 4 HBV, Hep B – hepatitida B; 5 MenC – meningokok typu C; 6 DTwP – difterie, tetanus, celobuněčná pertuse; 7 MMR – spalničky, příušnice, zarděnky; 8 V – plané neštovice (varicella); 9 Rota – rotaviry (perorální); 10 OPV – dětská obrna (perorální)
Seznam použité literatury
- [1] O'Brien KL, Santosham M. Potential impact of conjugate pneumococcal vaccines on pediatric pneumococcal diseases. Am J Epidemiol 2004; 159: 634–644.
- [2] World Health Organization Recommendations for production and control of pneumococcal conjugate vaccines. WHO Technical Report Series 2005; No 927, Annex 2.
- [3] Henckaerts I, Durant N, De Grave D, et al. Validation of Routine High-throughput Pneumococcal Opsonophagocytosis Assays. Link with Clinical Efficacy. [Abstract DT.07]. In: Proceedings of the Program and Abstracts of the 5th International Symposium on Pneumococci and Pneumococcal Diseases. Alice Springs (Australia); 2-6 April 2006.
- [4] Ruan MR, Akkoyunlu M, Grubb A, Forsgren A. Protein D of Haemophilus influenzae. A novel bacterial surface protein with affinity for human IgD. J Immunol 1990; 145: 3379–3384.
- [5] Křížová P, Marešová V, Prymula R, et al. Pneumokoková onemocnění. Pediatrie pro praxi 2009; 10 (Suppl. B): 45 s.
- [6] Black S, Shinefield H, Fireman B, et al. Efficacy, safety and immunogenicity of heptavalent pneumococcal conjugate vaccine in children. Pediatr Infect Dis J 2000; 19: 187–195.
- [7] Eskola J, Kilpi T, Palmu A, et al. Efficacy of a pneumococcal conjugate vaccine against acute otitis media. N Engl J Med 2001; 344: 403–409.
- [8] Prymula R, Peeters P, Chrobok, et al. Pneumococcal capsular polysaccharides conjugated to protein D provide protection against otitis media caused by both Streptococcus pneumoniae and nontypable Haemophilus influenzae. Lancet 2006; 367: 740–748.