Abemaciklib v terapii metastatického HR pozitivního/HER2 negativního karcinomu prsu
Souhrn:
Palácová M. Abemaciklib v terapii metastatického HR pozitivního/HER2 negativního karcinomu prsu. Remedia 2020; 30: 391–395.
Metastatický karcinom prsu představuje i nadále nevyléčitelné onemocnění. Úvodní terapií u luminálního HR+/HER2– typu nádoru je hormonální léčba (HT), která je velmi efektivní a má nízkou toxicitu. Její účinnost je však limitovaná, časem dochází vždy k progresi onemocnění v důsledku vzniku hormonální rezistence. Na překonání hormonální rezistence je zaměřen výzkum posledních let. Uplatňují se léčebné kombinace nejenom dvou hormonálních přípravků, ale především kombinace HT s cílenou léčbou. Kromě již využívané kombinace exemestanu s everolimem je v posledních letech v popředí skupina inhibitorů cyklin‑dependentních kináz (CDK) 4/6, které jsou v léčbě kombinovány s HT. Abemaciklib je zatím posledním ze skupiny inhibitorů CDK 4/6, který je v kombinované léčbě s inhibitory aromatáz nebo s fulvestrantem využíván.
Summary:
Palacova M. Abemaciclib in the therapy of metastatic HR positive/HER2 negative breast cancer. Remedia 2020; 30: 391–395.
Metastatic breast cancer remains an incurable disease. The initial therapy for luminal HR+/HER2– type tumor is endocrine therapy (HT), which is very effective with low toxicity. However, its effectiveness is limited; over time, the disease always progresses due to the development of hormonal resistance. Research in recent years has focused on overcoming hormonal resistance. Therapeutic combinations of not only 2 hormonal drugs are used, but above all combinations of endocrine treatment with targeted treatment. In addition to the already used combination of exemestane with everolimus, a group of CDK 4/6 inhibitors combined with HT during treatment has been in the forefront in recent years. Abemaciclib is so far the last of the group of CDK 4/6 inhibitors to be used in combination therapy with aromatase inhibitors or fulvestrant.
Key words: advanced breast cancer , SR+/HER, immunophenotype, hormonal resistance, endocrine treatment, CDK 4/6 inhibitors.
Metastatický karcinom prsu je
i nadále nevyléčitelným onemocněním. U luminálních
nádorů, tzn. nádorů s pozitivitou hormonálních receptorů
(HR), je uváděno pětileté přežití kolem 25−30 %. Asi 70 %
všech metastatických nádorů prsu vykazuje expresi HR a standardně
jsou tyto pacientky léčeny paliativní hormonální terapií (HT),
nicméně lze použít i chemoterapii a v posledních
letech i cílenou terapii. Preferovanou úvodní terapií je HT,
která je efektivní a velmi dobře snášena. Její účinnost
je ale limitovaná a u většiny pacientek dojde k jejímu
selhání – k progresi nemoci. V první linii léčby
u metastatického onemocnění dochází k progresi
po 6−15 měsících terapie. Příčinou progrese
onemocnění je primární nebo sekundární hormonální rezistence.
Proto je snahou posledních let překonat tuto rezistenci nejenom
kombinací dvou hormonálních přípravků, ale především
kombinací HT s cílenými léky [1,2]. V současné době
je nejefektivnější a preferovanou terapií kombinace
inhibitorů aromatázy, popřípadě fulvestrantu s inhibitory
cyklin dependentních kináz 4/6 (CDK 4/6). K dispozici
máme v současné době tři přípravky – palbociklib,
ribociklib a abemaciklib.
Abemaciklib
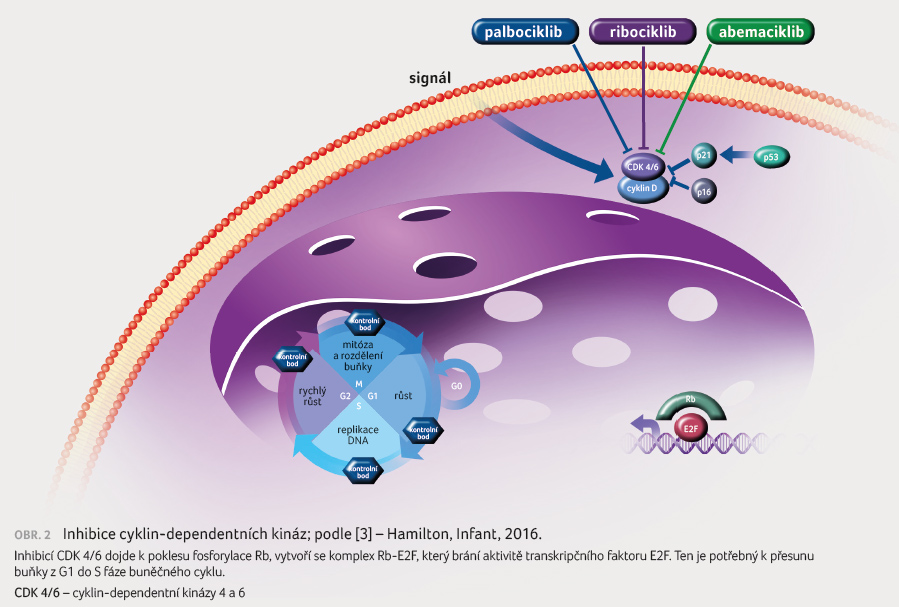
Abemaciklib je perorální vysoce selektivní inhibitor CDK 4 a CDK 6. Abemaciklib je strukturálně odlišný od dalších inhibitorů CDK 4/6 a je 14krát efektivnější v blokádě cyklinu
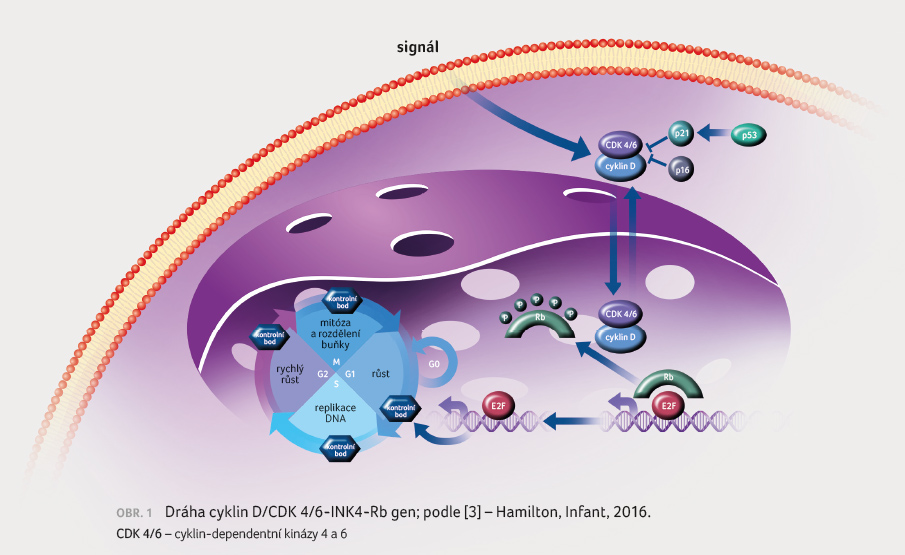
D1/CDK 4 než cyklinu D3/CDK 6 v enzymatických testech. Zabraňuje fosforylaci Rb proteinu, čímž blokuje postup buněčného cyklu z G1 do S fáze a to vede k potlačení růstu nádoru (obr. 1, 2). Preklinická data prokázala protinádorovou aktivitu abemaciklibu u HR pozitivních (HR+)/HER2 negativních (HER2–) buněčných linií karcinomu prsu [3,4]. Abemaciklib je podáván v dávce 150 mg 2× denně kontinuálně.
Data z klinických studií
Efektivita abemaciklibu byla prokázána v klinických studiích MONARCH 1, MONARCH 2 a MONARCH 3. V klinické studii MONARCH 1 byla testována toxicita a efektivita přípravku v monoterapii u pacientek předléčených chemoterapií a HT. Zařazeno bylo 128 pacientek, které byly léčeny monoterapií – 200 mg abemaciklibu 2× denně kontinuálně do progrese onemocnění nebo do nepřijatelné toxicity. Objektivní odpověď (overall response rate, ORR) byla zaznamenána u 17,4 % pacientek, doba do progrese onemocnění (progression-free survival, PFS) byla 5,7 měsíce [5].
Abemaciklib je schválen pro klinickou praxi v EU na základě klinických studií MONARCH 3 v kombinaci s inhibitorem aromatáz a MONARCH 2 v kombinaci s fulvestrantem. Do studie MONARCH 3 byly zařazeny pacientky s metastatickým karcinomem prsu s pozitivními steroidními receptory (SR+)/HER2–, které nebyly doposud léčeny HT, nebo pacientky, u kterých bylo bezpříznakové období po ukončení adjuvantní HT delší než 12 měsíců. Primárním cílovým ukazatelem byla PFS, sekundárními cílovými ukazateli byly celkové přežití (overall survival, OS), ORR a bezpečnost terapie. Studijní léčbu podstoupilo 493 pacientek, které byly randomizovány do dvou ramen − abemaciklib + anastrozol nebo letrozol versus abemaciklib + placebo. V rameni s kombinační léčbou byla prokázána signifikantně vyšší PFS ve srovnání s placebem – 28,18 měsíce vs. 14,76 měsíce.
Kromě efektivity terapie jsou nedílnou součástí monitorace i nežádoucí účinky léčby (NÚ). Nejčastějším NÚ byl průjem, který se ve všech stupních závažnosti vyskytoval až u 82,3 % pacientek léčených abemaciklibem a u 32,3 % žen s monoterapií inhibitorem aromatáz. K dalším nejčastěji se vyskytujícím NÚ stupně ≥ 3 patřily neutropenie (u 23,9 % vs. 1,2 % pacientek), průjem (9,5 % vs. 1,2 %) a leukopenie (u 8,6 % vs. 0,6 %). Pozorován byl i výskyt flebotrombózy (u 6,1 % vs. 0,6 %) [6,7].
MONARCH 2 byla randomizovaná, dvojitě zaslepená klinická studie fáze III, v níž byly pacientky randomizovány do dvou léčebných ramen. Léčeny byly kombinací abemaciklibu s fulvestrantem vs. fulvestrantem a placebem. Zařazeny mohly být pacientky s metastatickým SR+/HER2– karcinomem prsu, u kterých došlo k progresi v průběhu neoadjuvantní nebo adjuvantní HT, do 12 měsíců od ukončení adjuvantní HT, nebo nemocné, u nichž byla zjištěna progrese při první linii paliativní HT. Zařazení pacientek probíhalo v období od srpna 2014 do prosince 2015. Léčeno bylo 669 pacientek z 19 zemí. Při randomizaci byly pacientky stratifikovány na základě lokalizace metastáz (viscerální vs. kostní) a hormonální rezistence (primární vs. sekundární). Za primárně rezistentní je považováno onemocnění, u kterého dojde k progresi v prvních dvou letech adjuvantní HT nebo v prvních šesti měsících HT pro metastatické onemocnění. Pacientky, které nesplňují definovaná kritéria pro primární rezistenci, mají sekundární rezistenci – tzn. k progresi dojde za více než dva roky při adjuvantní HT nebo za více než šest měsíců při paliativní HT v první linii pro metastatické onemocnění (definice European Society for Medical Oncology, ESMO). Pacientky dostávaly 150 mg abemaciklibu 2× denně nebo placebo a fulvestrant v dávce 500 mg 1× měsíčně včetně úvodní nasycovací dávky v den 1, 15 a v den 1 následujícího cyklu. Z celkového počtu 669 pacientek bylo léčeno kombinací abemaciklib + fulvestrant 446 žen; fulvestrant a placebo dostávalo 223 pacientek. Většina pacientek měla viscerální metastázy (373 žen), kostní metastázy byly zaznamenány u 180 žen. U 169 pacientek bylo onemocnění definováno jako primárně rezistentní, u 489 žen jako sekundárně rezistentní. V parametru PFS byl prokázán statisticky signifikantní přínos v kombinaci fulvestrant + abemaciklib vs. fulvestrant + placebo – 16,9 měsíce vs. 9,3 měsíce (poměr rizik [HR] 0,553, 95% interval spolehlivosti [CI] 0,049−0,681; p < 0,001). U pacientek s měřitelným onemocněním bylo odpovědi – ORR – dosaženo ve 48,1 % ve srovnání s 21,3 % v rameni s monoterapií. K dispozici jsou již data týkající se OS. Medián sledování byl 47,7 měsíce. Přidáním abemaciklibu k fulvestrantu došlo ke statisticky signifikantnímu zlepšení OS o 9,4 měsíce – s mediánem OS 46,7 měsíce v rameni s abemaciklibem versus 37,3 měsíce v rameni s placebem. Zlepšení OS bylo konzistentní napříč všemi sledovanými podskupinami pacientek. Také doba do druhé progrese nemoci byla statisticky signifikantně delší v rameni s abemaciklibem – medián PFS2 byl 23,1 měsíce vs. 20,6 měsíce.
Dalším parametrem, který se v poslední době u pacientek s metastatickým karcinomem prsu v souvislosti s kvalitou života posuzuje, je doba do zahájení chemoterapie. Ve studii byl definován parametr doby přežití bez chemoterapie, který zahrnuje chemoterapii i úmrtí jako událost; ten představoval 25,5 měsíce v rameni s abemaciklibem a 18,2 měsíce v rameni s placebem. Výskyt toxicity zůstal konzistentní s předchozími publikovanými daty z primární analýzy. Hematologická toxicita stupně 3 a vyššího v rameni s abemaciklibem zahrnovala neutropenii, která se vyskytovala ve 29,9 %, anémii v 9,1 % a leukopenii v 11,1 % případů. Nebyl pozorován výskyt febrilní neutropenie. Nejčastěji se vyskytujícím nehematologickým NÚ abemaciklibu je průjem, přičemž průjem stupně 3 byl zaznamenán u 14,5 % pacientek. Terapii muselo ukončit kvůli průjmu pouze 1,4 % pacientek.
Ve studii MONARCH 2 byl v rameni s abemaciklibem prokázán statisticky signifikantní přínos v parametru OS – rozdíl 9,4 měsíce ve srovnání s placebem. Přínos v parametru PFS 7,6 měsíce tak byl přenesen i do OS; abemaciklib prodlužuje přežití o 9,4 měsíce ve srovnání s placebem [8,9].
Bezpečnost léčby
Jak již bylo zmíněno, profil
nežádoucích účinků terapie se mírně liší od ostatních
inhibitorů CDK 4/6. Nejčastějším NÚ je průjem – až
u 84,6 % léčených, stupeň 3 se vyskytuje u 11,7−14,5 %
pacientek. V žádné z klinických studií nebyl pozorován
průjem stupně 4. Terapie je symptomatická. Nejčastěji se průjem
objevuje v prvních čtyřech týdnech terapie, je dobře
ovlivnitelný podáním loperamidu nebo redukcí dávky (tab. 1). Medián doby do objevení se průjmu byl
zaznamenán ve studiích MONARCH 2 a 3 v délce
přibližně 7 dní, medián trvání průjmu stupně 2 v délce
9−12 dní, stupně 3 pak 6−8 dní.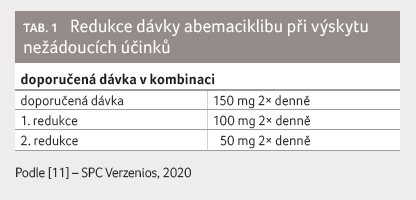
Druhým nejčastěji se vyskytujícím NÚ je neutropenie, která byla ve všech stupních dohromady doložena až u 45 % pacientek. Závažná neutropenie stupně 3 byla popsána u 22,9 %, stupně 4 u 2,5 % pacientek. Ke vzniku neutropenie dochází v důsledku pouze „cytostatického“ efektu na neutrofilní prekurzory; tento efekt vede k zástavě jejich vyzrávání, proto je neutropenie rychle ovlivnitelná pouze přerušením terapie a myeloidní růstové faktory (např. filgrastim) jsou používány spíše výjimečně.
Dalšími častými NÚ jsou únava, nevolnost, anémie, abdominální bolesti, zvracení, nechutenství, leukopenie, alopecie, elevace hodnot aspartátaminotransferázy (AST) a alaninaminotransferázy (ALT), infekce. Většina těchto NÚ je pouze střední intenzity a terapii většinou neovlivní. Možný výskyt hepatotoxicity je doporučeno sledovat v průběhu terapie kontrolou jaterních testů.
Ve studiích MONARCH 2 a 3 byl na rozdíl od ostatních inhibitorů CDK 4/6 popsán výskyt hluboké žilní trombózy (5 % vs. 0,9 % a 5 % vs. 0,5 %). Také je popisována elevace hodnot kreatininu v důsledku inhibice některých transportních míst ovlivňujících tubulární sekreci (OCT2, MATE1 a MATE2). Glomerulární filtrace ovlivněna není, a tudíž nedochází k poškození ledvin. Proto je také vhodné při terapii monitorovat renální parametry (kreatinin, urea, cystatin C) [6−9].
Je u nějaké skupiny pacientek
abemaciklib účinnější než ostatní inhibitory CDK 4/6?
Kombinace inhibitorů CDK 4/6 (palbociklibu, ribociklibu a abemaciklibu) s HT zlepšuje PFS a ORR u pacientek s hormonálně pozitivním karcinomem prsu v úvodu léčby pro metastatický karcinom prsu i při progresi při podávání HT. Doposud neexistují žádné prediktivní markery, které by nám mohly pomoci s výběrem určitého přípravku. Z předchozích klinických studií byly popsány potenciální prognostické faktory, jako jsou lokalizace metastáz (viscerální, jaterní, pouze kostní) a předchozí senzitivita k HT. Z dalších faktorů, které jsou hodnoceny při adjuvantním podání, se jedná o expresi progesteronového receptoru (PR), popř. o grade nádoru. Využití těchto faktorů k rozhodnutí, zda je potřeba pouze HT, či kombinace HT s inhibitorem CDK 4/6, však není doposud jasné.
V prosinci 2018 byl publikován článek, kde autoři analyzovali data z klinických studií MONARCH 2 a MONARCH 3 s cílem identifikovat skupinu pacientek, pro kterou má podání abemaciklibu největší přínos, a skupinu pacientek, u níž je i varianta pouze HT efektivní. Výsledky efektivity − PFS a ORR − byly posuzovány u každé podskupiny pacientek, která byla definována konkrétním prognostickým faktorem. Byl potvrzen prognostický význam u těchto klinických faktorů: pouze kostní metastázy, jaterní metastázy, grade nádoru, status PR, performance status (PS), interval bez terapie po ukončení adjuvantní HT (therapy free interval, TFI) a doba od diagnózy do rekurence nemoci. Prognóza byla horší u pacientek s jaterními metastázami, s negativitou PR, vysokým grade tumoru nebo kratším TFI (< 36 měsíců). Přínos (dle PFS a ORR) byl pozorován ve všech těchto podskupinách. U pacientek se špatnou prognózou byl zaznamenán největší efekt abemaciklibu. U pacientek s dobrými prognostickými faktory (TFI ≥ 36 měsíců, pouze kostní metastázy) bylo pomocí HT dosaženo PFS > 20 měsíců. Tato analýza identifikovala prognostické faktory a prokázala, že u pacientek s přítomností špatných prognostických faktorů je přidání abemaciklibu k HT nejpřínosnější [10].
Závěr
Cyklin dependentní kinázy hrají významnou roli v rozvoji a progresi karcinomu prsu, proto přinesly inhibitory CDK 4/6 revoluci do léčby metastatického SR+/HER2– karcinomu prsu. V kombinaci s HT – inhibitory aromatáz, popřípadě s fulvestrantem – se staly novým standardem v terapii SR+/HER2– karcinomu prsu. Abemaciklib je dalším z inhibitorů CDK 4/6, který je součástí terapie karcinomu prsu. Indikován je na základě klinické studie MONARCH 3 v kombinaci s nesteroidním inhibitorem aromatázy (anastrozolem nebo letrozolem) v první linii lokálně pokročilého/inoperabilního a metastatického HR+/HER2– karcinomu prsu. Dále je na základě výsledků klinické studie MONARCH 2 indikován v kombinaci s fulvestrantem u pacientek progredujících při léčbě první linie HT metastatického karcinomu prsu nebo u těch, u kterých došlo k progresi onemocnění v průběhu nebo do 12 měsíců od ukončení adjuvantní HT. Cílem kombinační terapie je překonání hormonální rezistence, která je vždy nakonec příčinou selhání konkrétní linie léčby u metastatického karcinomu prsu.
Díky inhibitorům CDK 4/6 došlo k zásadnímu zlepšení léčebných výsledků nejenom v parametru PFS, ale i v parametru OS. Nicméně i při léčebné kombinaci HT s inhibitorem CDK 4/6 dochází v určitém okamžiku k selhání terapie, ke vzniku rezistence na léčbu. Aktuálně probíhají studie zabývající se příčinou rezistence na léčbu inhibitory CDK 4/6. S příchodem nových léčebných kombinací se objevuje i řada otázek, na které doposud neznáme odpověď. Jistě existuje určitá, spíše menší skupina pacientek s indolentním průběhem nemoci, u které by bylo dostačující v úvodu použití pouze HT a teprve při progresi onemocnění podání kombinace inhibitoru CDK 4/6 s fulvestrantem. Na základě práce publikované v prosinci 2018 se jeví, že se bude jednat o pacientky pouze s kostními metastázami a ty, u kterých došlo k progresi onemocnění za více než 36 měsíců po ukončení adjuvantní HT. Doposud jde spíše o ojedinělé informace. Na základě stejné práce byly ovšem stanoveny nepříznivé prognostické faktory, kde se naopak kombinace abemaciklibu s HT jeví jako nejefektivnější. Jedná se především o pacientky s jaterními metastázami, s tumorem grade 3, s PR negativními a s kratším bezpříznakovým obdobím (disease free survival, DFS ≤ 36 měsíců).
Do budoucna zůstává ještě spousta nezodpovězených otázek: Budou mít místo i v další linii po selhání inhibitorů CDK 4/6? Jaká je optimální druhá linie terapie po selhání léčebné kombinace inhibitor CDK 4/6 s HT? V současné době zatím neznáme optimální sekvenci jednotlivých léčebných kombinací, popř. monoterapie u pacientek s pokročilým SR+/HER2– karcinomem prsu. Nicméně i přes zatím řadu ještě nezodpovězených otázek se staly inhibitory CDK 4/6 jedním ze zásadních průlomů v terapii luminálního HER2– metastatického karcinomu prsu.
Seznam použité literatury
- [1] Pritchard KI, Gelmon KA, Rayson D, et al. Endocrine therapy for postmenopausal women with hormone receptor – positive, HER2 negative advanced breast cancer after progression or recurrence on non‑steroidal aromatase inhibitor therapy. A Canadian consensus statement. Curr Oncol 2013; 20: 48−61.
- [2] Kennecke H,Yerushalmi R, Woods R, et al. Metastatic behaviour of breast cancer subtypes. J Clin Oncol 2010; 28: 3271−3277.
- [3] Hamilton E, Infante JR. Targeting CDK 4/6 in patients with cancer. Cancer Treat Rev 2016; 45: 129−138.
- [4] Shapiro G, Rosen LS, Tolcher AW, et al. A first‑in‑human phase I study of the CDK 4/6 inhibitor for patients with advanced cancer. J Clin Oncol 2013; 31(Suppl): Abstr 2500.
- [5] Dickler MN, Tolaney SM, Rugo HS, et al. MONARCH 1, a phase II study of abemaciclib, a CDK 4 and CDK 6 inhibitor, a single agent in patients with refractory HR1/HER2– metastatic breast cancer. Clin Cancer Res 2017; 23: 5218−5224.
- [6] Johnson S, Martin M, di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer 2019; 5: 1−8.
- [7] Goetz MP, Toi M, Campone M, et al. MONARCH 3: abemaciclib as initial therapy for advanced breast cancer. J Clin Oncol 2017; 5: 3638−3646.
- [8] Sledge GW, Toi M, Neven P, et al. MONARCH 2: Abemaciclib in combination with fulvestrant in women with HR+/HER2– advanced breast cancer who had progressed while receiving endocrine therapy. J Clin Oncol 2017; 25: 2875−2886.
- [9] Sledge GW, Toi M, Neven P, et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor‑positive, HER2‑negative breast cancer that progressed on endocrine therapy – MONARCH 2, a randomized clinical trial. JAMA Oncol 2019; 6: 116−124.
- [10] di Leo A, O‘Shaugnessy J, Sledge GW, et al. Prognostic characteristics in hormone receptor‑positive advanced breast cancer and characterization of abemaciclib efficacy. NPJ Breast Cancer 2018; 4: 41.
- [11] Souhrn údajů o přípravku Verzenios. Dostupné na http://www.sukl.cz/