Alektinib – rozšíření možností léčby nemalobuněčného karcinomu plic
Souhrn:
Roubec J. Alektinib – rozšíření možností léčby nemalobuněčného karcinomu plic. Remedia 2018; 28: 326–330.
Alektinib je vysoce selektivní, v centrálním nervovém systému aktivní ALK (anaplastic lymphoma kinase) inhibitor. Léčivo vykazuje silnou klinickou aktivitu u nepředléčených a krizotinib rezistentních pacientů s ALK pozitivní transformací nemalobuněčného plicního karcinomu (non‑small cell lung cancer, NSCLC). Alektinib nabízí prodloužení mediánu času do progrese (progression free survival, PFS) a zvyšuje četnost objektivních odpovědí (objective response rate, ORR) ve srovnání s chemoterapií v první linii a po selhání léčby krizotinibem. Je dobře tolerován s excelentním průnikem do centrálního nervového systému, a je tedy vhodnou léčbou v první linii nebo po progresi choroby při terapii krizotinibem.
Summary:
Roubec J. Alectinib – diversifying treatment options for non‑small cell lung cancer. Remedia 2018; 28: 326–330.
Alectinib is a highly selective, CNS‑active ALK inhibitor. Alectinib shows strong activity in non-precured and crizotinib‑resistant patients with ALK‑rearranged (ALK‑positive) non‑small cell lung cancer (NSCLC). Alectinib confers improved progression free survival (PFS) and ORR (objective response rate) compared with chemotherapy in the first line treatment in anaplastic lymphoma kinase (ALK)‑rearranged NSCLC and after failure of the treatment with crizotinib. It is well tolerated with excellent CNS penetration and therefore is a suitable treatment for patients with ALK‑positive disease in the first line treatment or after progression on crizotinib.
Key words: non‑small cell lung cancer ‒ ALK positive, alectinib.
Nemalobuněčný karcinom plic (non small cell lung cancer, NSCLC) lokálně pokročilého a metastatického stadia je standardně, obvykle v závislosti na výkonnostním stavu pacienta a jeho komorbiditách, léčen systémově chemoterapií přípravky 3. generace spolu s platinovými deriváty. Preferovanou kombinací jsou v první linii pro adenokarcinomy pemetrexed s cisplatinou s možností udržovací léčby pemetrexedem nebo platinový dublet s bevacizumabem a pokračovací léčba bevacizumabem. Skvamózní nemalobuněčný karcinom plic je v těchto případech obvykle léčen chemoterapií. Pro některé pacienty, především neskvamózních histologií, je možností již v první linii léčba tyrozinkinázovými inhibitory v případě pozitivní aktivační mutace genu EGFR (receptor pro epidermální růstový faktor, epidermal growth factor receptor; 5‒15 % v kavkazské populaci) a také v případě translokace ALK (anaplastická lymfomová kináza, anaplastic lymphoma kinase) inhibitory ALK tyrozinkinázy. Touto mutací disponuje přibližně 5 % pacientů s pokročilým NSCLC bez rozdílu etnického původu, zatímco incidence EGFR mutací se liší dle etnické rasy (Asiati vs. kavkazská populace). Incidence ALK pozitivity NSCLC je vyšší u neskvamózní histologie, nekuřáků nebo bývalých kuřáků, mladších pacientů, žen, EGFR nebo KRAS negativních. Tyto nádory nemají specifické klinické rysy [1,2].
ALK tyrozinkinázové inhibitory
Gen pro ALK je umístěn na 2. chromozomu v exonu 20, poprvé byl popsán u anaplastického velkobuněčného non Hodgkinova lymfomu. Primárně je exprimován během vývoje CNS, méně v CNS dospělých. Kóduje receptorovou tyrozinkinázu ze skupiny inzulinových receptorů. Exprese ALK a preklinické modely naznačují úlohu ve vývoji CNS [3].
Nejčastější variantu přestavby genu ALK, která byla popsána v roce 2009, představuje intrachromozomální zlom v exonu 20, inverze genu a následně jeho fúze s EML4 (echinodermový s mikrotubuly asociovaný protein) na úrovni chromozomu. Výsledkem fúze EML4 ALK je pak produkce ALK fúzního proteinu, který nemá ALK transmembránovou doménu. Vazba EML4 vede k dimerizaci fúzního proteinu a tím ke konstituční aktivaci cestou stimulované autofosforylace ALK kinázové domény, jejímž důsledkem je zvýšená proliferace, tumorigeneze. In vitro probíhá stejná odpověď na ALK tyrozinkinázové inhibitory pro různé varianty ALK fúzních proteinů. Inhibice tyrozinkinázového receptoru indukuje apoptózu nádorových buněk.
V průběhu nádorové klonální evoluce vzniká však na tyrozinkinázové inhibitory rezistence. Tato je buď ALK závislá na základě sekundární mutace v ALK kinázové doméně, nebo na podkladě genové amplifikace. Vyšší účinnost dalších generací ALK tyrozinkinázových inhibitorů spočívá ve schopnosti překonávání a snižování počtu těchto na tyrozinkinázový inhibitor rezistentních sekundárních mutací. Může se také jednat o ALK nezávislou rezistenci na podkladě nádorové heterogenity a prostřednictvím uplatnění alternativních onkogenních driverů. Další možností je rezistence farmakologická, například v důsledku nedostatečné penetrace do CNS.
Zástupcem první generace ALK
tyrozinkinázových inhibitorů je krizotinib,
který je selektivním nízkomolekulárním inhibitorem receptorové
ALK a jejích onkogenních variant (tj. případ EML4 ALK
fúze a vybraných mutací ALK). Zástupcem druhé
generace je alektinib (obr. 1),
vysoce selektivní a potentní inhibitor ALK a RET
tyrozinkinázy.
V preklinických studiích vedla inhibice ALK tyrozinkinázy k blokádě tzv. downstream signalizační dráhy včetně STAT3 a PI3K/AKT a k indukci smrti nádorových buněk (apoptóze). Alektinib in vitro a in vivo prokázal aktivitu proti mutantním formám enzymu ALK, včetně mutací zodpovědných za rezistenci na krizotinib. Hlavní metabolit alektinibu (M4) prokázal in vitro obdobnou potenci a aktivitu. Podle preklinických údajů není alektinib substrátem P glykoproteinu nebo BCRP (protein rezistence karcinomu prsu), které jsou oba efluxními transportéry v hematoencefalické bariéře. Alektinib je vysoce selektivní a potentní inhibitor ALK a RET tyrozinkinázy, a je proto schopný se distribuovat do CNS a přetrvávat v něm [4‒6].
Proběhla celá řada regionálních i globálních klinických studií, z nichž je nutno se zmínit o pivotních studiích fáze II NP28673 a NP28761, kde vstupním kritériem byli nemocní již předléčení chemoterapií nebo krizotinibem a léčení alektinibem ve druhé linii. Významná jsou data o účinnosti léčby alektinibem u nemocných s mozkovými metastázami.
Registrační studie ALEX (BO28984)
Bezpečnost a účinnost alektinibu byla zkoumána v randomizované otevřené klinické studii fáze III (BO28984, ALEX) u pacientů s pokročilým NSCLC s pozitivním nálezem ALK, kteří dosud nebyli léčeni. Před zařazením do studie bylo vyžadováno centrální testování tkáňových vzorků všech pacientů na přítomnost pozitivity exprese proteinu ALK pomocí Ventana anti ALK (F5F3) imunohistochemie. Do studie fáze III bylo zařazeno celkem 303 pacientů, 151 pacientů bylo randomizováno do ramene s krizotinibem a 152 pacientů do ramene s alektinibem, v němž dostávali přípravek perorálně. Hodnocenou intervencí byl alektinib (v dávce 1 200 mg/den), komparativní intervencí krizotinib (250 mg dvakrát denně). Nemocní byli v obou ramenech studie léčeni do progrese onemocnění nebo do ukončení terapie z důvodu neakceptovatelné toxicity.
Stratifikačními faktory pro randomizaci byl výkonnostní stav ECOG PS (Eastern Cooperative Oncology Group Performance Status; 0/1 oproti 2), rasa (asijská oproti neasijské) a metastázy v CNS při zahájení léčby (ano oproti ne). Primárním cílovým ukazatelem studie bylo prokázání superiority alektinibu oproti krizotinibu vycházející z přežití bez progrese (progression free survival, PFS) na základě posouzení zkoušejícího pomocí kritérií RECIST 1.1. Demografické znaky a charakteristiky onemocnění při zahájení léčby alektinibem představovaly střední věk 58 let (54 let u krizotinibu), 55 % tvořily ženy (58 % u krizotinibu), 55 % nemocných bylo neasijské rasy (54 % u krizotinibu), 61 % osob bez kouření v anamnéze (65 % u krizotinibu), 93 % pacientů mělo výkonnostní stav ECOG PS 0 nebo 1 (93 % u krizotinibu), 97 % pacientů mělo onemocnění stadia IV (96 % u krizotinibu), 90 % trpělo adenokarcinomem dle histologie (94 % u krizotinibu), 40 % s metastázami v CNS při zahájení léčby (38 % u krizotinibu) a 17 % po ozáření (14 % u krizotinibu).
Základními vstupními kritérii studie byly věk ≥ 18 let; histologicky nebo cytologicky prokázaný pokročilý, rekurentní nebo metastatický ALK pozitivní NSCLC (ALK pozitivita byla verifikována centrální laboratoří); předpokládané dožití ≥ 12 týdnů; výkonnostní stav ECOG PS 0‒2; stav bez předchozí terapie pro pokročilý (stadium IIIb) nebo metastatický (stadium IV) NSCLC; dostatečná funkce ledvin, jater a kostní dřeně (s přesnou definicí v protokolu studie); měřitelné onemocnění podle kritérií RECIST (verze 1.1) a asymptomatické metastázy do CNS.
Klíčová vylučovací kritéria studie:
- Pacienti s malignitou v anamnéze během posledních tří let.
- Poruchy gastrointestinálního traktu, které by mohly ovlivnit absorpci léků.
- Jaterní metastázy se zvýšením hodnot jaterních enzymů (AST, ALT) na/nad trojnásobek normy (nad pětinásobek u pacientů s jaterními metastázami) nebo s hyperbilirubinemií, koagulopatií, encefalopatií, hypoalbuminemií, ascitem nebo s krvácením z jícnových varixů. Dále akutní virová, autoimunní nebo alkoholická hepatitida.
- Anamnéza orgánové transplantace.
- Současné užívání jiné protinádorové terapie.
- Symptomatická bradykardie nebo QT interval > 470 ms.
- Těhotenství nebo kojení.
- HIV pozitivita, AIDS.
K významným sekundárním cílovým ukazatelům patřily hodnoty ORR (četnost objektivních odpovědí, objective response rate) a DOR (trvání odpovědi, duration of response rate); doba do progrese v CNS; ORR v oblasti CNS u pacientů s CNS metastázami a s CNS měřitelným onemocněním; progrese v oblasti CNS po 6, 12, 18 a 24 měsících terapie; PFS podle IRC (Institute of Cancer Research); celkové přežití (overall survival, OS) a snášenlivost a bezpečnost v obou ramenech studie. Parametr PFS byl hodnocen jako doba od randomizace do první dokumentované progrese nebo úmrtí, identicky byla hodnocena progrese v CNS (nezávislou komisí). Parametr ORR představuje podíl pacientů s výchozím měřitelným onemocněním, u kterého bylo dosaženo kompletní nebo částečné remise, DOR je definována jako doba od první kontroly s kompletní nebo částečnou odpovědí do první dokumentované progrese nebo úmrtí a OS je definováno jako doba od randomizace do úmrtí z jakékoliv příčiny.
Profil pacientů zařazených do obou
ramen byl srovnatelný z pohledu demografických a výchozích
parametrů, včetně přítomnosti asymptomatických CNS metastáz
(40 % v obou ramenech). Průměrný věk byl 54 let, většinou
se jednalo o ženy (57 %), ve většině neasijské rasy.
Většina pacientů měla ECOG PS 0 nebo 1, histologicky šlo
převážně o adenokarcinom (92 %) a stadium onemocně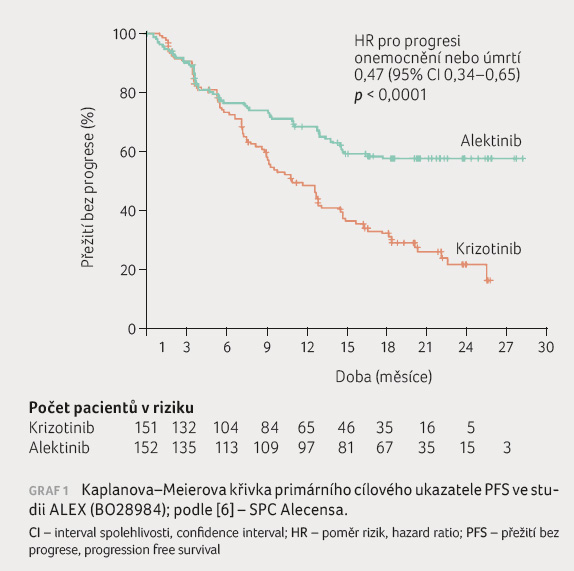 ní
bylo převážně metastatické (96 %).
ní
bylo převážně metastatické (96 %).
Studie splnila svůj primární cíl, což představuje statisticky signifikantní zlepšení v PFS posuzovaném zkoušejícím (graf 1). Medián doby sledování byl u pacientů ve skupině s alektinibem 27,8 měsíce vs. 22,8 měsíce ve skupině s krizotinibem. Medián PFS dosahoval u alektinibu 34,8 měsíce, u krizotinibu 10,9 měsíce, což představuje snížení rizika progrese onemocnění nebo smrti o 57 % pro pacienty léčené alektinibem (poměr rizik [HR] 0,43; 95% interval spolehlivosti [CI] 0,31–0,58). Ve studii byl medián délky léčby 17,9 měsíce u alektinibu a 10,7 měsíce u krizotinibu, dávkovací intenzita byla podobná (95,6 % vs. 92,4 %).
U nemocných, kteří měli již při náboru do studie mozkové metastázy, byl medián PFS 27,7 měsíce pro alektinib, 7,4 měsíce pro krizotinib, jednalo se tedy o snížení rizika progrese o 65 % ve prospěch alektinibu (HR 0,35; 95% CI 0,22–0,56). Podobný rozdíl vykazovala i skupina nemocných bez mozkových metastáz na začátku sledování: medián PFS u alektinibu byl 34,8 měsíce, u krizotinibu 14,7 měsíce, tj. snížení rizika o 53 % (HR 0,47; 95% CI 0,32–0,71). V obou skupinách byl vyvážený počet nemocných, kteří podstoupili cílené ozařování mozkových metastáz nebo stereotaktickou radiační terapii.
Souhrnná analýza CNS
Alektinib prokázal silnou aktivitu v CNS u pacientů trpících ALK pozitivním NSCLC dříve léčených krizotinibem. Analyzována byla rovněž podskupina s měřitelnými CNS lézemi při vstupu do studie, přičemž CNS odpověď byla zaznamenána u 81 % pacientů léčených alektinibem oproti 50 % pacientů léčených krizotinibem. Více nemocných léčených alektinibem dosáhlo kompletní CNS odpovědi (38 % vs. 1 %). Medián trvání intrakraniální odpovědi byl 17,3 měsíce (95% CI 14,8 ‒ nedosaženo) vs. 5,5 měsíce (95% CI 2,1‒17,3). Kumulativní incidence CNS progrese byla výrazně nižší při terapii alektinibem. Dvanáctiměsíční kumulativní incidence CNS progrese činila 9,4 % (95% CI 5,4‒14,7) vs. 41,4 % (95% CI 33,2‒49,4); HR 0,16 (95% CI 0,10‒0,28; p < 0,0001). Podíl ORR činil 64,0 % (95% CI 49,2–77,1) podle hodnocení nezávislou komisí odborníků (IRC) u pacientů s měřitelným CNS onemocněním při vstupu do studie, CNS odpověď byla setrvalá s mediánem 10,8 měsíce (95% CI 7,6–14,1).
Nežádoucí účinky a shrnutí
Celkový výskyt nežádoucích účinků byl srovnatelný, nicméně počet reakcí stupně 3‒5 byl v rameni s alektinibem nižší (41 % u alektinibu vs. 50 % u krizotinibu). Stejně tak byl srovnatelný výskyt závažných nežádoucích účinků, a to (ve stejném pořadí) 28 % vs. 29 % v obou skupinách, výskyt nežádoucích účinků vedoucích k přerušení léčby (11 % vs. 13 %) a fatálních nežádoucích účinků (2 % vs. 5 %). Mezi nežádoucími reakcemi stupně 3‒5 byly nejčastěji zaznamenány anémie (5 % u alektinibu vs. 1 % u krizotinibu), zvýšení hodnot jaterních enzymů (ALT 5 % u alektinibu vs. 15 % u krizotinibu; AST 5 % u alektinibu vs. 11 % u krizotinibu), zvýšení hodnot bilirubinu (2 % u alektinibu vs. 0 % u krizotinibu) a nauzea (1 % u alektinibu vs. 3 % u krizotinibu).
Ve studii ALEX bylo prokázáno klinicky a statisticky významné snížení rizika progrese nebo úmrtí (o 53 %) pro alektinib oproti krizotinibu u pacientů s ALK pozitivním dříve neléčeným lokálně pokročilým nebo metastatickým NSCLC. Efekt alektinibu přetrvával významně déle a výrazná odpověď byla zaznamenána i v případě CNS metastáz. Ve studii bylo dosaženo bezprecedentního snížení rizika v parametru CNS progrese o 84 %. Snášenlivost alektinibu byla dobrá, výskyt závažných a fatálních nežádoucích účinků a toxicit vedoucích k přerušení terapie byl v obou skupinách srovnatelný.
Studie J ALEX
V případě podpůrné studie J ALEX (JO28928) [2,4] se jednalo o velmi podobně uspořádané klinické hodnocení fáze III, jež však zahrnovalo pacienty s ALK pozitivním NSCLC, kteří již mohli být léčeni jednou předchozí chemoterapií, nikoliv však ALK inhibitorem. Studie zahrnovala asijskou populaci. Komparátorem byl i v tomto případě krizotinib a sledování bylo navrženo k průkazu superiority alektinibu. V rámci studie bylo zaznamenáno snížení rizika progrese nebo úmrtí o 62 % (HR 0,38; 95% CI 0,26‒0,55; p < 0,0001), hodnocení PFS bylo obdobné jako ve studii ALEX (HR 0,35; 95% CI 0,23‒0,52). Mediánu DOR nebylo v rameni s alektinibem dosaženo, a to ani po 22 měsících sledování (HR 0,39; 95% CI 0,24‒0,63). Riziko progrese mozkových metastáz bylo rovněž sníženo o 49 %.
Shrnutí bezpečnostního profilu alektinibu
Údaje popsané níže odrážejí expozici alektinibu u 405 pacientů s pokročilým ALK pozitivním NSCLC, kteří se účastnili jedné randomizované klinické studie fáze III (BO28984) a dvou klinických studií fáze II s jednoramennými léčbami (NP28761, NP28673). Tito pacienti byli léčeni doporučenou dávkou 600 mg dvakrát denně. V pivotních klinických studiích fáze II (NP28761, NP28673; n = 253) byl medián trvání expozice alektinibu 11 měsíců. Ve studii BO28984 (ALEX; n = 152) představoval medián trvání expozice alektinibu 17,9 měsíce, zatímco medián trvání expozice krizotinibu byl 10,7 měsíce.
Mezi nejčastější nežádoucí
účinky (≥ 20 %) patřily zácpa (35 %), edém (30 %
včetně periferního edému, edému, generalizovaného edému, edému
očních víček, periorbitálního edému, obličejového edému
a lokalizovaného edému) a myalgie (28 % včetně
myalgie a muskoloskeletální bolesti).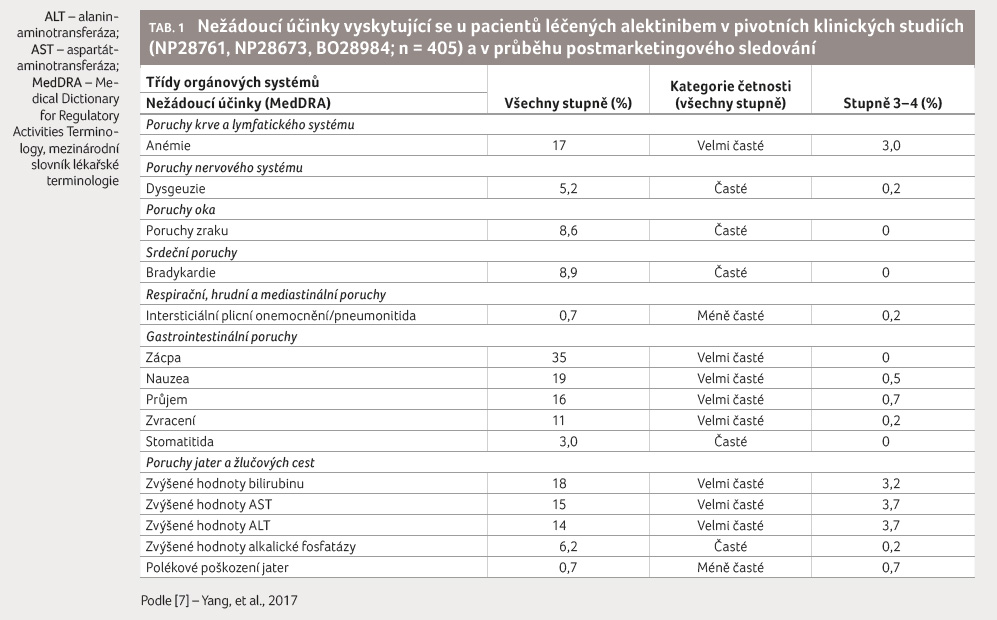
Tabulka 1 přináší přehled nežádoucích účinků zaznamenaných ve dvou pivotních klinických studiích fáze II (NP28761 a NP28673) a v jedné klinické studii fáze III (BO28984; ALEX) a v průběhu postmarketingového sledování u pacientů léčených alektinibem [7].
Závěr
Vysoce selektivní inhibitor ALK a RET tyrozinkinázy alektinib prokázal systémovou i silnou aktivitu v CNS a u pacientů s ALK pozitivním NSCLC dříve léčených krizotinibem. U léčiva byly rovněž potvrzeny dlouhodobá systémová odpověď, dobrá snášenlivost a bezpečnostní profil. Alektinib (Alecensa) je indikován v monoterapii jako léčba první linie dospělých pacientů s NSCLC s pozitivním nálezem ALK a v monoterapii k léčbě dospělých pacientů s ALK pozitivním pokročilým NSCLC po předchozí léčbě krizotinibem [7]. Přípravek Alecensa obsahuje 150 mg alektinibu v jedné tvrdé tobolce. Po průkazu ALK pozitivity je alektinib užíván v dávce 600 mg (4 tobolky) dvakrát denně s jídlem, celková denní dávka je tedy 1 200 mg. Přípravek je užíván do progrese choroby nebo do nezvládnutelné toxicity [1]. V případě toxicity je možno snížit denní dávku, a to ve dvou krocích ‒ nejprve na 450 mg dvakrát denně a dále na 300 mg dvakrát denně.
Seznam použité literatury
- [1] Dearden S, Stevens J, Wu YL, Blowers D. Mutation incidence and coincidence in non small‑cell lung cancer: meta‑analyses by ethnicity and histology (mutMap). Ann Oncol 2013; 24: 2371‒2376.
- [2] West H, Oxnard, GR, Doebele RC (Author Affiliations From the Swedish Cancer Institute, Seattle, WA; Dana‑Farber Cancer Institute, Boston). Acquired Resistance to Targeted Therapies in Advanced Non‑Small Cell Lung Cancer New Strategies and New Agents, Meeting Library (Abstracts, Presentations) 2013 May 31. Dostupné na: http://europepmc.org/articles/PMC4142045
- [3] Morris SW, Kirstein MN, Valentine MB, et al. Fusion of a kinase gene, ALK, to a nucleolar protein gene, NPM, in non‑Hodgkin’s lymphoma. Science 1994; 263: 1281‒1284.
- [4] Iwahara T, Fujimoto J, Wen D, et al. Molecular characterization of ALK, a receptor tyrosine kinase expressed specifically in the nervous system. Oncogene 1997; 14: 439‒449.
- [5] Hallberg B, Palmer RH. Mechanistic insight into ALK receptor tyrosine kinase in human cancer biology. Nat Rev Cancer 2013; 13: 685‒700.
- [6] SPC Alecensa. Dostupné na: http://www.sukl.cz.
- [7] Yang JC, Ou SI, De Petris L, et al. Pooled systemic efficacy and safety data from two phase II studies (NP28673 and NP28761) of alectinib in ALK‑positive non‑small‑cell lung cancer (NSCLC). J Thorac Oncol 2017; 12: 1552–1560.