Cesta k oddálení progrese u pacientů s roztroušenou sklerózou
Souhrn:
Kubala Havrdová E, Kalinčík T. Cesta k oddálení progrese u pacientů s roztroušenou sklerózou. Remedia 2021; 31: 367–373.
Roztroušená skleróza představuje závažné autoimunitní onemocnění centrálního nervového systému, jehož fenotypy se tradičně klasifikují jako relabující a progresivní. Podle současných poznatků jsou zánětlivý proces i neurodegenerace přítomny od začátku nemoci a odlišují se pouze klinickými projevy. Primární a sekundární progrese vedou postupně k nárůstu ireverzibilního neurologického postižení. Dlouhodobé klinické zkušenosti a analýza dat z registrů a databází doložily účinnost včas použitých protizánětlivých léků v ovlivnění pozdější neurodegenerativní složky RS. Zároveň se ukázala nutnost klinicky přesněji definovat sekundární progresi, aby bylo možno včas zahájit její farmakologickou léčbu. Aktivní léčba RS vysoce účinnými přípravky a její včasné zahájení významně oddalují nástup sekundárně progresivní fáze a pozitivně ovlivňují prognózu pacientů.
Summary:
Kubala Havrdova E, Kalincik T. Road to delaying a progression in patients with multiple sclerosis. Remedia 2021; 31: 367–373.
Multiple sclerosis is a serious autoimmune disorder of the central nervous system, whose phenotypes are traditionally classified as relapsing or progressive. According to the contemporary knowledge, both inflammation and neurodegeneration are present from the onset of the disease and differ only in clinical presentation. Primary and secondary progression lead to slow accumulation of irreversible neurological disability. Long‑term clinical experience and data analyses from registries and databases showed that early anti‑inflammatory therapy is effective in mitigating the neurodegenerative component of MS even in the later stages of the disease. However, an objective, reproducible definition of secondary progression is still warranted, to enable a timely initiation of its pharmacological management. Active treatment of MS with highly effective drugs, especially when started early, considerably delays the clinical progressive phase of the disease and improves the prognosis among patients living with MS.
Key words: multiple sclerosis, secondary progression, immunomodulatory treatment.
Úvod
Roztroušená skleróza (RS) je
autoimunitní onemocnění centrálního nervového systému (CNS).
Cílem zánětlivého útoku jsou sice obaly nervových vláken
(myelin), ale podkladem trvalého postižení
je ztráta nervových vláken. Na počátku onemocnění jsou
nápadná zánětlivá ložiska tvořící se v typických
oblastech CNS. Podkladem akutních neurologických příznaků jsou
rozpadající se myelinové pochvy, protože vlákno zbavené myelinu
není schopno vést nervový impulz. Během několika dnů dochází
k přestěhování iontových kanálů podél demyelinizovaného
nervového vlákna a k obnovení funkce. Některá vlákna
však v zánětlivém ložisku zanikají již na počátku
nemoci. Onemocnění má tak dvě složky – zánětlivou
a neurodegenerativní. Zpočátku choroby je nápadnější
složka zánětlivá, klinicky se projevující atakami neurologické
symptomatologie, na magnetické rezonanci (MR) vznikem nových
hyperintenzních lézí, které po několik týdnů vychytávají
gadolinium jako projev porušené hematoencefalické bariéry. Během
zánětlivé fáze nemoci se vyčerpávají rezervy CNS a po letech
dochází k postupně se zhoršující invaliditě v důsledku
ztracených axonů [1-3]. Ve výsledcích
vyšetření zobrazovacími metodami tomu odpovídá ztráta mozkové
tkáně, která je rychlejší (více než 0,4 % ročně) než
u zdravé populace (do 0,3 % ročně), obrázek 1.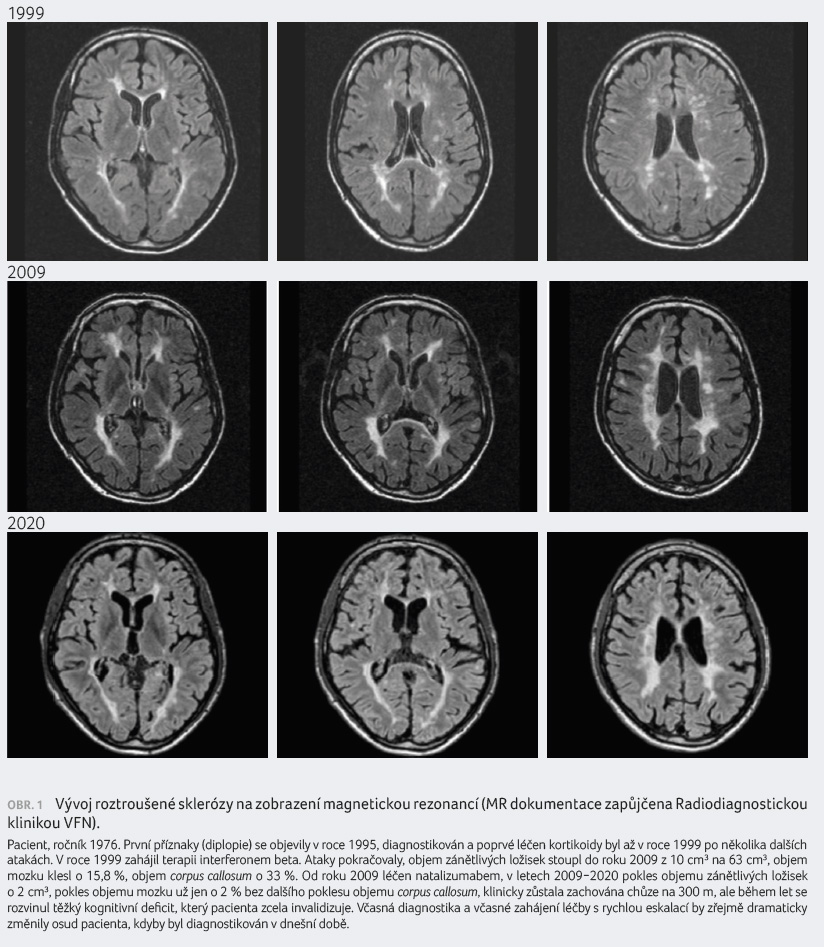
Rizikové faktory rozvoje RS
Etiologie onemocnění není objasněna, je však jistě multifaktoriální. Podílejí se na ní geny susceptibility (většinou lokalizované na 6. chromozomu spolu s geny pro funkce imunitního systému). Podle výsledků studií monozygotních dvojčat však nejsou zodpovědné za více než 30 % rizika vzniku nemoci. Můžeme proto právem usuzovat, že za zbytek rizika jsou odpovědné faktory prostředí. Virus Epsteina-Barrové (EBV) patří mezi prominentní rizikové faktory [4]. Velká část pacientů má v anamnéze infekční mononukleózu a téměř všichni pacienti mají sérologický důkaz kontaktu s EBV v minulosti. Jde tedy zřejmě o aberantní reakci na tento ubikvitní virus, v době diagnózy mají pacienti velmi vysoké titry protilátek proti EBV. Na druhou stranu, EBV je v naší populaci vysoce prevalentní (až 99 %), což svědčí o tom, že ke vzniku RS je nutná přítomnost dalších rizikových faktorů [5]. Dalším rizikovým faktorem je hypovitaminóza D, která je jednou z příčin zvyšujícího se výskytu RS se zvětšující se vzdáleností od rovníku. Jiným významným faktorem je kouření (zřejmě jako epigenetický faktor). Mezi další faktory, které jsou podezřelé ze souvislosti s RS, patří složení mikrobiomu, nadbytek soli v potravě, další infekční agens, stres. U některých pacientů vede RS přes adekvátní současnou léčbu k rychlému vývoji postižení, u jiných může být průběh relativně benignější s minimální disabilitou po mnoha letech. Co vede k rozdílnému průběhu, není dosud známo.
Diagnostika a historie léčby RS
Diagnostická kritéria RS se vyvíjela na základě poznání patogenetických mechanismů a zobrazovacích metod. V současnosti používáme McDonaldova kritéria z roku 2017 [6]. Trvá požadavek na průkaz diseminace v prostoru a čase a za použití MR a izoelektrické fokusace likvoru lze u většiny pacientů diagnózu stanovit již po prvních klinických příznacích.
V 60. letech minulého století bylo zjištěno, že kortikoidy vedou k rychlejší úpravě stavu při akutních atakách. K rozvoji a jednoznačnému přijetí konceptu kontinuální imunomodulační léčby to však trvalo ještě dalších 30 let, ačkoliv v některých zemích (Československo, Francie, Německo) se lékaři pokoušeli onemocnění ovlivnit tak jako jiné autoimunitní choroby kontinuální léčbou kortikoidy a imunosupresivy (v Československu prof. MUDr. Pavel Jedlička, DrSc., zaváděl tuto léčbu již v 70. letech minulého století na základě studia imunologie) [7]. V roce 1993 byl prokázán efekt rekombinantního interferonu beta na snížení počtu relapsů, zanedlouho následoval glatiramer acetát v podstatě se stejným efektem. Lékaři však dlouho pochybovali o schopnosti těchto léků oddálit progresi disability. Klinické studie v porovnání s délkou choroby zachycovaly pouze zlomek průběhu RS. Teprve dlouhodobé sledování pacientů v běžné klinické praxi, vznik registrů a databází a analýza dat z nich vedly k průkazu schopnosti protizánětlivých léků ovlivnit i neurodegenerativní složku nemoci [8]. Zároveň se ukázalo, že k ovlivnění prognózy nemoci vede především včasné zahájení efektivní protizánětlivé léčby. To prokázaly i studie s těmito léky u prvních projevů nemoci (klinicky izolovaný syndrom, CIS) a jejich dlouhodobá data v otevřených sledovacích studiích [9]. U více než dvou třetin pacientů však nebyl efekt léků dostatečný a dlouhodobý. V roce 2007 byla zavedena do léčby první monoklonální protilátka, natalizumab, s více než dvojnásobnou efektivitou. Díky ní vznikl v roce 2009 koncept „no evidence of disease activity“ (NEDA) jako nový cíl léčby. NEDA hodnotí nepřítomnost relapsů, progrese a nových či gadolinium vychytávajících lézí na MR. Celkem 37 % pacientů ve studii fáze III dosáhlo díky natalizumabu konceptu NEDA oproti 7 % pacientů léčených placebem [10]. V roce 2011 byl schválen první perorální lék – fingolimod (modulátor sfingosin 1 fosfátových receptorů zadržující aktivované lymfocyty v uzlinách) – s účinností vyšší než interferon beta či glatiramer acetát. V roce 2013 byly registrovány další perorální léky teriflunomid a dimetylfumarát a také další monoklonální protilátka alemtuzumab, první lék pro pulzní podání s cílem změnit dlouhodobě skladbu lymfocytárních subpopulací a vytvořit imunitní toleranci (imunitní rekonstituce). Podobný efekt pulzní léčby má i perorální kladribin, který byl zaveden do terapie RS v roce 2019. Cílem všech těchto léků byly převážně T lymfocyty, které byly považovány za hlavní protagonisty patologického zánětu u RS. Mnoho let se však spekulovalo i o úloze B lymfocytů. Jejich produkty, oligoklonální proužky v likvoru, patřily k diagnostice RS od 60. let minulého století. Protilátky proti molekule CD20 se ukázaly jako velmi účinné nejen v omezení počtu relapsů, ale i v ovlivnění progrese. Potvrdila se tak klíčová role B lymfocytů v patogenezi RS [11]. Schopnost ovlivnit SP RS s ještě prokazatelnou aktivitou nemoci vedla k registraci jednoho ze sfingosin 1 fosfátových modulátorů, siponimodu, v roce 2020.
Průběh onemocnění a klasifikace
do fenotypů
Průběh RS je ve většině učebnic dělen na relabující (u 85 % pacientů v prvních letech nemoci), který po vyčerpání rezerv CNS přechází v sekundárně progresivní (méně relapsů, pozvolný nárůst disability), a na primárně progresivní (od počátku pozvolný nárůst disability, začátek v pozdějším věku). Asi 3 % pacientů mají průběh s relapsy a zároveň nárůstem disability i mezi nimi. Toto dělení odpovídá tradičním představám o patogenezi. V současnosti se však ukazuje, že jak zánětlivý proces, tak i neurodegenerace, kterou zánět spouští, jsou přítomny od začátku nemoci a pouze klinicky se projevují jinak. Dělení, které se tak stává poněkud arbitrárním, bylo důležité i z důvodu náboru pacientů do klinických studií, protože všechny v současnosti používané léky mají především protizánětlivý mechanismus účinku. Individuální fenotyp RS tak lze u pacientů popsat jako poměr epizodického, lokalizovaného zánětlivého procesu a progrese, což zohledňuje také nejnovější klasifikace RS dle Lublina [12]. Ta rozděluje fenotypy RS na relabující a progresivní a oba pak na aktivní nebo neaktivní – podle přítomnosti relapsů nebo aktivních zánětlivých lézí na MR.
Zánět je nejsnáze postižitelný v prvních letech nemoci, kdy je hematoencefalická bariéra otevřená a imunitní buňky zaměřené proti antigenům CNS mohou vstupovat do tkáně. V pozdějších letech, především v progresivní fázi nemoci, se bariéra uzavírá, což se projeví nepřítomností gadolinium vychytávajících lézí na MR. To však neznamená, že zánět vymizel. Doutná uzavřen za bariérou, především na okraji již existujících ložisek v podobě aktivované mikroglie. Je ovšem daleko hůře dosažitelný pro naše léčebné možnosti. Na MR nacházíme tzv. doutnající léze (smouldering lesions) a postupující atrofii, v patologickém nálezu difuzní postižení bílé hmoty, subpiální kortikální demyelinizaci, meningeální uzlíky se shluky B lymfocytů a vyčerpané reparační a kompenzační mechanismy [13,14].
Problematika definice progresivní
fáze nemoci
Snaha ovlivnit RS v progresivním stadiu naráží na kompartmentalizovaný zánět za bariérou, na neurodegenerativní kaskádu, která je důsledkem dřívějšího zánětu, a na již výraznou míru poškození či ztráty axonů a neuronů. Klinické studie s protizánětlivými léky se potýkaly vždy i s faktem, že definice progresivní RS nebyla jednotná. Sdělení diagnózy zvláště progresivního stadia RS pacientovi není vůbec lehké. Nemocný takové sdělení vnímá jako pád do beznaděje. Až s registrací prvního léku, u něhož klinická studie potvrdila určitý efekt na vývoj progrese, se tato situace začala měnit. Do té doby byla všude ve světě spíše přijímána představa, že je lepší pacienta udržovat na jakýchkoliv lécích pro remitující stadium, protože jejich vysazení a označení nemocného oficiálně za pacienta v sekundárně progresivním stadiu hrozí jeho propadem do deprese, inaktivity z důvodu beznaděje a často objektivního zhoršení neurologického stavu.
Tento trend se v posledních letech změnil. Je snaha objektivizovat přechod do tohoto stadia na základě analýzy průběhu RS u velkého množství pacientů a klinicky tak lépe definovat sekundární progresi (objektivní způsob hodnocení neexistuje – nejsou ani laboratorní biomarkery, ani MR jasně definovaná kritéria, že v tuto chvíli přešel pacient do sekundární progrese). I když je přechod z relabujícího remitujícího do sekundárně progresivního stadia nemoci spíše kontinuální, lze se dohodnout na klinických kritériích důležitých pro možnost zahájení léčby schválené pro toto stadium. Nejdůležitějšími se ukazují škála hodnocení neurologického nálezu a disability (Expanded Disability Status Scale, EDSS; hodnota 0 představuje normální neurologický nález, EDSS 10 znamená smrt v důsledku RS) a věk pacienta [15]. Nejlépe přijímanou je v současnosti definice vycházející z dat MSBase (mezinárodní databáze pacientů s RS, kde jsou v současnosti soustředěna data více než 76 000 pacientů z 39 zemí včetně České republiky) publikovaná v roce 2016 Lorscheiderem a kol. [16]. Pacient by podle ní měl mít alespoň středně těžké neurologické postižení (EDSS nejméně 4, schopnost chůze omezena na 500 m bez přestávky) a progresi nálezu (nikoliv v důsledku relapsu) o jeden stupeň EDSS, pokud je jeho EDSS maximálně 5,5, nebo o půl stupně EDSS, pokud je jeho EDSS nejméně 6,0. Tato progrese by měla být potvrzena po třech měsících (k vyloučení nepřesnosti měření nebo efektu předchozího relapsu). Pacient by měl mít neurologicky detekovatelnou parézu alespoň jedné končetiny.
Samozřejmě, že se progrese může objevit i dříve, nemocný si často stěžuje na pozvolné zhoršování některé z denních aktivit ještě před dosažením omezení chůze bez známek jasného relapsu. Lorscheiderova definice je však obecně dobře přijímána, protože dříve byla sekundární progrese typicky diagnostikována až ve stadiu těžkého postižení (EDSS 6,5, schopnost chůze s oboustrannou oporou na vzdálenost 20 m). Je také nutno zdůraznit, že Lorscheiderova MSBase/melbournská definice byla vyvinuta v datech registrů a není míněna jako rigidní definice pro diagnostiku individuálních pacientů.
Primární a sekundární progrese vedou postupně k nárůstu ireverzibilního neurologického postižení. Tento nárůst má tendenci progredovat rychleji u pacientů s primárně progresivní RS. I když sekundárně progresivní fáze RS se projevuje v pozdějším věku a progrese postižení je pomalejší, pacienti vstupují do stadia sekundární progrese s disabilitou, která je důsledkem relabující remitující fáze nemoci. Výsledkem je, že primárně i sekundárně progresivní RS vedou k rozvoji těžké disability (jako je ztráta schopnosti samostatné chůze, stupeň EDSS 7) v podobném věku.
Jak diagnostikovat progresivní fázi
RS?
Jak může neurolog progresi RS
detekovat? Diagnózu progresivní fáze je někdy možné stanovit
na základě objektivního měření (zpomalování rychlosti
chůze měřené na 8 metrů, zhoršování jemné motorické
funkce ruky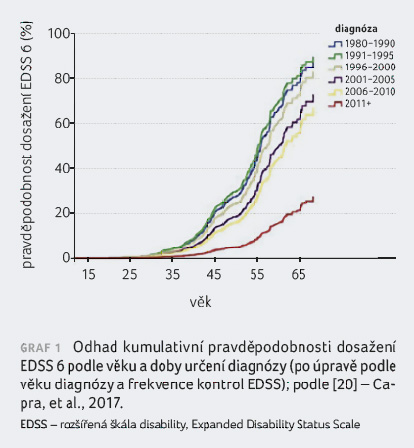 hodnocené v testu 9 jamek – Nine Hole Peg
Test, 9HPT), zhoršování kognice sledované pomocí SDMT (Symbol
Digit Modalities Test). Nejdůležitější je však anamnestická
informace - je úlohou neurologa
pozorně naslouchat pacientům, zejména jejich hodnocení běžných
aktivit, fyzické kapacity a kognitivní funkce. I když se
změny pozorované pacienty nemusejí nutně projevit změnou stupně
EDSS, jsou pro identifikaci progrese RS klíčové. Diagnóza
sekundární progrese je tak stále spíše retrospektivní a záleží
na komplexním přístupu ke zhodnocení subjektivních
a objektivních změn, fyzické i kognitivní funkce
a kapacity [17,18]. Mezi rizikové faktory
sekundární progrese patří zejména věk pacienta, délka trvání
nemoci a celková disabilita. Podle některých studií je
zvýšené riziko progrese také u mužů, u pacientů
s vyšší frekvencí relapsů v anamnéze a u osob
s rychlejším nárůstem disability během
relabující remitující fáze. Podle původních
studií přirozeného průběhu choroby přecházelo
v minulosti do stadia sekundární progrese 40 % pacientů
po 6–10 letech relabující RS [19]. Pravděpodobnost vývoje
sekundární progrese se zvyšuje s časem – po 10
letech se zdvojnásobuje, po 20 letech je čtyřnásobná.
Vrchol incidence diagnózy sekundárně progresivní
RS se pohybuje kolem 50. roku života (graf 1) [20].
V éře protizánětlivé léčby se však čas od počátku
onemocnění do sekundárně progresivní fáze výrazně
prodloužil a dnes u 50 % pacientů dosahuje až 30-35
let (obr. 2) [21].
hodnocené v testu 9 jamek – Nine Hole Peg
Test, 9HPT), zhoršování kognice sledované pomocí SDMT (Symbol
Digit Modalities Test). Nejdůležitější je však anamnestická
informace - je úlohou neurologa
pozorně naslouchat pacientům, zejména jejich hodnocení běžných
aktivit, fyzické kapacity a kognitivní funkce. I když se
změny pozorované pacienty nemusejí nutně projevit změnou stupně
EDSS, jsou pro identifikaci progrese RS klíčové. Diagnóza
sekundární progrese je tak stále spíše retrospektivní a záleží
na komplexním přístupu ke zhodnocení subjektivních
a objektivních změn, fyzické i kognitivní funkce
a kapacity [17,18]. Mezi rizikové faktory
sekundární progrese patří zejména věk pacienta, délka trvání
nemoci a celková disabilita. Podle některých studií je
zvýšené riziko progrese také u mužů, u pacientů
s vyšší frekvencí relapsů v anamnéze a u osob
s rychlejším nárůstem disability během
relabující remitující fáze. Podle původních
studií přirozeného průběhu choroby přecházelo
v minulosti do stadia sekundární progrese 40 % pacientů
po 6–10 letech relabující RS [19]. Pravděpodobnost vývoje
sekundární progrese se zvyšuje s časem – po 10
letech se zdvojnásobuje, po 20 letech je čtyřnásobná.
Vrchol incidence diagnózy sekundárně progresivní
RS se pohybuje kolem 50. roku života (graf 1) [20].
V éře protizánětlivé léčby se však čas od počátku
onemocnění do sekundárně progresivní fáze výrazně
prodloužil a dnes u 50 % pacientů dosahuje až 30-35
let (obr. 2) [21].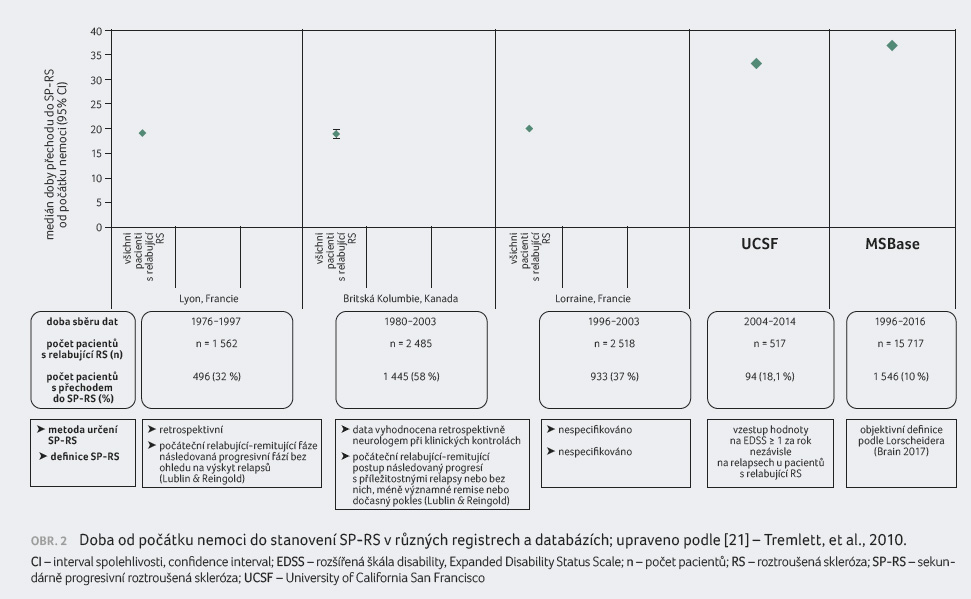
Jak oddálit sekundární progresi?
Změnil se tento trend po zavedení imunomodulační léčby? Jinými slovy – změnila se prognóza pacienta? A má čas zahájení léčby vliv na její účinnost? Odpověď na všechny otázky zní ANO. Studie z registru MSBase prokázala, že aktivní léčba RS, obzvláště pak léčba vysoce účinnými přípravky, výrazně oddaluje nástup sekundárně progresivní fáze [22]. Také pacienti, kteří stráví větší část života s RS na aktivní léčbě, čelí dlouhodobě nižšímu riziku konverze do sekundární progrese [23]. Navíc platí, že čím dříve je léčba zahájena, tím větší je její účinek na oddálení sekundární progrese (graf 2A−C) [22].
I když se v minulosti
soustředil vývoj nových léků na relabující remitující
formu RS, v poslední dekádě vidíme nárůst počtu
klinických studií zaměřených na prevenci progrese. Mnoho
studií přineslo nepřesvědčivé, nebo přímo negativní
výsledky. Pozoruhodná byla studie OLYMPUS, která neprokázala
celkový efekt monoklonální protilátky rituximab (lék snižující
počet B lymfocytů v krvi) na progresi primárně
progresivní nemoci [24]. U podskupiny pacientů mladších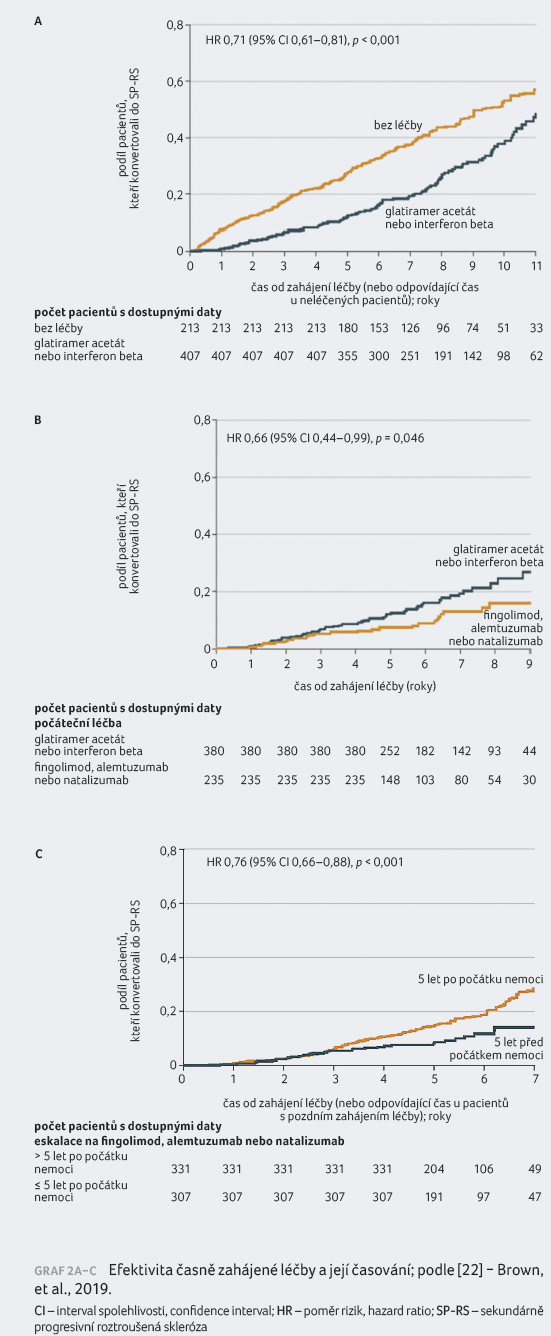 51 let a s MR nálezem aktivních zánětlivých lézí
však rituximab vedl ke zpomalení nárůstu disability.
Na základě tohoto pozorování byla koncipována studie
ORATORIO se zaměřením na mladší pacienty, potenciálně
s aktivnější primárně progresivní nemocí. U těchto
pacientů okrelizumab (humanizovaná monoklonální protilátka proti
CD20 pozitivním B lymfocytům) vedl ke zpomalení progrese
[25]. Následovala studie EXPAND s přípravkem siponimod
(modulátor receptorů sfingosin 1 fosfátu, který
sekvestruje periferní lymfocyty v lymfatických uzlinách), jež
prokázala efekt protizánětlivé terapie u sekundárně
progresivní RS [26]. V obou případech byla velikost efektu
na progresi podstatně menší než u relabující remitující
nemoci. Stejně jako ORATORIO i studie EXPAND ukázala, že
efekt protizánětlivé léčby je nejvýraznější u těch
pacientů, jejichž onemocnění se před vstupem do studie
projevovalo mimo jiné i relapsy nebo aktivními MR lézemi.
Tato pozorování jsou ve shodě se závěry
poněkud detailnějších observačních studií
z registru MSBase. U pacientů s primárně
progresivní formou RS, kteří také trpěli občasnými relapsy
(aktivní primárně progresivní RS dle Lublina), konzistentní
protizánětlivá léčba zpomalila tempo progrese až o 30 %
[27]. Podobně pacienti s aktivní sekundárně progresivní RS
profitovali z léčby ve formě zpomalení progrese až
o 70 %, zejména pokud byli léčeni vysoce efektivními
přípravky [28].
51 let a s MR nálezem aktivních zánětlivých lézí
však rituximab vedl ke zpomalení nárůstu disability.
Na základě tohoto pozorování byla koncipována studie
ORATORIO se zaměřením na mladší pacienty, potenciálně
s aktivnější primárně progresivní nemocí. U těchto
pacientů okrelizumab (humanizovaná monoklonální protilátka proti
CD20 pozitivním B lymfocytům) vedl ke zpomalení progrese
[25]. Následovala studie EXPAND s přípravkem siponimod
(modulátor receptorů sfingosin 1 fosfátu, který
sekvestruje periferní lymfocyty v lymfatických uzlinách), jež
prokázala efekt protizánětlivé terapie u sekundárně
progresivní RS [26]. V obou případech byla velikost efektu
na progresi podstatně menší než u relabující remitující
nemoci. Stejně jako ORATORIO i studie EXPAND ukázala, že
efekt protizánětlivé léčby je nejvýraznější u těch
pacientů, jejichž onemocnění se před vstupem do studie
projevovalo mimo jiné i relapsy nebo aktivními MR lézemi.
Tato pozorování jsou ve shodě se závěry
poněkud detailnějších observačních studií
z registru MSBase. U pacientů s primárně
progresivní formou RS, kteří také trpěli občasnými relapsy
(aktivní primárně progresivní RS dle Lublina), konzistentní
protizánětlivá léčba zpomalila tempo progrese až o 30 %
[27]. Podobně pacienti s aktivní sekundárně progresivní RS
profitovali z léčby ve formě zpomalení progrese až
o 70 %, zejména pokud byli léčeni vysoce efektivními
přípravky [28].
Závěr
Diagnóza RS klade vždy velké nároky na pacienta i tým jeho ošetřujících specialistů. Vyslovení diagnózy progresivního stadia nemoci však bylo mnoho let tabu. Doba se začíná měnit. Včasná diagnostika progresivní RS a možnost použití prvních efektivních léků k ovlivnění tohoto stadia nemoci mohou mít účinek na prognózu pacienta i v tomto náročnějším období nemoci. K okrelizumabu a siponimodu se v budoucnu jistě přidají další léčiva. Inhibitory Brutonovy tyrozinkinázy (BTK inhibitory) působí na mikroglii i B lymfocyty, mají tak šanci ovlivnit nejen remitující stadium nemoci.
Stále však platí, že nejefektivnějším ovlivněním progresivního stadia nemoci je co nejčasnější a nejefektivnější léčba počátečních stadií choroby, dokud má CNS dostatečné rezervy a plasticitu.
Seznam použité literatury
- [1] Correale J, Gaitán MI, Ysrraelit MC, Fiol MP. Progressive multiple sclerosis: from pathogenic mechanisms to treatment. Brain 2017; 140: 527−546.
- [2] Lassmann H. Multiple Sclerosis Pathology. Cold Spring Harb Perspect Med 2018; 8: a028936.
- [3] Lassmann H, van Horssen J. The molecular basis of neurodegeneration in multiple sclerosis. FEBS Lett 2011; 585: 3715−3723.
- [4] Bar‑Or A, Pender MP, Khanna R, et al. Epstein‑Barr Virus in Multiple Sclerosis: Theory and Emerging Immunotherapies. Trends Mol Med 2020; 26: 296−310.
- [5] Alfredsson L, Olsson T. Lifestyle and Environmental Factors in Multiple Sclerosis. Cold Spring Harb Perspect Med 2019; 9: a028944.
- [6] Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revision of the McDonald criteria. Lancet Neurol 2018; 17: 162−173.
- [7] Havrdová E, a kol. Roztroušená skleróza. Praha: Mladá fronta, 2013: 253−255.
- [8] Signori A, Gallo F, Bovis F, et al. Long‑term impact of interferon or Glatiramer acetate in multiple sclerosis: A systematic review and meta‑analysis. Mult Scler Relat Disord 2016; 6: 57−63.
- [9] Filippini G, Del Giovane C, Clerico M, et al. Treatment with disease‑modifying drugs for people with a first clinical attack suggestive of multiple sclerosis. Cochrane Database Syst Rev 2017; 4: CD012200.
- [10] Havrdova E, Galetta S, Hutchinson M, et al. Effect of natalizumab on clinical and radiological disease activity in multiple sclerosis: A retrospective analysis of the Natalizumab Safety and Efficacy in Relapsing‑Remitting Multiple Sclerosis (AFFIRM) study. Lancet Neurol 2009; 8: 254–260.
- [11] Romme Christensen J, Börnsen L, Ratzer R, et al. Systemic inflammation in progressive multiple sclerosis involves follicular T‑helper, Th17‑ and activated B‑cells and correlates with progression. PLoS One 2013; 8: e57820.
- [12] Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology 2014; 83: 278−286.
- [13] Absinta M, Sati P, Masuzzo F, et al. Association of Chronic Active Multiple Sclerosis Lesions With Disability In Vivo. JAMA Neurol 2019; 76: 1474−1483.
- [14] Dal‑Bianco A, Grabner G, Kronnerwetter C, et al. Long‑term evolution of multiple sclerosis iron rim lesions in 7 T MRI. Brain 2021; 144: 833−847.
- [15] Ramanujam R, Zhu F, Fink K, et al; BeAMS Study group. Accurate classification of secondary progression in multiple sclerosis using a decision tree. Mult Scler 2021; 27: 1240−1249.
- [16] Lorscheider J, Buzzard K, Jokubaitis V, et al.; MSBase Study Group. Defining secondary progressive multiple sclerosis. Brain 2016; 139(Pt 9): 2395−2405.
- [17] Inojosa H, Proschmann U, Akgün K, Ziemssen T. Should We Use Clinical Tools to Identify Disease Progression? Front Neurol 2021; 11: 628542.
- [18] Ziemnssen T, Piani‑Meier D, Bennett B, et al. A Physician‑Completed Digital Tool for Evaluating Disease Progression (Multiple Sclerosis Progression Discussion Tool): Validation Study. J Med Internet Res 2020; 22: e16932.
- [19] Kremenchutzky M, Rice GP, Baskerville J, et al. The natural history of multiple sclerosis: a geographically based study 9: observations on the progressive phase of the disease. Brain 2006; 129(Pt 3): 584−594.
- [20] Capra R, Cordioli C, Rasia S, et al. Assessing long‑term prognosis improvement as a consequence of treatment pattern changes in MS. Mult Scler J 2017; 23: 1757−1761.
- [21] Tremlett H, Zhao Y, Rieckmann P, Hutchinson M. New perspectives in the natural history of multiple sclerosis. Neurology 2010; 74: 2004−2015.
- [22] Brown JWL, Coles A, Horakova D, et al. Association of initial disease‑modifying therapy with conversion to secondary progressive multiple sclerosis among patients with relapsing‑remitting multiple sclerosis. JAMA 2019; 321: 175−187.
- [23] Fambiatos A, Jokubaitis V, Horakova D, on behalf of the MSBase Study Group. Risk of secondary progressive multiple sclerosis: A longitudinal study. Mult Scler J 2020; 26: 79−90.
- [24] Hawker K, OʼConnor P, Freedman MS, et al.; OLYMPUS trial group. Rituximab in patients with primary progressive multiple sclerosis: results of a randomized double‑blind placebo‑controlled multicenter trial. Ann Neurol 2009; 66: 460–471.
- [25] Montalban X, Hauser SL, Kappos L, et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med 2017; 376: 209−220.
- [26] Kappos L, Bar‑Or A, Cree BAC, et al. Siponimod versus placebo in secondary progressive multiple sclerosis (EXPAND): a double‑blind, randomised, phase 3 study. Lancet 2018; 391: 1263–1273.
- [27] Hughes J, Jokubaitis V, Lugaresi A, et al. Association of Inflammation and Disability Accrual in Patients With Progressive‑Onset Multiple Sclerosis. JAMA Neurol 2018; 75: 1407−1415.
- [28] Lizak N, Malpas CB, Sharmin S, et al. Association of Sustained Immunotherapy With Disability Outcomes in Patients With Active Secondary Progressive Multiple Sclerosis. JAMA Neurol 2020; 77: 1398−1407.