Emicizumab – nový směr léčby u osob s hemofilií A a inhibitorem
Souhrn:
Léčba hemofilie A prodělala v průběhu posledních desítek let významný vývoj. Vedle standardní léčby koncentráty koagulačního faktoru VIII jsou dnes v klinickém zkoušení a již také i v klinické praxi dostupné tzv. nefaktorové léčivé přípravky. Jejich prvním představitelem, který nedávno vstoupil i na český trh, je emicizumab ‒ bispecifická protilátka částečně nahrazující chybějící koagulační faktor VIII v jeho funkci kofaktoru a obnovující hemostatický potenciál. Emicizumab je v současné době podáván hemofilikům A, jejichž léčba je komplikována rozvojem inhibitoru a u nichž selhala imunotoleranční terapie.
Summary:
The treatment of haemophilia A has undergone significant development over the last decade. In addition to standard treatment with clotting factor VIII concentrates, so‑called non‑factorial products are being tested in clinical trials and some of them have already been introduced to the clinical practice. The first agent, called emicizumab, was recently approved for the Czech market. Emicizumab is a bispecific antibody that partially replaces function of the missing factor VIII as a cofactor and restores hemostatic potential of persons with haemophilia A. Emicizumab is currently being administered to haemophiliacs A, whose treatment has been complicated by the development of inhibitors and whose immunotolerance treatment has failed.
Key words: emicizumab, haemophilia A, inhibitors, prophylaxis
Úvod
Hemofilie A (HA) je vrozené krvácivé onemocnění, jehož podstatou je snížená tvorba koagulačního faktoru VIII (FVIII). Onemocnění je vázané na chromozom X, proto je klinicky významné zejména u mužské populace. Závažnost onemocnění se odvíjí od míry nedostatku FVIII, rozlišuje se mírná (aktivita FVIII 5‒40 %), středně těžká (1‒5 %) a těžká forma nemoci (< 1 %). Zejména u nejtěžších forem HA jsou častá krvácení, jež se objevují od raného věku, nezřídka bez jasného vyvolávajícího faktoru. Typická jsou krvácení do kloubů, jež při recidivách vedou k rozvoji hemofilické artropatie. Riziková jsou krvácení do životně důležitých orgánů či krvácení do svalů. Většina operačních výkonů může být provedena po příslušné hemostatické přípravě.
Moderní léčba HA zahrnuje intravenózní podávání koncentrátů FVIII. Tyto jsou připravované buď z plazmy, v současné době se jedná o vysoce purifikované produkty ošetřené několika kroky proti přenosu infekčních agens, či vyráběné rekombinantními technologiemi. Léčba koncentrátem FVIII může být podávána buď při krvácení (tzv. epizodicky) s cílem je zastavit, či pravidelně s cílem krvácení předcházet (profylaktická léčba).
Profylaktická léčba HA standardními přípravky znamená pravidelnou intravenózní aplikaci, nejčastěji 2‒3× týdně, nicméně zejména u menších dětí i frekventněji. U řady pacientů může být aplikace obtížná vzhledem k horšímu perifernímu přístupu.
Léčba koncentráty FVIII je velmi efektivní, avšak může být komplikována rozvojem neutralizační protilátky proti podávanému proteinu (tzv. inhibitor), jež pak činí léčbu neefektivní. Toto riziko se pohybuje kolem 30 % u nositelů těžké formy hemofilie A a nejvyšší je během prvních 50 podaných dávek [1].
Přítomnost inhibitoru významně komplikuje léčbu, při vysokém titru inhibitoru je nutno pro zástavu krvácení podávat přípravky s bypassovou aktivitou (bypassing agent, BPA), jež obcházejí funkci FVIII. Jedná se o koncentrát aktivovaného protrombinového komplexu (aPCC) či o rekombinantní aktivovaný FVII (rFVIIa). Obě tyto látky jsou ve většině případů účinné, ale účinek je obtížně předvídatelný a laboratorní kontrola jejich efektu je komplikovaná. Bypassové přípravky lze podávat také profylakticky, nicméně riziko krvácení a komplikací s krvácením spojených je vyšší než při profylaktické léčbě koncentráty FVIII u pacientů bez inhibitoru. Cílem je tedy eradikovat inhibitor, což znamená v současné době velmi intenzivní, nákladnou, časově náročnou a pro pacienty a jejich rodiny zatěžující imunotoleranční léčbu. Šance na eradikaci inhibitoru se pohybuje mezi 60‒80 % [2]. V případě selhání imunotoleranční terapie pak tito jedinci byli až do nedávné doby léčeni výše zmíněnými BPA, ale jejich kvalita života byla ve většině horší než u hemofiliků bez inhibitoru.
Charakteristika emicizumabu
Emicizumab (ACE910; obchodní název Hemlibra) představuje zcela nový přístup k léčbě hemofilie A, tzv. nefaktorovou léčbu. Jedná se o humanizovanou bispecifickou protilátku, jež váže a k sobě navzájem přibližuje aktivovaný koagulační faktor IX (FIXa) a faktor X (FX), tím tedy alespoň částečně nahrazuje funkci koagulačního faktoru VIII (FVIII) jako kofaktoru důležitého pro aktivaci FX na FXa [3]. Jeho strukturu přibližuje obrázek 1A, B [4]. Emicizumab funguje bez závislosti na přítomnosti FVIII v plazmě, současně není jeho funkce ovlivněna ani přítomností inhibitoru proti FVIII. Přítomnost emicizumabu taktéž neindukuje tvorbu inhibitoru.
Hemlibra je v současnoti
schválena pro rutinní profylaxi krvácivých epizod u osob
s HA s inhibitorem FVIII, bez věkového omezení. 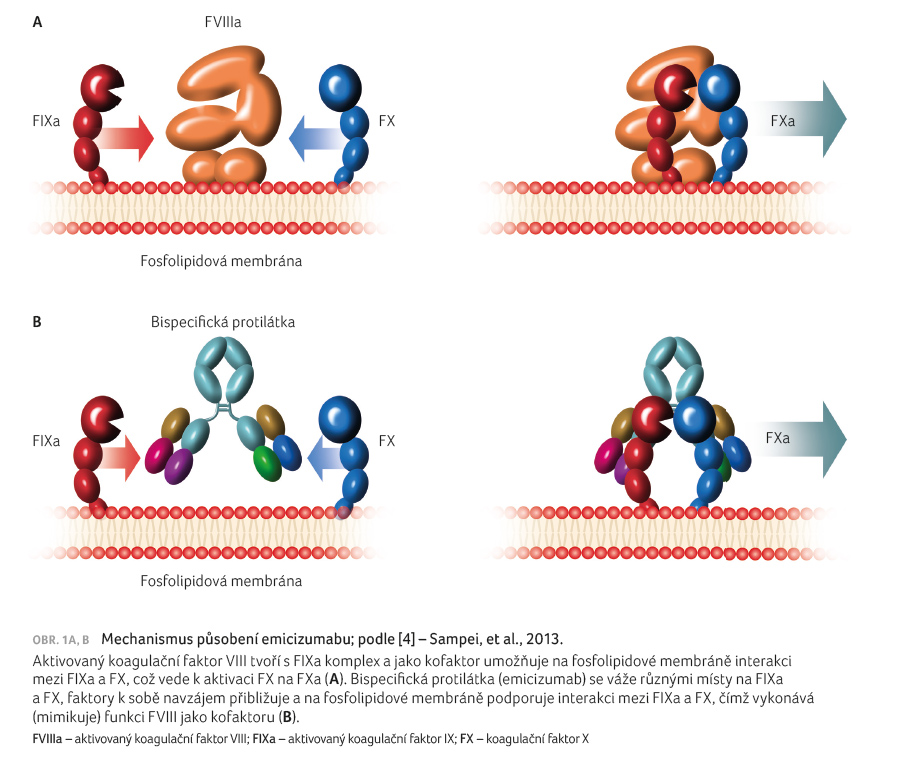
Emicizumab nelze využít pro zvládnutí průlomového krvácení. V případě klinicky významného krvácení je potřeba podat u pacientů s vysokým titrem inhibitoru BPA, u nemocných s nízkým titrem inhibitoru či u nemocných bez inhibitoru koncentrát FVIII v příslušné dávce.
Farmakokinetická data
Preklinické modely i studie fáze I ukázaly dobrou subkutánní biodostupnost, lineární farmakokinetický profil a biologický poločas 4‒5 týdnů (28,3‒34,4 dne) [5].
Interindividuální studie s eskalací dávky, kdy byl emicizumab podáván po dobu 12 týdnů pacientům s těžkou HA (s inhibitorem či bez inhibitoru) subkutánně v dávce 0,3 či 1,0 či 3,0 mg/kg jednou týdně ukázala, že koncentrace emicizumabu v plazmě narůstala v závislosti na dávce a měla tendenci se ustálit po 12 týdnech [6]. S ohledem na předchozí modelování účinnosti a na získané farmakokinetické parametry byla postulována hypotéza, že koncentrace emicizumabu 30‒50 mg/ml odpovídá aktivitě FVIII nejméně 10‒15 %, což by zjednodušeně znamenalo, že pravidelné podávání emicizumabu mění fenotyp hemofilie A na mírný a tím významně snižuje riziko krvácení, zejména do kloubů.
Ve studii HAVEN 1 u hemofiliků starších 12 let (blíže níže v textu) bylo dosaženo hodnoty průměrné plazmatické koncentrace emicizumabu převyšující 50 mg/ml po podání čtyř úvodních nasycovacích dávek a dále byla koncentrace stabilní [7].
U dětské populace (studie HAVEN 2, blíže dále v textu) byly farmakokinetické profily konzistentní bez ohledu na věk či tělesnou hmotnost [8].
Data týkající se účinnosti
Stěžejní studie fáze III
u dvanáctiletých a starších pacientů s HA
a s inhibitorem ve vysokém titru, označená jako
HAVEN 1, hodnotila účinnost, bezpečnost
a farmakokinetiku emicizumabu. Emicizumab byl podáván
v nasycovací dávce 3,0 mg/kg po dobu prvního měsíce
a dále v udržovací dávce 1,5 mg/kg jednou týdně
[7]. Studie se účastnilo 109 pacientů. Jako primární cíl
bylo stanoveno srovnání krvácivých epizod (pomocí ukazatele
roční míra krvácivosti, annual bleeding rate, ABR) u pacientů
dříve léčených epizodicky BPA, kteří dále dostávali
emicizumab profylakticky, oproti nemocným, již užívali BPA jen
epizodicky, a to po dobu 24 týdnů. Roční míra
krvácivosti u jedinců léčených emicizumabem byla 2,9 oproti
23,3 ve skupině léčené BPA jen epizodicky. Toto
představovalo 87% snížení ABR ve prospěch léčby
emicizumabem (p < 0,001).
Při léčbě emicizumabem byla pozorována redukce výskytu
spontánních krvácení, krvácení do kloubů či krvácení
do cílových kloubů (tab. 1). Celkem 63 % pacientů
léčených emicizumabem (celkový počet 35) neprodělalo ve studii
žádnou krvácivou epizodu, kdežto ve skupině léčené BPA
(celkový počet 18) to byl jen jeden nemocný. Součástí studie
bylo také intraindividuální porovnání ABR při léčbě
emicizumabem oproti předcházející profylaxi BPA (data získaná
z neintervenční studie vedené před zahájením HAVEN 1).
Pokles ABR při profylaxi emicizumabem představoval 79 %
(p < 0,001). Hodnocena
byla také kvalita života (QoL) několika dotazníky, výsledky
ukázaly, že emicizumab byl pro nemocné signifikantním přínosem
s ohledem na kvalitu života spojenou se zdravím.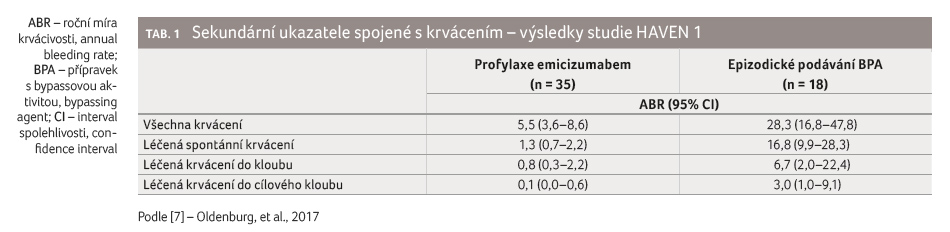
Pokud jde o dětské pacienty, k dispozici jsou pouze průběžná data vycházející ze studie HAVEN 2 [8]. Tato zkoumá u dětí mladších 12 let jak schéma dávkování obdobné studii HAVEN 1, tak také podávání udržovací dávky 3 mg/kg každé 2 týdny a 6 mg/kg každé 4 týdny (kumulativní dávka je tedy stejná). Hodnota ABR u léčených pacientů byla 0,3, pro léčená krvácení 2,2. Nulový výskyt léčených krvácení byl zaznamenán u 76,9 %, 90 % a 60 % dětí léčených emicizumabem podáváným jednou týdně, ob týden a jednou za 4 týdny. Celkem 83,3 % léčených krvácení bylo hodnoceno jako krvácení traumatická. Intraindividuální srovnání u 18 pacientů, u nichž byla k dispozici data z neintervenční studie, ukázalo 99% snížení rizika krvácení vyžadujících léčbu při terapii emicizumabem oproti předchozí léčbě BPA.
Ve studii bylo také provedeno 21 malých chirurgických výkonů, převážně extrakcí centrálního žilního katétru, bez podání dalšího hemostatického přípravku.
Bezpečnostní data
Nejčastěji pozorovanou nežádoucí příhodou spojenou s léčbou emicizumabem byla ve studii HAVEN 1 reakce v místě aplikace (15 % účastníků), jež byla převážně mírná a rychle se vstřebala [7].
Nicméně ve studii byly zaznamenány dvě trombotické komplikace a tři případy trombotické mikroangiopatie (thrombotic microangiopathy, TMA). Všechny tyto závažné nežádoucí příhody byly zachyceny u nemocných, kteří k léčbě průlomového krvácení dostávali aPCC v dávce > 100 U/kg po dobu více než 24 hodin. Žádná podobná událost se neobjevila při podávání rFVIIa či nižších dávek aPCC, jenž byl užíván po dobu kratší než jeden den. Žádná z těchto událostí rovněž nebyla zaznamenána při léčbě pouze emicizumabem. Přesný mechanismus rozvoje trombotických komplikací a zejména TMA dosud není objasněn. Data jsou tedy omezená, avšak zdá se, že riziko rozvoje výše zmíněných komplikací nastává v případě kombinace podání aPCC a profylaxe emicizumabem. Z toho také vycházejí doporučení pro klinickou praxi publikovaná například pracovní skupinou pro inhibitor u hemofilie při UKHCDO (United Kingdom Haemophilia Centre Doctors’ Organisation) ve Velké Británii [9], jejichž souhrn je uveden v následující části textu.
Ve studii HAVEN 2 již byla implementována výše zmíněná doporučení a nebyla pozorována žádná tromboembolická událost či výskyt TMA [8].
Pokud jde o výskyt protilátek proti emicizumabu, ve studii HAVEN 1 nebyla prokázána tvorba protilátek proti emicizumabu [7]. Ve studii HAVEN 2 byly protilátky detekovány u čtyř pacientů, přičemž u dvou měly neutralizační potenciál s ohledem na snížené koncentrace emicizumabu [8].
Doporučení týkající se managementu
průlomového krvácení při léčbě emicizumabem
Emicizumab mění hemostatický potenciál nemocného. Řada krvácení může být zvládnuta jen lokálním opatřením, či dle charakteru krvácení podáním antifibrinolytika. Ne každé krvácení tedy bude vyžadovat podání dalšího hemostatického přípravku. V případě léčby BPA může být jeho dávka nižší než standardní dávka užívaná bez profylaxe emicizumabem. Dávka léčiva a délka jeho užívání závisí na charakteru a rozsahu krvácení. Léčbou volby je rFVIIa, jenž může být podle charakteru krvácení podáván v dávce do 90 mg/kg a dále podle efektu. Koncentrát aktivovaného protrombinového komplexu by neměl být použit, jsou li k dispozici jiné alternativy léčby. V tomto případě by počáteční dávka aPCC neměla překročit 50 U/kg, v případě potřeby druhé dávky by pacient měl být pečlivě observován, ideálně za hospitalizace, a je nutné monitorovat též laboratorní parametry spojené s TMA (mimo jiné krevní obraz, schistocyty, laktátdehydrogenázu, renální funkce, D dimery). Maximální celková dávka aPCC by neměla překročit 100 U/kg podaných během 24 hodin terapie.
Vzhledem k dlouhému biologickému poločasu emicizumabu musejí být pokyny pro léčbu krvácení dodržovány po dobu 6 měsíců od ukončení jeho podávání.
Vliv emicizumabu na laboratorní
vyšetření
Laboratorní monitorování při profylaxi emicizumabem není v běžné praxi nutné. Při podávání emicizumabu dochází k arteficiálnímu zkrácení aktivovaného parciálního tromboplastinového času (activated partial thromboplastine time, aPTT). Koagulační eseje založené na aPTT, včetně stanovení aktivity FVIII, jsou tedy ovlivněny přítomností emicizumabu a nejsou spolehlivé. Chromogenní metody nejsou ovlivněny, stanovení titru inhibitoru s využitím bovinního FVIII je možné. Vzhledem k dlouhému biologickému poločasu emicizumabu platí tato doporučení po dobu až 6 měsíců od ukončení podávání léku.
Závěr
Emicizumab představuje ve světě léčby hemofilie A inovativní přístup. Výsledky studií prokázaly, že emicizumab je účinný v prevenci krvácení u pacientů s HA a inhibitorem. Současně vede ke zlepšení kvality života. Po implementaci doporučení týkajících se používání BPA při léčbě krvácení nebyly zaznamenány žádné další závažné nežádoucí příhody spojené s tímto lékem.
Nedávno publikované výsledky studie HAVEN 3 [10] s emicizumabem podávaným hemofilikům A bez inhibitoru taktéž naznačují velmi příznivý efekt u této skupiny pacientů.
Emicizumab je tedy velmi slibným lékem, jehož plné místo v klinické praxi se v budoucnosti teprve ukáže.
Seznam použité literatury
- [1] Fischer K, Lassila R, Peyvandi F, et al. Inhibitor development in haemophilia according to concentrate. Four‑year results from the European Haemophilia Safety Surveillance (EUHASS) project. Thromb Haemost 2015; 113: 968‒975.
- [2] Hay CR, DiMichelle DM. The principal results of the International Immune Tolerance Study: a randomized dose comparison. Blood 2012; 119: 1335‒1344.
- [3] Lenting PJ, Denis CV, Christophe OD. Emicizumab, a bispecific antibody recognizing coagulation factors IX and X: how does it actually compare to factor VIII? Blood 2017; 130: 2463‒2468.
- [4] Sampei Z, Igawa T, Soeda T, et al. Identification and multidimensional optimization of an asymmetric bispecific IgG antibody mimicking the function of factor VIII cofactor activity. PLoS One 2013; 8: e57479.
- [5] Uchida N, Sambe T, Yoneyama K, et al. A first‑in‑human phase 1 study of ACE910, a novel factor VIII‑mimetic bispecific antibody, in healthy subjects. Blood 2016; 127: 1633–1641.
- [6] Shima M, Hanabusa H, Taki M, et al. Factor VIII‑mimetic function of humanized bispecificantibody in hemophilia A. N Engl J Med 2016; 374: 2044–2053.
- [7] Oldenburg J, Mahlangu JN, Kim B, et al. Emicizumab prophylaxis in hemophilia A with inhibitors. N Engl J Med 2017; 377: 809–818.
- [8] Guy Y, Sidonio RF, Liesner R, et al. HAVEN 2 Updated Analysis: Multicenter, Open‑Label, Phase 3 Study to Evaluate Efficacy, Safety and Pharmacokinetics of Subcutaneous Administration of Emicizumab Prophylaxis in Pediatric Patients with Hemophilia A with Inhibitors. Blood 2017; 130: 85.
- [9] Collins PW, Liesner R, Makris M, et al. Treatment of bleeding episodes in haemophilia A complicated by a factor VIII inhibitor in patients receiving emicizumab. Interim guidance from UKHCDO Inhibitor Working Partz and Executive Committee. Haemophilia 2018; 24: 344‒347.
- [10] Mahlangu J, Oldenburg J, Paz‑Priel I, et al. Emicizumab prophylaxis in patients who have hemophilia A without inhinitors. N Eng J Med 2018; 379: 811‒822.