Ertugliflozin
Souhrn:
Edelsberger T. Ertugliflozin. Remedia 2020; 30: 82–85.
Článek přináší souhrn farmakologických vlastností molekuly a přehled aktuálně dostupných publikovaných dat o účinnosti a bezpečnostním profilu ertugliflozinu z rozsáhlého programu klinických studií VERTIS (eValuation of ERTugliflozin effIcacy and Safety study group).
Summary:
Edelsberger T. Ertugliflozin. Remedia 2020; 30: 82–85.
Ertugliflozin is the most recent representative of the group of sodium glucose transporter type 2 (SGLT2) inhibitors, i.e., gliflozins. The article reviews pharmacological molecular characteristics and currently available published data regarding efficacy and safety profile of ertugliflozin from VERTIS, a large program of clinical studies (eValuation of ERTugliflozin effIcacy and Safety study group).
Key words: SGLT2 inhibitors, oral antidiabetics, gliflozins, type 2 diabetes mellitus
Ertugliflozin (obr. 1), přípravek ze skupiny
inhibitorů transportéru pro glukózu a sodík v ledvinách SGLT2
(glifloziny), je dle aktuálních doporučení indikován u pacientů
s diabetem 2. typu jako monoterapie nebo v kombinaci
s metforminem nebo s jinými antidiabetiky. Je k dispozici
samostatně v denní dávce 5 mg
nebo 15 mg
(Steglatro), ve fixní kombinaci se sitagliptinem (Stegujan) nebo
s metforminem (Segluromet).
Farmakokinetika
Obdobně jako ostatní inhibitory SGLT2 blokuje ertugliflozin
zpětný transport glukózy z glomerulárního filtrátu přes membránu
epiteliálních buněk, což má za následek zvýšené vylučování glukózy močí.
Ertugliflozin v denní dávce 5 mg
nebo 15 mg vede
u pacientů s diabetem 2. typu k téměř maximální exkreci
glukózy do moči, přičemž dochází k 87%, respektive 96% inhibici
reabsorpce.
Po jedné perorální dávce 5 mg a 15 mg
ertugliflozinu nalačno se maximální plazmatické koncentrace (medián tmax) ertugliflozinu dosáhne za jednu hodinu
po podání dávky. Maximální plazmatická koncentrace (cmax)
a plocha pod křivkou plazmatické koncentrace (AUC) ertugliflozinu se
po jednorázových dávkách v rozpětí od 0,5 do 300 mg
a po opakovaných dávkách od 1 do 100 mg zvyšují závisle na dávce. Absolutní
perorální biologická dostupnost ertugliflozinu po podání dávky 15 mg je přibližně 100 %. Pozorovaný vliv potravy
na farmakokinetiku ertugliflozinu se nepovažuje za klinicky
relevantní a ertugliflozin lze podávat s jídlem nebo bez jídla.
Primárním mechanismem eliminace ertugliflozinu
z organismu je metabolizace. Hlavní metabolickou cestou je O‑glukuronidace
zprostředkovaná UDP‑glukuronosyltransferázami UGT1A9 a UGT2B7. Střední
hodnota eliminačního poločasu u pacientů s diabetes mellitus
2. typu s normální funkcí ledvin byla na základě populační
farmakokinetické analýzy odhadnuta na 17 hodin. Po perorálním podání
roztoku 14C‑ertugliflozinu zdravým subjektům bylo
přibližně 41 %
radioaktivity související s léčivem eliminováno do stolice a 50 % do moči. Pouze 1,5 % podané dávky bylo
vyloučeno jako nezměněný ertugliflozin do moči a 34 % jako nezměněný
ertugliflozin do stolice, což je pravděpodobně důsledkem vylučování
glukuronidových metabolitů do žluči a následné hydrolýzy
na mateřskou látku [1].
Vzhledem k tomu, že je ertugliflozin k dispozici
ve fixní kombinaci s metforminem a se sitagliptinem, byla
provedena studie k posouzení vzájemných interakcí těchto léčiv podávaných
současně. Celkem 12 zdravých dospělých jedinců dostávalo 15 mg ertugliflozinu, 100 mg sitagliptinu
a ertugliflozin v kombinaci se sitagliptinem. Dle výsledků
hodnocení nemělo současné podávání ertugliflozinu a sitagliptinu žádný
účinek na vstřebávání ertugliflozinu. Podobně ani ertugliflozin neovlivnil
plazmatické koncentrace sitagliptinu. Analogické výsledky byly získány při
podávání s metforminem. Absence farmakokinetické interakce ukazuje, že
ertugliflozin lze podávat současně se sitagliptinem i s metforminem
bez úpravy dávky [2].
Co se týče selektivity vůči subtypům přenašeče SGLT, řadí se
ertugliflozin mezi empagliflozin a dapagliflozin s vysokou mírou
selektivity vůči SGLT2 (viz tab. 1) [3].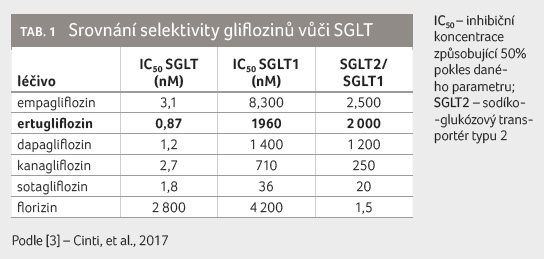
Účinnost ertugliflozinu v klinickém hodnocení
Účinnost a bezpečnost nového zástupce skupiny
inhibitorů SGLT2 ertugliflozinu byla sledována v programu klinických
studií VERTIS (eValuation of ERTugliflozin effIcacy and Safety study group), obrázek 2, většina výsledků již byla publikována.
Jednalo se vesměs
o multicentrické, randomizované, dvojitě zaslepené, placebem nebo aktivním
komparátorem kontrolované klinické studie fáze III, kterých se účastnilo celkem
4 863 pacientů s diabetes mellitus 2. typu,
včetně studie se středně závažnou poruchou funkce ledvin (468 pacientů).
Do tohoto počtu není zahrnuta dosud nepublikovaná studie VERTIS‑CV, které
se účastní více než 8 000 pacientů.
Distribuce podle ras představovala: 76,8 % – běloši,
13,3 % – Asiaté, 5,0 % – černoši, 4,8 % – ostatní. Hispánští nebo latinskoameričtí pacienti tvořili 24,2 % populace. Průměrný věk pacientů byl 57,8 roku
(rozmezí 21−87 let), přičemž 25,8 % pacientů bylo
ve věku 65 let a více a 4,5 % ve věku
75 let a více. Ertugliflozin byl hodnocen v monoterapii
a v kombinaci s metforminem a/nebo s inhibitorem
dipeptidylpeptidázy 4 (DPP‑4) sitagliptinem. Ertugliflozin byl rovněž hodnocen
u pacientů trpících diabetes mellitus 2. typu se středně závažnou
poruchou funkce ledvin v kombinaci se současnými způsoby léčby
diabetu, včetně léčby inzulinem a glimepiridem [4−14].
Glykovaný hemoglobin
Ve všech publikovaných studiích programu VERTIS vedlo
podávání ertugliflozinu v dávce 5 mg
nebo 15 mg
ke statisticky významnému (p < 0,001)
poklesu hodnot glykovaného hemoglobinu (HbA1c), přičemž
nejvýraznější efekt byl doložen u fixní kombinace ertugliflozinu se
sitagliptinem (viz graf 1).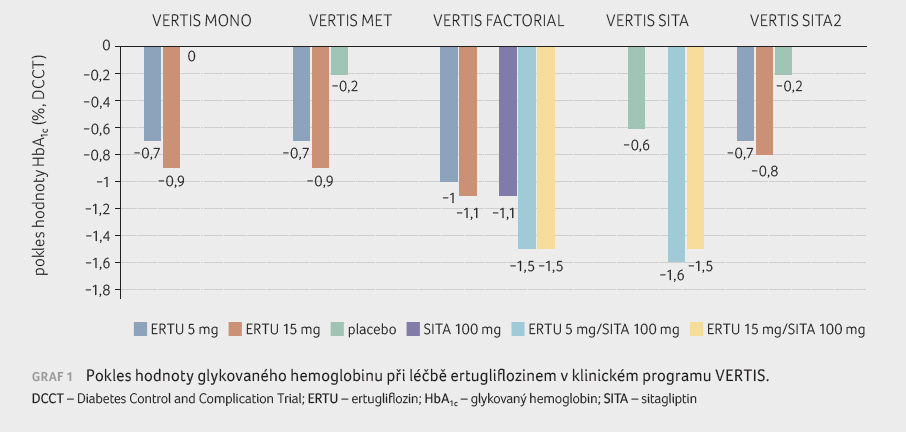
Glykemie nalačno
Užívání ertugliflozinu vedlo rovněž ke statisticky
významnému snížení glykemie nalačno (FPG). Ertugliflozin v dávce 5 mg a 15 mg podávaný oproti placebu
přinesl korigované snížení FPG o 1,92 a 2,44 mmol/l v monoterapii, o 1,48
a 2,12 mmol/l
jako přídatná terapie k metforminu (graf 2)
a o 1,40 a 1,74 mmol/l
jako přídatná terapie k metforminu a sitagliptinu. Kombinace
ertugliflozinu a sitagliptinu vedla opět k ještě výraznějšímu snížení
FPG v porovnání se sitagliptinem nebo ertugliflozinem v monoterapii
nebo v porovnání s placebem (ertugliflozin 5 mg nebo 15 mg
v kombinaci se sitagliptinem 2,16 mmol/l,
resp. 2,56 mmol/l).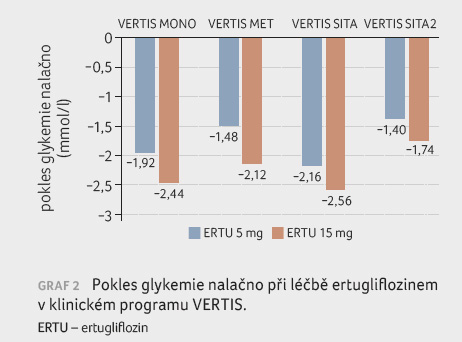
Postprandiální glykemie
Ve studii VERTIS MONO vedl ertugliflozin v dávkách
5 mg a 15 mg ke statisticky
významným snížením glykemie za dvě hodiny po příjmu potravy o 3,83
a 3,74 mmol/l
proti placebu.
Krevní tlak
Ve třech
ze studií programu VERTIS snižoval ertugliflozin systolický krevní tlak
v rozmezí od 2,9 do 3,7 mm Hg při dávce 5 mg a od 1,7 do 4,5 mm Hg při dávce 15 mg. Ve studii VERTIS SU bylo zaznamenáno snížení systolického
krevního tlaku oproti výchozímu stavu o 2,2 mm Hg při podávání
ertugliflozinu v dávce 5 mg a 3,8 mm Hg při
podávání dávky 15 mg
ertugliflozinu, zatímco u subjektů léčených glimepiridem došlo
ke zvýšení výchozího systolického tlaku o 1 mm Hg.
Tělesná hmotnost
Efekt podávání ertugliflozinu na snížení tělesné
hmotnosti v klinickém programu VERTIS ukazuje graf 3.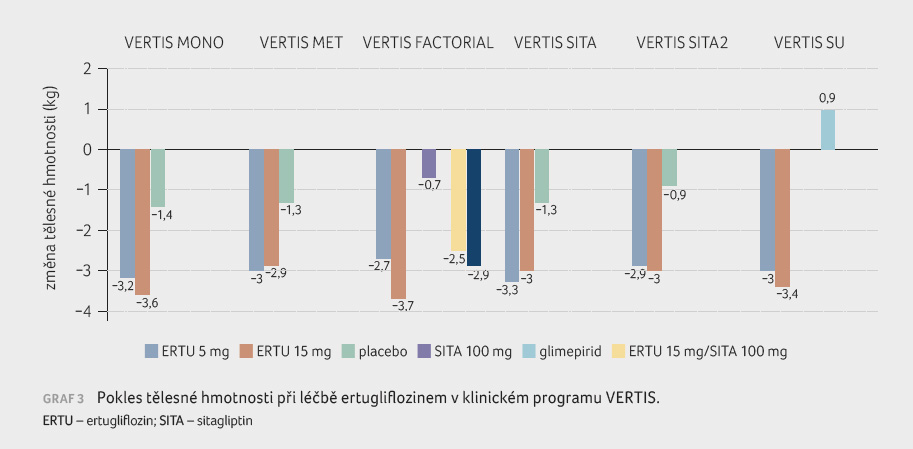
Pacienti s diabetickým onemocněním ledvin
Do studie
VERTIS RENAL byli zařazeni pacienti s diabetickým onemocněním ledvin
(chronic kidney disease, CKD) ve stadiu 3 (odhadovaná glomerulární
filtrace [eGFR] ≥ 0,5 až < 1 ml/s), kteří byli randomizováni k podávání
ertugliflozinu v dávce 5 mg, 15 mg nebo placeba jednou denně. Pacienti léčení
metforminem podstoupili před randomizací tzv. wash out periodu v délce 10
týdnů. V týdnu 26 bylo pozorováno snížení hodnot HbA1c
oproti výchozím hodnotám o 0,3 %, 0,3 % a 0,4 % pro placebo,
ertugliflozin 5 mg, respektive
pro dávku 15 mg. Nepovolené užívání
metforminu však bylo identifikováno až u 17 % pacientů a mělo tak dopad na hodnocení primárního cílového
ukazatele. Ve 26. týdnu bylo při podávání ertugliflozinu oproti
placebu pozorováno větší snížení tělesné hmotnosti, pokles glykemie nalačno
a systolického krevního tlaku ve srovnání s výchozím stavem.
Kardiovaskulární bezpečnost
Primárním cílem dosud nepublikované kardiovaskulární (KV)
bezpečnostní studie s ertugliflozinem VERTIS CV je prokázat non‑inferioritu
léčby ertugliflozinem proti placebu ve výskytu závažných KV příhod (úmrtí,
nefatální infarkt myokardu nebo nefatální mozková příhoda). Sekundárním cílem
je prokázat oproti placebu jeho superioritu z hlediska výskytu KV úmrtí,
hospitalizace pro srdeční selhání nebo progrese diabetického onemocnění ledvin.
Do studie bylo randomizováno celkem 8 246 pacientů. Průměrný věk
zařazených osob byl 64,4 roku, průměrná délka trvání diabetu 12,9 roku
a hodnota HbA1c při vstupu do studie činila
průměrně 8,3 % (DCCT).
Při vstupu bylo aterosklerotické postižení srdce, cerebrovaskulární onemocnění
a periferní arteriální onemocnění přítomno u 76,3 %, 23,1 % resp. 18,8 % pacientů. Manifestní
srdeční selhání bylo dokumentováno u 23,1 %
a CKD 3. stupně u 21,6 %
pacientů [15].
Nežádoucí účinky
Klinické studie prokázaly, že bezpečnostní profil
ertugliflozinu je podobný jako u ostatních molekul této lékové skupiny.
Mezi nežádoucími účinky byly zaznamenány zvýšený výskyt genitálních mykotických
infekcí, infekce močových cest, hypotenze při poškození ledvin
a euglykemická ketoacidóza.
Ertugliflozin zvyšuje výskyt genitálních mykotických
infekcí. Ve studiích VERTIS MET a VERTIS MONO byl jejich výskyt
(genitální kandidóza, vaginální infekce, vulvitida, vulvovaginální kandidóza
atd.) zaznamenán u 4,4 %
žen z placebové skupiny, u 13,6 %
žen léčených 5 mg
ertugliflozinu a u 14,3 %
žen užívajících 15 mg
ertugliflozinu. U mužů se genitální mykotické infekce (balanitis,
balanopostitis, genitální infekce atd.) ve stejných studiích objevily
v 0,6 %, resp.
v 3,2 %
a 5,5 %.
Výskyt infekcí močových cest byl ve všech léčených
skupinách v průběhu klinických hodnocení VERTIS MET a VERTIS MONO
obecně podobný. Zajímavé je zjištění, že v prodloužené studii VERTIS MONO
byl výskyt infekcí močových cest významně vyšší ve skupině s placebem/metforminem
ve srovnání se skupinou, která dostávala 15 mg
ertugliflozinu (13,7 %
vs. 6,6 %; p = 0,039). Obecně platí, že pacienti
s diabetem mají významně vyšší riziko výskytu infekce močových cest
ve srovnání s nediabetickou populací. Mezi diabetické pacienty
ohrožené obzvláště vysokým rizikem infekce močových cest patří nemocní se
špatnou glykemickou kontrolou (HbA1c > 8,5 %), ve vyšším věku,
ženy a osoby s anamnézou močových infekcí v předchozích dvou
letech.
Závěr
Ertugliflozin představuje další účinný inhibitor SGLT2 pro
léčbu pacientů s diabetes mellitus 2. typu. Stejně jako u jiných
gliflozinů je jeho působení prokazatelně nezávislé na inzulinu
a účinné při snižování hodnot HbA1c, krevního tlaku
a tělesné hmotnosti, a to jak v monoterapii, tak
i v kombinaci s dalšími antidiabetiky. Diabetes mellitus
2. typu je značně heterogenní onemocnění, a tak se může individuální
reakce na léčbu ertugliflozinem mezi jednotlivci samozřejmě lišit. Pro
maximalizaci přínosů a minimalizaci nežádoucích účinků může být proto
v budoucnu důležitá identifikace farmakogenetických biomarkerů sloužících
pro predikci terapeutické odpovědi u konkrétního pacienta.
Jelikož není k dispozici dostatek validních studií
přímo srovnávajících jednotlivé glifloziny, volba konkrétního léku se tak musí
kromě intuice opírat především o souhrn publikovaných dat včetně KV
studií. Zajímavá metaanalýza McNeillové [16] sice prokázala, že ertugliflozin
v dávce 15 mg byl
v monoterapii a v kombinaci s metforminem o něco
účinnější v redukci hodnot HbA1c než podávání dapagliflozinu
v dávce 10 mg
nebo empagliflozinu v dávce 25 mg
denně, nejde však o přímé (head‑to‑head) srovnání.
V roce 2020 by měla být publikována i data
ze studie VERTIS CV, která bude klíčovou z hlediska dalšího
osudu ertugliflozinu. Doufejme, že prokáže přinejmenším neutrální efekt
na výskyt KV příhod a redukci výskytu srdečního selhání, což jsou
parametry, které od gliflozinů v současné době očekáváme.
Hlavní předností ertugliflozinu je v tuto chvíli
z mého pohledu především možnost použití v kombinované terapii se
sitagliptinem. Využití této léčby v počátcích onemocnění diabetem, ať už
v kombinaci s metforminem, nebo bez něj, se jeví optikou odlišných
farmakodynamických účinků jednotlivých molekul jako slibné z hlediska
zpomalení progrese diabetu, a to při minimu nežádoucích účinků
a v perorální lékové formě, a tudíž s předpokladem dobré
adherence k léčbě ze strany pacienta.
Seznam použité literatury
- [1] Souhrn údajů o přípravku Steglatro, 2020. Dostupné na: https://www.ema.europa.eu/en/documents/product information/steglatro epar product information_cs.pdf
- [2] Kumar V, Sahasrabudhe V, Matschke K, et al. Lack of a pharmacokinetic interaction between ertugliflozin and sitagliptin or metformin in healthy subjects. Poster presented at: ASCPT 2016 Annual Meeting of the American Society for Clinical Pharmacology and Therapeutics; March 12; 2016; San Diego, CA.
- [3] Cinti F, Moffa S, Impronta F, et al. Spotlight on ertugliflozin and its potential in the treatment of type 2 diabetes: Evidence to date. Drug Des Devel Ther 2017; 11: 2905−2919.
- [4] Terra SG, Focht K, Davies M, et al. Phase III, efficacy and safety study of ertugliflozin monotherapy in people with type 2 diabetes mellitus inadequately controlled with diet and exercise alone. Diabetes Obes Metab 2017; 19: 721–728.
- [5] Aronson R, Frias J, Goldman A, et al. Long term efficacy and safety of ertugliflozin monotherapy in patients with inadequately controlled T2DM despite diet and exercise: VERTIS MONO extension study. Diabetes Obes Metab 2018; 20: 1453−1460.
- [6] Rosenstock J, Frias J, Páll D, et al. Effect of ertugliflozin on glucose control, body weight, blood pressure and bone density in type 2 diabetes mellitus inadequately con-trolled on metformin monotherapy (VERTIS MET) Diabetes Obes Metab 2018; 20: 520–529.
- [7] Gallo, S, Charbonnel, B, Goldman, A, et al. Long‐term efficacy and safety of ertugliflozin in patients with type 2 diabetes mellitus inadequately controlled with metformin monotherapy: 104‐week VERTIS MET trial. Diabetes Obes Metab 2019; 21: 1027–1036.
- [8] Pratley R, Eldor R, Golm G, et al. Safety and efficacy of ertugliflozin plus sitagliptin versus either treatment alone in subjects with type 2 diabetes inadequately controlled with metformin: the VERTIS FACTORIAL trial. Poster presented at: EASD 2016 52nd European Association for the Study of Diabetes; September 15; 2016; Munich, Germany.
- [9] Pratley R, Raji A, Eldor R, et al. Safety and efficacy of ertugliflozin plus sitagliptin vs. either treatment alone after 52 weeks in subjects with T2DM inadequately controlled on metformin: VERTIS FACTORIAL trial extension. Oral presentation at: ADA 2017; June 9; 2017; San Diego, CA.
- [10] Lauring B, Miller SS, Krumins T, et al. Safety and efficacy of ertugliflozin in combination with sitagliptin in subjects with T2DM inadequately controlled on diet and exercise: the VERTIS SITA Trial. Poster presented at: ADA 2017; June 8; 2017; San Diego, CA.
- [11] Lauring B, Eldor R, Liu J, et al. Efficacy and safety of ertugliflozin in subjects with type 2 diabetes mellitus inadequately controlled on the dual combination of metformin and sitagliptin: the VERTIS SITA2 trial. Poster presented at: EASD 2016 52nd European Association for the Study of Diabetes; September 15; 2016; Munich, Germany.
- [12] Liu J, Eldor R, Dagogo Jack S, et al. Safety and efficacy of ertugliflozin after 52 weeks in subjects with T2DM inadequately controlled on metformin and sitagliptin: results from the extension phase of the VERTIS SITA2 Trial. Oral presentation at: ADA 2017; June 9; 2017; San Diego, CA.
- [13] Hollander P, Liu J, Hill J, et al. Safety and efficacy of ertugliflozin compared to glimepiride in patients with type 2 diabetes inadequately controlled on metformin: the VERTIS SU trial. Poster presentation at: EASD 2017; Lisbon, Portugal.
- [14] Grunberger G, Camp S, Johnson J, et al. Ertugliflozin in Patients with Stage 3 Chronic Kidney Disease and Type 2 Diabetes Mellitus: The VERTIS RENAL Randomized Study. Diabetes Ther 2018; 9: 49–66.
- [15] Cannon CP, McGuire DK, Pratley R, et al. Design and baseline characteristics of the eValuation of ERTugliflozin effIcacy and Safety CardioVascular outcomes trial (VERTIS CV), Am Heart J 2018; 206: 11−23.
- [16] McNeill AM, Davies G, Kruger E, et al. Ertugliflozin Compared to Other Anti hyperglycemic Agents as Monotherapy and Add on Therapy in Type 2 Diabetes: A Systematic Literature Review and Network Meta Analysis. Diabetes Ther 2019; 10: 473–491.