Léčba alergie na pyly břízovitých na dosah
Ve dnech 8.‒9. října 2020 proběhl XXXVII. sjezd českých a slovenských alergologů a klinických imunologů, vzhledem k pandemické situaci měla jednací platforma virtuální podobu. Prezidentkou tradiční odborné akce pořádané Českou společností alergologie a klinické imunologie ČLS JEP ve spolupráci s Českou imunologickou společností, z. s., Slovenskou spoločnosťou alergológie a klinickej imunológie a Slovenskou imunologickou spoločnosťou se stala prof. MUDr. Jiřina Bartůňková, DrSc., MBA. Součástí sjezdu bylo sympozium společnosti ALK, na němž byla blíže představena první sublinguální tableta pro léčbu pacientů trpících alergickou rinokonjunktivitidou na základě senzibilizace na pyly jarních stromů.
Význam homologie rostlin při léčbě
alergenovou imunoterapií (AIT) objasnil v úvodu sympozia
prof. MUDr. Petr Panzner, CSc., z Ústavu
imunologie a alergologie FN Plzeň, a to především
na základě loni publikace zaměřené na alergii
na břízovité stromy v evropském regionu [1]. Nová
sublinguální tableta (sublingual immunotherapy, SLIT) pod obchodním
názvem ITULAZAX je
totiž určena nejen pro léčbu alergie na pyl břízy, ale
rovněž přecitlivělosti na pyly dalších stromů z této
skupiny. Ve zmiňované práci se uvádí, že ve vymezené
oblasti se jedná o olši, lísku, buk, dub, habr a jedlý
kaštan ‒ posledně jmenovaný však v našich klimatických
podmínkách není relevantní. Pyly těchto stromů vykazují
výraznou zkříženou reaktivitu, která je dána zejména
molekulami homologními k hlavnímu alergenu břízy
označovanému Bet v 1 (Betula verrucosa). Zkříženou
reaktivitu vyplývající z homologie nejlépe dokládá
inhibice tvorby IgE (imunoglobulinu E) u pacientů
alergických na pyly různých stromů a inkubace jejich
séra s alergeny pylů břízy. Jedna z publikovaných
prací prokázala, že tato inhibice se pohybovala v průměru
kolem 82 % [2], což ukazuje na velmi silnou homologii
a silnou zkříženou reaktivitu. V případě břízy pak
tato hodnota činila 92 %, u olše 88 % a u lísky
80 %. Uvedená data tedy přinášejí jednoznačné důkazy pro
to, aby bylo možné s alergenem pylu břízy pracovat jako
s alergenem pokrývajícím celou skupinu břízovitých stromů.
Výsledky mezinárodní studie
se „stromovou“ tabletou
Účinnosti SLIT v léčbě alergie na břízovité věnovala svoji přednášku MUDr. Ester Seberová (Respiral, s.r.o., Plzeň). Stromové pyly hrají významnou roli v rozvoji respiračních alergií. Obdobím, kdy v naší lokalitě dominuje pyl břízy, je měsíc duben. Potíže pacientů alergických na pyl břízy se však neodvíjejí pouze od výskytu pylů v dubnu právě z důvodu už zmíněné zkřížené reakce na homologní alergeny. Pylová sezona stromů u nás začíná už koncem ledna vlivem homologní reakce s lískou a olší a vzhledem k pozdějšímu výskytu pylu dubu přetrvává až do května. Přibližně 84‒87 % pacientů citlivých na břízu je současně senzibilizovaných na lísku a 92 % je současně senzibilizovaných na olši. U zhruba 73 % pacientů s alergií na břízu se navíc vyskytuje tzv. orální alergický syndrom, přičemž 86 % z nich trpí celoročními příznaky na sliznici úst. Tento syndrom představuje zkříženou reakci na některé potraviny, zejména některé druhy ovoce a zeleniny [3–5]. Ke zkříženě reagujícím potravinám patří kromě jablka i další malvice, dále peckovice (nektarinky, broskve ad.), celá řada stromových ořechů, zejména lískové, či syrová kořenová zelenina, zejména mrkev [4,6,7]. Tato reakce je způsobena Bet v 1 homologií s hlavními alergeny uvedených potravin. Orální alergický syndrom většinou nemívá vážný průběh a omezuje se na příznaky v orofaryngu. Projevuje se jako svědění sliznice v ústech, jako otoky (v některých případech otoky rtů), aftózní stomatitida, výjimečně sevření hrdla. Jen zcela ojediněle se objevují celkové symptomy.
Průzkum z 19 zemí sledující celkem 1 029 osob doložil, že jako alergeny vyvolávající respirační potíže dominovaly bříza, olše a líska. Mezi pacienty trpícími alergickým respiračním onemocněním se uvedená alergie vyskytuje velmi často [8]. V Evropě byla zaznamenána prevalence alergie na břízu u 24 % alergiků [9]. Polyvalentní alergie na pyly trav a stromů se u nemocných s alergickou rýmou vyskytuje ve vysoké frekvenci.
Diagnostika alergické rýmy vyvolané jarními pyly je spjata s některými úskalími. Diagnóza je většinou jednoduchá, pokud se objevují typické příznaky – alergická rinokonjunktivitida, sezonní alergické astma – a jsou vázány na období výskytu pylů. Důležité je však vědět, že u pylových alergiků nastává určité zeslabení imunity proti virovým infekcím a mohou trpět dráždivým kašlem nebo sinusitidami. Dříve než jsou diagnostikováni jako pyloví alergici, jsou často opakovaně léčeni antibiotiky nebo terapií určenou pro respirační infekce. Problémem může být také zmiňovaný orální alergický syndrom, pokud nejsou pacienti dostatečně informováni o souvislosti těchto potíží s pylovou alergií.
V guidelines pro terapii alergické rýmy hraje velmi důležitou roli AIT, která je dnes již doporučována v celém spektru pacientů, tedy i u mírné formy onemocnění. „Čím dříve se s terapií začne, tím lépe, protože se zabrání progresi onemocnění a rozvoji polysenzibilizace,“ vysvětlila přednášející.
Účinnost přípravku Itulazax
v datech
Dále už doktorka Seberová seznámila účastníky sympozia s výsledky klinické studie fáze III, která porovnávala léčbu tabletou obsahující extrakt z pylu břízy oproti placebu u pacientů s projevy alergie na pyl břízy a homologní pyly [3]. Do studie bylo zařazeno 654 pacientů ve věku 12‒65 let (průměrný věk 36 let). Zařazení pacienti trpěli projevy pylové alergie minimálně dva roky před vstupem do studie (průměrně 15,9 roku projevy alergické rinokonjunktivitidy v souvislosti s pyly stromů), byla u nich stoprocentně prokázána alergie na břízu, ve vysokém podílu i senzibilace na lísku (85 %) a olši (92 %), u 66 % osob byl přítomen orální alergický syndrom, u 57 % z nich byly prokázány specifické protilátky proti bříze (sIgE) třídy 4‒6, u 44 % se vyskytovalo i bronchiální astma, u 76 % pacientů polysenzibilizace (nehomologními alergeny, s výskytem mimo sezonu stromů).
Pacienti byli do studie zařazeni na podzim roku 2016 a randomizováni do dvou početně zhruba stejných skupin. První skupina dostávala sublinguální tabletu s extraktem z pylu břízy, druhá skupina placebo. Sledování zahrnovalo léčbu presezonní a kosezonní – tablety byly užívány minimálně 16 týdnů před začátkem stromové pylové sezony a během ní. Celková délka léčby byla různá u různých pacientů (6,5‒9,5 měsíce). Během celé stromové sezony pylů byla měřena účinnost léčby, pacienti byli vybaveni elektronickými diáři a zaznamenávali skóre příznaků a skóre medikace.
Studijní medikací byly sublinguální tablety obsahující alergenový extrakt z přírodního pylu břízy (12 SQ Bet sublinguální lyofilizát). Tablety se snadno rozpouštějí v ústech, jejich užívání je jednoduché a pacienty nezatěžuje. Účastníci studie měli přístup k úlevové medikaci, kterou užívali podle potřeby (perorální antihistaminikum, topické oční antihistaminikum, intranazální kortikosteroid).
Primárním cílovým ukazatelem studie bylo denní celkové kombinované skóre (skóre symptomů plus medikační skóre) během sezony pylu břízy. Klíčovými sekundárními cílovými ukazateli byly průměrné celkové kombinované skóre během celé stromové pylové sezony, průměrné denní skóre symptomů během pylové sezony břízy a průměrné denní skóre symptomů během celé stromové pylové sezony. Další sekundární cílové ukazatele pak představovaly průměrné denní medikační skóre během sezony pylů břízy a průměrné denní medikační skóre během celé stromové pylové sezony.
Pacienti vyhodnocovali příznaky
pomocí vizuální analogové škály (VAS). Celkové denní
symptomové skóre bylo stanoveno na maximálně 18 (2 oční
symptomy, 4 nosní symptomy), celkové denní medikační skóre
na maximálně 20. Účastníci studie hodnotili průběh léčby
odpověďmi od „ne“ po „závažné symptomy“
a číselně 0‒3 body.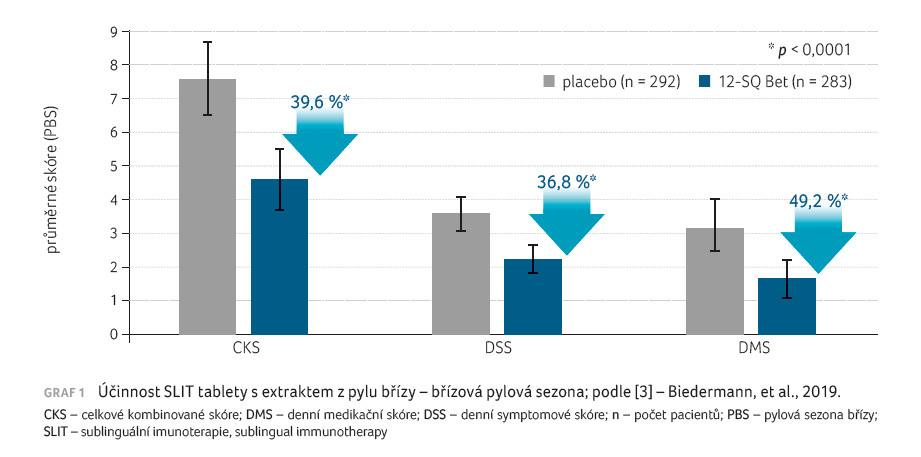
Rovněž byla sledována korelace mezi
množstvím pylů a celkovým kombinovaným skóre (max. 38).
V případě pylové sezony břízy celkové kombinované skóre
pokleslo oproti placebu o 39,6 %, denní symptomové skóre
o 36,8 % a denní medikační skóre o 49,2 % ‒
byl tedy doložen statisticky významný rozdíl mezi aktivně
léčenými pacienty a pacienty užívajícími placebo (graf 1). U stromové pylové sezony byly zaznamenány podobné
výsledky: celkové kombinované skóre pokleslo oproti placebu
o 36,5 %, denní symptomové skóre o 32,7 %, denní
medikační skóre o 46,7 % (graf 2). Pro sezonu pylů
olše a lísky byly hodnoty poklesu následující: 29,7 %,
resp. 26,0 %, resp. 43,8 %; pro sezonu pylů dubu: 36,0 %,
resp. 31,6 %, resp. 45,9 %.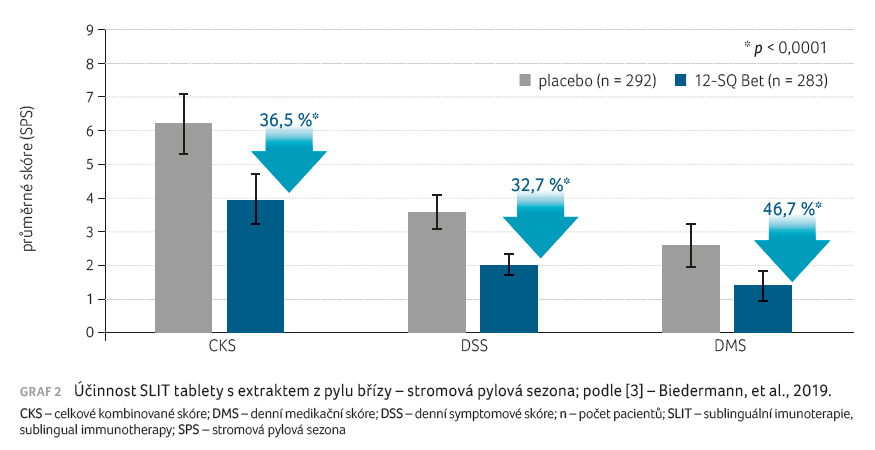
V rámci imunologických parametrů byly zachyceny změny koncentrací sIgE a IgG4 pro břízový alergen. Už krátce po randomizaci došlo nejprve ke vzestupu a poté k pozvolnému poklesu koncentrace IgE specifického pro břízu, podobná imunologická odezva nastala i u koncentrací protilátek IgG4, které po celou dobu léčby od randomizace kontinuálně stoupaly (graf 3A, B).
Léčba byla obecně dobře snášena.
Mezi nejčastější nežádoucí účinky sublinguální terapie
patřily lokální reakce mírné až střední intenzity po podání
tablety (svědění v ústech, podráždění krku, orální
parestezie, otoky; 94 % vs. 89 % u placeba). Pouze 8 %
pacientů muselo ukončit léčbu z důvodu výskytu těchto
nežádoucích účinků, které pro ně byly netolerovatelné.
Nebyly hlášeny úmrtí, anafylaktický šok ani obstrukce dýchacích
cest.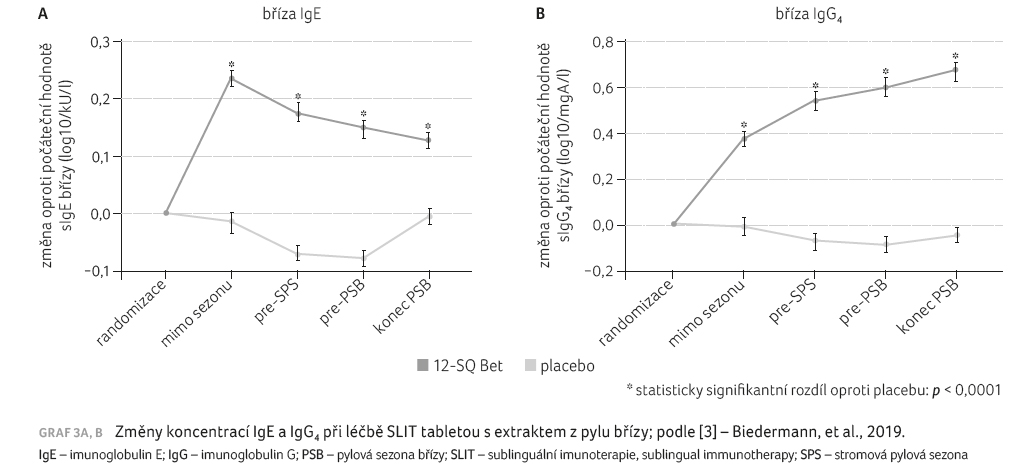
První tableta se podává pod dozorem lékaře. Při podání první tablety je nutné upozornit pacienta na lokální nežádoucí účinky léčby a na to, jak dlouho budou obtíže trvat v den podání a následující dny. Nástup účinku je velmi rychlý, většinou krátce po podání tablety. Doba odeznění nežádoucích účinků po užití tablety činí obvykle 10‒45 minut. Za jeden až dva týdny léčby (méně třetí týden) nepříjemné příznaky u většiny pacientů zcela vymizejí.
Imunitní odpověď na SLIT
s extraktem z pylu břízy
Další přednášející, prof. MUDr. Miloš Jeseňák, PhD., MBA, z Oddělení klinické imunologie a alergologie Kliniky dětí a dorostu 1. LF UK a UNM, Martin, připomněl, že každý konkrétní přípravek a každá konkrétní forma AIT by měly podle posledních doporučení Evropské akademie alergologie a klinické imunologie (EAACI) disponovat svými vlastními daty nejen z hlediska účinnosti a bezpečnosti, ale také z hlediska imunitních parametrů, z nichž některé jsou hodnoceny pouze experimentálně.
Alergenová imunoterapie je dostupná již od dětského věku (v závislosti na typu přípravku od 5 či 6 let, v některých případech od 12 let) a je běžnou součástí mnoha guidelines a doporučení. Při podávání AIT by mělo být prováděno pravidelné hodnocení z hlediska bezpečnosti a požadovaného efektu jak u subkutánní, tak u sublinguální formy, a to nejméně jednou ročně.
K dispozici máme klinické nástroje hodnocení, které vycházejí z našich klinických zkušeností, subjektivní popis účinnosti léčby pacientem a rovněž objektivní nástroje, k nimž se řadí například symptomová skóre u alergické rinitidy, skóre na základě spotřeby záchranné medikace či různé dotazníky kvality života [10]. U každého pacienta bychom měli kromě vlivu dané léčby AIT zohledňovat průběh pylové sezony, možnost snížení spotřeby záchranné medikace a pravidelné léčby antihistaminiky.
Viditelné klinické výstupy doplňují také měřitelné laboratorní parametry, jako jsou alergen specifické IgE, resp. komponentová diagnostika, popř. hodnocení alergen specifických IgE a IgG4. Zde je nutné opět připomenout, že dynamika sIgE může být variabilní, z počátku léčby dokonce s narůstající tendencí. Z experimentálních nástrojů je k dispozici např. analýza cytokinů, v klinické praxi se však tyto nástroje většinou nepoužívají.
Imunologické reakce a korelace
úspěšně aplikované AIT
Pro zjištění imunologických reakcí a korelací používáme analýzu sIgE a analýzu IgG4 specifického vůči konkrétnímu alergenu, přičemž lze zohlednit i poměr mezi IgE a IgG4. Autoři jedné z prací [11] se zaměřili mimo jiné na laboratorní důsledky aplikované AIT nejen ve vztahu k hlavnímu alergenu (bříze), ale i k ostatním homologním dřevinám (olše, líska, dub, habr). Porovnáním sIgE byla zjištěna vysoká a silná pozitivní korelace a zkřížená reaktivita mezi sIgE proti bříze a proti olši a mezi sIgE proti bříze a proti lísce.
V souvislosti s vývojem tablety Itulazax byly zkoumány některé další možnosti a síly této lékové formy imunoterapie. Jako klinicky relevantní z hlediska účinnosti se jevila síla od 4 SQ Bet výše, z hlediska optimalizace účinnosti a bezpečnosti byla zvolena síla 12 SQ Bet. Při poklesu sIgE by měla logicky koncentrace protilátek sIgG4, které v konečném důsledku ovlivňují dostupnost daného alergenu v organismu a zejména aktivaci imunitních buněk, stoupat. Nárůst sIgG4 v této analýze jednoznačně potvrzoval klinický účinek, ale především navození imunitní tolerance.
Testování přípravku Itulazax v jednotlivých klinických sledováních a v jednotlivých lokalitách Evropy přineslo identické výsledky, ať už z hlediska vzájemné indukce zkříženě reagujících IgG4, které indikují navození tolerance v rámci AIT, nebo vysoké homologie z hlediska koncentrace sIgE reagujících mezi břízovým alergenem a jednotlivými vedlejšími alergeny.
Profesor Jeseňák zdůraznil i význam podpory compliance a adherence k léčbě. Pacient by měl být při každé kontrole opakovaně informován o očekávaném průběhu léčby a očekávaných nežádoucích účincích.
V posledních letech se objevila rovněž řada publikací, které analyzovaly mechanismy účinku AIT, jež jsou podkladem pro efektivní fungování této léčby u konkrétního pacienta. Zabývaly se např. modulací alergen specifických paměťových T a B lymfocytů, regulací tvorby sIgE a sIgG4, modulací prahu aktivace mastocytů, eozinofilů a bazofilů, změnou fenotypu antigen prezentujících buněk, změnou spektra secernovaných cytokinů (pokles hodnot Th2 – IL 4, IL 5, IL 13), proliferací a aktivitou specifických buněčných populací ‒ Treg, Breg, přirozené lymfoidní buňky typu 3 [12,13].
V závěru přednášky profesor Jeseňák shrnul podstatné výsledky působení přípravku Itulazax v následujících bodech: regulace tvorby sIgE proti bříze a homologním alergenům, aktivace tvorby sIgG4 proti bříze a homologním alergenům, stanovená optimální dávka, postupně se vyvíjející dynamické změny v imunitním systému, léčba alergické rinokonjunktividy vyvolané břízou a dřevinami z homologní skupiny a možný efekt na projevy orálního alergického syndromu.
Simultánní léčba SLIT
u polysenzibilizovaného pacienta
Otázkou, zda je možné polysenzibilizovaného nemocného léčit několika SLIT tabletami současně, se zabývala primářka MUDr. Irena Krčmová, CSc., z Ústavu klinické imunologie a alergologie FN Hradec Králové. Na začátek také zdůraznila, že právě polysenzibilizovaní nemocní tvoří v ordinacích alergologů převahu.
„Imunomodulační proces v rámci AIT je alergen specifický, což nás nutí řešit jednotlivé spouštěcí vazby u pacientů buď simultánně, nebo následně,“ vysvětlila přednášející. Polyvalentní alergie je problém, který pacienty provází celoživotně. Alergenová imunoterapie s extrakty založená na jednom druhu alergenu je dostačující k pokrytí celého rozsahu alergenů z téže biologické rodiny tam, kde byla dokumentována homologie. Evropská léková agentura (EMA) definovala pylové i roztočové homologní skupiny, které se ve své reaktivitě překrývají a obsahují homologní alergeny.
Při diagnostice je nutné si položit otázku, zda je pacient monoalergický a souběžně polysenzibilizovaný, nebo zda je polyalergický (má překryvné symptomy s vazbou na různé alergeny) a polysenzibilizovaný. Pacienty z tohoto hlediska stratifikujeme na základě odebrané anamnézy, s podporou komponentové diagnostiky, ev. posouzení s nosní/spojivkovou provokací. Ta je však s ohledem na aktuální pandemickou situaci komplikovanější a v případě nutnosti provokace je třeba po pacientovi požadovat negativní test na COVID 19.
Pokud pacienta posoudíme jako
polysenzibilizovaného a polyalergického rinitika na homologní
(biologicky příbuzné) alergeny, je vhodná léčba jediným
alergenovým přípravkem nebo směsí dvou homologních alergenů.
Pokud je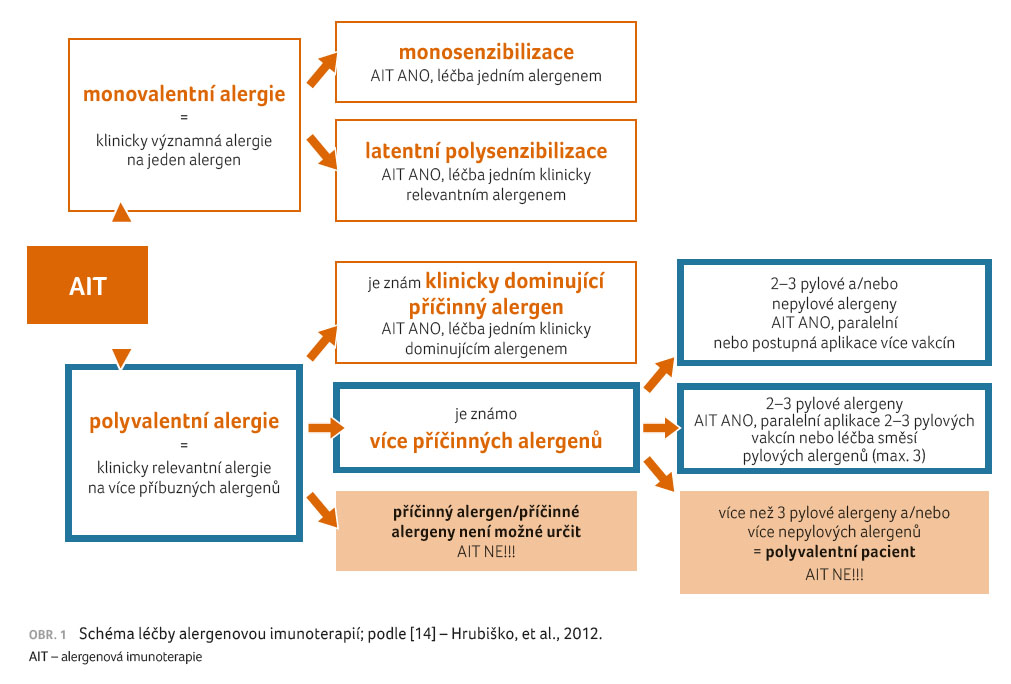 pacient rinitik s vazbou na nehomologní alergeny,
nabízí se otázka, zda lze užít dva oddělené produkty AIT.
Evropské guidelines k tomu uvádějí, že alergeny je možno
podávat v intervalu 30‒60 minut, při subkutánní alergenové
imunoterapii (SCIT) na místech od sebe oddělených,
a doporučují zvážit poměr efektivita/bezpečnost/compliance.
pacient rinitik s vazbou na nehomologní alergeny,
nabízí se otázka, zda lze užít dva oddělené produkty AIT.
Evropské guidelines k tomu uvádějí, že alergeny je možno
podávat v intervalu 30‒60 minut, při subkutánní alergenové
imunoterapii (SCIT) na místech od sebe oddělených,
a doporučují zvážit poměr efektivita/bezpečnost/compliance.
Existují různé studie, které se zabývají tím, na co jsou pacienti s převahou alergičtí [8]. Řada z těchto pacientů je úspěšně léčena AIT, ale stále si klademe otázku, kterým typem AIT začít, jak dlouho v léčbě pokračovat a kdy navázat jinou léčbou (obr. 1) [14]. „K této situaci máme sice k dispozici určitá doporučení, ale v klinické praxi není jednoduché léčit simultánně několik alergenů a uchylujeme se k tomu zřídka,“ uvedla primářka Krčmová.
Dále přednášející představila studii, která řešila následné a posléze simultánní podávání sublinguálních tablet s extraktem pylu bojínku a ambrozie [15]. Toto sledování detailně monitorovalo nežádoucí účinky s vazbou na podávanou sublinguální terapii a sledovalo subjektivní pocity pacientů. Cílem klinického hodnocení bylo potvrdit bezpečnost a toleranci souběžného podávání dvou SLIT přípravků. Studijní medikaci představovaly přípravky Grazax (bojínek) a Ragwizax (ambrozie). Multicentrická otevřená studie fáze IV zahrnula dospělé alergiky senzibilizované na pyly trav a ambrozie (n = 102) a probíhala od října 2014 do února 2015 ve třech lokalitách v USA a v Kanadě. Primárním cílovým ukazatelem studie byl podíl pacientů s jedním či více lokálními otoky v dutině ústní dle fáze studie. Další cílový ukazatel pak představoval podíl pacientů s jednou či více nežádoucími lokálními příhodami, které vedly k přerušení SLIT či vyžadovaly léčbu. Po screeningové části studie pacienti při druhé návštěvě užili sublinguální tabletu a byli pozorováni 30 minut (fáze 1, den 1‒14). Při další návštěvě po 14 dnech dostali SLIT ambrozie, opět byli sledováni a byli požádáni, aby tabletu s obsahem bojínku užívali večer (fáze 2, den 15‒28). Po dalších dvou týdnech pacienti pod dohledem lékařů užili obě tablety následně po sobě v intervalu 5 minut a byli monitorováni z hlediska nežádoucích účinků (fáze 3, den 29‒42).
Zařazení pacienti byli v průměru středního věku, měli pozitivní kožní testy, muži a ženy byli zastoupeni podobným podílem. Výskyt nežádoucích účinků byl monitorován do 30 minut po aplikaci tablety pod dohledem lékaře a do 60 minut v domácím prostředí. Byly posuzovány jak příznaky lokální v dutině ústní, tak např. nauzea, průjem, nucení na zvracení a další dyspeptické potíže.
Otokem v dutině ústní po prvním užití tablety s extraktem pylu bojínku bylo postiženo 81 % pacientů, po 14 dnech už pouze 48 %; u tablety s extraktem pylu ambrozie to bylo 55 % při prvním užití, u obou tablet 61 % po prvním užití. V okamžiku, kdy byla přidána druhá tableta s obsahem ambrozie, do určité míry opět narostla reaktivita na tabletu s bojínkem. Oba alergeny podávané simultánně mohou přechodně zvýšit slizniční reaktivitu i na pyl trav, protože alergenový podnět je zde výraznější a opakovaný. Poté byla zaznamenána postupně klesající tendence, rovněž při podání dvou alergenů.
Z nežádoucích reakcí byly posuzovány zejména iritace v hrdle, ústní pruritus a ušní pruritus. Ve fázi 3 studie (den 29‒42) došlo ke zkrácení doby nepříjemných projevů, byla tedy zaznamenána postupně narůstající tolerance podání dvou SLIT.
V klinickém sledování nebyly dokumentovány žádný těžký otok v dutině ústní, anafylaxe ani astmatický záchvat, 99 % příznaků bylo hodnoceno jako mírné a střední. Pouze 5 % pacientů ukončilo studii ve fázi 1, v následujících fázích už to bylo vždy jen jedno procento zúčastněných. Rovněž výskyt otoků v dutině ústní měl klesající tendenci, s přechodným zvýšením při přidání druhé sublinguální tablety. Jeden či více otoků v dutině ústní se ve fázi 1, 2 a 3 vyskytly ve 14 %, resp. 22 %, resp. 15 %; jeden či více lokálních příznaků v dutině ústní v 71 %, resp. 69 %, resp. 56 %.
„Schéma uvedeného klinického hodnocení, které doložilo možnost souběžného podávání SLIT, lze zřejmě přenést i do klinické praxe. Léčba dvěma tabletami SLIT je možná po navození tolerance na první alergen (2‒4 týdny). V první fázi je vhodné oddělit od sebe časově oba terapeutické alergeny, např. ve schématu ráno‒večer (z důvodu sledování příznaků), přičemž můžeme očekávat přechodnou reaktivitu i na první alergen. Po monitorování nežádoucích lokálních reakcí a navození tolerance je možné podávání obou SLIT tablet v kratším časovém intervalu simultánně. Ve studii je uvedeno 5 minut, osobně bych se přikláněla k delšímu časovému úseku přibližně 30 minut,“ shrnula poznatky z klinického hodnocení primářka Krčmová.
Redakčně zpracovala PhDr. Nikola Homolová Richtrová
Seznam použité literatury
- [1] Biedermann T, Winther L, Till SJ, et al. Birch pollen allergy in Europe. Allergy 2019; 74: 1237‒1248.
- [2] Niederberger V, Laffer S, Fröschl R, et al. IgE antibodies to recombinant pollen allergens (Phl p 1, Phl p 2, Phl p 5, and Bet v 2) account for a high percentage of grass pollen‑specific IgE. J Allergy Clin Immunol 1998; 101: 258–264.
- [3] Biedermann T, Kuna T, Panzner P, et al. The SQ tree SLIT‑tablet is highly effective and well‑tolerated: Results from a randomized, double‑blind, placebo‑controlled phase III trial. J Allergy Clin Immunol 2019; 143: 1058‒1066.
- [4] Geroldinger‑Simic M, Zelniker T, Aberer W, et al. Birch pollen‑related food allergy: clinical aspects and the role of allergen‑specific IgE and IgG4 antibodies. J Allergy Clin Immunol 2011; 127: 616‒622.
- [5] Lorenz AR, Lüttkopf D, Seitz R, Vieths S. The Regulatory System in Europe with Special Emphasis on Allergen Products. Int Arch Allergy Immunol 2008; 147: 263–275.
- [6] Smith M, Jäger S, Berger U, et al. Geographic and temporal variations in pollen exposure across Europe. Allergy 2014; 69: 913‒923.
- [7] Jantunen J, Saarinen K, Rantio‑Lehtimäki A. Allergy symptoms in relation to alder and birch pollen concentrations in Finland. Aerobiologia 2012; 28: 169‒176.
- [8] Wahn U, Calderon MA, Demoly P. Real‑life clinical practice and management of polysensitized patients with respiratory allergies: a large, global survey of clinicians prescribing allergen immunotherapy. Expert Rev Clin Immunol 2017; 13: 283‒289.
- [9] Burbach GJ, Heinzerling LM, Edenharter G, et al. GA2LEN skin test study II: clinical relevance of inhalant allergen sensitizations in Europe. Allergy 2009; 64: 1507‒1515.
- [10] Shamji MH, Layhadi JA, Durham SR. Differences in Mechanistic and Clinical Responses to Allergen Immunotherapy Between Adults and Children. In Allergen Immunotherapy in Children User’s Guide. Pediatr Allergy Immunol 2020; 31: 1‒101.
- [11] Kleine‑Tebbe J, Zuberbier T, Werfel T, et al. Is allergy immunotherapy with birch sufficient to treat patients allergic to pollen of tree species of the birch homologous group? Allergy 2020; 75: 1327‒1336.
- [12] Komlósi ZI, Kovács N, Sokolowska M, et al. Mechanisms of subcutaneous and sublingual aeroallergen immunotherapy. What is new? Immunol Allergy Clin 2020; 40: 1‒14.
- [13] Kucuksezer UC, Ozdemir C, Cevhertas L, et al. Mechanisms of allergen‑specific immunotherapy and allergen tolerance. Allergol Int 2020; 69: 549‒560.
- [14] Hrubiško M, Špičák V. Polyalergie a polysenzitivita ‒ je vhodná alergenová imunoterapie? Alergie 2012; 14: 217‒222.
- [15] Maloney J, Berman G, Gagnon R, et al. Sequential Treatment Initiation with Timothy Grass and Ragweed Sublingual Immunotherapy Tablets Followed by Simultaneous Treatment Is Well Tolerated. J Allergy Clin Immunol Pract 2016; 4: 301‒309.