Methadon – analgetikum s pozoruhodným účinkem. Lze použít methadon v kardiovaskulární anesteziologii?
Souhrn:
Methadon je opioid s unikátními farmakodynamickými a farmakokinetickými charakteristikami. Má chirální molekulu a tvoří dva izomery. Pravotočivý izomer methadonu se váže na receptory NMDA (podobný účinek má ketamin, oxid dusný nebo xenon). Levotočivý izomer methadonu se váže zejména na opioidní receptory. V Německu i Rakousku se využívá levotočivý izomer při léčbě akutní bolesti. Unikátní farmakokinetické účinky methadonu se využívají v substitučním methadonovém programu při léčbě závislosti na opioidech. Methadon je také součástí nové strategie využití opioidů v kardiovaskulární anesteziologii. Jeho dlouhý biologický poločas prodlužuje délku a kvalitu analgezie v pooperační době.
Key words: methadone – opioid – opioid receptor – NMDA receptor – quitting – substitution methadone program – pain.
Summary:
Methadone is an opioid with unique pharmacodynamic and pharmacokinetic characteristics. It has a chiral molecule and forms two isomers. The dextrorotatory isomer binds to NMDA receptors (ketamin, nitrous oxide or xenon have similar mechanism of effect). The sinistrorotatory isomer binds predominantly to opioid receptors. In Germany and Austria, the sinistrorotatory isomer is used for treatment of acute pain. Unique pharmacokinetic effects of methadone are being used in the substitution methadone program, i.e. in the treatment of opioid dependence. Methadone is also the part of a new strategy of opioid use in cardiovascular anesthesiology. Its long biological halftime prolongs the duration and quality of postoperative analgesia.
Methadon je syntetický opioid se silným analgetickým účinkem, chemicky jde o (RS)‑6‑(dimethylamino)‑4,4‑diphenylheptan‑3‑on (obr. 1 a 2).
Od roku 2005 je methadon veden Světovou zdravotnickou organizací v seznamu nenahraditelných léčiv.
Metha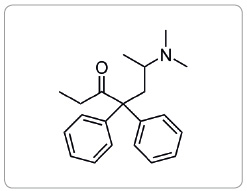 don byl syntetizován v roce 1937 Maxem Bockmühlem (1882–1945) a Gustavem Ehrhartem (1894–1971) ve společnosti I. G. Farben v Německu. V roce 1942 byl v malé klinické studii prokázán výrazný analgetický účinek methadonu. V roce 1945 C. C. Scott a K. K. Chen, spolupracovníci společnosti Lilly Research Laboratories v Eli Lilly, definitivně prokázali větší studií jeho výborné analgetické účinky a od roku 1947 je methadon ve Spojených státech amerických veden pod obchodním názvem Dolophine. V roce 1949 pak uvedla společnost Hoechts methadon na německý trh pod obchodním názvem Polamidon [1].
don byl syntetizován v roce 1937 Maxem Bockmühlem (1882–1945) a Gustavem Ehrhartem (1894–1971) ve společnosti I. G. Farben v Německu. V roce 1942 byl v malé klinické studii prokázán výrazný analgetický účinek methadonu. V roce 1945 C. C. Scott a K. K. Chen, spolupracovníci společnosti Lilly Research Laboratories v Eli Lilly, definitivně prokázali větší studií jeho výborné analgetické účinky a od roku 1947 je methadon ve Spojených státech amerických veden pod obchodním názvem Dolophine. V roce 1949 pak uvedla společnost Hoechts methadon na německý trh pod obchodním názvem Polamidon [1].
Chemickou strukturou se methadon výrazně liší od heroinu, který byl syntetizován polosynteticky z přirozeného alkaloidu morfinu. Technická syntéza methadonu je jednoduchá.
Methadon má chirální molekulu, tj. je tvořen v poměru 1 : 1 levotočivým a pravotočivým izomerem. Levotočivý izomer methadonu má především silný analgetický účinek, pravotočivý izomer má slabší analgetický a silný antitusický účinek.
Methadon má dvojí mechanismus účinku. Jako opioid se klasicky váže na opioidní receptory, ale také na N‑methyl‑D‑aspartátové (NMDA) receptory. Podrobným farmakologickým zkoumáním bylo zjištěno, že levotočivý izomer methadonu má především analgetický účinek, který je dvakrát silnější než u pravotočivého izomeru a čtyřikrát silnější než u morfinu. Pravotočivý izomer se váže zejména na NMDA receptory jako kompetitivní antagonista [2], tzn. že činnost receptorů přechodně blokuje. Na receptory NMDA se váže glutamát a aspartát, hlavní neuroexcitační neurotransmitery mozku a míchy. NMDA receptory se v organismu podílejí na četných fyziologických funkcích, např. na mechanismu bolesti, paměti nebo učení. NMDA receptory přechodně blokuje také xenon, oxid dusný, ketamin a další disociativní anestetika a také překvapivě dietyléter. Rostlinný alkaloid ibogain se také váže na tyto receptory a je s úspěchem používán při odvykání závislostí na různých drogách. Aktivace NMDA receptorů se podílí na vzniku hyperalgezie, na vzniku chronické a akutní bolesti, na chronických bolestivých stavech. Podobně vyvolává aktivaci NMDA receptorů také ultrakrátce působící analgetikum remifentanil, které je známo velmi rychlým vznikem akutní tolerance a hyperalgezie v časné pooperační době [3]. Hyperalgezie indukovaná opioidy vzniká při jejich opakovaném nebo infuzním podání. Je charakterizována zvýšenou citlivostí na nociceptivní podněty. Přesný mechanismus účinku není znám. V centrálním nervovém systému je možné hyperalgezii příznivě ovlivnit blokádou NMDA receptorů, ketaminem, dextromethorphanem nebo také methadonem. Svým inhibičním účinkem na NMDA receptory působí methadon proti vzniku akutní opioidní tolerance a proti vzniku hyperalgezie a tím přispívá ke snížení potřeby analgetik. Je také nekompetitivním antagonistou nikotinového acetylcholinového receptoru. Kromě toho ovlivňuje v závislosti na dávce draslíkový kanál v srdečním svalu, čímž může prodloužit interval QT. Již od šedesátých let 20. století byl methadon nejprve v USA a pak později v Evropě používán jako substituční prostředek při závislosti na heroinu.
Methadon má podobné farmakologické účinky jako ostatní opioidy. Jeho biologický poločas je velmi dlouhý – 24–48 hodin. Kromě intramuskulární (i.m.) nebo intravenózní (i.v.) aplikace ho lze také doporučit pro perorální aplikaci, kde biologická dostupnost dosahuje 80 %! Nástup účinku nastává po intravenózní aplikaci za 8–10 minut, což odpovídá nástupu účinku morfinu.
I u nás je methadon používán jako substituční látka při odvykání závislosti na opioidech. V Německu je užíván při léčení těžkých akutních bolestí jeho levotočivý izomer. Podobně je jeho levotočivý izomer používán také ve veterinární medicíně v Německu a Rakousku.
Studie se zvířaty prokazují výrazné kardioprotektivní účinky methadonu [4]. Velikost myokardiální ischemie byla ve srovnání s placebem výrazně redukována, jestliže byl podán methadon v dávce 0,3 mg/kg před ischemií. Methadon snižuje ischemické postižení srdce cestou vazby na opioidní receptor δ. Fentanyl a jeho deriváty vykazují v klinicky relevantních koncentracích vzhledem ke své nízké afinitě pro opioidní receptor δ menší kardioprotektivní účinky [5].
Opiody zaujímají v kardioanesteziologii již čtyřicet let výsadní postavení. Průkopnická práce Lowensteina a kol. z roku 1968 [6] zavedla vysoké dávky morfinu do kardiovaskulární anesteziologie. Později byl morfin nahrazen fentanylem a jeho deriváty pro větší řiditelnost účinku a větší stabilitu kardiovaskulárního systému. Zavedení tzv. fast track, tedy použití opiodů s krátkým poločasem účinku v kardioanestezii, vedlo k rychlému zotavení, dřívější intubaci a k rychlejšímu propuštění pacienta z jednotky intenzivní péče. Byla tady zřejmá tendence použít opiody s krátkým poločasem účinku [7].
Nicméně pooperační bolest zůstávala pro kardiovaskulární chirurgii výrazným problémem. Použití opioidů s rychlou eliminací způsobilo nedostatečnou pooperační analgezii. Proto byly hledány různé cesty a způsoby podání opioidů k dosažení účinné pooperační analgezie. Murphy a kol. se v roce 2015 [8] rozhodli uplatnit zcela jiný přístup. Zavedli do kardiovaskulární anesteziologie methadon. Ten se užívá nejen k léčení závislosti na opiátech, ale i v léčbě akutní a chronické bolesti a je výborným opioidem během operace, protože zajistí výraznou pooperační analgezii po různých chirurgických výkonech. Murphy a spolupracovníci zahrnuli do své studie 156 pacientů s aortokoronárním bypassem nebo s náhradou chlopně v mimotělním oběhu. U všech byla provedena sternotomie. Pacienti byli randomizováni do dvou skupin, z nichž jedna dostala ekvipotentní dávku methadonu 0,3 mg/kg a druhá dávku fentanylu 12 µg/kg. Vždy polovina dávky byla podána při indukci a zbytek ve dvouhodinové i.v. infuzi. V pooperační době byla bolest hodnocena jedenáctistupňovou slovní škálou bolesti a sedace čtyřstupňovou škálou bolesti. Pooperačně užívali pacienti na požádání morfin i.v., a jakmile to bylo možné, opioidy p.o. Obě skupiny pacientů měly shodnou osobní charakteristiku a byla u nich pooperačně sledována hodnota troponinu I, koncentrace natriuretického peptidu a výskyt pooperačních komplikací v závislosti na pooperační bolesti a spotřeba analgetik.
Během prvních 24 hodin byla spotřeba morfinu v pooperační době ve skupině s methadonem v průměru 6 mg (v rozpětí 4–12 mg) versus 10 mg (v rozpětí 6–21 mg) ve skupině pacientů s fentanylem. Verbální hodnocení na stupnici bolesti bylo výrazně nižší u pacientů ve skupině s methadonem [2–3] než ve skupině pacientů s fentanylem [3–5] během prvních 72 hodin. Pooperační spotřeba morfinu byla snížena o 40 % ve skupině s methadonem a také intenzita pooperační bolesti byla o 30–40 % nižší při podávání tohoto opioidu. Mezi oběma skupinami pacientů nebyly zjištěny rozdíly ve výskytu opioidních nežádoucích účinků, v extubačním čase, v délce pobytu na jednotce intenzivní péče nebo v celkové délce hospitalizace.
Studie prokázala, že podání methadonu je účinné a bezpečné a v budoucnosti musí být stanovena optimální dávka methadonu podávaná při kardiovaskulárních operacích.
Závěr
V současné době vzniká nová strategie použití opioidů v kardiovaskulární anestezii – od krátkodobě účinných opioidů v tzv. „fast track anestezii“ se přechází k opioidům s dlouhým biologickým poločasem, např. k methadonu. Tím se zlepší kvalita analgezie v bezprostředním pooperačním období. Teprve budoucnost a bohatší klinické zkušenosti ukáží, zda je tento směr perspektivní.
Práce vznikla s přispěním grantů VG20102015014 a VG20102015041.
Seznam použité literatury
- [1] Gerlach R. The History of Methadone [online]. Dostupné informace online: http://www.indro online.de/historymethadone.htm
- [2] Holman JR, Wala EP. Characterization of the Antinociceptive and Pronociceptive Effects of Methadone in Rats. Anesthesiology 2007; 106: 563–571.
- [3] Hahnenkamp K, Nollet J, Van Aken DH, et al. Remifentanil Directly Activates Human N methyl d aspartate Receptors Expressed in Xenopus Laevis Oocytes. Anestesio-logy 2004; 100: 1531–1537.
- [4] Gross ER, Hsu AK, Gross GJ. Acute methadone treatment reduces myocardial infarct size via the delta opioid receptor in rats during reperfusion. Anesth Analg 2009; 109: 1395–1402.
- [5] Benedict PE, Benedict MB, Su TP, Bolling SF. Opiate drugs and δ receptor mediated myocardial protection. Circulation 1999; 100: 357–360.
- [6] Lowenstein E, Hallowell P, Levine FH, et al. Cardiovascular response to large doses of intravenous morphine in man. N Engl J Med 1969; 281: 1389–1393.
- [7] Kharasch ED. Opioid Half lives and Hemlines. The long and short of Fashion. Anestesiology 2015; 122: 969–970.
- [8] Murphy GS, Szokol JW, Avram MD, et al. Intraoperative Methadone for the Prevention of Postoperative Pain. A Randomized, Double Blinded Clinical Trial in Cardiac Surgical Patients. Anestesiology 2015; 122: 1112–1122.