Novorozenecký screening spinální svalové atrofie a těžké kombinované imunodeficience
Ve dnech 4.–5. října 2022 se v pražském hotelu Step konala již pátá konference PREVON organizovaná v rámci projektu Národní koordinační centrum programů časného záchytu onemocnění. Dvoudenní cyklus přednášek se věnoval současnosti a budoucnosti screeningových programů v České republice. Pozornost byla mimo jiné upřena na první zkušenosti z pilotního programu screeningu spinální svalové atrofie (spinal muscular atrophy, SMA) a těžké kombinované imunodeficience (severe combined immunodeficiency, SCID), který probíhá v ČR od 1. ledna 2022.
Docentka MUDr. Jana Haberlová, Ph.D., (vědecký sekretář a člen výboru Společnosti dětské neurologie ČLS JEP, Neuromuskulární centrum, Klinika dětské neurologie FN Motol) ve svém sdělení připomněla, proč je novorozenecký screening u SMA tak důležitý.
Spinální svalová atrofie se řadí mezi vzácná onemocnění, její incidence se pohybuje okolo 10/10 000 živě narozených dětí. V České republice je aktuálně asi 200 diagnostikovaných pacientů. SMA je genetické, autozomálně recesivní onemocnění, které vzniká ve většině případů na podkladě mutace genu SMN1 (survival motor neuron 1). Ten kóduje protein SMN potřebný pro přežití motoneuronů předních rohů míšních. Při jeho nedostatku dochází ke svalové ochablosti, hypotonii a atrofizaci svalů. Onemocnění má progredující charakter. SMA představuje spektrum onemocnění, jež se liší dobou nástupu příznaků a závažností [1]. Hlavním určujícím faktorem je počet kopií genu SMN2, který je podobný genu SMN1 a je schopen tvořit malý podíl funkčního proteinu SMN (5–10 %). Čím méně kopií genu SMN2 pacient má, tím je onemocnění závažnější. Typ I se dvěma až třemi kopiemi genu SMN2 zahrnuje asi 60 % nemocných. Pacienti s tímto onemocněním nejsou nikdy schopni sedu, onemocnění rychle progreduje a nemocní bez umělé plicní ventilace umírají ve věku do dvou let. U typu II se třemi kopiemi genu SMN2, který zahrnuje asi 30 % nemocných, není pacient schopen samostatné chůze a věk dožití je zkrácen, umělá plicní ventilace je bez dostupné léčby nezbytná v období adolescence. U typu III a IV již věk dožití zkrácen není, k omezení motorických funkcí dochází postupně s pomalejší progresí.
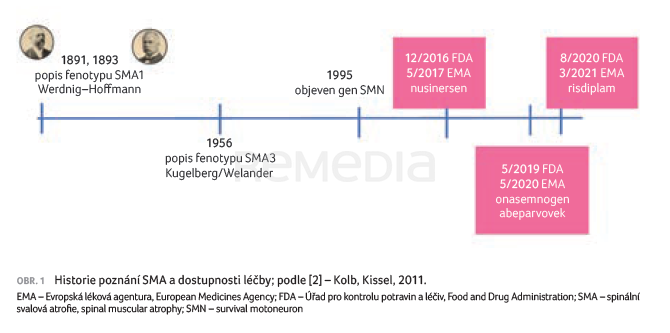 Ještě před deseti lety byla pro pacienty dostupná pouze symptomatická léčba k prodloužení přežití a kompenzaci stavu. Aktuálně jsou v Evropské unii schváleny tři přípravky, které kauzálně řeší příčinu nemoci (obr. 1) a jsou schopny progresi zastavit.
Ještě před deseti lety byla pro pacienty dostupná pouze symptomatická léčba k prodloužení přežití a kompenzaci stavu. Aktuálně jsou v Evropské unii schváleny tři přípravky, které kauzálně řeší příčinu nemoci (obr. 1) a jsou schopny progresi zastavit.
Nusinersen a risdiplam modulují transkripci genu SMN2, díky jejich podávání se pak prostřednictvím exprese genu SMN2 tvoří dostatek proteinu SMN. Léčba je celoživotní. Druhou možností je genová terapie, první systémová genová terapie schválená v medicíně, která nahrazuje chybějící gen SMN1 transgenem. Potřebný genetický materiál je do cílových buněk dopraven prostřednictvím virového vektoru. Dle současných poznatků se zhruba pětiletou zkušeností je dostačující jednorázové podání.
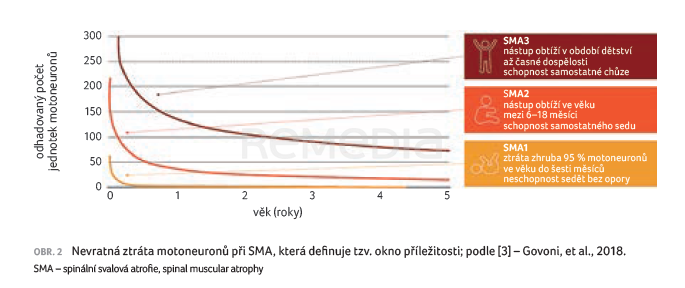 Docentka Haberlová ocenila, že Česká republika se z hlediska dostupnosti léčby řadí mezi vyspělé země. V ČR jsou dostupné a dle indikačních kritérií hrazené všechny tři schválené přípravky. Péče o pacienty se SMA probíhá v ČR ve čtyřech neumomuskulárních centrech (při FN v Motole, Thomayerově nemocnici, FN Brno a FN Ostrava). Z hlediska prognózy je ale zásadní včasné zahájení terapie, tj. než dojde k nevratné ztrátě motoneuronů (obr. 2). Pouze presymptomatická terapie je schopna dle aktuálních znalostí umožnit normální vývoj motorických funkcí. Při léčbě v době, kdy jsou již přítomny příznaky, tedy kdy došlo ke ztrátě motoneuronů, nemůže dojít k úplné kompenzaci handicapu.
Docentka Haberlová ocenila, že Česká republika se z hlediska dostupnosti léčby řadí mezi vyspělé země. V ČR jsou dostupné a dle indikačních kritérií hrazené všechny tři schválené přípravky. Péče o pacienty se SMA probíhá v ČR ve čtyřech neumomuskulárních centrech (při FN v Motole, Thomayerově nemocnici, FN Brno a FN Ostrava). Z hlediska prognózy je ale zásadní včasné zahájení terapie, tj. než dojde k nevratné ztrátě motoneuronů (obr. 2). Pouze presymptomatická terapie je schopna dle aktuálních znalostí umožnit normální vývoj motorických funkcí. Při léčbě v době, kdy jsou již přítomny příznaky, tedy kdy došlo ke ztrátě motoneuronů, nemůže dojít k úplné kompenzaci handicapu.
V ČR probíhá v období od 1. ledna 2022 do 31. prosince 2023 pilotní fáze novorozeneckého screeningu pro SMA a SCID. O první zkušenosti z pohledu screeningové laboratoře se s přítomnými podělila Ing. Karolína Pešková (primář laboratorní části Diagnostické laboratoře dědičných poruch metabolismu, KPDPM, VFN Praha).
Novorozenecký screening se týká asi 110–115 tisíc novorozenců ročně. Podstoupí ho 99,7–99,9 % novorozenců (vyjma malého podílu domácích porodů, odmítnutí screningu rodiči apod.) [4]. Z hlediska kritérií pro zařazení nemoci do novorozeneckého screeningu musí být sledované onemocnění závažné, musí mít latentní fázi, kdy je bezpříznakové, jeho průběh a patogeneze musejí být známy a test musí být spolehlivý (s vysokou specifitou a senzitivitou). Mezi další předpoklady zařazení patří kontinuální proces hledání pacientů, konsenzus o účinné léčbě a ekonomická vyváženost nákladů na diagnostiku a léčbu. Nové onemocnění by také nemělo narušit stávající novorozenecký screening [5].
Cílem pilotní fáze novorozeneckého screeningu SMA/SCID je optimalizace metod (volba přístrojů, diagnostických kitů i postupů), následných konfirmačních laboratorních testů a klinické péče. Vyhodnocení je průběžné i finální. Účast v pilotní fázi screeningu SMA/SCID je dobrovolná (na základě informovaného souhlasu maminek). Pro analýzu není nutný další odběr vzorku, provádí se ze stejné suché kapky krve odebírané pro rutinní novorozenecký screening. Zvolená molekulárně genetická metoda funguje na principu kvantitativní polymerázové řetězové reakce (quantitative polymerase chain reaction, qPCR). Na screeningu se aktuálně podílejí laboratoře VFN Praha (Diagnostické laboratoře dědičných poruch metabolismu) a FN Brno (Interní hematologická a onkologická klinika, Centrum molekulární biologie a genetiky).
Primárním cílem pilotního projektu je záchyt SMA s homozygotní delecí exonu 7 a SCID. Vedlejší cíle zahrnují primární imunodeficienci (X‑vázanou agamaglobulinemii, autozomálně dědičné agamaglobulinemie, diGeorgův syndrom, ataxia teleangiectasia, Downův syndrom a Nijmegen breakage syndrome).
Průběžné výsledky ukazují, že doposud se projektu zúčastnilo 90,7 % novorozenců (n = 29 542). Pozitivita SMA byla zachycena u dvou novorozenců, SCID u čtyř. Po pozitivním výsledku screeningu následně probíhá další konfirmace nálezu. Jak uvedla Ing. Pešková, projekt je zdrojem i vedlejších nálezů, příkladem je nejasný výsledek screeningu u novorozence, jehož matka s diagnózou ulcerózní kolitidy byla v průběhu těhotenství léčena protizánětlivou terapií. Další podnět připojila doc. Haberlová, kdy během screeningu byl identifikován pacient s pěti kopiemi genu SMN2, v klinické praxi vzácný úkaz. Těmito nálezy je třeba se dále zabývat.
Primářka Pešková potvrdila, že o účast v pilotním projektu měly zájem i maminky, jejichž děti se narodily v roce 2021. Pravidla byla nicméně stanovena jasně (od 1. 1. 2022). Na základě domluvy komise a dostatečné kapacity laboratoře bylo zájemcům o screening vyšetření umožněno – na vlastní úhradu (cena vyšetření je přijatelná, napřesahuje 500 Kč). Dosud bylo vyšetřeno 752 miminek narozených v roce 2021. Jedna zachycená pacientka se SMA je v šesti měsících již zaléčena.
Inženýrka Pešková v závěru shrnula jednoznačný přínos novorozeneckého screeningu. Diagnostika v preklinickém stadiu umožňuje včasné zahájení léčby pacienta. Pilotní fáze je nedílnou součástí úspěšné implementace nové nemoci do stávajícího novorozeneckého screeningu, během ní je možné vyladit průběh a odhalit slabá místa procesu. Projekt je mezioborovou spoluprací biochemiků, genetiků, imunologů a kliniků.
K průběžným výsledkům pilotní fáze novorozeneckého screeningu SCID se vyjádřila prof. MUDr. Anna Šedivá, DSc., (Imunodeficitní skupina, Ústav imunologie a Klinika dětské hematologie a onkologie, 2. LF UK a FN v Motole).
Vrozené poruchy imunity zahrnují zejména buněčné a kombinované deficience. SCID představuje nejtěžší formu vrozených imunodeficiencí. Jedná se o závažnou poruchu ve vývoji T lymfocytů nebo T i B lymfocytů na podkladě různých genových mutací. Dle Národního registru primárních imunodeficiencí je aktuálně sledováno 1 036 pacientů. Vyšetření se provádí pomocí testů na přítomnost naivních T lymfocytů, eventuálně B lymfocytů – TREC (T cell receptor excision circles) pro T lymfocyty a KREC (kappa‑deleting recombination excision circles) pro B lymfocyty [6].
Při pozitivním záchytu je kontaktována a edukována rodina, dítě by mělo být izolováno v domácím prostředí, dle nálezu (CMV infekce) se rozhoduje o kojení. Indikována jsou další vyšetření, v případě suspektního SCID je zahájena profylaxe, řešeno očkování rodiny a následná léčba.
V rámci pilotní fáze screeningu bylo na pražském pracovišti zachyceno šest pozitivních nálezů, na brněnském čtyři. Mezi nimi byl zaznamenán případ SCID; imunodeficit, který je nyní řešen dalšími genetickými testy; nedonošené dítě; několik případů sekundárního imunodeficitu v důsledku imunosuprese matky; dále diGeorgův syndrom i hraniční nález s následnou kontrolou, která byla v pořádku.
Zavedení SCID do novorozeneckého screeningu by umožnilo časný záchyt dětí s možností léčebně zasáhnout v prvních měsících života, dříve než dojde ke komplikacím zdravotního stavu v důsledku hlubokého imunodeficitu. V případě potvrzení diagnózy je u genetické poruchy ve vývoji T lymfocytů nejčastěji indikována transplantace hematopoetických buněk kostní dřeně, raritně transplantace thymu při jeho absenci, při poruše B lymfocytů profylaxe, substituce imunoglobulinů a řešeno očkování.
Literatura
[1] Farrar MA, Park SB, Vucic S, et al. Emerging therapies and challenges in spinal muscular atrophy. Ann Neurol 2017; 81: 355–368.
[2] Kolb SJ, Kissel JT. Spinal muscular atrophy: a timely review. Arch Neurol 2011; 68: 979–984.
[3] Govoni A, Gagliardi D, Comi GP, Corti S. Time Is Motor Neuron: Therapeutic Window and Its Correlation with Pathogenetic Mechanisms in Spinal Muscular Atrophy. Mol Neurobiol 2018; 55: 6307–6318.
[4] Věstník Ministerstva zdravotnictví ČR 2016; částka 6: 2–11.
[5] Wilson JMG. Principles and practice of screening for disease. J. M. G. Wilson, G. Jungner. World Health Organization. 1968.
[6] Šedivá A, Zachová R, Klocperk A, Bloomfield M. Závažné primární imunodeficience a možnosti jejich časné diagnostiky, uvedení testu TREC/KREC. Čes‑slov Pediat 2019; 74: 182–187.