Perorální semaglutid v léčbě diabetu 2. typu
Souhrn:
Haluzík M. Perorální semaglutid v léčbě diabetu 2. typu. Remedia 2021; 31: 292–299.
Možnosti farmakoterapie diabetu 2. typu se v posledních deseti letech významně rozšířily díky zavedení nových lékových skupin – gliptinů, gliflozinů a agonistů receptoru pro GLP‑1 (GLP‑1RA). Glifloziny a GLP‑1RA jsou unikátní tím, že kromě zlepšení kompenzace diabetu vedou k poklesu hmotnosti i krevního tlaku a řada z nich má také nefroprotektivní a kardioprotektivní účinky. Přes výbornou účinnost i bezpečnost byla určitou nevýhodou GLP‑1RA nutnost jejich injekčního podávání. V letošním roce je v řadě zemí uváděn na trh první perorálně podávaný GLP‑1RA semaglutid. V tomto článku shrnujeme účinnost a bezpečnost perorálně podávaného semaglutidu u pacientů s diabetes mellitus 2. typu a diskutujeme jeho postavení a význam v kontextu dalších současných možností antidiabetické léčby.
Summary:
Haluzik M. Oral semaglutid in the therapy of type 2 diabetes mellitus. Remedia 2021; 31: 292–299.
The treatment options of type 2 diabetes mellitus have markedly broadened in the last decade owing to the introduction of novel drug classes – gliptins, gliflozins and GLP‑1 receptor agonists (GLP‑1RA). The unique feature of gliflozins and GLP‑1RA lies in their ability to not only improve glucose control but also decrease body weight and blood pressure along with nephroprotective and cardioprotective properties of some of the drugs from these classes. Despite having excellent efficacy and safety, the disadvantage of GLP‑1RA was the necessity of their injectable application. In many countries, the first oral GLP‑1RA semaglutide is being introduced to the market this year. In this paper, we summarize efficacy and safety of oral semaglutide in patients with type 2 diabetes mellitus and its position and significance in the context of other current antidiabetic treatment options.
Key words: type 2 diabetes mellitus, oral semaglutide, glucose control, body weight
Úvod
Spektrum možností farmakoterapie diabetu 2. typu se v posledních deseti letech významně rozšířilo díky zavedení nových lékových skupin – gliptinů, gliflozinů a agonistů receptoru pro GLP 1 (GLP 1RA) [1]. Zejména glifloziny a GLP 1RA jsou unikátní tím, že kromě zlepšení kompenzace diabetu vedou k poklesu hmotnosti i krevního tlaku a řada z nich má také nefroprotektivní a kardioprotektivní účinky [2−6]. Jejich využití v léčbě diabetu 2. typu se tak nadále zvyšuje a pro podávání řady z těchto léků již je nebo se v brzké době stane indikací k léčbě ochrana před vznikem kardiovaskulárních komplikací či zpomalení progrese diabetického onemocnění ledvin bez ohledu na aktuální hodnotu glykovaného hemoglobinu (HbA1c).
Agonisté GLP 1R jsou pak z hlediska zlepšení kompenzace diabetu kromě inzulinu nejúčinnějšími antidiabetiky a vedou také k nejvýraznějšímu poklesu hmotnosti [7−9]. Na rozdíl od gliptinů a gliflozinů bylo ovšem donedávna možné podávání GLP 1RA pouze formou subkutánní injekce. Přestože nejnovější GLP 1RA se již podávají pouze jednou týdně pomocí velmi jednoduchých předplněných per, představuje nutnost injekční aplikace u některých pacientů určitou bariéru zahájení této léčby [10]. Je rovněž známo, že u injekčně aplikovaných léků je horší také dlouhodobá compliance nemocných k této léčbě, která navíc s delším podáváním dále klesá. Možnost nahrazení injekční aplikace perorálním podáním by tak pro mnohé nemocné mohla představovat vynikající alternativu, která by z dlouhodobého hlediska mohla zlepšit compliance i dlouhodobé výsledky léčby.
Perorální podávání peptidů, mezi něž GLP 1RA patří, nebylo v diabetologii ještě donedávna možné v důsledku jejich rychlé degradace již v horní části trávicího traktu. Tento axiom však zcela zásadně mění objev a průkaz klinické účinnosti prvního perorálně podávaného GLP 1RA semaglutidu, který je již v některých zemích používán v klinické praxi a blíží se i jeho zavedení na trh v České republice [11]. Cílem tohoto článku je poskytnout stručný přehled o mechanismu vstřebávání, účinnosti a bezpečnosti perorálního semaglutidu u pacientů s diabetes mellitus 2. typu. Dále se tento článek zabývá postavením perorálního semaglutidu v současném algoritmu léčby diabetu 2. typu a dalšími perspektivami jeho využití.
Historie výzkumu perorálního
podávání peptidových látek
Pokusy s perorálním podáváním peptidových či bílkovinných hormonů byly prováděny prakticky již od objevu inzulinu ve dvacátých letech minulého století [12]. Byly ovšem neúspěšné vzhledem k degradaci inzulinu či jiných proteinů již kyselým pH v žaludku. Dalšími problémy komplikujícími tento způsob podání je minimální vstřebávání i nedegradovaných peptidů ve sliznici žaludku, a tím pádem i velmi nízká až prakticky nulová biologická dostupnost neumožňující žádný detekovatelný klinický účinek. I v nedávné minulosti byly opakovaně publikovány výsledky studií testujících perorální podávání inzulinu [13]. Žádný z vývojových programů však nepokročil do finálních fází klinických studií a řada z programů byla ještě před dokončením zastavena.
Mechanismus vstřebávání perorálního
semaglutidu a jeho biodegradace
Struktura perorálního semaglutidu je shodná se semaglutidem podávaným subkutánně. Stejný je také biologický poločas, který dosahuje jednoho týdne [14].
Vstřebávání semaglutidu při perorálním podání je umožněno jeho podáváním v kombinované tabletě se salcaprozátem sodným, látkou označovanou zkratkou SNAC utvořenou z chemického názvu sodium N [8 (2 hydroxybenzoyl) amino] caprylate [15]. Tato látka patří chemicky mezi deriváty mastných kyselin. Již dříve byla s cílem zlepšení absorpce využívána její kombinace s heparinem, ibandronátem a vitaminem B12. Bezpečnost SNAC je tak již z těchto studií dostatečně prokázána.
Přidání SNAC k semaglutidu
zvyšuje lokální pH při kontaktu s žaludeční sliznicí
[16], čímž je semaglutid chráněn před degradací. Zlepšuje
dále jeho průnik žaludeční sliznicí a urychluje tak jeho
transcelulární vstřebávání v gastrických epiteliálních
buňkách (obr. 1A, B) [17]. Díky kombinaci semaglutidu se
SNAC vede jeho perorální podávání k biologické dostupnosti
0,4–1 % s dosažením maximálních koncentrací jednu
hodinu po podání. Ke vstřebávání semaglutidu dochází
výlučně v žaludku, v dalších částech trávicího
traktu se již nevstřebává. Studie také prokázaly, že
k optimálnímu vstřebání by semaglutid měl být zapit
definovaným množstvím vody – optimálně 120 ml – a poté
by mělo následovat 30minutové lačnění [18].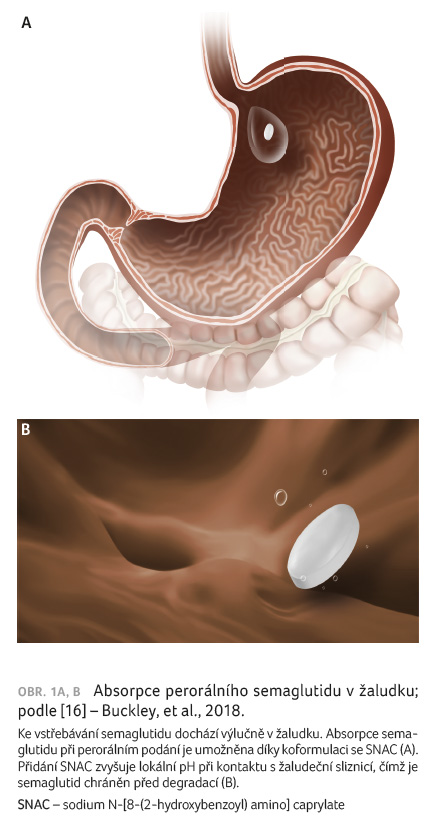
Perorálně podaný semaglutid se podobně jako při jeho subkutánní aplikaci silně váže na albumin, což je spolu s jeho rezistencí proti degradaci dipeptidyl peptidázou 4 zodpovědné za dlouhý biologický poločas (jeden týden) [18]. Semaglutid je degradován primárně proteolýzou hlavního peptidového řetězce s následnou β oxidací SNAC a degradační produkty jsou vylučovány močí a stolicí.
Klinické studie s podáváním
perorálního semaglutidu
Studie fáze II
Studie fáze II studovaly farmakokinetiku a farmakodynamiku perorálního semaglutidu jak u zdravých jedinců, tak i u nemocných s diabetes mellitus 2. typu. V první ze studií byl sledován efekt různých dávek semaglutidu podávaných v rozmezí od 2 do 20 mg spolu s různou dávkou (150–600 mg) SNAC [18]. Bylo zjištěno, že plazmatické koncentrace semaglutidu jsou nejvyšší při použití 300 mg SNAC. Další studie se zaměřila hlavně na tolerabilitu různých dávek semaglutidu včetně udržovacích dávek 20 mg a 40 mg při podávání po dobu 10 týdnů. Na základě těchto iniciálních výsledků byla provedena rozsáhlejší randomizovaná studie, kde byly účinnost a bezpečnost perorálně podávaného semaglutidu v dávkách 2,5 mg, 5 mg, 10 mg, 20 mg nebo 40 mg denně srovnávány s placebem nebo se subkutánně podávaným semaglutidem v dávce 1 mg týdně podávané po dobu 26 týdnů [19]. Při podávání perorálního semaglutidu došlo k poklesu koncentrace HbA1c o 0,7−1,9 % v závislosti na dávce a při podávání semaglutidu subkutánně o 1,9 %. Tělesná hmotnost při podávání perorálního semaglutidu poklesla o 2,1−6,9 kg a při podávání semaglutidu subkutánně o 6,4 kg. Výskyt nežádoucích účinků byl vyšší při podávání semaglutidu než placeba a byl srovnatelný u semaglutidu podávaného perorálně a subkutánně.
Studie fáze III
V rámci studií fáze III byly účinky perorálního semaglutidu testovány u širokého spektra pacientů s různou délkou trvání diabetu a různými typy léčby včetně inzulinoterapie v rozsáhlém klinickém programu nazvaném PIONEER [20]. Ve studii PIONEER 1 bylo 26týdenní podávání tří dávek semaglutidu – 3 mg, 7 mg, 14 mg – srovnáváno s placebem u pacientů s nově diagnostikovaným diabetem dosud bez farmakoterapie [21]. Podávání semaglutidu vedlo v závislosti na dávce k poklesu koncentrace HbA1c o 0,9 %, 1,2 % a 1,4 % a tělesné hmotnosti o 1,5 kg, 2,3 kg a 3,7 kg. Při podávání semaglutidu byl mírně zvýšen výskyt nežádoucích gastrointestinálních účinků, které byly ve většině případů mírné a nevedly k přerušení léčby.
Ve studii PIONEER 2 byla srovnávána účinnost perorálního semaglutidu s podáváním inhibitoru SGLT2 (sodium glucose co transporter 2) empagliflozinu u diabetiků 2. typu s HbA1c v rozmezí hodnot 7,0−10 %, kteří byli léčeni stabilní dávkou metforminu [22]. Po 26 týdnech podávání byla prokázána superiorita semaglutidu v dávce 14 mg denně oproti empagliflozinu (pokles koncentrace HbA1c o 1,3 % vs. 0,9 %). Pokles tělesné hmotnosti po 26 týdnech byl srovnatelný (o 3,8 kg vs. 3,7 kg). Po 52 týdnech byl pokles hmotnosti výraznější při podávání semaglutidu (o 4,7 kg vs. 3,8 kg).
PIONEER 3 byla 78týdenní studie srovnávající podávání semaglutidu v dávkách 3 mg, 7 mg a 14 mg s léčbou sitagliptinem u pacientů s diabetem 2. typu, kteří měli hodnoty HBA1c v rozmezí 7,0−10,5 % a byli léčeni stabilní dávkou metforminu buď samostatně, nebo v kombinaci s derivátem sulfonylurey [23]. Dávky 7 mg a 14 mg semaglutidu vedly k významnějšímu poklesu hodnot HbA1c ve srovnání se sitagliptinem (pokles o 1,0 % a 1,3 % ve srovnání s poklesem o 0,8 % při podávání sitagliptinu). Podobně i snížení tělesné hmotnosti bylo významnější při podávání semaglutidu v dávkách 7 mg a 14 mg (pokles o 2,2 kg a 3,1 kg vs. o 0,6 kg při léčbě sitagliptinem). Semaglutid v dávce 3 mg denně vedl k podobnému poklesu hodnot HbA1c i hmotnosti jako sitagliptin.
Studie PIONEER 4 porovnávala podávání perorálního semaglutidu v dávce 14 mg s léčbou liraglutidem v dávce 1,8 mg 1× denně nebo s podáváním placeba po dobu 52 týdnů u pacientů s diabetes mellitus 2. typu s hodnotou HbA1c 7−9,5 % léčených metforminem samotným nebo v kombinaci s gliflozinem [24]. Po 26 týdnech podávání byl pokles hodnoty HbA1c srovnatelný při podávání semaglutidu a liraglutidu (snížení o 1,2 % vs. 1,1 %), zatímco hmotnost poklesla při léčbě semaglutidem výrazněji (snížení o 4,4 kg vs. 3,1 kg). Výskyt nežádoucích účinků byl mírně vyšší při podávání semaglutidu než liraglutidu.
Studie PIONEER 5 srovnávala 26týdenní podávání semaglutidu v dávce 14 mg denně s podáváním placeba u pacientů s diabetes mellitus 2. typu s renální insuficiencí definovanou hodnotami glomerulární filtrace 30−59 ml/min [25]. Pacienti byli před zařazením do studie léčeni metforminem, případně derivátem sulfonylurey nebo bazálním inzulinem ve stabilních dávkách po dobu posledních 90 dní. Podávání semaglutidu vedlo k významně vyššímu poklesu koncentrace HbA1c ve srovnání s placebem (pokles o 1,0 % vs. 0,2 %) a také k významnějšímu poklesu hmotnosti (snížení o 3,4 kg vs. 0,9 kg).
Studie PIONEER 8 zkoumala účinek
52týdenního podávání semaglutidu v dávkách 3 mg,
7 mg nebo 14 mg nebo placeba u pacientů s neuspokojivou
kompenzací diabetu při léčbě inzulinem v kombinaci
s metforminem, případně bez metforminu [26]. Po 26
týdnech podávání došlo k poklesu koncentrace HbA1c
v závislosti na dávce (snížení o 0,6 %; 0,9 %
respektive 1,3 % ve srovnání s poklesem o 0,1 %
u placebové skupiny). Hmotnost poklesla o 1,4 kg; 2,4 kg
a 3,7 kg ve srovnání s poklesem o 0,4 kg
při podávání placeba.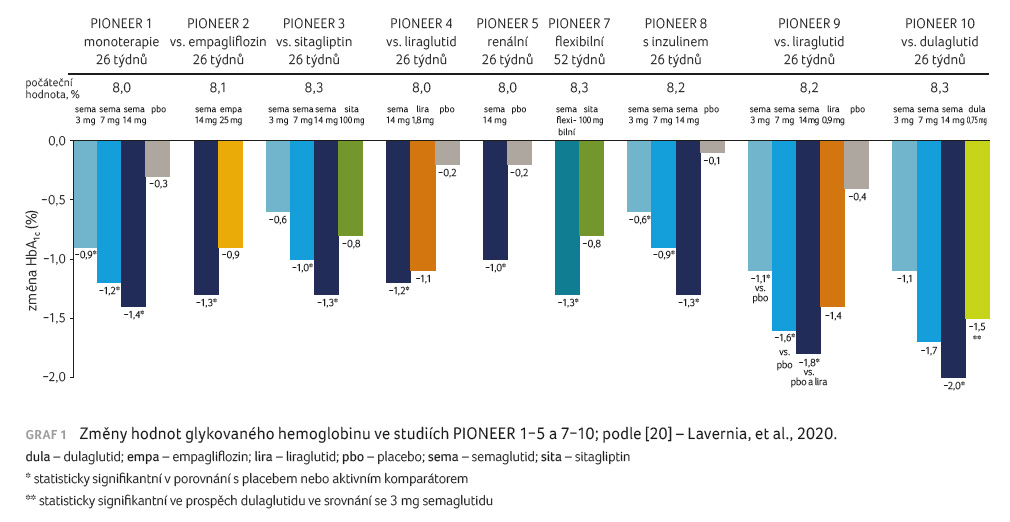
Pro úplnost ještě uvádíme studie provedené u jiných etnických populací – PIONEER 7 sledující vliv podávání flexibilní dávky semaglutidu ve srovnání se sitagliptinem u jihokorejských pacientů [27] a studie u japonské populace PIONEER 9 (semaglutid vs. liraglutid nebo placebo) [28] a PIONEER 10 (semaglutid vs. dulaglutid) [29]. Ve studii PIONEER 7 byla prokázána superiorita semaglutidu vůči sitagliptinu jak ve zlepšení kompenzace, tak i v poklesu hmotnosti. Ve studiích PIONEER 9 a PIONEER 10 byla prokázána superiorita semaglutidu v dávce 14 mg vůči liraglutidu, respektive dulaglutidu při poklesu hodnoty HbA1c i hmotnosti.
Změny hodnot HbA1c
ve studiích programu PIONEER shrnuje graf 1 a změny
tělesné hmotnosti graf 2.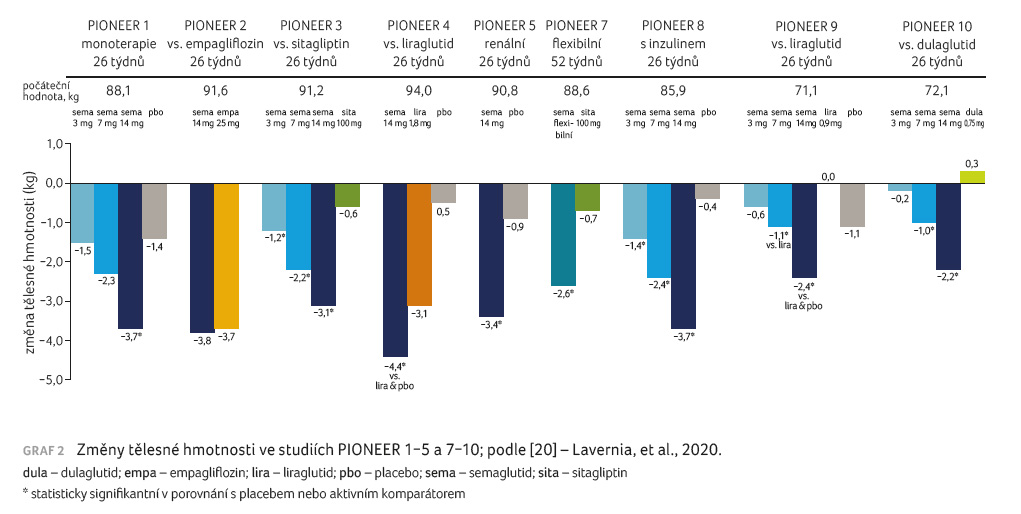
Kardiovaskulární bezpečnost
semaglutidu: studie PIONEER 6
Studie PIONEER 6 byla na rozdíl od předchozích studií v rámci programu PIONEER provedena u pacientů s diabetes mellitus 2. typu buď již s anamnézou kardiovaskulárních komplikací, nebo starších 50 let s vysokým kardiovaskulárním rizikem [30]. Primárním cílem studie byl průkaz kardiovaskulární bezpečnosti semaglutidu na základě sledování kombinovaného kardiovaskulárního cílového ukazatele – smrt z kardiovaskulárních příčin, nefatální infarkt myokardu, nefatální cévní mozkové příhody ve srovnání s placebem. Výskyt kombinovaného cílového ukazatele byl ve skupině léčené semaglutidem prokázán u 61 z 1 591 pacientů ve srovnání s výskytem u 76 z 1 592 pacientů ve skupině s podáváním placeba. Došlo tak k numerickému snížení výskytu primárního cílového ukazatele u skupiny léčené semaglutidem o 21 % ve srovnání s placebem. Statisticky signifikantně byla prokázána kardiovaskulární bezpečnost, tedy non inferiorita semaglutidu vůči placebu, zatímco superiorita vůči placebu nebyla statisticky významná (při hodnotě p = 0,17).
Podobně jako v ostatních studiích fáze III byla bezpečnost perorálního semaglutidu podobná jako u jiných GLP 1RA s vyšším výskytem nežádoucích (zejména gastrointestinálních) účinků oproti placebu.
Další sekundární cíle v rámci
programu PIONEER
I další sekundární cíle potvrdily vysokou účinnost perorálního semaglutidu v léčbě diabetu. Prakticky ve všech srovnáních s aktivními komparátory i s placebem byl podíl pacientů dosahujících hodnoty HbA1c < 53 mmol/mol vyšší při léčbě perorálním semaglutidem. To se týkalo hodnoty po 26 týdnech i po 52 týdnech. V rámci studie PIONEER 8, kde byl semaglutid přidáván k léčbě inzulinem, vedlo jeho podávání ve srovnání s placebem k poklesu dávky inzulinu o 8 jednotek (j.) po 26 týdnech a o 17 j. po 52 týdnech trvání studie [26]. V rámci programu PIONEER bylo při podávání semaglutidu opakovaně zaznamenáno snížení hodnoty krevního tlaku, které bylo statisticky signifikantní zejména pro dávku 14 mg denně.
Spokojenost pacientů s léčbou
semaglutidem
Při přímém srovnání se sitagliptinem byla spokojenost pacientů s léčbou semaglutidem podobná, podobné bylo i hodnocení pohodlnosti a flexibility léčby. Při přímém hodnocení dávkovacích podmínek semaglutidu (nutnost užívat lék nalačno a poté lačnit 30 minut) 79 % pacientů odpovědělo, že jsou lehké či velmi lehké, 19 % je hodnotilo jako neutrální a pouze 2 % jako obtížné [31]. Ve studii PIONEER 2 bylo ve srovnání s empagliflozinem zaznamenáno snížení touhy po jídle a zlepšení kontroly příjmu potravy. Podávání perorálního semaglutidu také ve srovnání se sitagliptinem zlepšilo kvalitu života jak v oblasti psychologické, tak i fyzické.
Bezpečnostní profil semaglutidu
Bezpečnostní profil perorálního semaglutidu je velmi podobný bezpečnostnímu profilu jiných GLP 1RA. Nežádoucí účinky jsou zejména gastrointestinální (bolesti břicha, nauzea, průjem, zácpa či zvracení). Jejich výskyt je nejvyšší při zahájení léčby, respektive při navyšování dávky a s delším podáváním výskyt obvykle klesá či nežádoucí účinky zcela vymizejí. Celkem se nauzea vyskytovala u 15−23 % pacientů léčených semaglutidem v dávce 14 mg. K ukončení podávání semaglutidu pro nežádoucí účinky došlo u 7−15 % pacientů. Tato čísla odpovídají údajům zjištěným u jiných GLP 1RA.
Ostatní nežádoucí účinky, jež byly v minulosti často diskutovány v souvislosti s léčbou GLP 1RA (akutní pankreatitida, medulární karcinom štítné žlázy či jiné nádory), se při podávání semaglutidu vyskytovaly srovnatelně s placebovou skupinou. V případě perorálního semaglutidu také nebyl zaznamenán žádný vliv na výskyt komplikací diabetické retinopatie, který byl doložen v kardiovaskulární studii se semaglutidem podávaným subkutánně 1× týdně (studie SUSTAIN 6). Nález ve studii SUSTAIN 6 byl vysvětlován mimořádně rychlým zlepšením kompenzace diabetu při podávání subkutánního semaglutidu, tzv. fenoménem časného zhoršení retinopatie, jenž je typický také pro rychlé zlepšení kompenzace po zahájení inzulinoterapie.
Celkově tak výsledky svědčí pro fakt, že léčba perorálním semaglutidem je dlouhodobě bezpečná.
Dávkování a praktické poznámky
k podávání perorálního semaglutidu
Perorální semaglutid (obchodní název Rybelsus) je indikován k léčbě dospělých pacientů s neuspokojivě kompenzovaným diabetem 2. typu jako doplněk k dietním opatřením a cvičení, a to jako monoterapie, pokud je metformin považován za nevhodný v důsledku nesnášenlivosti nebo kontraindikací, nebo v kombinaci s jinými léčivými přípravky k léčbě diabetu.
Perorální semaglutid je v současné době k dispozici ve třech dávkách – 3 mg, 7 mg a 14 mg. Počáteční dávka semaglutidu je 3 mg jednou denně po dobu jednoho měsíce. Po měsíci se má dávka zvýšit na udržovací dávku 7 mg jednou denně. Minimálně po jednom měsíci s dávkou 7 mg jednou denně se pro další zlepšení glykemie může dávka zvýšit na udržovací dávku 14 mg jednou denně.
Pokud jde o úpravu současně podávané medikace, platí podobná pravidla jako v případě nasazení jiných GLP 1RA. U pacientů léčených deriváty sulfonylurey bychom měli zvážit snížení jejich dávky, případně i vysazení k prevenci vzniku hypoglykemie. Z podobného důvodu by měla být snížena i dávka inzulinu. Výhodou je, že titrace semaglutidu je postupná, a u většiny pacientů proto lze očekávat plný účinek až při dávkách 7 mg, respektive 14 mg.
Semaglutid by měl být podán ráno nalačno a měl by být spolknut vcelku a zapit definovaným množstvím vody – optimálně 120 ml. Po 30 minutách se pak pacient může najíst, případně si vzít další léky. Při vynechání dávky by tato již neměla být podávána během stejného dne a měla by být podána až ve standardní dobu (ráno nalačno) v den následující.
Postavení perorálního semaglutidu
v léčbě a další perspektivy
Perorální semaglutid představuje v současné době nejúčinnější perorální antidiabetikum, a to jak z hlediska zlepšení kompenzace diabetu, tak pokud jde o snížení hmotnosti. Jeho účinnost je navíc vedle ostatních GLP 1RA s injekčním podáním minimálně srovnatelná nebo vyšší. Perorální semaglutid má v tuto chvíli potvrzenu kardiovaskulární bezpečnost předregistrační studií PIONEER 6, kde bylo jeho podávání při ovlivnění kombinovaného kardiovaskulárního cíle non inferiorní vůči placebu. V současné době navíc probíhá rozsáhlá kardiovaskulární studie SOUL, jejímž cílem je prokázat superioritu perorálního semaglutidu vůči placebu při snížení výskytu kardiovaskulárních komplikací.
Jaké je tedy postavení perorálního semaglutidu v algoritmu léčby diabetu 2. typu? I přes výrazné zjednodušení injekční aplikace a její frekvenci pouze 1× týdně může být injekční podání GLP 1RA pro řadu pacientů stále určitou bariérou. Studie navíc ukazují, že i dlouhodobá compliance injekční léčby bývá horší než u léků perorálních. Perorální semaglutid se tedy nabízí jako zajímavá možnost intenzifikace léčby především v časných stadiích diabetu 2. typu. U pacientů se suboptimální compliance není vyloučeno, že ne vždy budou přesně dodrženy podmínky jeho ranního podání 30 minut před jídlem či před užitím jiných léků, což v reálné klinické praxi může vést k určitému snížení účinnosti. Na druhou stranu, podobně je již desítky let podáván při hypotyreóze L tyroxin a u většiny pacientů se nezdá, že by byly podmínky podání 30 minut před jídlem či před další medikací zásadnějším problémem. Naopak u některých nemocných obávajících se injekční aplikace či se špatnou compliance k tomuto typu léčby může perorální podání být výhodou.
Existence jak injekční, tak i perorální formy semaglutidu nadále zvyšuje možnost personalizace a individualizace léčby diabetu 2. typu. V tomto případě si pacient dokonce může podle své preference vybrat z těchto dvou možností nebo je v případě neúspěchu možné jednu zaměnit za druhou. Z praktického hlediska stojí za zmínku, že účinnost 14mg dávky perorálního semaglutidu se pohybuje na pomezí účinnosti 0,5–1,0mg dávky injekčního semaglutidu, přičemž dávka 1 mg aplikovaná subkutánně 1× týdně je zřejmě mírně účinnější. Velmi zajímavé je, že již byly prezentovány i výsledky klinické studie SUSTAIN FORTE s dávkou 2 mg semaglutidu aplikovanou 1× týdně subkutánně, kdy zlepšení kompenzace i pokles hmotnosti byly významně vyšší než u standardních dávek. V současné době navíc probíhá studie PIONEER PLUS s titrací perorálního semaglutidu až do dávky 50 mg denně. V přípravě je navíc klinický program fixní kombinace inzulinu icodec s aplikací 1× týdně s injekčním semaglutidem. Z výše uvedeného je zřejmé, že rozšíření nových možností inkretinové léčby i nadále pokračuje vysokým tempem. Možnost využití prvního perorálního GLP 1RA představuje zcela zásadní inovativní krok v této oblasti, který jistě významně rozšíří možnosti léčby našich pacientů.
Podporováno RVO VFN 64165.
Seznam použité literatury
- [1] Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet 2017; 389: 2239−2251.
- [2] Mosenzon O, Wiviott SD, Cahn A, et al. Effects of dapagliflozin on development and progression of kidney disease in patients with type 2 diabetes: an analysis from the DECLARE‑TIMI 58 randomised trial. Lancet Diabetes Endocrinol 2019; 7: 606−617.
- [3] Marso SP, Daniels GH, Brown‑Frandsen K, et al. Liraglutide and Cardiovascular Outcomes in Type 2 Diabetes. N Engl J Med 2016; 375: 311−322.
- [4] McMurray JJV, Solomon SD, Inzucchi SE, et al. Dapagliflozin in Patients with Heart Failure and Reduced Ejection Fraction. N Engl J Med 2019; 381: 1995−2008.
- [5] Mahaffey KW, Jardine MJ, Bompoint S, et al. Canagliflozin and Cardiovascular and Renal Outcomes in Type 2 Diabetes and Chronic Kidney Disease in Primary and Secondary Cardiovascular Prevention Groups: Results from the Randomized CREDENCE Trial. Circulation 2019; 140: 739−750.
- [6] Perkovic V, Jardine MJ, Neal B, et al. Canagliflozin and Renal Outcomes in Type 2 Diabetes and Nephropathy. N Engl J Med 2019; 380: 2295−2306.
- [7] Htike ZZ, Zaccardi F, Papamargaritis D, et al. Efficacy and safety of glucagon‑like peptide‑1 receptor agonists in type 2 diabetes: A systematic review and mixed‑treatment comparison analysis. Diabetes Obes Metab 2017; 19: 524−536.
- [8] Kushner RF, Calanna S, Davies M, et al. Semaglutide 2.4 mg for the Treatment of Obesity: Key Elements of the STEP Trials 1 to 5. Obesity (Silver Spring) 2020; 28: 1050−1061.
- [9] Ryan DH, Lingvay I, Colhoun HM, et al. Semaglutide Effects on Cardiovascular Outcomes in People With Overweight or Obesity (SELECT) rationale and design. Am Heart J 2020; 229: 61−69.
- [10] Romera I, Cebrian‑Cuenca A, Alvarez‑Guisasola F, et al. A Review of Practical Issues on the Use of Glucagon‑Like Peptide‑1 Receptor Agonists for the Management of Type 2 Diabetes. Diabetes Ther 2019; 10: 5−19.
- [11] Kalra S, Sahay R. A Review on Semaglutide: An Oral Glucagon‑Like Peptide 1 Receptor Agonist in Management of Type 2 Diabetes Mellitus. Diabetes Ther 2020; 11: 1965−1982.
- [12] Haluzík M, Svačina Š. Inkretinová léčba diabetu. Praha: Mladá fronta; 2010.
- [13] Chatterjee S, Bhushan Sharma C, Lavie CJ, et al. Oral insulin: an update. Minerva Endocrinol 2020; 45: 49−60.
- [14] Andersen A, Knop FK, Vilsboll T. A Pharmacological and Clinical Overview of Oral Semaglutide for the Treatment of Type 2 Diabetes. Drugs 2021; https://doi.org/10.1007/s40265‑021‑01499‑w
- [15] Pineo G, Hull R, Marder V. Oral delivery of heparin: SNAC and related formulations. Best Pract Res Clin Haematol 2004; 17: 153−160.
- [16] Twarog C, Fattah S, Heade J, et al. Intestinal Permeation Enhancers for Oral Delivery of Macromolecules: A Comparison between Salcaprozate Sodium (SNAC) and Sodium Caprate (C10). Pharmaceutics 2019; 11: 78.
- [17] Buckley ST, Bækdal TA, Veggel A, et al. Transcellular stomach absorption of a derivatized glucagon‑like peptide‑1 receptor agonist. Sci Transl Med 2018: 10: eaar7047.
- [18] Granhall C, Donsmark M, Blicher TM, et al. Safety and Pharmacokinetics of Single and Multiple Ascending Doses of the Novel Oral Human GLP‑1 Analogue, Oral Semaglutide, in Healthy Subjects and Subjects with Type 2 Diabetes. Clin Pharmacokinet 2019; 58: 781−791.
- [19] Davies M, Pieber TR, Hartoft‑Nielsen ML, et al. Effect of Oral Semaglutide Compared With Placebo and Subcutaneous Semaglutide on Glycemic Control in Patients With Type 2 Diabetes: A Randomized Clinical Trial. JAMA 2017; 318: 1460−1470.
- [20] Lavernia F, Blonde L. Clinical review of the efficacy and safety of oral semaglutide in patients with type 2 diabetes compared with other oral antihyperglycemic agents and placebo. Postgrad Med 2020; 132: 15−25.
- [21] Aroda VR, Rosenstock J, Terauchi Y, et al. PIONEER 1: Randomized Clinical Trial of the Efficacy and Safety of Oral Semaglutide Monotherapy in Comparison With Placebo in Patients With Type 2 Diabetes. Diabetes Care 2019; 42: 1724−1732.
- [22] Rodbard HW, Rosenstock J, Canani LH, et al. Oral Semaglutide Versus Empagliflozin in Patients With Type 2 Diabetes Uncontrolled on Metformin: The PIONEER 2 Trial. Diabetes Care 2019; 42: 2272−2281.
- [23] Rosenstock J, Allison D, Birkenfeld AL, et al. Effect of Additional Oral Semaglutide vs Sitagliptin on Glycated Hemoglobin in Adults With Type 2 Diabetes Uncontrolled With Metformin Alone or With Sulfonylurea: The PIONEER 3 Randomized Clinical Trial. JAMA 2019; 321: 1466−1480.
- [24] Pratley R, Amod A, Hoff ST, et al. Oral semaglutide versus subcutaneous liraglutide and placebo in type 2 diabetes (PIONEER 4): a randomised, double‑blind, phase 3a trial. Lancet 2019; 394: 39−50.
- [25] Mosenzon O, Blicher TM, Rosenlund S, et al. Efficacy and safety of oral semaglutide in patients with type 2 diabetes and moderate renal impairment (PIONEER 5): a placebo‑controlled, randomised, phase 3a trial. Lancet Diabetes Endocrinol 2019; 7: 515−527.
- [26] Zinman B, Aroda VR, Buse JB, et al. Efficacy, Safety, and Tolerability of Oral Semaglutide Versus Placebo Added to Insulin With or Without Metformin in Patients With Type 2 Diabetes: The PIONEER 8 Trial. Diabetes Care 2019; 42: 2262−2271.
- [27] Pieber TR, Bode B, Mertens A, et al. Efficacy and safety of oral semaglutide with flexible dose adjustment versus sitagliptin in type 2 diabetes (PIONEER 7): a multicentre, open‑label, randomised, phase 3a trial. Lancet Diabetes Endocrinol 2019; 7: 528−539.
- [28] Yamada Y, Katagiri H, Hamamoto Y, et al. Dose‑response, efficacy, and safety of oral semaglutide monotherapy in Japanese patients with type 2 diabetes (PIONEER 9): a 52‑week, phase 2/3a, randomised, controlled trial. Lancet Diabetes Endocrinol 2020; 8: 377−391.
- [29] Yabe D, Nakamura J, Kaneto H, et al. Safety and efficacy of oral semaglutide versus dulaglutide in Japanese patients with type 2 diabetes (PIONEER 10): an open‑label, randomised, active‑controlled, phase 3a trial. Lancet Diabetes Endocrinol 2020; 8: 392−406.
- [30] Marso SP, Bain SC, Consoli A, et al. Semaglutide and Cardiovascular Outcomes in Patients with Type 2 Diabetes. N Engl J Med 2016; 375: 1834−1844.
- [31] Ishii H, Hansen BB, Langer J, Horio H. Effect of Orally Administered Semaglutide Versus Dulaglutide on Diabetes‑Related Quality of Life in Japanese Patients with Type 2 Diabetes: The PIONEER 10 Randomized, Active‑Controlled Trial. Diabetes Ther 2021; 12: 613−623.