Prasugrel – perspektivní léčivá látka v terapii aterotrombotických příhod
Nově registrovaný ireverzibilní blokátor ADP receptorů (receptory pro adenosin-difosfát), léčivá látka prasugrel, je zajímavou inovací ve spektru antitrombotik. Oproti dosud užívanému klopidogrelu má spolehlivější protidestičkový účinek, který je dán nižším výskytem rezistence a rychlejším nástupem účinku. Prasugrel byl schválen k léčbě nemocných s akutními koronárními syndromy indikovaných ke koronární angioplastice.
Léčba a prevence pandemie kardiovaskulárních chorob je založena na pěti základních pilířích – na ovlivnění vývoje a progrese vlastního aterosklerotického procesu zásahem do rizikových faktorů, na prevenci trombotické okluze postižených tepen, na zlepšení perfuze ischemického myokardu, dále na profylaxi a léčbě poruch srdečního rytmu a konečně na prevenci a léčbě ztráty kontraktilního myokardu a vývoje srdečního selhání. Antitrombotická léčba má zásadní postavení jednak v prevenci trombózy u nemocných s ICHS (ischemická choroba srdeční), u pacientů po mozkové příhodě či při ateroskleróze lokalizované v periferním řečišti, jednak v léčbě a v zabránění progrese trombu u akutních cévních příhod. Vzhledem k tomu, že vývoj aterotrombotické okluze v tepenném řečišti je realizován primárně vývojem destičkového trombu, uplatní se optimálně protidestičková léčba.
Princip blokády receptorů ADP
Medikamentózně můžeme zasáhnout do primární hemostázy na úrovni adheze, aktivace a degranulace či vlastní agregace. V profylaxi aterotrombotického uzávěru jsou nejvýhodnější léčivé látky, které blokují aktivaci trombocytů. Aktivace destičky je zprostředkována řadou receptorů: trombinových, tromboxanových, adenosindifosfátových (ADP), serotoninových a dalších. Všechny tyto základní aktivační receptory lze inhibovat. V praxi se nejvíce osvědčila blokáda receptorů ADP thienopyridinovými antagonisty ADP receptorů či blokáda metabolické cesty vedoucí k syntéze a uvolnění tromboxanu A2 kyselinou acetylsalicylovou (ASA). Obě skupiny si vzájemně nekonkurují, ale optimálně se doplňují.
Inhibice receptorů pro adenosin-difosfát je výhodná. ADP se účastní nejen při vlastní aktivaci trombocytu a při expresi receptorů IIb/IIIa, které následně zprostředkují vlastní agregaci, tedy vzájemnou vazbu destiček, ale též chemotakticky působí na ostatní trombocyty. Růst bílého trombu tak pokračuje. Vlastních receptorů pro ADP na 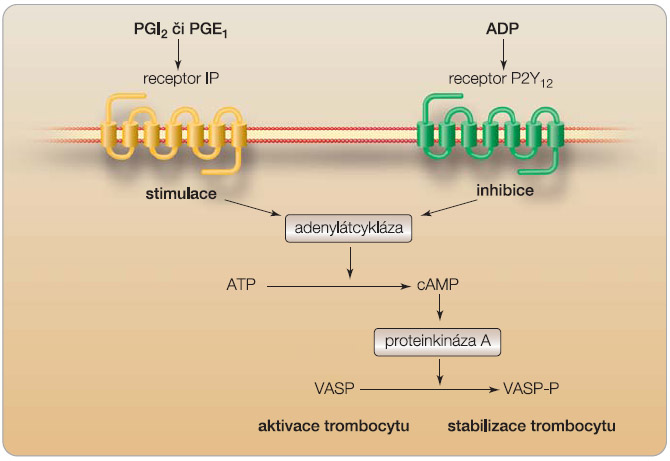 povrchu trombocytu se nachází více, mezi nejvýznamnější patří receptor P2Y12, který po stimulaci ADP zprostředkuje dlouhodobou aktivaci, degranulaci i agregaci trombocytu. Na molekulární úrovni je funkce tohoto receptoru sdruženého s G-inhibičním proteinem velmi zajímavá. Jeho aktivita je opačná než efekt obdobného receptoru IP (prostacyklinový receptor), který je aktivován prostaglandinem E1 a prostacyklinem (obr. 1). Oba receptory (P2Y12 i IP) působí na specifický protein VASP (vasodilator-stimulated phospho-protein), zatímco prostanoidy stimulují jeho fosforylaci, čímž vzniká fosforylovaný VASP (VASP-P), ADP fosforylaci proteinu inhibuje [1]. VASP-P trombocyt stabilizuje, naopak defosforylovaný VASP stimuluje výše popsaný efekt, tj. sekreci a amplifikaci agregace trombocytů. Poměr VASP a VASP-P pak můžeme v praxi detekovat a určit stupeň aktivace destiček, resp. efekt blokády receptoru P2Y12.
povrchu trombocytu se nachází více, mezi nejvýznamnější patří receptor P2Y12, který po stimulaci ADP zprostředkuje dlouhodobou aktivaci, degranulaci i agregaci trombocytu. Na molekulární úrovni je funkce tohoto receptoru sdruženého s G-inhibičním proteinem velmi zajímavá. Jeho aktivita je opačná než efekt obdobného receptoru IP (prostacyklinový receptor), který je aktivován prostaglandinem E1 a prostacyklinem (obr. 1). Oba receptory (P2Y12 i IP) působí na specifický protein VASP (vasodilator-stimulated phospho-protein), zatímco prostanoidy stimulují jeho fosforylaci, čímž vzniká fosforylovaný VASP (VASP-P), ADP fosforylaci proteinu inhibuje [1]. VASP-P trombocyt stabilizuje, naopak defosforylovaný VASP stimuluje výše popsaný efekt, tj. sekreci a amplifikaci agregace trombocytů. Poměr VASP a VASP-P pak můžeme v praxi detekovat a určit stupeň aktivace destiček, resp. efekt blokády receptoru P2Y12.
V současné době máme k dispozici tři ireverzibilní blokátory receptoru P2Y12 – thienopyridinové deriváty tiklopidin, klopidogrel a recentně registrovaný prasugrel. Aby byla umožněna dostatečná biologická dostupnost, jsou všechny látky podávány jako proléčivo, k jejich bioaktivaci dochází v několika metabolických krocích. Ve fázi vývoje máme dále řadu non-thienopyridinových blokátorů receptorů P2Y12 působících bez nutnosti bioaktivace reverzibilní inhibici: kangrelor, tikagrelor, PRT060128 a elinogrel.
Proč zavádět nové blokátory receptoru P2Y12?
Proč zavádět novou léčivou látku, používáme-li v klinické praxi jinou a dobře zavedenou? Klopidogrel je proléčivo s nízkou konverzí na aktivní metabolit, většina látky je degradována esterázami a jen 10–15 % je oxidázami CYP (cytochrom P) biotransformováno na účinný metabolit. Při jakémkoli snížení aktivity řetězce izoenzymů (CYP2C19, CYP1A2, CYP3A4 aj.) podíl látky degradované esterázami stoupá a výsledná koncentrace aktivní látky klesá pod terapeutickou hladinu. Bohužel v praxi je toto snížení aktivity časté, třetinu nemocných tvoří geneticky pomalí metabolizátoři na úrovni CYP2C19, či k blokádě konverze vedou lékové interakce s inhibitory některého ze zúčastněných izoenzymů. Nejvýznamnější pak je inhibice CYP2C19 omeprazolem – inhibitorem protonové pumpy, který je velmi často užíván k prevenci krvácení do trávicího traktu právě u nemocných léčených protidestičkovými léky. Jak polymorfismus metabolismu (tj. přítomnost inaktivní alely pro CYP2C19), tak současné podávání inhibitorů kaskády bioaktivace má významný praktický dopad; zvyšuje asi o polovinu mortalitu a morbiditu pacientů s trombotickými stavy i nemocných s akutními koronárními příhodami řešenými přímou angioplastikou [2–5].
Prasugrel – spolehlivá bioaktivace a rychlý nástup účinku
Nedávno byl centrálním registračním postupem schválen v Evropě nový inhibitor trombocytárních receptorů ADP typu P2Y12 – prasugrel (tab. 1).  Nejedná se sice o představitele inovativního přístupu blokády primární hemostázy, ale významný přínos pro zlepšení prognózy nemocných s aterotrombotickým postižením je nepochybný. Účinek je dán opět blokádou receptoru P2Y12, jedná se tedy o stejný mechanismus účinku jako u klopidogrelu a tiklopidinu.
Nejedná se sice o představitele inovativního přístupu blokády primární hemostázy, ale významný přínos pro zlepšení prognózy nemocných s aterotrombotickým postižením je nepochybný. Účinek je dán opět blokádou receptoru P2Y12, jedná se tedy o stejný mechanismus účinku jako u klopidogrelu a tiklopidinu.
Od těchto, již zavedených léčivých látek se prasugrel významně liší. Prasugrel je sice též proléčivem s nutností konverze, nicméně nepodléhá inaktivaci esterázami a polymorfismus izoenzymů CYP či jejich inhibice pouze zpomalí biotransformaci, ale nedojde k degradaci na metabolity neúčinné. První předností prasugrelu je tak jeho spolehlivější protidestičkový účinek, u něhož se nepředpokládá (a v současnosti nezjistila) rezistence k léčbě. Druhou, stejně důležitou výhodou je významně rychlejší nástup účinku při srovnání s klopidogrelem či s tiklopidinem (cmax je pouze 30–60 min.).
Po perorálním podání se prasugrel rychle vstřebává, potrava pouze zpomaluje resorpci, nemění však celkovou biologickou dostupnost léčiva. V játrech je prasugrel metabolizován řadou izoenzymů, jako je CYP3A, CYP2B6 a v menší míře i CYP2C9 a CYP2C19, na aktivní metabolit (R-138727). 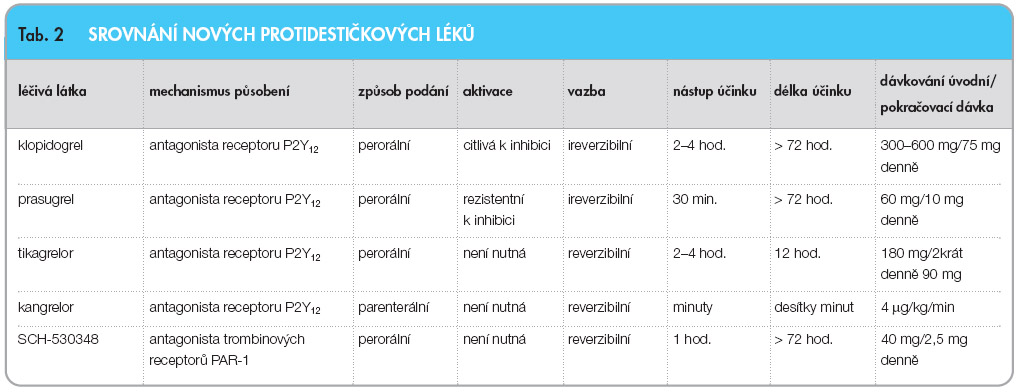 Nástup protidestičkového účinku je rychlý, do hodiny je dosaženo více než 50% inhibice trombocytů. Aktivní metabolit je degradován konjugací a metylací, metabolity jsou eliminovány ledvinami a částečně i játry. Eliminační poločas kolem 7 hodin nemá na délku účinku velký vliv, díky ireverzibilní blokádě receptoru přetrvává účinek po nasycovací dávce 60 mg 7–9 dnů, po udržovací dávce 10 mg asi 5 dnů. Efekt prasugrelu je nezávislý na renálních a jaterních funkcích, není nutno redukovat dávku při tomto orgánovém postižení [6]. Přehled vlastností prasugrelu ve srovnání s obdobnými klasickými léčivými látkami či molekulami ve vývoji je uveden v tab. 2.
Nástup protidestičkového účinku je rychlý, do hodiny je dosaženo více než 50% inhibice trombocytů. Aktivní metabolit je degradován konjugací a metylací, metabolity jsou eliminovány ledvinami a částečně i játry. Eliminační poločas kolem 7 hodin nemá na délku účinku velký vliv, díky ireverzibilní blokádě receptoru přetrvává účinek po nasycovací dávce 60 mg 7–9 dnů, po udržovací dávce 10 mg asi 5 dnů. Efekt prasugrelu je nezávislý na renálních a jaterních funkcích, není nutno redukovat dávku při tomto orgánovém postižení [6]. Přehled vlastností prasugrelu ve srovnání s obdobnými klasickými léčivými látkami či molekulami ve vývoji je uveden v tab. 2.
Prasugrel – momentální vítěz u akutních koronárních příhod
Rychlý efekt prasugrelu oceníme v zatím jediné schválené indikaci, tj. v prevenci trombotických komplikací u nemocných s akutními koronárními příhodami ošetřenými koronární angioplastikou (v kombinaci s ASA). V registrační studii TRITON-TIMI 38 došlo v této indikaci k poklesu výskytu akutních koronárních příhod (typu STEMI i ![Graf 1 Srovnání účinnosti a bezpečnosti prasugrelu a klopidogrelu u pacientů s akutní koronární příhodou indikovaných ke koronární angioplastice (studie TRITON-TIMI 38, n = 13 608, medián – 14,5 měsíce léčby); KV – kardiovaskulární, IM – infarkt myokardu, CMP – cévní mozková příhoda, HR – hazard ratio; podle [7] – Wiviott, et al., 2007.](https://www.remedia.cz/photo-a-27634---.jpg) non-STEMI) o pětinu proti kontrolní větvi léčené klasicky kombinací klopidogrelu a ASA (graf 1). Téměř o třetinu vyšší výskyt krvácení ve srovnání s podáváním klopidogrelu je logický: odpovídá-li o třetinu více nemocných na léčbu, musí se dopad na větší část léčené populace projevit odpovídajícím nárůstem počtu nežádoucích příhod. Výrazný přesah příznivého účinku nad rizikem krvácení se odráží v poměru počtu nemocných, které je nutno léčit k zabránění jedné kardiovaskulární příhodě: NNT (number needed to treat) je pouze 42 léčených oproti počtu nemocných, u nichž dojde k významnému krvácení, kde NNT představuje 162 léčených [7, 8].
non-STEMI) o pětinu proti kontrolní větvi léčené klasicky kombinací klopidogrelu a ASA (graf 1). Téměř o třetinu vyšší výskyt krvácení ve srovnání s podáváním klopidogrelu je logický: odpovídá-li o třetinu více nemocných na léčbu, musí se dopad na větší část léčené populace projevit odpovídajícím nárůstem počtu nežádoucích příhod. Výrazný přesah příznivého účinku nad rizikem krvácení se odráží v poměru počtu nemocných, které je nutno léčit k zabránění jedné kardiovaskulární příhodě: NNT (number needed to treat) je pouze 42 léčených oproti počtu nemocných, u nichž dojde k významnému krvácení, kde NNT představuje 162 léčených [7, 8].
Významnější klinický efekt prasugrelu odráží výsledek farmakodynamické studie PRINCIPLE-TIMI 44. U nemocných indikovaných ke koronární angioplastice zde měla saturační dávka 60 mg prasugrelu výraznější účinek na inhibici trombocytu než saturační dávka 600 mg klopidogrelu; podobný efekt prokázala udržovací dávka 10 mg prasugrelu denně proti dvojnásobné udržovací dávce 150 mg klopidogrelu denně. Obě dávky byly testovány při bazální léčbě ASA [9].
Klinický efekt, tj. spolehlivější protidestičkový účinek i odpovídající vyšší výskyt krvácení, zcela potvrzuje teoretický předpoklad: nebude-li kvůli výskytu farmakogenetické rezistence či kvůli lékové interakci snížen farmakodynamický efekt, pak je možno očekávat pokles počtu aterotrombotických příhod a zvýšený výskyt krvácení. Oproti klopidogrelu, u něhož se s rezistencí na podkladě geneticky nefunkčního CYP2C19 můžeme setkat až u 30 % naší populace, by měl být prasugrel účinný u všech nemocných. S lékovými interakcemi inhibujícími bioaktivaci klopidogrelu se setkáváme nejméně u pětiny české populace. V zatím nezveřejněné studii Suchopára a kol. užívalo plných 20 % z celkového počtu léčených klopidogrelem současně omeprazol.
Jak užívat prasugrel v praxi?
V souladu s výsledkem registrační studie je prasugrel indikován v kombinaci s ASA u nemocných s akutními koronárními příhodami typu nestabilní anginy pectoris či infarktu myokardu (STEMI i non-STEMI), kteří jsou indikováni k provedení angioplastiky, tedy u rozhodující části populace s koronárními příhodami. Doklady o prospěšnosti léčby jsou při podávání prasugrelu přítomny nejméně po dobu 6–12 měsíců po příhodě. Doporučené dávkování je 60 mg (6 tablet) na úvod k saturaci a dále 10 mg denně k udržení efektu, lék se podává perorálně. Riziko krvácení je úměrné účinku. Významné krvácení, které vedlo k ukončení léčby, se objevilo ve studii TIMI 38 u 2,5 % pacientů ve větvi prasugrelové a v 1,4 % případů ve větvi klopidogrelové. Vyskytne-li se krvácení, nemáme bohužel dostupné antidotum, léčíme lokálně i celkově (převody náplavů destiček či deriváty krve). S cílem snížit riziko krvácení při zachování efektu byla navržena studie TRILOGY ACS, která prověřuje účinek polovičních dávek.
Jaké jsou perspektivy a využití prasugrelu?
Podíváme-li se, kdo je přednostně indikován k léčbě prasugrelem, pak není pochyb, že všichni nemocní s vysokým rizikem aterotrombotické příhody či trombotické příhody v tepně s implantovaným stentem, a to po dobu trvání tohoto vysokého rizika. Toto riziko je nejvyšší v prvních šesti měsících po koronární příhodě, v případě implantovaného lékového stentu pak ještě podstatně déle. Vzhledem k tomu, že léčba bude zcela jistě ekonomicky nákladnější, bude nutno zvážit, kteří nemocní mají z této léčby největší přínos a kde není jiná výhodnější cesta. Nepochybnou skupinou s jasnou a jinak neřešitelnou terapeutickou metodou jsou nemocní s přímou koronární intervencí, kteří mají prokázánu rezistenci ke klopidogrelu. Stanovení rezistence lze dnes již rutinně testovat stanovováním polymorfismu izoenzymu CYP2C19. Méně výhodný je průkaz nedostatečné protidestičkové odpovědi (např. testováním VASP/VASP-P). Při potřebě denně testovat několik desítek nemocných by dnešní kapacity farmakogenetických a hematologických laboratoří tento úkol zcela jistě zvládly. Finanční náklady by při větším počtu vyšetření byly příznivější. Druhou skupinou, která rovněž velmi profituje z léčby prasugrelem, jsou diabetici. I v této podskupině by indikace prasugrelu mohla být po farmakoekonomické stránce racionální. Otázkou je indikace prasugrelu u nemocných léčených inhibitory protonové pumpy. Omeprazol a lansoprazol snižují, případně až eliminují léčebný potenciál klopidogrelu. Zdá se, že pantoprazol a esomeprazol tento interakční potenciál nemají. Vhodným řešením interakce s inhibitory protonové pumpy se tedy zdá být záměna inhibitoru.
Kromě zavedení prasugrelu je ve vývoji ještě řada nových protidestičkových léků. Zmíněny již byly reverzibilní inhibitory receptoru P2Y12: kangrelor, tikagrelor, PRT060128 a elinogrel. Díky tomu, že se jedná již přímo o aktivní látky, odpadá nutnost biokonverze a nástup účinku je rychlejší. Kratší efekt (tj. do 24 hodin) může být výhodou při krvácení či nutnosti operačního zákroku, naopak obráceně při vynechání dávky může vést k selhání účinku a k trombotické příhodě. Další a nepříliš vzdálenou perspektivou jsou inhibitory trombinových receptorů PAR-1. I zde probíhají pokročilé fáze klinického hodnocení. Závěrem lze konstatovat, že již dnes máme účinné léčivé látky k prevenci a léčbě aterotrombotických příhod a další inovace nás čekají. Důležité je, aby indikovaní nemocní byli optimální protidestičkovou terapií skutečně léčeni.
Seznam použité literatury
- [1] Michelson AD. P2Y12 antagonism: promises and challenges. Arterioscler Thromb Vasc Biol 2008; 28: s33–38.
- [2] Ho PM, Maddox TM, Wang L, et al. Risk of adverse outcomes associated with concomitant use of clopidogrel and proton pump inhibitors following acute coronary syndrome. JAMA 2009; 301: 937–944.
- [3] Siller-Matula JM, Spiel AO, Lang IM, et al. Effects of pantoprazole and esomeprazole on platelet inhibition by clopidogrel. Am Heart J 2009; 157: 148.e1–5.
- [4] Mega JL, Close SL, Wiviott SD, et al. Cytochrome P-450 polymorphisms and response to clopidogrel. N Engl J Med 2009; 360: 354–362.
- [5] Simon T, Verstuyft C, Mary-Krause M, et al. Genetic determinants of response to clopidogrel and cardiovascular events. N Engl J Med 2009; 360: 363–375.
- [6] http: //www.emea.europa.eu/humandocs/Human/EPAR/efient/efient.htm (29. 7. 2009)
- [7] Wiviott SD, Braunwald E, McCabe CH, et TRITON-TIMI 38 Investigators. Prasugrel versus clopidogrel in patients with acute coronary syndromes. N Engl J Med 2007; 357: 2001–2015.
- [8] Motovska Z, Widimsky P. Improving outcomes in patients undergoing percutaneous coronary intervention: role of prasugrel. Vasc Health Risk Manag 2009; 5: 475–481.
- [9] Wiviott SD, Trenk D, Frelinger AL, et PRINCIPLE-TIMI 44 Investigators. Prasugrel compared with high loading- and maintenance-dose clopidogrel in patients with planned percutaneous coronary intervention: the Prasugrel in Comparison to Clopidogrel for Inhibition of Platelet Activation and Aggregation-Thrombolysis in Myocardial Infarction 44 trial. Circulation 2007; 116: 2923–2932.