Sofosbuvir
Formou přehledového článku je prezentován sofosbuvir jako nová léčebná varianta chronické virové hepatitidy C. V článku je podán rozbor jeho základních farmakologických vlastností a přehled výsledků registračních studií fáze II a III s tímto inhibitorem HCV RNA polymerázy.
Úvod
Chronická infekce virem hepatitidy C (HCV) představuje i ve 21. století závažný zdravotní problém s velkými sociálními dopady. Infekce postihuje kolem 170 milionů osob na celém světě a je považována za hlavní příčinu rozvoje jaterní cirhózy a hepatocelulárního karcinomu v ekonomicky vyspělých zemích [1, 2]. Situaci dobře ilustruje skutečnost, že úmrtnost na komplikace spojené s infekcí HCV ve Spojených státech překračuje od roku 2007 úmrtnost související s infekcí HIV [3, 4].V posledních 10–12 letech byla standardní terapie chronické infekce HCV založena na podání kombinace pegylovaných interferonů alfa (PEG-IFN) s ribavirinem (RBV) [5]. Délka léčby byla 48 týdnů v případech chronické infekce HCV vyvolané genotypem 1 a 24 týdnů v případech infekce vyvolané genotypy 2 a 3. Účinnost této kombinační terapie (setrvalá virologická odpověď, SVR) u genotypu 1 je 40–60 %, u genotypu 2 a 3 kolem 80 % [6, 7].
V roce 2011 vstoupila léčba virové hepatitidy C do zcela nové éry, která je charakterizována rychlým průnikem tzv. přímo působících virostatik (DAA, Directly Acting Antivirals) do terapeutických kombinací této závažné infekce. Na začátku této éry stálo schválení prvních dvou zástupců této heterogenní skupiny léčiv – bocepreviru a telapreviru – k užití u chronické infekce HCV. Přímo působící virostatika mají svůj název odvozen od mechanismu účinku. Látky této skupiny přímo inhibují některý z enzymů uplatňujících se v průběhu replikačního cyklu HCV.
V rámci replikace HCV dochází k syntéze jediného prekurzorového proteinu, který je translačním produktem celého virového genomu. Jeho následné štěpení zahajuje virová proteáza, která postupně uvolňuje jednotlivé strukturální i nestrukturální proteiny. Posledním krokem procesu je uvolnění RNA polymerázy, která je klíčovým enzymem celé replikace. DAA jsou látky inhibující nejčastěji buď právě proteázu (produkt NS3/4 oblasti virového genomu) či RNA polymerázu (produkt NS5B).
Boceprevir a telaprevir jsou zástupci první generace virostatik, jež se používají pouze a zásadně v kombinaci s PEG-IFN a RBV. Tato první virostatika mají účinek pouze u genotypu HCV 1, u ostatních genotypů buď žádný, nebo velice slabý účinek s vysokým rizikem vzniku virologické rezistence. Jejich účinnost (SVR vyjádřená v %) v trojkombinaci s PEG-IFN a RBV se u genotypu HCV 1 pohybuje kolem 65–70 % [8, 9].

Dnes je jisté, že velmi brzo dojde k jejich vytlačení přípravky vyšších generací, které budou mít příznivější bezpečnostní profil, nebudou vyžadovat současné podání interferonu, či dokonce RBV a jejich genotypové spektrum bude ve srovnání s boceprevirem a telaprevirem širší.Boceprevir i telaprevir patří mezi inhibitory virové proteázy, přesněji mezi tzv. první vlnu první generace DAA. Jednotlivé třídy a srovnání jejich vlastností ukazuje tab. 1.
V současné době se jeví jako nejúčinnější dostupný přípravek vhodný k léčbě infekce HCV v mnoha jejích podobách a variantách virostatikum sofosbuvir, jemuž se budeme věnovat podrobněji.
Farmakologická charakteristika sofosbuviru
Sofosbuvir (SOF) je syntetický nukleotidový inhibitor (analog uridinu) virové RNA-dependentní RNA polymerázy (RdRp) – produkt NS5B oblasti virového genomu. Sofosbuvir je proléčivo, které prodělává intracelulární trifosforylaci, jejíž produkt je pomocí RdRp inkorporován do HCV RNA. Mechanismem účinku je tzv. ukončení řetězce, kdy po navázání aktivní látky (v našem případě SOF) nemůže pokračovat další řetězení dceřiné virové RNA. SOF je účinný u všech hlavních nejrozšířenějších genotypů HCV (1–6), neinterferuje se syntézou lidské DNA či RNA, neinhibuje ani mitochondriální RNA polymerázy.
SOF není metabolizován systémem cytochromu P450, potenciál lékových interakcí je tedy mnohem omezenější nežli u virostatik nižších generací. SOF je substrátem lékového transportéru P-glykoproteinu (P-gp) a „breast cancer resistance protein“ (BCRP), jeho aktivní metabolit však nikoliv. Potentní induktory P-gp ve střevě (rifampicin, karbamazepin a fenytoin) snižují plazmatickou koncentraci SOF, snižuje se tedy rovněž intracelulární přítomnost aktivního metabolitu a dochází ke snížení protivirové účinnosti SOF. Naopak inhibitory P-gp/BCRP zvyšují plazmatickou hladinu SOF, avšak nikoliv aktivního metabolitu, takže SOF může být s inhibitory podáván současně. SOF je dostupný ve formě potahované tablety obsahující 400 mg účinné látky.
Klinické použití SOF
SOF byl schválen ve zrychlených procedurách jak americk ým úřadem FDA (Food and Drug Administration), tak evropskou agenturou EMA (European Medicines Agency) v indikaci léčby chronické infekce HCV koncem roku 2013, respektive počátkem roku 2014. Schválené a v SPC uvedené indikace a režimy ukazuje tab. 2. Přesvědčivé podklady pro takováto závažná rozhodnutí poskytly klinické studie fází II a III, jejichž přehled uvádí tab. 3. Z tabulky je vidět i cílovou populaci každé studie.
ým úřadem FDA (Food and Drug Administration), tak evropskou agenturou EMA (European Medicines Agency) v indikaci léčby chronické infekce HCV koncem roku 2013, respektive počátkem roku 2014. Schválené a v SPC uvedené indikace a režimy ukazuje tab. 2. Přesvědčivé podklady pro takováto závažná rozhodnutí poskytly klinické studie fází II a III, jejichž přehled uvádí tab. 3. Z tabulky je vidět i cílovou populaci každé studie. 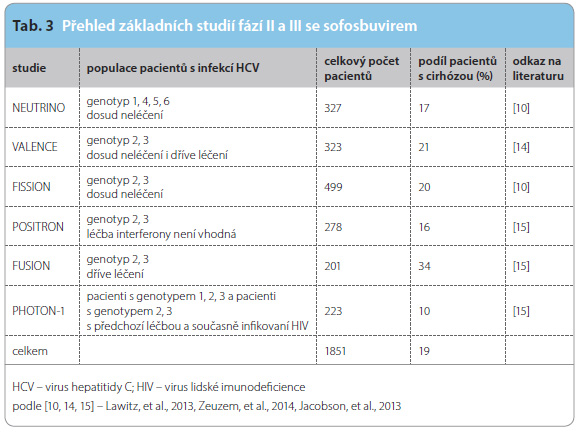
Základní studií, která zahrnovala pacienty infikované genotypem 1 a dosud neléčené jakoukoliv protivirovou léčbou (tzv. naivní osoby), je studie NEUTRINO [10]. Tato studie také jako jediná obsahovala v léčebné fázi režim, v němž byl podáván PEG-IFN. Další studie se věnovaly specifickým skupinám osob infikovaných genotypy 2 a 3 včetně koinfekce HCV/HIV a zahrnovaly léčebné režimy pouze s podáním SOF v kombinaci s RBV.Infekce HCV vyvolaná genotypy 2 a 3 se v ČR dosud vyskytuje mnohem méně často nežli infekce vyvolané genotypem 1, proto se budeme podrobněji zabývat především výsledky studie NEUTRINO. Od okamžiku schválení SOF v indikacích vyplývajících z uvedené sestavy klinických studií bylo publikováno nebo jinou formou zveřejněno obrovské množství údajů o účinnosti SOF i u jiných pacientských skupin a těmto věnujeme stručnou pozornost na závěr tohoto přehledového článku.
Studie NEUTRINO
Uspořádání studie bylo poměrně jednoduché. Celkem 327 léčebně naivních osob infikovaných HCV genotypy 1–6 bylo léčeno po dobu 12 týdnů kombinací SOF (400 mg p.o. denně) + PEG-IFN alfa-2a (180 μg s.c. 1krát týdně) + RBV (1000–1200 mg p.o. denně). Ke statistickému hodnocení byla jako kontrolní skupina zvolena data o účinnosti telapreviru a bocepreviru v regist![Graf 1 Dosažení primárního cíle ve studii NEUTRINO – setrvalé virologické odpovědi ve 12. týdnu po léčbě (SVR12); podle [10] – Lawitz, et al., 2013. HCV RNA – ribonukleová kyselina viru hepatitidy C; n/N – počet HCV RNA-negativních pacientů/počet sledovaných pacientů](https://www.remedia.cz/photo-a-29782---.jpg) račních studiích těchto přípravků (historická kontrola). Studie NEUTRINO kontrolní skupinu neměla. Mezi osobami s genotypem 1 bylo 69 % infikovaných subtypem 1a, 20 % infikovaných subtypem 1b a jeden pacient měl infekci oběma subtypy. Tento poměr reflektuje situaci ve Spojených státech, v České republice stále dominuje subtyp 1b. Primárním cílem studie bylo zhodnocení účinnosti léčby pomocí parametru SVR12 (procentuálně vyjádřený počet pacientů HCV RNA-negativních ve 12. týdnu po skončení léčb
račních studiích těchto přípravků (historická kontrola). Studie NEUTRINO kontrolní skupinu neměla. Mezi osobami s genotypem 1 bylo 69 % infikovaných subtypem 1a, 20 % infikovaných subtypem 1b a jeden pacient měl infekci oběma subtypy. Tento poměr reflektuje situaci ve Spojených státech, v České republice stále dominuje subtyp 1b. Primárním cílem studie bylo zhodnocení účinnosti léčby pomocí parametru SVR12 (procentuálně vyjádřený počet pacientů HCV RNA-negativních ve 12. týdnu po skončení léčb![Graf 2 Dosažení setrvalé virologické odpovědi ve 12. týdnu po léčbě (SVR12) podle genotypu HCV; podle [10] – Lawitz, et al., 2013. HCV RNA – ribonukleová kyselina viru hepatitidy C; n/N – počet HCV RNA-negativních pacientů/počet sledovaných pacientů](https://www.remedia.cz/photo-a-29783---.jpg) y); SVR12 dosahovala u historické kontrolní skupiny (viz výše) 60 %. Naplnění primárního cíle studie ukazuje graf 1 (pro srovnání se SVR12 60 % bylo dosaženo statistické významnosti, p < 0,001). Při pohledu na vývoj virologické odpovědi (týden 2, 4, 12) a celkovou hodnotu SVR je jasné, že dosažení negativity HCV RNA ve 2. či 4. týdnu (rychlá virologická odpověď, RVR) ztrácí při použití SOF svou prediktivní hodnotu. Nelze proto v daném případě uvažovat o modifikacích léčebného režimu ve smyslu „léčby vedené podle odpovědi“ ani o pravidlech pro předčasné ukončení léčby (futility rules), jak tomu bylo při podávání PEG-IFN + RBV + boceprevir/telaprevir; SVR12 pro genotyp 1 je 89 %, u ostatních genotypů i vyšší, jak ukazuje graf 2. Dalším parametrem, o němž je známo, že výrazně ovlivňuje účinnost protivirové léčby, je stupeň jaterní fibrózy a přítomnost či
y); SVR12 dosahovala u historické kontrolní skupiny (viz výše) 60 %. Naplnění primárního cíle studie ukazuje graf 1 (pro srovnání se SVR12 60 % bylo dosaženo statistické významnosti, p < 0,001). Při pohledu na vývoj virologické odpovědi (týden 2, 4, 12) a celkovou hodnotu SVR je jasné, že dosažení negativity HCV RNA ve 2. či 4. týdnu (rychlá virologická odpověď, RVR) ztrácí při použití SOF svou prediktivní hodnotu. Nelze proto v daném případě uvažovat o modifikacích léčebného režimu ve smyslu „léčby vedené podle odpovědi“ ani o pravidlech pro předčasné ukončení léčby (futility rules), jak tomu bylo při podávání PEG-IFN + RBV + boceprevir/telaprevir; SVR12 pro genotyp 1 je 89 %, u ostatních genotypů i vyšší, jak ukazuje graf 2. Dalším parametrem, o němž je známo, že výrazně ovlivňuje účinnost protivirové léčby, je stupeň jaterní fibrózy a přítomnost či ![Graf 3a, b Dosažení setrvalé virologické odpovědi ve 12. týdnu po léčbě (SVR12) podle stupně jaterní fibrózy – stanovena na základě: a – jaterní biopsie (N = 232), b – FibroTest (N = 323); podle [16] – Patel, et al., 2013. n/N – počet pacientů, kteří dosáhli SVR12/počet sledovaných pacientů](https://www.remedia.cz/photo-a-29784---.jpg) nepřítomnost jaterní cirhózy. Na grafu 3a, b je ukázáno h
nepřítomnost jaterní cirhózy. Na grafu 3a, b je ukázáno h![Graf 4 Srovnání dosažení setrvalé virologické odpovědi ve 12. týdnu po léčbě (SVR12) u pacientů s cirhózou a u pacientů bez cirhózy; podle [10] – Lawitz, et al., 2013. HCV RNA – ribonukleová kyselina viru hepatitidy C; n/N – počet HCV RNA-negativních pacientů/počet sledovaných pacientů SVR12 genotypu 1 = 81 %](https://www.remedia.cz/photo-a-29785---.jpg) odnocení SVR12 podle stupně jaterní fibrózy u osob, které podstoupily v rámci studie jaterní biopsii nebo byla tato diagnostika provedena do dvou let před zahájením léčby v rámci studie NEUTRINO. Nástup nových, neinvazivních metod ilustruje graf 3b, kde je k hodnocení stupně fibrózy užito krevního testu. Hodnocení SVR12 ve skupině osob s jaterní cirhózou a bez cirhózy ukazuje graf 4.
odnocení SVR12 podle stupně jaterní fibrózy u osob, které podstoupily v rámci studie jaterní biopsii nebo byla tato diagnostika provedena do dvou let před zahájením léčby v rámci studie NEUTRINO. Nástup nových, neinvazivních metod ilustruje graf 3b, kde je k hodnocení stupně fibrózy užito krevního testu. Hodnocení SVR12 ve skupině osob s jaterní cirhózou a bez cirhózy ukazuje graf 4.
Z obojího je patrno, že i při použití SOF v kombinaci s PEG-IFN a RBV představuje pokročilost choroby určitý negativní prediktivní faktor. Účinnost léčby je však i u naivních pacientů s jaterní cirhózou poměrně vysoká. Publikovaná data ze studie CUPIC (tzv. real life studie s opakovanou léčbou, Francie) ukazují, že při použití telapreviru je SVR ve skupině pacientů, u nichž došlo po předchozí léčbě PEG-IFN + RBV k relapsu, 74 %, při použití bocepreviru je SVR 54 %, u non-respondérů pak 19 %, respektive 0 % [11].
Studie NEUTRINO ukázala také vysokou bezpečnost léčby SOF – přípravek byl dobře tolerován bez přídatných účinků nad očekávaný bezpečnostní profil terapeutické kombinace PEG-IFN + RBV. Nejčastějšími nežádoucími účinky byly únava (59 %), bolesti hlavy (36 %), nauzea (34 %) a nespavost (25 %). Pouze 5 z 327 (1,5 %) pacientů ukončilo léčbu předčasně z důvodu nežádoucích účinků.Možná největší přínos SOF spočívá v jeho bezpečnosti a především v možnosti podávat jej s vysokou účinností v režimech bez PEG-IFN (tzv. IFN-free režimy). Léčebné režimy bez interferonu představují obrovskou naději pro skupinu pacientů s nejpokročilejším onemocněním, tj. pro pacienty před transplantací jater. V současnosti jsou léčebné možnosti v této indikaci velmi omezené, účinnost a hlavně tolerance léčby PEG-IFN v kombinaci s RBV, ev. PEG-IFN + RBV + boceprevir/telaprevir, je velmi nízká [12, 13]. Přitom rekurence infekce HCV po transplantaci jater pro jaterní cirhózu při chronické infekci HCV dosahuje takřka 100 % a představuje hlavní příčinu sníženého přežívání pacientů po transplantaci oproti jiným indikacím. V tuto chvíli je dle SPC indikována léčba kombinací SOF + RBV před transplantací. Postupem času se ukazuje, že tímto režimem lze velmi účinně bránit potransplantační rekurenci HCV. Formou ústní prezentace (Curry MP a kol., APASL 2014) byly prezentovány výsledky pretransplantační studie, kde se podařilo ukázat, že ve skupině osob léčených před provedením transplantace jater alespoň 28 dnů kombinací SOF + RBV prakticky nedochází k rekurenci HCV.
Výsledky léčby u genotypů HCV 2 a 3
Léčebný režim SOF + RBV vedl ve studiích u naivních pacientů infikovaných genotypy 2 [14, 15] k hodnotám SVR12 pohybujícím se v rozmezí 90–100 % při délce trvání léčby 12 týdnů. Nebyl prokázán významný rozdíl při prodloužení léčby na 24 týdnů. U pacientů léčených v minulosti neúspěšně kombinací PEG-IFN + RBV bylo dosaženo rovněž srovnatelné odpovědi ve větvích léčených 12 a 24 týdnů, a to 91–96 %. Jedinou výjimkou, kde byla prokázána vyšší účinnost 24týdenní léčby, byli pacienti s opakovaně léčenou jaterní cirhózou; SVR12 zde byla při 12týdenní léčbě 60 %, po 24týdenní léčbě dosahovala SVR 88 %.Kombinace SOF + RBV podávaná po dobu 24 týdnů vedla mezi dosud neléčenými pacienty infikovanými genotypem HCV 3 k SVR12 dosahující 92–94 %, a to jak mezi pacienty s jaterní cirhózou, tak mezi pacienty bez cirhózy. U pacientů bez cirhózy, kteří byli v minulosti již léčeni neúspěšně, bylo dosaženo srovnatelné účinnosti režimů SOF + RBV po dobu 24 týdnů a SOF + RBV + PEG-IFN po dobu 12 týdnů, a to 83–87 %. Kupodivu mezi opakovaně léčenými cirhotiky byla prokázána nejvyšší účinnost 12týdenního podávání kombinace SOF + RBV + PEG-IFN. Nicméně tato data budou vyžadovat další ověření.
Závěr
Objev a zavedení DAA do léčby chronické infekce HCV vyvolané genotypem 1 je nutno považovat za skutečný milník ve vývoji léčby této závažné infekce. Vysoká účinnost léčebných režimů se SOF je při jeho vysoké bezpečnosti a komfortu podávání nadějí i pro pacienty s nejpokročilejší podobou onemocnění. Je prakticky jisté, že léčebné režimy založené na podávání PEG-IFN a RBV budou postupně vytlačeny režimy bezinterferonovými, které budou kombinovat několik virostatik s různým místem účinku. Sofosbuvir můžeme považovat za ideální virostatikum, které je účinné proti všem genotypům, podává se jednou denně a má minimum nežádoucích účinků.
Seznam použité literatury
- [1] World Health Organization. Global alert and response (GAR). Hepatitis C. (2012 )http://www.who.int/csr/disease/hepatitis/whocdscsrlyo2003/en/index4html
- [2] Perz JF, Armstrong GL, Farrington LA, et al. The contributions of hepatitis B virus and hepatitis C virus infections to cirrhosis and primary liver cancer worldwide. J Hepatol 2006; 45: 529–538.
- [3] Kanwal F, Hoang T, Kramer JR, et al. Increasing prevalence of HCC and cirrhosis in patients with chronic hepatitis C virus infection. Gastroenterology 2011; 4: 1182el–1188el.
- [4] Deuffic-Burban S, Poynard T, Sulkowski MS, Wong JB. Estimating the future health burden of chronic hepatitis C and human immunodeficiency virus infections in the United States. J Viral Hepat 2007; 14: 107–115.
- [5] Urbánek P, Husa P, Galský J, et al. Standardní diagnostický a terapeutický postup chronické infekce virem hepatitidy C (HCV). ČLČ 2008; 5: příloha: I–XII.
- [6] Fried MW, Shiffman ML, Reddy KR, et al. Peginterferon alfa-2a plus ribavirin for chronic hepatitis C virus infection. N Engl J Med 2002; 13: 975–982.
- [7] Hadziyannis SJ, Sette H, Morgan TR, et al. Peginterferon-alfa2a and ribavirin combination therapy in chronic hepatitis C. Ann Intern Med 2004; 5: 346–355.
- [8] Urbánek P. Novinky v terapii chronické infekce virem hepatitidy C. Remedia 2011, 5: 380–385.
- [9] Urbánek P, Husa P, Galský J, et al. Standardní diagnostický a terapeutický postup u chronické infekce virem hepatitidy C (HCV). Gastroent Hepatol 2012; 3: 214–229.
- [10] Lawitz E, Mangia A, Wyles D, et al. Sofosbuvir for previously untreated chronic hepatitis C infection. N Engl J Med 2013; 20: 1878–1887.
- [11] Hézode C, Fontaine H, Dorival C, et al. Triple therapy in treatment-experienced patients with HCV-cirrhosis in a multicentre cohort of the French Early Access Programme (ANRS CO20-CUPIC) – NCT01514890. J Hepatol 2013; 3: 434–441.
- [12] Šperl J, Fraňková S, Trunečka P. Transplantace jater pro chronickou hepatitidu C, význam protivirové léčby. Gastroent Hepatol 2013; 5: 407–412.
- [13] Dumortier J, Scoazec JY, Chevallier P, et al. Treatment of recurrent hepatitis C after liver transplantation: a pilot study of peginterferon alfa-2b and ribavirin combination. J Hepatol 2004; 4: 669–674.
- [14] Zeuzem S, Dusheiko GM, Salupere R, et al. Sofosbuvir and Ribavirin in HCV Genotypes 2 and 3. N Engl J Med 2014; 370: 1993–2001.
- [15] Jacobson IM, Gordon SC, Kowdley KV, et al. Sofosbuvir for hepatitis C genotype 2 or 3 in patients without treatment options. N Engl J Med 2013; 20: 1867–1877.
- [16] Patel K, et al. Efficacy and safety of sofosbuvir in patients according to fibrosis stage: an analysis of Phase 3 data. AASLD 1–5 November 2013, Washington DC, USA: Abstract 1093.