Technologické novinky v léčbě diabetu 1. typu u dětí
Souhrn:
Obermannová B. Technologické novinky v léčbě diabetu 1. typu u dětí. Remedia 2021; 31: 328–334.
V posledním desetiletí proběhla v diabetologii zásadní revoluce v možnostech léčby převážně v oblasti technologií. To přináší zcela novou éru léčby dětského diabetu, která zásadním způsobem zlepšuje možnosti dosažení dobré kompenzace a také kvality života dětí s tímto onemocněním. U dětí s diabetem 1. typu se tímto významně mění jejich osud jak bezprostředně, tak i do jejich budoucího dospělého života. Zásadní rozvoj v oblasti technologií započal v devadesátých letech minulého století využíváním inzulinových pump, na který navázalo v posledních letech použití kontinuálních monitorů glykemie (CGM). Nejdůležitějším nástrojem moderních technologií v léčbě diabetu jsou právě CGM, jejichž používání zlepšuje kompenzaci pacientů s diabetem bez ohledu na způsob podávání inzulinu. Spojení kontinuální monitorace s inzulinovou pumpou pomocí algoritmu hybridního uzavřeného okruhu je nejnovější léčebnou modalitou, kterou máme k dispozici teprve posledních několik měsíců. Nezbytností a velkou výzvou pro diabetologický tým je poskytnout pacientovi adekvátní edukaci, aby mohl nové technologie správně používat.
Summary:
Obermannova B. Technological advances in the therapy of type 1 diabetes in children. Remedia 2021; 31: 328–334.
Last decade has brought a huge revolution in diabetes care regarding new possibilities of treatment, mainly in the use of modern technologies. It has brought a completely new era in the treatment of childhood diabetes that significantly improves the possibilities of reaching the ideal metabolic control as well as the quality of life of children with type 1 diabetes. These improvements dramatically change the perspectives of children with diabetes, not only immediately but also for their future adult lives. The rapid progress in technology development started in the 90s when insulin pumps became more broadly available, followed in recent years by the use of continuous glucose monitoring (CGM). The most important tool of modern technologies in the treatment of diabetes is the use of CGM, improving the metabolic control of patients with diabetes regardless of insulin administration mode. In last couple of months, the most current advanced hybrid closed loop became available combining an official algorithm, CGM and automated insulin delivery via insulin pump. A necessity and a great challenge arises for the diabetes team regarding the proper education of patients about the right use of modern technologies.
Key words: time in range, glucose variability, continuous glucose monitoring, hybrid closed loop
Úvod
Používání technologií u dětí i dospělých s diabetem 1. typu (DM1) přineslo revoluci v možnostech léčby, a to zlepšením nejen kompenzace, ale také kvality života.
Tento rozvoj započal používáním inzulinových pump, na který navázalo v posledních více než deseti letech použití kontinuálních monitorů glykemie (CGM). Spojení těchto dvou technologií na bázi automatických úprav dávek inzulinu ve formě hybridního uzavřeného okruhu představuje nejnovější technologickou možnost léčby DM1.
Pozitivní efekt těchto nových léčebných modalit pozorujeme i v České republice, kdy je v posledních letech jednoznačný trend snižování hodnot glykovaného hemoglobinu (HbA1c) u dětí s DM1. Nedávno publikovaná studie monitorující data z českého registru dětských diabetických pacientů (ČENDA) ukazuje signifikantní sestupný trend hodnot HbA1c u sledovaných dětí s DM1 v posledních sedmi letech; v roce 2017 byla střední hodnota HbA1c 61,0 mmol/mol oproti roku 2013, kdy byla 66,3 mmol/mol, p < 0,001 [1]. Tento pozitivní trend nadále pokračuje, v roce 2019 byla tato hodnota HbA1c 57,3 mmol/mol (Výroční zpráva registru dětského diabetu ČENDA za rok 2019). Populační přístup sice neumožňuje průkaz kauzality, nicméně se zdá více než pravděpodobné, že na snižování hodnoty HbA1c u dnešních dětí s DM1 má vliv jednak úhrada CGM zdravotními pojišťovnami zavedená na podzim roku 2016 a jednak samotné založení terapeutického registru ČENDA (za podpory České diabetologické společnosti [ČDS] ČLS JEP) v roce 2013. Tento registr umožňuje anonymní porovnávání parametrů kompenzace mezi ambulancemi a tím přispívá k edukaci členů diabetologických týmů, což bylo již úspěšně vyzkoušeno například v Německu [2].
Rutinní používání technologií v moderní diabetologii podporuje také Doporučený postup ČDS publikovaný v roce 2018 kolektivem autorů Technologické sekce [3].
Aktuální trendy v hodnocení
kompenzace DM1
Moderní přístup v léčbě DM1 u dětí podstatně rozšířil možnosti posuzovaných parametrů a změnil definici cílů pro dobrou kompenzaci diabetu. Právě používání nových technologií v posledních několika letech posunulo cíle kompenzace diabetu do úrovně biochemických hodnot, které se vyskytují i u člověka bez diabetu, tedy do hodnot odpovídajících normoglykemiím.
Už od 80. let minulého
století se kompenzace diabetu posuzuje dle hodnocení HbA1c,
jehož hodnota se standardně stanovuje každé tři měsíce při
ambulantních kontrolách. Již od studie DCCT publikované před
více než 20 lety známe jeho přímou souvislost s rizikem
rozvoje dlouhodobých komplikací diabetu v budoucnu (čím
vyšší hodnota HbA1c, tím vyšší průměrná glykemie
a tím vyšší riziko rozvoje pozdních komplikací diabetu)
[4]. Proto se cílové hodnoty HbA1c odpovídající
ideální kompenzaci diabetu stále zpřísňují. V současnosti
nepanuje jednota mezinárodních společností v číselné
definici ideálních hodnot HbA1c u dětí. Podle
mezinárodní společnosti zabývající se léčbou dětského
diabetu (ISPAD), která publikovala poslední konsenzus v roce
2018, se za optimální hodnotu HbA1c u dítěte
s DM1 považuje < 53 mmol/mol, dle britské
společnosti NICE je to dokonce HbA1c < 48 mmol/mol,
tabulka 1 [5], což je i cílem stanoveným Sekcí
pro dětskou diabetologii ČDS (www.detskydiabetes.cz). Tyto hodnoty
se zdají být přísné, avšak dle našich zkušeností jsou
v současné době při využití CGM v léčbě reálně
dosažitelné. O tom svědčí i skutečnost, že v České
republice dosahovalo v roce 2019 hodnot HbA1c < 48 mmol/mol
20 % všech dětí s DM1 (registr dětského diabetu ČENDA)
[1].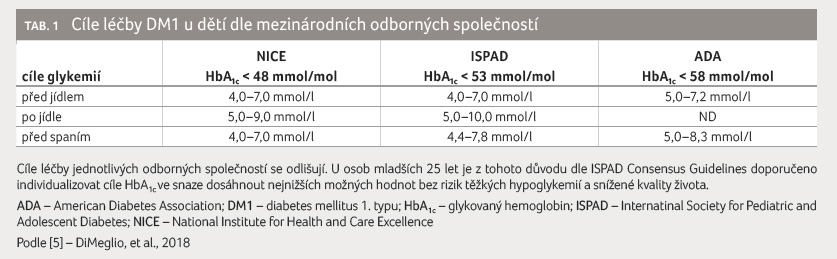
Kontinuální monitorace umožňuje
posouzení kompenzace diabetu dle reálných glykemií hodnocených
zpětně dle záznamů, které jsou k dispozici v elektronické
podobě (pacientské softwary, například Carelink nebo Diasend),
kam se průběžně stahují data všech pacientů. K posouzení
kompenzace diabetu dle těchto nových parametrů je samozřejmě
stěžejní, aby pacient využíval CGM po většinu času (více
než 70 %), jinak je hodnocení neprůkazné. Na rozdíl
od hodnot HbA1c poskytuje CGM kromě možnosti
posouzení dlouhodobé kompenzace diabetu i neustálý přehled
o glykemiích v reálném čase a jejich trendech
a tím se stává zásadním terapeutickým nástrojem.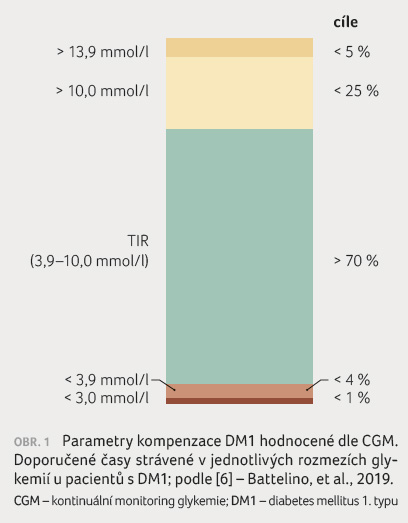
Nejdůležitějším z nich je stanovení procentuálního času v cílovém rozmezí (Time In Range, TIR), jež je mezinárodně definováno rozmezím glykemií 3,9–10,0 mmol/l [6]. Za uspokojivou kompenzaci diabetu se považuje co nejdelší čas strávený v tomto rozmezí, a to minimálně 70 % času v doporučeném pásmu (tento ukazatel dle studií také odpovídá hodnotě HbA1c 48 mmol/mol) [7]. TIR aktuálně představuje nejpodstatnější parametr hodnocení kompenzace diabetu, zohledňuje jak výhody hodnocení průměrné glykemie (resp. HbA1c), tak i glykemické variability (viz následující odstavec) a dle studií je nezávislým faktorem rizika rozvoje pozdních komplikací diabetu [8]. Dle nejnovějších doporučení existují i doporučené hodnoty pro rozpětí glykemií mimo cílové rozmezí, a to jak hodnoty hypoglykemií (hypoglykemie 1. stupně mezi 3,0–3,9 mmol/l, hypoglykemie 2. stupně < 3,0 mmol/l), tak i hyperglykemií (hyperglykemie 1. stupně mezi 10–13,9 mmol/l, hyperglykemie 2. stupně > 13,9 mmol/l) [6]. Na obrázku 1 je vyjádřeno cílové doporučení těchto procentuálních časů rozmezí glykemie v číselné podobě, obrázek 2 uvádí konkrétní příklad záznamu dobře kompenzovaného pacienta.
Dalším podstatným parametrem, který
se dá hodnotit dle záznamů CGM, je glykemická variabilita, která
je podle limitovaných studií považována za nezávislý
faktor rizika rozvoje pozdních komplikací diabetu [9]. Ta se dá
vyjádřit pomocí směrodatné odchylky (standard deviation, SD)
glykemií, jež je dostupná k nahlédnutí ve všech
používaných pacientských softwarech a je definována jako
ideální, pokud je nižší než 3,5 mmol/l [10]. Tento parametr
je však ovlivněn výší průměrné glykemie, a její
hodnocení může být proto zavádějící. Lepším ukazatelem
stanovení glykemické variability je variační koeficient (VK),
který je definován procentuálním poměrem směrodatné odchylky
versus průměrné glykemie (VK = SD: průměrná
glykemie × 100). Doporučená hodnota je menší než
36 %, ještě lépe 33 % [10].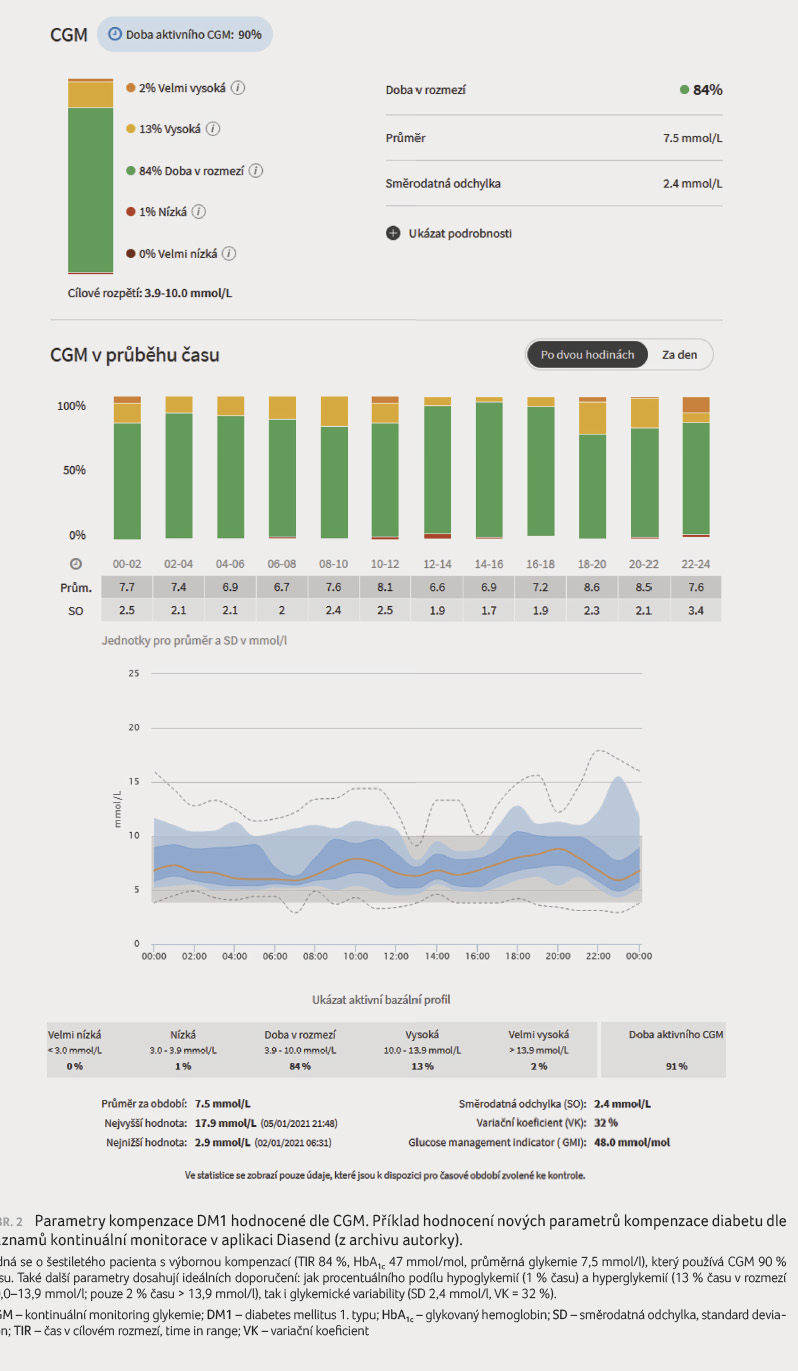
Žádný z výše uvedených parametrů kompenzace diabetu však není možné z pohledu diabetologa hodnotit izolovaně, ale pouze ve vztahu k ostatním.
Abychom dosahovali ideálních cílů těchto parametrů kompenzace diabetu u co největšího podílu našich pacientů, je nutná důsledná a opakovaná edukace. Všechny děti trpící diabetem a jejich rodiče by měli cíle těchto parametrů znát a měli by být motivováni jich dosahovat (hojně využívaným nástrojem pro edukaci cílů léčby diabetu pro děti s diabetem jsou webové stránky www.detskydiabetes.cz).
Aktuální trendy v selfmonitoringu
glykemií
V minulých dobách bylo jedinou možností selfmonitoringu používání měření glykemií glukometrem (Self Monitoring of Blood Glucose, SMBG), který stanovuje koncentraci glukózy v kapce kapilární krve. V posledních několika letech však tuto metodu zásadním způsobem zastínila CGM pomocí senzorů, které měří koncentraci glukózy v intersticiální tekutině. CGM je technologie, která radikálně zlepšila možnosti léčby i kvalitu života osob s DM1 a stala se zlatým standardem selfmonitoringu glykemií. V posledních deseti letech dochází k jejímu rychlému rozvoji se zlepšováním přesnosti a zmenšováním velikosti i zásahu do organismu.
V České republice v roce 2019 používalo nějaký typ kontinuální monitorace okolo 75 % dětí s DM1, z nich 40 % strávilo na CGM více než 70 % času (Výroční zpráva registru dětského diabetu ČENDA za rok 2019).
Samotná technologie CGM se skládá ze tří komponent: ze senzoru, který detekuje koncentraci glukózy v mezibuněčné tekutině; vysílače, který je umístěn na kůži a každých pět minut vysílá zaznamenané hodnoty, a nakonec z přijímače, který změřené glykemie a jejich změny znázorňuje graficky pomocí glykemické křivky a trendových šipek (buď externí čtečka, nebo stále více používaná aplikace v chytrém telefonu). Další výhodou je možnost sdílení naměřených dat více uživateli. Kromě pacienta mohou změřené glykemie kontinuálně sledovat například rodiče malých nemocných či učitel. Navíc se záznam naměřených hodnot průběžně ukládá do cloudu. To umožňuje například ošetřujícímu lékaři vyhodnocovat zpětně data a optimálně upravit léčbu.
Z hlediska jednotlivých možností rozdělujeme CGM na dvě skupiny. První z nich je intermitentně skenovaná kontinuální monitorace (is CGM) neboli Flash Glucose Monitoring (FGM) (v České republice je dostupný výhradně systém FreeStyle Libre) umožňující opakované skenování glykemií detekované v intersticiu pomocí čtečky (doporučeno skenovat minimálně 10× denně). Druhou skupinu CGM, která je z hlediska terapeutických možností výhodnější, představuje kontinuální monitorace v reálném čase (rt CGM), která zobrazuje glykemie v reálném čase. Pacientům tak umožňuje včas reagovat na alarmy a upravovat dávkování inzulinu, korigovat hrozící hypoglykemie a případně umožňuje využívat automatické funkce inzulinové pumpy, což poskytuje lepší možnosti pro dosažení optimální kompenzace diabetu [11]. V České republice jsou v současné době u dětí nejvíce využívány dva tyto systémy rt CGM: Enlite/Guardian a Dexcom. Pokud pacient takto senzor používá frekventně (> 70 % času), vede to ke zlepšení metabolické kompenzace diabetu, a to, jak bylo již řečeno, bez ohledu na způsob podávání inzulinu, který pacient používá.
Všechny tři výše uvedené typy CGM mají senzor, jenž měří koncentraci glukózy transdermálně, a to pomocí chemické glukózaoxidázové reakce. Jsou tedy samotným pacientem nebo rodičem aplikovány do podkoží a vyměňovány v pravidelných intervalech dle trvanlivosti jednotlivých systémů (7−14 dní).
U starší generace senzorů (prozatím stále systém Enlite/Guardian, také intradermální Eversense) je pro přesnost měřené hodnoty glukózy senzorem nutná kalibrace, kdy se glykemie zaznamenané senzorem kalibrují podle glykemie měřené glukometrem z kapilární krve. Nejnovější generace senzorů poskytuje však natolik přesná měření, že nutnost kalibrace glukometrem odpadá (Dexcom G6, FreeStyle Libre). Přesnost měření jednotlivých technologických modalit používaných v selfmonitoringu glykemií můžeme vyjádřit podle parametru MARD (Mean Absolute Relative Difference), který vyjadřuje procentuální rozdíl změřených hodnot oproti laboratorně změřené glykemii. Přesnost měření nejnovější generace senzorů je dokonce lepší (MARD < 10 %) než u běžně dostupných glukometrů (MARD ≤ 15 %) [12].
Výhodou rt CGM oproti is CGM je možnost bezprostředně reagovat na aktuální glykemii a její trendy. Donedávna byly tyto terapeutické úpravy prováděny přímo edukovaným pacientem nebo jeho rodičem, u nejnovějších technologií jsou dokonce prováděny automaticky samotnou pumpou pomocí automatických funkcí nebo hybridního uzavřeného okruhu. Pro adekvátní reakci pacienta je zásadní funkce alarmů (výstrah) a trendových šipek.
Pro své četné výhody tak v současné době CGM zcela zastínila na poli selfmonitoringu měření glykemie glukometrem z kapilární krve. U našich pacientů se snažíme o co největší využití CGM již od manifestace diabetu. Rozšíření této technologie umožnila také změna úhrad pojišťovnou. Za minulý rok se v české diabetologii odehrála zásadní změna ve způsobu úhrady kontinuální monitorace. Od prosince roku 2019 je pro děti i dospělé s DM1, kteří splní indikační kritéria, dostupná technologie FGM (FreeStyle Libre) bez doplatku. Podobně je nyní dostupná i technologie rt CGM (Enlite/Guardian a Dexcom), kdy každý pacient má možnost čerpat finanční částku do ročního limitu 60 000 Kč vyhrazených pro tuto technologii. Česká republika se tím dostává mezi státy s nejvyspělejší péčí o pacienty s DM1 [13].
Efekt rutinního použití rt CGM pro zlepšení kompenzace ve všech hodnotitelných parametrech u diabetiků 1. typu prokázalo velké množství randomizovaných kontrolovaných studií (randomised controlled trial, RCT) publikovaných v posledních letech. Zlepšení kompenzace se projeví nejen ve smyslu snížení hodnot HbA1c a průměrné glykemie, ale také snížením glykemické variability, zkrácením doby strávené v hypoglykemii a delší dobou strávenou v cílovém rozmezí glykemie [14]. Studie COMISAIR z roku 2016 prokázala, že zásadním faktorem zlepšení metabolické kompenzace je primárně právě použití CGM, více než způsob intenzifikované léčby inzulinem [15]. Navazující studie publikovaná v minulém roce prokázala ve tříletém sledování zlepšení všech parametrů metabolické kompenzace diabetu jak u pacientů léčených intenzifikovaným inzulinovým režimem pery, tak u pacientů léčených inzulinovou pumpou [16].
K ověření efektu používání is CGM (jinak FGM) oproti tomu mnoho studií nemáme. Z dostupných zdrojů je patrné, že ve srovnání s monitorací glykemií glukometrem vede používání FGM k redukci výskytu hypoglykemií, aniž by došlo ke zhoršení dalších parametrů kompenzace (HbA1c, TIR). U osob s diabetem 2. typu existují studie potvrzující zlepšení parametrů kompenzace ve smyslu HbA1c [17] a také zkrácení doby strávené v hypoglykemii bez ohledu na hodnotu HbA1c nebo věk [18]. Oproti rt CGM chybí možnost proaktivního přístupu pacienta, který nemůže reagovat na alarmy a trendy, také z principu není možná kombinace FGM s inzulinovými pumpami s automatickou úpravou dávky inzulinu. Při porovnání efektu rutinního využívání rt CGM oproti FGM na metabolickou kompenzaci jednoznačně dominuje kontinuální monitorace v reálném čase. Randomizovaná klinická studie CORRIDA publikovaná v roce 2020 [11] prokázala lepší efekt rt CGM oproti FGM na parametry kompenzace (TIR) při jejich rutinním používání, a to nejen v klidu, ale i při fyzické aktivitě. Zajímavým poznatkem je, že při nepřetržitém používání obou typů CGM se obě skupiny stejně zlepšují z hlediska kompenzace a zvyšuje se kvalita jejich života [16].
Aktuální trendy v léčbě
inzulinovou pumpou
Inzulinové pumpy používáme v diabetologii už několik desetiletí a jejich využití se stále rozšiřuje. Oproti minulosti je v pediatrické populaci tato léčebná modalita stále více preferována, hlavně u nejmenších dětí ve věku do šesti let [19]. V České republice bylo v roce 2019 léčeno inzulinovou pumpou 25 % všech dětí s DM1 (Výroční zpráva registru dětského diabetu ČENDA za rok 2019). Principem léčby inzulinovou pumpou je intenzifikovaný režim bazál–bolus, kdy inzulinová pumpa dávkuje inzulin jednak kontinuálně formou bazální dávky (v jednotkách za hodinu), jednak ve formě bolusů v jednotkách inzulinu, které slouží buď na pokrytí jídel (prandiální bolusy), nebo na korekci glykemie (korekční bolusy). Bazální dávka je nastavena do časových pásem dle individuálních potřeb a věkově specifické diurnální potřeby inzulinu pacienta [20]. Bolusové dávky jsou ideálně nastavovány pomocí bolusového kalkulátoru s individualizovanými parametry (sacharidový poměr, citlivost, cílová glykemie), podle kterých pumpa vypočte bolusovou dávku inzulinu. Samozřejmostí je použití rychlých analog inzulinu, aby se zajistila co největší flexibilita úprav dávek inzulinu. U velmi malých dětí s minimální potřebou inzulinu někdy přistupujeme k ředění inzulinu pro zajištění jeho co nejpřesnějšího dávkování [19].
Propojením CGM a inzulinové pumpy vzniká systém „senzor a pumpa“ (SAP, Sensor Augmented Pump). Jejich propojení vedlo k vývoji funkcí automaticky upravujících dávku inzulinu dle aktuálních glykemií zachycených pomocí senzoru.
První generace inzulinových pump s automatickými funkcemi zahrnuje pumpy, které pomáhají snížení výskytu nebo prevenci rozvoje hypoglykemie. Prvním krokem byla funkce „nízké zastavení“ (LGS, Low Glucose Suspend), jejím principem je automatické zastavení bazální dávky inzulinu na dvě hodiny při dosažení nastaveného dolního limitu. Tato funkce prokazatelně snižuje dobu trvání hypoglykemie a byla k dispozici už u starší verze pumpy Medtronic VeoTM. Pokročilejší funkcí je „prediktivní zastavení“ (PLGS, Predictive Low Glucose Management), kdy při rychlém sestupu glykemie pumpa automaticky zastaví bazální dodávku inzulinu a při opětovném vzestupu ji zase obnoví. Cílem je zabránění vzniku hypoglykemie bez rizika následné hyperglykemie [21]. Na našem pracovišti jsme publikovali studii o jeho příznivém efektu při intenzivní fyzické aktivitě v podmínkách dětského diatábora [22]. Na našem trhu je pro tyto účely stále dostupná pumpa MiniMed 640G (Medtronic) nebo pumpa Tandem t:slim X2 se systémem Basal IQ.
Další kroky výzkumu vedly k uzavření okruhu systému inzulinová pumpa a CGM. V principu se jedná o systém složený z inzulinové pumpy a CGM propojených přes software, který pomocí individuálního algoritmu samostatně a kontinuálně upravuje dávky inzulinu ve formě bazálů, ale i automatických korekčních bolusů, a to dle aktuálních trendů glykemie měřených rt CGM. Vše se provádí automaticky, pacient s diabetem do procesu nezasahuje. Avšak co stále pacient musí provádět samostatně, je zadávání prandiálních bolusů před každým jídlem, ideálně pomocí bolusového kalkulátoru (proto název hybridní uzavřený systém, Hybrid Closed Loop, HCL). Aby tento systém fungoval flexibilně a rychle, je nutné v inzulinových pumpách dávkovat inzulin s co nejrychlejším nástupem účinku. Používáme tedy rychlá analoga a v budoucnu očekáváme i u dětí využití ultrarychlých inzulinových analog. Další nezbytností je zapojení nejpřesnějších CGM nové generace (Dexcom G6, Guardian 3), ideálně bezkalibračních.
Historicky první studie hodnotící HCL mimo nemocnici vznikla ze spolupráce dětských diabetologů z Izraele, Německa a Slovinska. Ti v roce 2013 publikovali výsledky úspěšného využití automatického řízení dodávky inzulinu pumpou podle koncentrace glukózy měřené CGM po dobu 24 hodin v podmínkách dětského diatábora [23].
Na výzkumu uzavřeného okruhu má také velký podíl profesor Roman Hovorka, český rodák působící ve výzkumném centru na univerzitě v Cambridgi. S ostatními spoluautory publikoval v roce 2014 studii, která prokázala bezpečné a účinné použití umělé slinivky v domácím prostředí během noci [24].
Po úspěšném a bezpečném testování uzavřeného okruhu v domácím prostředí schválil již v roce 2016 americký Úřad pro kontrolu potravin a léčiv (U.S. Food and Drug Administration, FDA) použití prvního oficiálního hybridního uzavřeného systému pro pacienty s DM1 (670G MiniMed – Medtronic, který však nebyl k dispozici v České republice), v následujících letech se přidávaly další systémy.
Od prosince 2020 můžeme v České republice u pacientů s DM1 používat dva oficiálně dostupné firemní algoritmy pokročilého HCL (Advanced Hybrid Closed Loop, AHCL), a to systém Control IQ pumpy Tandem T slim X2 a systém MiniMed 780G (Medtronic).
Tento oficiální vývoj v posledních několika letech předběhly pacientské organizace, které vyvinuly několik open source algoritmů pro HCL (např. OpenAPS a jeho varianta AndroidAPS, AAPS nebo Loop). Tyto algoritmy již několik let s úspěchem používají některé motivované skupiny pacientů, zvláště rodiče malých dětí. V roce 2018 jsme publikovali studii o úspěšném a bezpečném využití Open source HCL (AAPS) v podmínkách zvýšené fyzické aktivity na zimním dětském diatáboře [25], v současné době probíhají kroky k certifikaci tohoto algoritmu.
Několik studií publikovaných v posledních letech jednoznačně prokázalo pozitivní efekt HCL, a to jak na parametry kompenzace diabetu [26] – snížení hodnoty HbA1c, prodloužení doby strávené v cílovém rozmezí, zkrácení doby strávené v hypoglykemii i hyperglykemii – tak i na zlepšení kvality života pacientů [27]. U dětí je oficiální použití komerčně dostupných HCL zatím limitováno věkem nebo tělesnou hmotností (používání systému 780G schváleno u dětí starších 7 let, používání systému Control IQ je podmíněno hmotností vyšší než 25 kg a věkem vyšším než 6 let) a také celkovou denní dávkou inzulinu (systém 780G – inzulin > 8 j/den, Control IQ – inzulin > 10 j/den). Dle našich recentních zkušeností však věková ani hmotnostní hranice není limitující a v případě malé celkové denní dávky inzulinu používáme již výše zmíněný ředěný inzulin. Efektivitu i bezpečnost používání aktuálně dostupných HCL u dětí potvrzují nejrecentnější studie [28], studie zkoumající bezpečnost a efektivitu HCL u dětí mladších než šest let právě probíhají.
Závěr
Obecnými cíli léčby DM1, a tedy veškerou naší terapeutickou snahou je absence akutních komplikací diabetu a zabránění rozvoji pozdních komplikací prostřednictvím udržení dlouhodobě takřka normálních glykemií při zachování dobré kvality života.
Seznam použité literatury
- [1] Šumník Z, Venháčová J, Škvor J, et al.; ČENDA Project Group. Five years of improving diabetes control in Czech children after the establishment of the population‑based childhood diabetes register ČENDA. Pediatr Diabetes 2020; 21: 77–87.
- [2] Miller KM, Hermann J, Foster N, et al. T1D Exchange and DPV Registries Longitudinal Changes in Continuous Glucose Monitoring Use Among Individuals With Type 1 Diabetes: International Comparison in the German and Austrian DPV and U.S. T1D Exchange Registries. Diabetes Care 2020; 43: e1–e2.
- [3] Prázný M, Rušavý Z, Šumník Z, et al. Použití inzulinové pumpy a glukózových senzorů u pacientů s diabetem léčených inzulinem. DMEV 2019; 22: 152–169.
- [4] DCCT. Effect of intensive diabetes treatment on the development and progression of long‐term complications in adolescents with insulin‐dependent diabetes mellitus: diabetes control and complications trial. Diabetes control and complications trial research group. J Pediatr 1994; 125: 177–188.
- [5] DiMeglio LA, Acerini CL, Codner E, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Glycemic control targets and glucose monitoring for children, adolescents, and young adults with diabetes. Pediatr Diabetes 2018; 19: 105–114.
- [6] Battelino T, Danne T, Bergenstal RM, et al. Clinical Targets for Continuous Glucose Monitoring Data Interpretation: Recommendations From the International Consensus on Time in Range. Diabetes Care 2019; 42: 1593–1603.
- [7] Vigersky RA, McMahon C. The Relationship of Hemoglobin A1C to Time‑in‑Range in Patients with Diabetes. Diabetes Technol Ther 2019; 21: 81–85.
- [8] Beck RW, Bergenstal RM, Riddlesworth TD, et al. Validation of Time in Range as an Outcome Measure for Diabetes Clinical Trials. Diabetes Care 2019; 42: 400–405.
- [9] Zhou JJ, Coleman R, Holman RR, Reaven P. Long‑term glucose variability and risk of nephropathy complication in UKPDS, ACCORD and VADT trials. Diabetologia 2020; 63: 2482–2485.
- [10] Gorst C, Kwok CS, Aslam S, et al. Long‑term Glycemic Variability and Risk of Adverse Outcomes: A Systematic Review and Meta‑analysis. Diabetes Care 2015; 38: 2354–2369.
- [11] Hásková A, Radovnická L, Petruželková L, et al. Real‑time CGM Is Superior to Flash Glucose Monitoring for Glucose Control in Type 1 Diabetes: The CORRIDA Randomized Controlled Trial. Diabetes Care 2020; 43: 2744–2750.
- [12] Guillot FH, Jacobs PG, Wilson LM, et al. Accuracy of the Dexcom G6 Glucose Sensor during Aerobic, Resistance, and Interval Exercise in Adults with Type 1 Diabetes. Biosensors (Basel) 2020; 10: 138.
- [13] Sumnik Z, Szypowska A, Iotova V, et al.; SWEET study group. Persistent heterogeneity in diabetes technology reimbursement for children with type 1 diabetes: The SWEET perspective. Pediatr Diabetes. 2019; 20: 434–443.
- [14] Battelino T, Conget I, Olsen B, et al.; SWITCH Study Group. The use and efficacy of continuous glucose monitoring in type 1 diabetes treated with insulin pump therapy: a randomised controlled trial. Diabetologia 2012; 55: 3155–3162.
- [15] Šoupal J, Petruželková L, Flekač M, et al. Comparison of Different Treatment Modalities for Type 1 Diabetes, Including Sensor‑Augmented Insulin Regimens, in 52 Weeks of Follow‑Up: A COMISAIR Study. Diabetes Technol Ther 2016; 18: 532–538.
- [16] Šoupal J, Petruželková L, Grunberger G, et al. Glycemic Outcomes in Adults With T1D Are Impacted More by Continuous Glucose Monitoring Than by Insulin Delivery Method: 3 Years of Follow‑Up From the COMISAIR Study. Diabetes Care 2020; 43: 37–43.
- [17] Yaron M, Roitman E, Aharon‑Hananel G, et al. Effect of Flash Glucose Monitoring Technology on Glycemic Control and Treatment Satisfaction in Patients With Type 2 Diabetes. Diabetes Care 2019; 42: 1178–1184.
- [18] Haak T, Hanaire H, Ajjan R, et al. Flash Glucose‑Sensing Technology as a Replacement for Blood Glucose Monitoring for the Management of Insulin‑Treated Type 2 Diabetes: a Multicenter, Open‑Label Randomized Controlled Trial. Diabetes Ther 2017; 8: 55–73.
- [19] Danne T, Phillip M, Buckingham BA, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Insulin treatment in children and adolescents with diabetes. Pediatr Diabetes 2018; 19: 115–135.
- [20] Bachran R, Beyer P, Klinkert C, et al.; German/Austrian DPV Initiative; German Pediatric CSII Working Group; BMBF Competence Network Diabetes. Basal rates and circadian profiles in continuous subcutaneous insulin infusion (CSII) differ for preschool children, prepubertal children, adolescents and young adults. Pediatr Diabetes 2012; 13: 1–5.
- [21] Battelino T, Nimri R, Dovc K, et al. Prevention of Hypoglycemia With Predictive Low Glucose Insulin Suspension in Children With Type 1 Diabetes: A Randomized Controlled Trial. Diabetes Care 2017; 40: 764–770.
- [22] Petruzelkova L, Pickova K, Sumnik Z, et al. Effectiveness of SmartGuard Technology in the Prevention of Nocturnal Hypoglycemia After Prolonged Physical Activity. Diabetes Technol Ther 2017; 19: 299–304.
- [23] Phillip M, Battelino T, Atlas E, et al. Nocturnal glucose kontrol with an artificial pancreas at a diabetes camp. N Engl J Med 2013; 368: 824–833.
- [24] Hovorka R, Elleri D, Thabit H, et al. Overnight closed‑loop insulin delivery in young people with type 1 diabetes: a free‑living, randomized clinical trial. Diabetes Care 2014; 37: 1204–1211.
- [25] Petruzelkova L, Soupal J, Plasova V, et al. Excellent Glycemic Control Maintained by Open‑Source Hybrid Closed‑Loop AndroidAPS During and After Sustained Physical Activity. Diabetes Technol Ther 2018; 20: 744–750.
- [26] Boughton CK, Hovorka R. Is an artificial pancreas (closed‑loop system) for Type 1 diabetes effective? Diabet Med 2019; 36: 279–286.
- [27] Farrington C. Psychosocial impacts of hybrid closed‑loop systems in the management of diabetes: a review. Diabet Med 2018; 35: 436–449.
- [28] Tauschmann M, Allen JM, Nagl K, et al.; KidsAP Consortium. Home Use of Day‑and‑Night Hybrid Closed‑Loop Insulin Delivery in Very Young Children: A Multicenter, 3‑Week, Randomized Trial. Diabetes Care 2019; 42: 594–600.