Tocilizumab v léčbě revmatoidní artritidy
Tocilizumab je humanizovaná monoklonální protilátka proti receptoru pro interleukin 6, která blokuje účinky tohoto cytokinu. Při léčbě revmatoidní artritidy je tocilizumab podáván ve formě intravenózních infuzí v dávce 8 mg/kg v intervalu 4 týdny, obvykle v kombinaci s methotrexátem. V zemích EU je indikován k léčbě středně těžké až těžké aktivní revmatoidní artritidy (RA) u dospělých pacientů po selhání léčby nebo při intoleranci tradičních chorobu modifikujících léků nebo inhibitorů tumor nekrotizujícího faktoru a (TNF-a). V klinických studiích vedla léčba tocilizumabem ke snížení aktivity nemoci, ke zpomalení rtg progrese a ke zlepšení kvality života nemocných. Profil nežádoucích účinků je poměrně příznivý.
Úvod
Ovlivnění imunitního systému pomocí biologických léků přineslo v posledních deseti letech skutečný převrat v léčbě řady zánětlivých revmatických onemocnění. Zároveň se ukazuje, že ani tato účinná léčba nemá dostatečný klinický efekt u podstatné části nemocných a u některých pacientů je její podání z různých důvodů kontraindikováno [1]. Proto je i nadále nutné hledat nové cíle zásahu do imunitních procesů. Jednou z možností je blokáda účinků interleukinu 6 (IL-6). IL-6 je klíčový cytokin, který se podílí na regulaci imunitní odpovědi a zodpovídá za přechod z akutního do chronického zánětu [2]. Dysregulace IL-6 hraje zřejmě významnou roli v patogenezi řady autoimunitních onemocnění. U nemocných s revmatoidní artritidou je IL-6 přímo zodpovědný nejen za rozvoj chronického kloubního zánětu, ale i za celou řadu mimokloubních projevů tohoto onemocnění [3].
Mechanismus účinku
 IL-6 je tvořen především mononukleáry, fibroblasty a endoteliálními buňkami. Receptory pro IL-6 (IL-6R) na svém povrchu exprimují hepatocyty, T lymfocyty a aktivované B lymfocyty; ovšem účinek IL-6 není zdaleka omezen pouze na tyto buňky. Samotné navázání IL-6 na transmembránový receptor IL-6R, na rozdíl od běžného mechanismu mezibuněčné signalizace využívaného například cytokinem TNF- a , nestačí k převedení signálu. Teprve spojení komplexu IL-6/IL-6R s další molekulou přítomnou na povrchu buňky, která je označována jako transducer signálu gp130, vede k fosforylaci tyrozinu za účasti cytoplazmatických JAK tyrozinkináz (Janus family tyrosine kinases) a pomocí STAT3 (signal transducer and activator of transcription) k translokaci produktu do jádra, kde následně dochází k aktivaci přepisu patřičných genů. Molekula gp130 je přítomna ubikvitérně na povrchu buněk a je využívána i
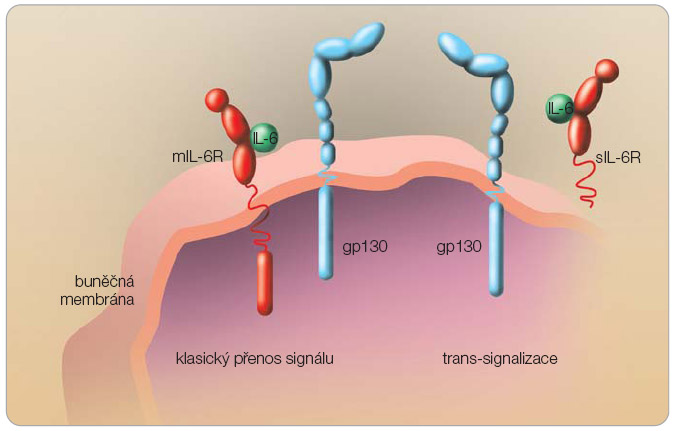
IL-6 je tvořen především mononukleáry, fibroblasty a endoteliálními buňkami. Receptory pro IL-6 (IL-6R) na svém povrchu exprimují hepatocyty, T lymfocyty a aktivované B lymfocyty; ovšem účinek IL-6 není zdaleka omezen pouze na tyto buňky. Samotné navázání IL-6 na transmembránový receptor IL-6R, na rozdíl od běžného mechanismu mezibuněčné signalizace využívaného například cytokinem TNF- a , nestačí k převedení signálu. Teprve spojení komplexu IL-6/IL-6R s další molekulou přítomnou na povrchu buňky, která je označována jako transducer signálu gp130, vede k fosforylaci tyrozinu za účasti cytoplazmatických JAK tyrozinkináz (Janus family tyrosine kinases) a pomocí STAT3 (signal transducer and activator of transcription) k translokaci produktu do jádra, kde následně dochází k aktivaci přepisu patřičných genů. Molekula gp130 je přítomna ubikvitérně na povrchu buněk a je využívána i 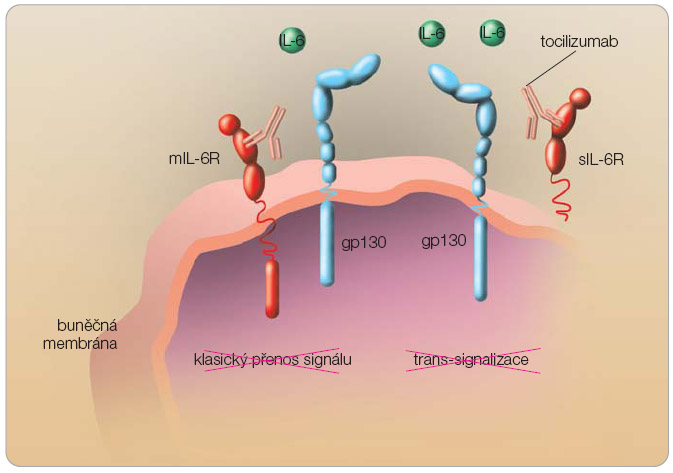 dalšími cytokiny z rodiny IL-6. Kromě transmembránové formy (mIL-6R) se IL-6R vyskytuje i v solubilní formě. Vazba IL-6 na solubilní IL-6R (sIL-6R) vytváří stimulační komplex, který navázáním na gp130 aktivuje i buňky neexprimující na svém povrchu transmembránové IL-6R. Jde o tzv. trans-signalizaci [4]. Přenos signálu IL-6 viz obr. 1 . Tocilizumab je humanizovaná monoklonální protilátka proti receptoru IL-6, která se váže s vysokou afinitou na transmembránovou i solubilní formu IL-6R. Vazba zabraňuje vzniku komplexu IL-6/IL-6R, a tím blokuje přenos signálu IL-6 ( obr. 2 ).
dalšími cytokiny z rodiny IL-6. Kromě transmembránové formy (mIL-6R) se IL-6R vyskytuje i v solubilní formě. Vazba IL-6 na solubilní IL-6R (sIL-6R) vytváří stimulační komplex, který navázáním na gp130 aktivuje i buňky neexprimující na svém povrchu transmembránové IL-6R. Jde o tzv. trans-signalizaci [4]. Přenos signálu IL-6 viz obr. 1 . Tocilizumab je humanizovaná monoklonální protilátka proti receptoru IL-6, která se váže s vysokou afinitou na transmembránovou i solubilní formu IL-6R. Vazba zabraňuje vzniku komplexu IL-6/IL-6R, a tím blokuje přenos signálu IL-6 ( obr. 2 ).
Farmakodynamika a farmakokinetika
K dosažení maximální saturace sIL-6R in vivo dochází při koncentraci tocilizumabu v séru vyšší než 1 m g/ml [5]. Ovšem přenos signálu IL-6 je blokován po celou dobu, kdy je v séru přítomen volný tocilizumab [6]. Po intravenózním podání prochází tocilizumab bifázickou eliminací z cirkulace. Na koncentraci závislá nelineární clearance hraje hlavní roli ve snižování koncentrací tocilizumabu. Při vyšších koncentracích tocilizumabu dochází k saturaci nelineární clearance a eliminaci léčiva pak určuje hlavně lineární clearance. Biologický poločas (t 1/2 ) tocilizumabu je proto závislý na koncentraci. Po podání první dávky 8 mg/kg byl průměrný t 1/2 160,2 hodiny. Po aplikaci tří dávek tozilizumabu dochází k prodloužení průměrného t 1/2 na 242 hodin, což odpovídá t 1/2 lidského imunoglobulinu [7]. Při léčbě revmatoidní artritidy je tocilizumab podáván ve formě intravenózních infuzí v dávce 8 mg/kg v intervalu 4 týdny. Na hladinu tocilizumabu nemá vliv současné podávání methotrexátu, NSA nebo kortikoidů [8].
Klinická hodnocení
První ověření bezpečnosti a účinnosti léčby tocilizumabem poskytlo několik klinických hodnocení studií I. a II. fáze klinického zkoušení, která probíhala v Japonsku a v Evropě [6, 9–11]. První údaje o příznivém vlivu léčby tocilizumabem na rtg progresi revmatoidní artritidy poskytla japonská studie SAMURAI [12]. Pro schválení podávání tocilizumabu pacientům s RA byly nejdůležitější výsledky pěti souběžně provedených klinických hodnocení s obdobným designem, které prokázaly účinnost přípravku u různých skupin nemocných.
Do studie OPTION (T O cilizumab P ivotal T rial in Methotrexate I nadequate resp ON ders) bylo zařazeno celkem 623 nemocných s nedostatečnou odpovědí na léčbu methotrexátem (MTX) [13]. Nemocní ke své zavedené léčbě MTX ve stabilní dávce 10–25 mg týdně dostávali navíc tocilizumab v dávce 8 mg/kg (n = 205), v dávce 4 mg/kg (n = 214) nebo placebo (n = 204). Odpovědi ACR20 (podíl pacientů, kteří dosáhli nejméně 20% zlepšení příznaků podle kritérií American College of Rheumatology) ve 24. týdnu léčby dosáhlo 120 nemocných (59 %) léčených tocilizumabem v dávce 8 mg/kg, 102 (48 %) nemocných léčených tocilizumabem v dávce 4 mg/kg a 54 (26 %) nemocných z kontrolní skupiny (odds ratio 4,0; 95% confidence interval 2,6–6,1; p < 0,0001 pro tocilizumab 8 mg vs. placebo). Odpovědi ACR70 a remise podle kritérií DAS28 (Disease Activity Score – vypovídá o aktivitě onemocnění u vybraných 28 kloubů) dosáhlo ve skupině pacientů léčených 8 mg/kg 45 (22 %) a 47 (27 %) nemocných, ve skupině pacientů léčených 4 mg/kg 26 (12 %) a 21 (13 %) nemocných a ve skupině kontrolní dosáhli tohoto skóre 4 (2 %) pacienti a 1 (0,8 %) pacient (p < 0,0001).
Ve studii T OWARD (Tocilizumab in c O mbination W ith traditional DM ARD therapy) bylo celkem 1220 nemocných s RA po selhání léčby různými chorobu modifikujícími léky (DMARD) randomizováno v poměru 2 : 1 k léčbě tocilizumabem v dávce 8 mg/kg nebo placebem po dobu 24 týdnů [14]. Ve 24. týdnu dosáhlo odpovědi ACR20 61 % nemocných léčených tocilizumabem a 25 % nemocných v kontrolní skupině. ACR50 a ACR70 dosáhlo 38 % a 21 % nemocných léčených tocilizumabem ve srovnání s 9 % a 3 % pacientů v kontrolní skupině (p < 0,0001).
Cílem klinického hodnocení RADIATE ( R heum A toi D Arthritis Study i n A nti- T NF Failur E s) bylo prokázat účinnost tocilizumabu po selhání léčby anti TNF- a [15]. Celkem 499 nemocných s aktivní chronickou RA trvající průměrně 11–13 let, u nichž selhala léčba jedním nebo více inhibitory TNF- α , bylo randomizováno k léčbě tocilizumabem v dávce 4 mg/kg, 8 mg/kg nebo i.v. placebem v kombinaci s MTX (průměrná dávka 16 mg týdně). Odpovědi ACR20 dosáhlo ve 24. týdnu 50 % nemocných léčených dávkou 8 mg/kg, 30,4 % nemocných léčených dávkou 4 mg/kg a 10,1 % nemocných v kontrolní skupině. Nebyl zjištěn žádný vztah mezi odpovědí a celkovým počtem nebo posledním podávaným blokátorem TNF- α .
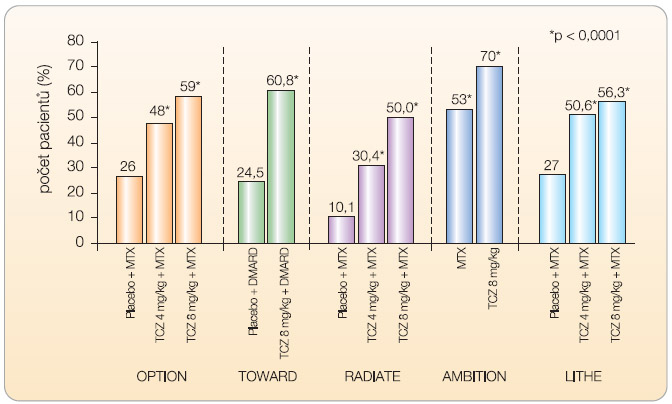 Zlatým standardem v léčbě RA zůstává i v současné době methotrexát. V klinickém hodnocení AMBITION (The A ctemra versus M ethotrexate double- B lind I nvestigative T rial I n m ON otherapy) byla u 572 nemocných srovnávána účinnost monoterapie tocilizumabem v dávce 8 mg/kg s monoterapií MTX v dávce 20 mg týdně [16]. Ve 24. týdnu dosáhlo odpovědi ACR20, ACR50 a ACR70 70 %, 44 % a 28 % nemocných léčených tocilizumabem ve srovnání s 53 %, 34 % a 15 % nemocných dostávajících MTX. Remise RA podle kritérií DAS28 dosáhlo 34 % nemocných ze skupiny
Zlatým standardem v léčbě RA zůstává i v současné době methotrexát. V klinickém hodnocení AMBITION (The A ctemra versus M ethotrexate double- B lind I nvestigative T rial I n m ON otherapy) byla u 572 nemocných srovnávána účinnost monoterapie tocilizumabem v dávce 8 mg/kg s monoterapií MTX v dávce 20 mg týdně [16]. Ve 24. týdnu dosáhlo odpovědi ACR20, ACR50 a ACR70 70 %, 44 % a 28 % nemocných léčených tocilizumabem ve srovnání s 53 %, 34 % a 15 % nemocných dostávajících MTX. Remise RA podle kritérií DAS28 dosáhlo 34 % nemocných ze skupiny 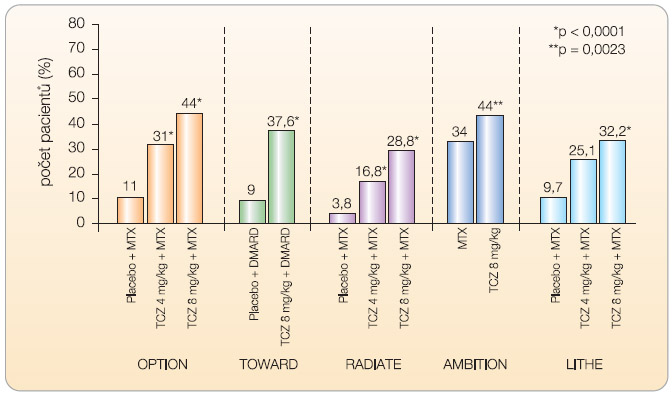 léčené tocilizumabem a 12 % nemocných v kontrolní skupině. Toto klinické hodnocení je první, které prokázalo při léčbě RA vyšší účinost biologického léku v porovnání s MTX. Zatím pouze ve formě abstraktu jsou k dispozici výsledky studie LITHE (Toci LI zumab safety and THE prevention of structural joint damage trial), která byla zaměřena na ovlivnění rentgenové progrese u nemocných s RA [17]. Při hodnocení rentgenové progrese onemocnění pomocí Genantovy modifikace
léčené tocilizumabem a 12 % nemocných v kontrolní skupině. Toto klinické hodnocení je první, které prokázalo při léčbě RA vyšší účinost biologického léku v porovnání s MTX. Zatím pouze ve formě abstraktu jsou k dispozici výsledky studie LITHE (Toci LI zumab safety and THE prevention of structural joint damage trial), která byla zaměřena na ovlivnění rentgenové progrese u nemocných s RA [17]. Při hodnocení rentgenové progrese onemocnění pomocí Genantovy modifikace 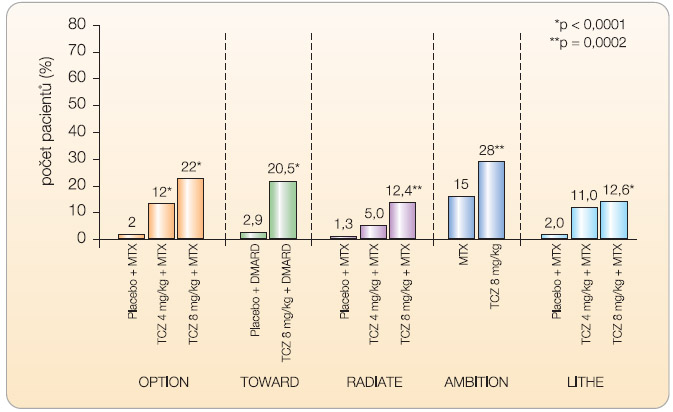 Sharpova skóre v týdnu 52 byla progrese nemocných léčených tocilizumabem statisticky významně menší než u nemocných v kontrolní skupině (0,3, 0,3 a 1,1; p < 0,0001). Po roce sledování bylo bez rentgenové progrese 85 % nemocných léčených dávkou 8 mg/kg, 81 % léčených dávkou 4 mg/kg a 67 % nemocných v kontrolní skupině. Definitivní výsledky studie LITHE budou k dispozici po ukončení dvouletého sledování nemocných. Výsledky klinických hodnocení III. fáze znázorňují graf 1 , 2 a graf 3 .
Sharpova skóre v týdnu 52 byla progrese nemocných léčených tocilizumabem statisticky významně menší než u nemocných v kontrolní skupině (0,3, 0,3 a 1,1; p < 0,0001). Po roce sledování bylo bez rentgenové progrese 85 % nemocných léčených dávkou 8 mg/kg, 81 % léčených dávkou 4 mg/kg a 67 % nemocných v kontrolní skupině. Definitivní výsledky studie LITHE budou k dispozici po ukončení dvouletého sledování nemocných. Výsledky klinických hodnocení III. fáze znázorňují graf 1 , 2 a graf 3 .
Nežádoucí účinky a kontraindikace
Závažné infuzní reakce jsou při podávání tocilizumabu vzácné. Stejně jako blokátory TNF- a zvyšuje i léčba tocilizumabem incidenci infekcí. Díky svému mechanismu účinku ale nezvyšuje riziko TBC. Dostupná data nesvědčí pro vzrůst incidence maligních onemocnění. Tocilizumab může vyvolávat elevaci transamináz, která je obvykle přechodná. V průběhu klinických hodnocení nebyly zaznamenány případy závažného postižení jater. Již v průběhu prvních klinických hodnocení s tocilizumabem byla u některých 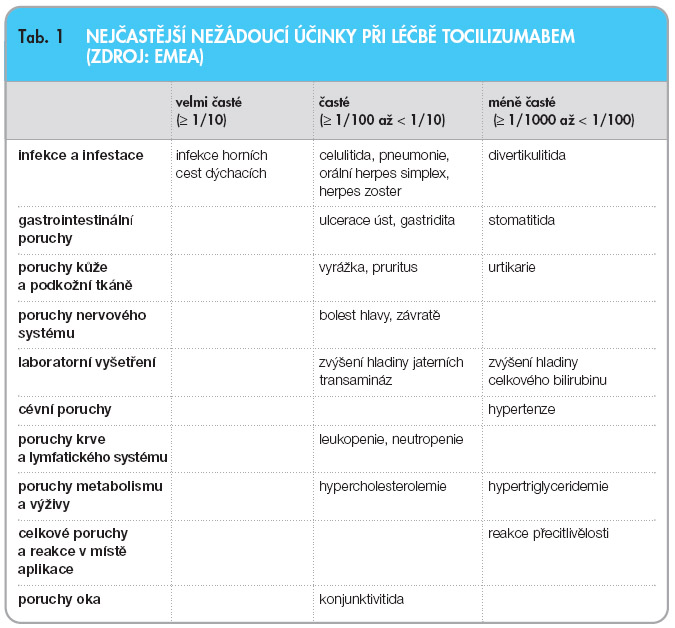 nemocných zjištěna elevace celkového cholesterolu, která obvykle není spojena se změnami aterogenního indexu. Vliv těchto změn na riziko kardiovaskulárních onemocnění zatím není jasný [18]. Tocilizumab příznivě ovlivňuje anémii spojenou s chronickým zánětem. U části nemocných může léčba vyvolávat neutropenii, která je většinou mírná a odezní i při pokračování léčby [19]. U nemocných léčených tocilizumabem nebyl prokázán vztah mezi neutropenií a rizikem infekcí. Při léčbě tocilizumabem je třeba věnovat zvýšenou pozornost riziku perforací gastrointestinálního traktu, zvláště u nemocných s divertikulózou. Nejčastější nežádoucí účinky v průběhu léčby tocilizumabem shrnuje tab. 1 .
nemocných zjištěna elevace celkového cholesterolu, která obvykle není spojena se změnami aterogenního indexu. Vliv těchto změn na riziko kardiovaskulárních onemocnění zatím není jasný [18]. Tocilizumab příznivě ovlivňuje anémii spojenou s chronickým zánětem. U části nemocných může léčba vyvolávat neutropenii, která je většinou mírná a odezní i při pokračování léčby [19]. U nemocných léčených tocilizumabem nebyl prokázán vztah mezi neutropenií a rizikem infekcí. Při léčbě tocilizumabem je třeba věnovat zvýšenou pozornost riziku perforací gastrointestinálního traktu, zvláště u nemocných s divertikulózou. Nejčastější nežádoucí účinky v průběhu léčby tocilizumabem shrnuje tab. 1 .
Shrnutí
Tocilizumab je nový lék pro léčbu revmatoidní artritidy s unikátním mechanismem účinku. Podle doporučení evropské agentury EMEA je tocilizumab indikován v kombinaci s methotrexátem (případně v monoterapii) k léčbě středně těžké až těžké aktivní revmatoidní artritidy u dospělých pacientů, kteří na předchozí terapii jedním nebo více tradičními DMARD nebo inhibitory TNF- α neodpovídali dostatečně nebo tuto léčbu netolerovali [8]. Tocilizumab se podává ve formě intravenózních infuzí v dávce 8 mg/kg i.v. každé 4 týdny.
Seznam použité literatury
- [1] Voll RE, Kalden JR. Do we need new treatment that goes beyond tumor necrosis factor blockers for rheumatoid arthritis? Ann N Y Acad Sci 2005; 1051: 799–810.
- [2] Romano M, Sironi M, Toniatti C, et al. Role of IL-6 and its soluble receptor in induction of chemokines and leukocyte recruitment. Immunity 1997; 6: 315–325.
- [3] Nishimoto N. Interleukin-6 in rheumatoid arthritis. Curr Opin Rheumatol 2006;18: 277–281.
- [4] Kishimoto T. The biology of interleukin-6. Blood 1989: 74: 1–10.
- [5] Ohsugi Y, Kishimoto T. The recombinant humanized anti-IL-6 receptor antibody tocilizumab, an innovative drug for the treatment of rheumatoid arthritis. Expert Opin Biol Ther 2008; 8: 669–681.
- [6] Nishimoto N, Yoshizaki K, Maeda K, et al. Toxicity, pharmacokinetics, and dose-finding study of repetitive treatment with the humanized anti-interleukin 6 receptor antibody MRA in rheumatoid arthritis. Phase I/II clinical study. J Rheumatol 2003; 30: 1426–1435.
- [7] Oldfield V, Dhillon S, Plosker GL. Tocilizumab: a review of its use in the management of rheumatoid arthritis. Drugs 2009; 69: 609–632.
- [8] www.emea.europa.eu
- [9] Choy EH, Isenberg DA, Garood T, et al. Therapeutic benefit of blocking interleukin-6 activity with an anti-interleukin-6 receptor monoclonal antibody in rheumatoid arthritis: a randomized, double-blind, placebo-controlled, dose-escalation trial. Arthritis Rheum 2002; 46: 3143–3150.
- [10] Nishimoto N, Yoshizaki K, Miyasaka N, et al. Treatment of rheumatoid arthritis with humanized anti-interleukin-6 receptor antibody: a multicenter, double-blind, placebo-controlled trial. Arthritis Rheum 2004; 50: 1761–1769.
- [11] Maini RN, Taylor PC, Szechinski J, et al. Double-blind randomized controlled clinical trial of the interleukin-6 receptor antagonist, tocilizumab, in European patients with rheumatoid arthritis who had an incomplete response to methotrexate. Arthritis Rheum 2006; 54: 2817–2829.
- [12] Nishimoto N, Hashimoto J, Miyasaka N, et al. Study of active controlled monotherapy used for rheumatoid arthritis, an IL-6 inhibitor (SAMURAI): evidence of clinical and radiographic benefit from an x ray reader-blinded randomised controlled trial of tocilizumab. Ann Rheum Dis 2007; 66: 1162–7306.
- [13] Smolen JS, Beaulieu A, Rubbert-Roth A, et al. Effect of interleukin-6 receptor inhibition with tocilizumab in patients with rheumatoid arthritis: a double-blind, placebo-controlled, randomised trial. Lancet 2008; 371: 987–997.
- [14] Genovese MC, McKay JD, Nasonov EL, et al. Interleukin-6 receptor inhibition with tocilizumab reduces disease activity in rheumatoid arthritis with inadequate response to disease-modifying antirheumatic drugs: the tocilizumab in combination with traditional disease-modifying antirheumatic drug therapy study. Arthritis Rheum 2008; 58: 2968–2980.
- [15] Emery P, Keystone E, Tony HP, et al. IL-6 receptor inhibition with tocilizumab improves treatment outcomes in patients with rheumatoid arthritis refractory to anti-tumour necrosis factor biologicals: results from a 24-week multicentre randomised placebo-controlled trial. Ann Rheum Dis 2008; 67: 1516–1523.
- [16] Jones G, Sebba A, Gu J, et al. Comparison of tocilizumab monotherapy versus methotrexate monotherapy in patients with moderate to severe rheumatoid arthritis: The AMBITION study. Ann Rheum Dis 2009 Mar 17. [Epub ahead of print]
- [17] Kremer JM, Fleischmann RM, Halland AM. Tocilizumab Inhibits Structural Joint Damage in Rheumatoid Arthritis Patients with an Inadequate Response to Methotrexate. Abstract L14 ACR 2008.
- [18] Choy E, Sattar N. Interpreting lipid levels in the context of high-grade inflammatory states with a focus on rheumatoid arthritis: a challenge to conventional cardiovascular risk actions. Ann Rheum Dis 2009; 68: 460–469.
- [19] Smolen JS, Beaulieu AD, Dikranian A, et al. Safety of Tocilizumab in Patients with Rheumatoid Arthritis: Pooled Analysis of Five Phase 3 Clinical Trials Arthritis Rheum 2008; 58: S784.