Farmakoterapie COVID‑19
Pracovní skupina České odborné společnosti klinické farmacie (ČOSKF) ČLS JEP ve složení výše uvedených autorek vypracovala v reakci na aktuální situaci dokument k farmakoterapii onemocnění COVID 19, verze 13, k 31. lednu 2021. Tento text respektuje následující dokument: Kümpel P, Holub M, Roháčová H, Plíšek S. Doporučený postup Společnosti infekčního lékařství (SIL) ČLS JEP léčby pacientů s onemocněním COVID 19 (vydáno 4. 12. 2020; dostupné na: https://www.infekce.cz/zprava20 132.htm). Oproti původním doporučením lze nyní v běžné klinické praxi podávat pouze medikaci uvedenou v doporučeném postupu SIL. Jiná léčiva mohou být použita jen v rámci studií. Cílem dokumentu ČOSKF je zhodnotit v krátkém souhrnu podávání doporučených léčiv ve specifických situacích, které mohou v klinické praxi nastat, a které přitom nejsou ve výše uvedeném dokumentu podrobně řešeny.
Remdesivir
Renální insuficience, náhrada funkce ledvin
Výrobce uvádí, že u pacientů s renální insuficiencí nebyla farmakokinetika remdesiviru studována, že pacientům s odhadovanou glomerulární filtrací (eGFR) ≥ 30 ml/min byl remdesivir podáván bez úpravy dávkování a že pacientům s eGFR < 30 ml/min není remdesivir doporučeno podávat. Nicméně, podíl pacientů s těžší renální insuficiencí (akutní či chronickou) je nezanedbatelný. V terénu renální insuficience lze očekávat kumulaci látek s významnou renální složkou eliminace, a to hlavního defosforylovaného metabolitu remdesiviru (GS 441524) a také pomocné látky sulfobutyléter beta cyklodextrinu, resp. sulfobutoxybetadexu (SBECD).
Důsledky kumulace metabolitu
GS 441524 nejsou známy. Recentní malá retrospektivní
hodnocení naznačují, že podání remdesiviru je bezpečné
i u pacientů s GFR < 30 ml/min –
podání remdesiviru u nich nevedlo ke zvýšení sérové
koncentrace kreatininu ani k těžké hepatotoxicitě. Pokud jde
o pacienty závislé na intermitentní hemodialýze (IHD),
farmakokinetika remdesiviru a jeho metabolitu GS 441524
byla řešena v rámci kazuistických sdělení. Ta ukazují, že
plazmatické koncentrace jak remdesiviru, tak metabolitu GS 441524
mohou být zvýšené, nedochází však k jejich významné
kumulaci.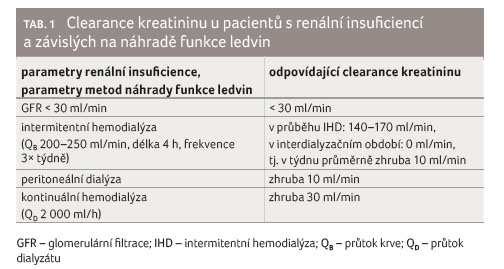
Rozebereme li, metabolit GS 441524, který má malou molekulu (molekulová hmotnost 292,26 g/mol) a minimální vazbu na bílkoviny (přibližně 2 %), je dialýzou účinně odstraňován. Během tří až pětihodinové IHD s průtokem krve [QB] 200‒250 ml/min stoupá clearance kreatininu na 140‒170 ml/min. V interdialyzačním období pak opět klesá a blíží se nule. Při třech čtyřhodinových IHD týdně tak průměrná clearance kreatininu v týdnu činí zhruba 10 ml/min. Lze proto předpokládat, že i u pacientů s renální insuficiencí s clearance kreatininu alespoň 10 ml/min, ev. u pacientů na jakékoliv náhradě funkce ledvin, která zajistí clearance kreatininu alespoň 10 ml/min (viz tab. 1), je krátkodobé podávání remdesiviru v doporučeném dávkování (1. den 1 200 mg, dále 1 100 mg, celkem 5 dnů) možné.
U pacientů léčených IHD je nutné vhodně časovat podání léčiva s ohledem na provedení IHD – ta by měla být zahájena nejdříve za 3‒4 hodiny po podání remdesiviru, aby mohla proběhnout potřebná distribuce remdesiviru do tkání a intracelulárně. Obecně lze tedy doporučit podání remdesiviru po provedení IHD.
Pokud jde o cyklodextriny, pak zejména přirozeně se vyskytující cyklodextriny jsou spojovány s toxickým působením – nejčastěji s nefrotoxicitou, nicméně také s hepatotoxicitou a s postižením dalších orgánů. SBECD je synteticky modifikovaný cyklodextrin, který je ionizovaný, bez dispozice k reabsorpci a intracelulární koncentraci v renálních tubulech – tudíž teoreticky s nižším nefrotoxickým potenciálem. V rámci preklinických zkoušek byly popsány na dávce závislé, většinou reverzibilní histologické změny bez dopadu na funkci ledvin. Na základě klinických studií provedených s injekčním přípravkem obsahujícím vorikonazol se zdá, že podání přípravku se SBECD není rizikovým faktorem pro zhoršení renálních funkcí u pacientů s preexistující renální insuficiencí (pozn. ‒ injekční přípravek s vorikonazolem obsahuje množství SBECD srovnatelné s množstvím v přípravku s remdesivirem).
Intermitentní hemodialýza s běžnými parametry (high fluxová membrána, průtok krve [QB] 250 ml/min) a zřejmě ani kontinuální hemodialýza (průtok dialyzátu [QD] 2 000 ml/h) nejsou schopny odstraňovat SBECD zdaleka tak účinně jako zdravé ledviny. Efektivní by však mohly být jiné kontinuální metody, konkrétně hemofiltrace nebo hemodiafiltrace (v závislosti na výši průtoku ultrafiltrátu [QUF]).
Při posuzování poměru rizika a prospěchu je třeba vzít v úvahu dostupnost terapeutických alternativ (zde t. č. prakticky žádné – pokud pacient přijímá per os, lze zvážit favipiravir), délku terapie (zde relativně krátká – 5 dnů), souběžné podávání jiných injekčních přípravků se SBECD (např. Vfend), tíži renální insuficience (anurická ledvina je před působením SBECD relativně chráněna).Zdroje
[1] Aiswarya D, Arumugam V, Dineshkumar T, et al. Use of Remdesivir in Patients With COVID-19 onHemodialysis: A Study of Safety and Tol- erance. Kidney Int Rep 2020 Dec 18; doi:
10.1016/j.ekir.2020.12.003. Epub ahead of print.
[2] Hafner V, Czock D, Burhenne J, et al. Pharmacokinetics of sulfo-
butylether-beta-cyclodextrin and voriconazole in patients with end-stage renal failure during
treatment with two hemodialysis systems and hemodiafiltration. Antimicrob Agents Chemother 2010;
54: 2596 ‒2602.
[3] Kiser TH, Fish DN, Aquilante CL, et al. Evaluation of sulfobutylether-
-β-cyclodextrin (SBECD) accumulation and voriconazole pharmaco- kinetics in critically ill patients
undergoing continuous renal replace- ment therapy. Crit Care 2015; 19: 32.
[4] Lê MP, Le Hingrat Q, Jaquet P, et al. Removal of Remdesivir’s Me- tabolite GS-441524 by
Hemodialysis in a Double Lung Transplant Recipient with COVID-19. Antimicrob Agents Chemother 2020;
64: e01521‒20.
[5] Luke DR, Tomaszewski K, Damle B, Schlamm HT. Review of the ba- sic and clinical pharmacology
of sulfobutylether-beta-cyclodextrin (SBECD). J Pharm Sci 2010; 99: 3291‒3301.
[6] Remdesivir: Drug information. Uptodate [navštíveno 31. 1. 2021].
[7] Sörgel F, Malin JJ, Hagmann H, et al. Pharmacokinetics of remdesivir in a COVID-19 patient
with end-stage renal disease on intermittent haemodialysis. J Antimicrob Chemother 2020 Nov 30:
dkaa500; doi:
10.1093/jac/dkaa500. Epub ahead of print.
[8] Turner RB, Martello JL, Malhotra A. Worsening renal function in patients with baseline renal
impairment treated with intravenous voriconazole: A systematic review. Int J Antimicrob Agents
2015; 46:
362‒366.
[9] Veklury: Souhrn údajů o přípravku [navštíveno 31. 1. 2021]. Dostupné na:
https://www.ema.europa.eu/en/documents/product-informa-
tion/veklury-epar-product-information_cs.pdf
Hepatální
insuficience
Výrobce uvádí, že u pacientů s poruchou funkce jater nebyla farmakokinetika remdesiviru studována a že u těchto pacientů lze remdesivir použít pouze v případě, že potenciální přínos převáží riziko; není přitom známo, zda je potřeba upravit dávkování. S ohledem na případy elevace hodnoty aminotransferázy reportované v rámci klinických hodnocení provedených s remdesivirem nemá být podávání remdesiviru zahájeno při elevaci hodnoty alaninaminotransferázy (ALT) nad pětinásobek horní hranice normy. Dále je třeba podávání remdesiviru přerušit při vzestupu hodnoty ALT nad pětinásobek horní hranice normy (při poklesu hodnoty ALT pod pětinásobek horní hranice normy lze v terapii opět pokračovat) nebo pokud je zvýšená hodnota ALT doprovázena příznaky zánětu jater či elevací hodnot konjugovaného bilirubinu, alkalické fosfatázy (ALP) nebo mezinárodního normalizovaného poměru (INR).
Podle jiných zdrojů (americký Úřad pro kontrolu potravin a léčiv, FDA, databáze Uptodate či Livertox) je doporučeno přerušit podávání remdesiviru až při vzestupu hodnoty ALT nad desetinásobek horní hranice normy.
Zvýšení hodnoty aminotransferázy při terapii remdesivirem není neobvyklé – může se jednat o přímé toxické působení léčiva navozené inhibicí mitochondriální RNA polymerázy. Idiosynkratická reakce spojená s podáním remdesiviru nebyla dosud jasně prokázána.
Vzestup hodnot jaterních testů může mít rovněž nelékové příčiny. Samotný virus SARS CoV 2 může infikovat játra – související poškození jater však bývá pouze mírné. Vliv na elevaci hodnot jaterních testů pak může mít i případný septický stav pacienta atd.
[1] Remdesivir: Drug information. Uptodate [navštíveno 31. 1. 2021].
[2] Remdesivir. LiverTox: Clinical and Research Information on Drug-In- duced Liver Injury
[navštíveno 31. 1. 2021]. Dostupné na: https:// www.ncbi.nlm.nih.gov/books/NBK564049/
[3] Veklury: Highlights of Prescribing Information. Publikováno: 22. 10.
2020. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_
docs/label/2020/214787Orig1s000lbl.pdf
[4] Veklury: Souhrn údajů o přípravku [navštíveno 31. 1. 2021]. Dostupné na:
https://www.ema.europa.eu/en/documents/product-informa-
tion/veklury-epar-product-information_cs.pdf
Extrakorporální
membránová oxygenace
Při rozhodování o zahájení léčby remdesivirem u pacienta léčeného extrakorporální membránovou oxygenací (ECMO) je třeba nejprve kriticky zvážit indikaci tohoto léčiva.
Pokud je remdesivir indikován, je nutno počítat s tím, že u pacientů na ECMO nebyla farmakokinetika remdesiviru studována. Při hodnocení možných změn farmakokinetiky je třeba vzít v úvahu následující skutečnosti:
- remdesivir je lipofilní léčivo (hodnota rozdělovacího koeficientu [logP] v závislosti na zdroji 2,01, resp. 2,2),
- vazba na bílkoviny – remdesivir (proléčivo) 88 %, hlavní metabolit GS 441524 pouze přibližně 2 %,
- plazmatický poločas – remdesivir přibližně 1 h (tj. krátký), GS 441524 25,3 h (tj. podstatně delší), farmakodynamicky aktivní trifosforylovaný metabolit GS 443902 přibližně 43,4 h,
- maximální koncentrace v plazmě (cmax) v rovnovážném stavu – remdesivir 2,23 mg/l, GS 441524 0,14 mg/l,
- distribuční objem – údaje nejsou známy, lze však předpokládat velký distribuční objem (viz lipofilní charakter léčiva, distribuce do intracelulárního prostoru), k odhadu lze použít vzorec Vd = D / cp (Vd = distribuční objem, D = dávka, cp = plazmatická koncentrace),
- plazmatická clearance – remdesivir 1 171 ml/min.
Shrneme li, remdesivir disponuje vlastnostmi, které byly identifikovány jako rizikové z hlediska možné sekvestrace léčiva v mimotělním okruhu (lipofilita, vyšší vazba na bílkoviny), nelze proto vyloučit potřebu podávat vyšší dávky. Nicméně, skutečná změna distribučního objemu remdesiviru u pacientů na ECMO není známa. S ohledem na velmi krátký plazmatický poločas a rychlou plazmatickou clearance remdesiviru, které vypovídají o rychlé distribuci do tkání a intracelulárně, se do doby, než budou provedeny odpovídající studie, přikláníme k podávání remdesiviru ve standardním dávkování.
Zdroje[1] Remdesivir. DrugBank [navštíveno 30. 9. 2020]. Dostupné na: https://
go.drugbank.com/drugs/DB14761
[2] Veklury: EPAR – Public assessment report. Publikováno: 25. 6. 2020.
Dostupné na: https://www.ema.europa.eu/en/documents/assess-
ment-report/veklury-epar-public-assessment-report_en.pdf
Těhotenství
Výrobce uvádí, že údaje o použití remdesiviru u těhotných žen jsou omezené (nízký počet žen v programu Compassionate Use), že studie reprodukční toxicity na zvířatech jsou nedostatečné a že remdesivir lze v těhotenství použít pouze tehdy, když tuto léčbu vyžaduje klinický stav ženy.
V rámci programu Compassionate Use byl remdesivir zatím podáván pouze 67 těhotným ženám, a to ve standardním dávkování. Dvanáct žen užívalo remdesivir v období do 24. týdne těhotenství, 44 žen ve 24.‒32. týdnu těhotenství, 11 žen v období od 32. týdne těhotenství dále. Nežádoucí účinky byly obdobné jako u netěhotných žen. Kvůli výskytu nežádoucích účinků byla terapie přerušena u 10 % těhotných žen (nejčastěji z důvodu elevace hodnot jaterních testů).
Těhotenství je podle Centers for Disease Control and Prevention považováno za vysoce rizikový zdravotní stav. Riziko závažného onemocnění vyvolaného infekcí COVID 19 je u těhotných pacientek zvýšeno. Pokud je potřeba, použití remdesiviru by nemělo být těhotným ženám odepřeno.
Zdroje[1] Burwick RM, Yawetz S, Stephenson KE, et al. Compassionate Use of Remdesivir in Pregnant
Women with Severe Covid-19. Clin Infect Dis. 2020 Oct 8: ciaa1466; doi: 10.1093/cid/ciaa1466. Epub
ahead of print.
[2] Centers for Disease Control and Prevention. Considerations for In- patient Obstetric
Healthcare Settings. Aktualizováno: 1. 12. 2020. Dostupné na:
https://www.cdc.gov/coronavirus/2019-ncov/hcp/ inpatient-obstetric-healthcare-guidance.html.
[3] National Institute of Health. COVID-19 and Special Populations. Ak- tualizováno: 9. 10.
2020. Dostupné na: https://files.covid19treat-
mentguidelines.nih.gov/guidelines/section/section_44.pdf
[4] Remdesivir: Drug information. Uptodate [navštíveno 31. 1. 2021].
[5] Veklury: Highlights of Prescribing Information. Publikováno: 22. 10.
2020. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_
docs/label/2020/214787Orig1s000lbl.pdf
[6] Veklury: Souhrn údajů o přípravku [navštíveno 31. 1. 2021]. Dostupné na:
https://www.ema.europa.eu/en/documents/product-informa-
tion/veklury-epar-product-information_cs.pdf
Komedikace
s potenciálem k lékovým interakcím
Klinické studie lékových interakcí remdesiviru nebyly provedeny.
Ovlivnění remdesiviru jinými léčivy
In vitro je remdesivir substrátem řady metabolizujících enzymů a transportních proteinů (plazmatické a tkáňové esterázy, cytochrom P450 [CYP] 3A4, CYP2D6, CYP2C8, P glykoprotein, membránový transportér OATP1B1). Jejich silné inhibitory mohou expozici remdesiviru zvyšovat, silné induktory snižovat. Klinický význam interakcí nebyl ověřen. Vyšší riziko lze teoreticky očekávat při podávání s induktory CYP450 – jejich efekt bývá nespecifický, tj. obvykle postihuje více různých izoforem CYP450 (ale také transportérů), a proto může být spojen s výraznějším kumulativním ovlivněním koncentrace substrátu. Nicméně, metabolismus remdesiviru je pravděpodobně zprostředkován převážně hydrolázami, nikoliv enzymy CYP450. S ohledem na vysoký extrakční koeficient remdesiviru je jeho jaterní clearance limitována průtokem krve játry, nikoliv aktivitou metabolizujících enzymů. Toto i krátký plazmatický poločas remdesiviru zřejmě předznamenávají obecně nízké riziko ovlivnění koncentrace remdesiviru interakcemi s jinými léčivy.
V rámci kazuistického sdělení byl reportován případ akutní hepatotoxicity po nasazení amiodaronu pacientovi léčenému remdesivirem – vzestup hodnot AST a ALT na více než dvacetinásobek horní hranice normy, ALP, gamaglutamyltransferázy a bilirubinu na více než dvoj až šestinásobek horní hranice normy. Po odnětí remdesiviru došlo k rychlému poklesu hodnot. Podle autorů sdělení se na pozorované elevaci hodnot jaterních testů mohla spolupodílet farmakokinetická interakce mezi oběma léčivy (mechanismus: inhibice P glykoproteinu amiodaronem, tj. inhibice efluxu remdesiviru z hepatocytu do žluči a v konečném důsledku vzestup hepatocelulární koncentrace remdesiviru nad práh pro hepatotoxické působení).
Ovlivnění jiných léčiv remdesivirem
In vitro působí remdesivir jako inhibitor CYP3A4, OATP1B1 a OATP1B3 a může tak zvyšovat expozici jejich substrátům. Klinický význam interakcí nebyl ověřen. Lze doporučit, aby substráty uvedených enzymů/proteinů byly podávány s odstupem alespoň dvou hodin po podání remdesiviru. In vitro je remdesivir induktorem CYP1A2 a potenciálně i CYP3A4 a může tak snižovat expozici jejich substrátům. Klinický význam interakcí nebyl ověřen.
ZdrojeIn[1t] erLaeekgcweatreer mE, dSteriskiAv,irWuilmasdEeB,xeatmal.eDtrhuag-siondnuuced liver injury in
a COVID-19 patient: potential interaction of remdesivir with P-gly- coprotein inhibitors. Clin
Infect Dis 2020 Jun 28: ciaa883. Epub ahead
pacieonf tpůrinlté. čených remdesivirem, je substrátem CYP3A4
a[ 2z]árVoevkeluňryi:nSdouuhkrtnoúrdeamjů oCpYřípPr3aAvk4u [an aPvšgtílvyeknoo p31r.o1t.e2i0n2u1]..
KDolsitnuipcnkéý
na: https://www.ema.europa.eu/en/documents/product-informa-výz
ntaiomn/ivnektelurray-kecpearr-epmrodduecsti-vinirfourms adtieoxn_acms.pedthf asonem je málo
p[r3a] vdYěanpgoKd.oWbhnaýt D(po řWíčeiKnnyowjsAobuouptoRdermodbensiěvjiri
DroruzgeIbnrteárnacytivoýnsš?eC).lin
Transl Sci 2020; 13: 842‒844.
Interakce remdesiviru a dexamethasonu
Dexamethason, který je běžnou součástí lékových režimů pacientů léčených remdesivirem, je substrátem CYP3A4 a zároveň induktorem CYP3A4 a P glykoproteinu. Klinický význam interakce remdesiviru s dexamethasonem je málo pravděpodobný (příčiny jsou podrobněji rozebrány výše).
Kortikosteroidy
Ve studii RECOVERY byl použit dexamethason v relativně nízkém dávkování 6 mg každých 24 hodin po dobu 10 dní, kortikoid byl podáván perorálně nebo intravenózně. Nicméně, rozhodnutí o podání kortikoidu musí vždy respektovat stav a komorbidity konkrétního pacienta. Protože stále chybějí jednoznačná data a doporučení, je třeba sledovat aktuální názory odborníků – viz např. dokument autorů Balík, et al., (Česká společnost intenzivní medicíny, 2020).
Dexamethason má významný protizánětlivý efekt, přitom postrádá efekt mineralokortikoidní. Jeho plazmatický poločas je krátký (zhruba 4 h), ale poločas biologického účinku je dlouhý (až 36 h). V ČR je doporučována dávka 8 mg – praktickým důvodem k volbě této dávky je síla přípravku registrovaného pro parenterální podání (Dexamed inj), který obsahuje 8 mg dexamethasonu. Přípravek registrovaný pro perorální podání (Fortecortin tbl) obsahuje 4 mg dexamethasonu – dexamethason se po perorálním podání rychle a téměř úplně vstřebává v žaludku a v tenkém střevě. Vzhledem k dlouhému biologickému poločasu by neměla být terapie prodlužována na více než 10 dní a postupné vysazování často nemá opodstatnění.
Dávka 6‒8 mg je považována za nízkou, nicméně ve vztahu k navození enzymové indukce je tato dávka dostatečná. To znamená, že dexamethason může v tomto dávkování významně ovlivnit plazmatické koncentrace a efekty některých souběžně podávaných léčiv (např. midazolamu, quetiapinu, fentanylu, alprazolamu, imunosupresiv). V těchto případech lze použít z důvodu minimalizace dopadu lékových interakcí ekvivalentní dávku jiného kortikoidu: methylprednisolon 40 mg i.v. (Solu Medrol inj), methylprednisolon 32 mg p.o. (Medrol tbl), prednison 50 mg p.o. (Prednison tbl), hydrokortison 200 mg i.v. (Hydrocortison VUAB inj).
Systémové kortikosteroidy jsou dle FDA řazeny do kategorie C, pokud jsou podávány v průběhu druhého a třetího trimestru těhotenství. V prvním trimestru byl nalezen sice malý, ale významný vztah mezi systémovým užíváním kortikosteroidů a výskytem rozštěpů, absolutní riziko je však malé. V těhotenství je lépe preferovat nefluorované kortikosteroidy, jako jsou prednison a methylprednisolon, protože jsou efektivněji metabolizovány placentárními enzymy.
Zdroje[1] Balík M, Votruba J, Matějovič M, et al. Použití kortikosteroidů u CO- VID-19. Publikováno:
5. 10. 2020. Dostupné na: https://csim.cz /
wp-content/uploads/Kortikosteroidy-u-Covid-19_5.10.2020.pdf
[2] Kemp MW, Newnham JP, Challis JG, et al. The clinical use of cortico- steroids in pregnancy.
Hum Reprod Update 2016; 22: 240 ‒259.
[3] RECOVERY Collaborative Group, Horby P, Lim WS, Emberson JR, et al.
Dexamethasone in Hospitalized Patients with Covid-19 ‒ Preliminary
Report. N Engl J Med 2020; 17: NEJMoa2021436.
[4] Wilmer E, Chai S, Kroumpouzos G. Drug safety: Pregnancy rating
classifications and controversies. Clin Dermatol 2016; 34: 401‒409.
Heparinová antikoagulancia
Zánět a hemostáza jsou vzájemně provázané děje. U pacientů s COVID 19 jsou typickými laboratorními změnami na úrovni hemostázy elevace hodnot D dimerů a fibrinogenu, zároveň pouze minimální změny protrombinového času (PT), aktivovaného parciálního tromboplastinového času (aPTT) a počtu trombocytů (pozn. – pokles hodnoty antitrombinu se vyskytuje pouze zřídka). Typickými klinickými projevy poruchy hemostázy jsou trombotické komplikace – venózní, arteriální, v katétrech, v umělých okruzích (náhrada funkce ledvin, ECMO). S ohledem na postižení plicních funkcí je zvláštní pozornost věnována mikrovaskulárním trombům v plicích.
Výskyt tromboembolie je nezanedbatelný i u pacientů, kterým je podávána standardní profylaktická antikoagulace. V této souvislosti je významná otázka rezistence k heparinu (nefrakcionovaný heparin [UFH] i nízkomolekulární hepariny [LMWH]), jejíž výskyt byl popsán u pacientů s COVID 19 v intenzivní péči. O příčinách se spekuluje, může se jednat o důsledek elevace hodnot faktoru VIII, fibrinogenu, bílkovin akutní fáze, ev. poklesu hodnot antitrombinu.
Studií hodnotících účinnost antikoagulace v závislosti na její intenzitě je stále málo. Práce se liší sledovaným endpointem i souborem zařazených pacientů.
Pokud jde o prevenci žilní tromboembolie u kriticky nemocných pacientů s COVID 19, podle výsledku metaanalýzy autorů Hasan, et al., (J Thromb Thrombolysis, 2020) by terapeutická dávka UFH nebo LMWH mohla být účinnější než dávka profylaktická. Závěry práce je však třeba interpretovat s opatrností – většina studií zařazených do metaanalýzy neuvedla cílový aPTT, resp. cílové anti Xa a mnohdy ani dávkování použité v rámci terapeutických režimů. S ohledem na riziko výskytu heparinové rezistence tedy chybějí informace o reálně dosažené intenzitě antikoagulace.
Pokud jde o snížení potřeby orgánové podpory u hospitalizovaných pacientů s COVID 19, průběžné výsledky tří probíhajících studií (REMAP CAP, ACTIV 4 a ATTACC) naznačují, že přínos terapeutické antikoagulace ve srovnání s antikoagulací profylaktickou závisí na tíži onemocnění, resp. na načasování terapie v průběhu onemocnění COVID 19. Zatímco u pacientů se středně závažným průběhem COVID 19 je terapeutická antikoagulace spojena se snížením potřeby orgánové podpory a s trendem k poklesu mortality, pacientům v intenzivní péči terapeutická antikoagulace tento benefit zřejmě nepřináší. Doplňující analýzy i odborné recenze výsledků stále pokračují.
Odborné společnosti a expertní skupiny doporučují podávat antikoagulancia všem hospitalizovaným pacientům s COVID 19, a to minimálně ve standardní profylaktické dávce – řada z nich navrhuje či doporučuje zvážit navýšení dávky na dávku intermediární, nebo dokonce terapeutickou, nejčastěji u pacientů v intenzivní péči. Téměř všechna doporučení však byla formulována před zveřejněním průběžných výsledků ze studií REMAP CAP, ACTIV 4 a ATTACC (viz výše). Pokud jde o podávání antikoagulace pacientům v domácím léčení, lze je zvážit u vysoce rizikových osob (ve standardní profylaktické dávce).
Shrneme li, zdá se, že antikoagulace v terapeutické intenzitě by mohla být v různých ohledech, minimálně pro některé podskupiny pacientů s COVID 19, prospěšná. S ohledem na možný výskyt heparinové rezistence doporučujeme zvážit rutinní a opakovaný monitoring účinnosti antikoagulace. Definitivní závěry a jednoznačná doporučení však zatím nelze učinit.
[1] American College of Cardiology. Thrombosis and COVID-19: FAQs For Current Practice.
Aktualizováno: 22: 4. 2020. Dostupné na: https://w w
w.acc.org/latest-in-cardiology/articles/2020/04/
/17/14/42/thrombosis-and-coronavirus-disease-2019-covid-19-
-faqs-for-current-practice
[2] Antitrombotická prof ylaxe u nemocných s Covid-19. Doporučený postup České společnosti pro
trombózu a hemostázu ČLS JEP. Ak- tualizováno: 13. 11. 2020. Dostupné na:
https://csth.cz/wp-content/ uploads/2020/11/COVID_tromboprofylaxe_doporuc%CC%8Ceni%
CC%81_C%CC%8CSTH_final_2020-11-13.pdf
[3] ASH Guidelines on Use of Anticoagulation in Patients with CO- VID-19 (draf t
recommendation). Aktualizováno: 8. 10. 2020. Dostupné na:
https://www.hematology.org/education/clinicians/ guideline s-and-qualit y-c are /clinic al-pr
actice-guideline s /ve- nous-thromboembolism-guidelines/ash-guidelines-on-use-of-an-
ticoagulation-in-patients-with-covid-19
[4] Barnes GD, Burnett A, Allen A, et al. Thromboembolism and anti- coagulant therapy during
the COVID-19 pandemic: interim clinical guidance from the anticoagulation forum. J Thromb
Thrombolysis
2020; 50: 72‒81.
[5] Cuker A, Peyvandi F. Coronavirus disease 2019 (COVID-19): Hyper- coagulability. Uptodate.
Aktualizováno: 27. 1. 2021.
[6] Hasan SS, Radford S, Kow CS, Zaidi STR. Venous thromboembolism in critically ill COVID-19
patients receiving prophylactic or therapeutic anticoagulation: a systematic review and
meta-analysis. J Thromb Thrombolysis 2020; 50: 814–821.
[7] Hughes S. COVID-19 Anticoagulation Trials ‘Pausedʼ for Futility, Safety. Medscape.
Publikováno: 22. 12. 2020. Dostupné na: https://
www.medscape.com/viewarticle/943085?nlid=138829_1842&src
=WNL_mdplsfeat_201225_mscpedit_wir&uac=65829CZ&spon=1
7&impID=2759731&faf=1
[8] Moores LK, Tritschler T, Brosnahan S, et al. Prevention, Diagnosis, and Treatment of V TE in
Patients With Coronavirus Disease 2019: CHEST Guideline and Expert Panel Report. Chest 2020; 158:
1143‒1163.
[9] National Institute of Health. Antithrombotic Therapy in Patients with COVID-19.
Aktualizováno: 17. 12. 2020. Dostupné na: https:// w w
w.covid19treatmentguidelines.nih.gov/adjunctive-therapy/ antithrombotic-therapy/
[10] Spyropoulos AC, Levy JH, Ageno W, et al; Subcommittee on Peri- operative, Critical Care
Thrombosis, Haemostasis of the Scientific, Standardization Committee of the International Society
on Throm- bosis and Haemostasis. Scientific and Standardization Committee communication: Clinical
guidance on the diagnosis, prevention, and treatment of venous thromboembolism in hospitalized
patients with COVID-19. J Thromb Haemost 2020; 18: 1859 ‒1865.
[11] Wendling P. Full-Dose Anticoagulation Reduces Need for Life Sup- port in COVID-19. Medscape.
Publikováno: 22. 1. 2021. Dostupné na: https://w w w.medscape.com/viewarticle/944584?src=WNL_md-
pls_210129_mscpedit_wir&uac=65829CZ&spon=17&impID=3161
330&faf=1
[12] White D, MacDonald S, Bull T, et al. Heparin resistance in COVID-19 patients in the intensive
care unit. J Thromb Thrombolysis 2020; 50:
287‒291.
REM2021-0