Konjunktivální aplikace farmak pohledem anesteziologa
Souhrn:
Hess L. Konjunktivální aplikace farmak pohledem anesteziologa. Remedia 2020; 30: 72–75.
Konjunktivální aplikace představuje nový způsob alternativního podání farmak. Nástup účinku je velmi rychlý, protože vstřebávání spojivkou je rychlé. Nevýhodou je poměrně malá plocha spojivky, což vyžaduje podání koncentrovaných farmak. Velmi výhodné pro tento způsob aplikace je podání opioidů, zejména sufentanilu a remifentanilu. Sufentanil je přítomen ve vysoké koncentraci, což umožňuje uvedený způsob aplikace. Remifentanil je v lyofilizované formě a můžeme připravit roztoky o vysoké koncentraci. Opioidy mají i vhodné pH umožňující aplikaci bez podráždění spojivky a celého oka. Stejně tak je výhodné podání specifických antagonistů opioidů – naloxonu a naltrexonu ‒, které rovněž nepůsobí podráždění oka. Opioidy aplikované touto cestou se mohou uplatnit zejména v akutní medicíně při tlumení bolesti. Neinvazivní způsob je však předurčuje k aplikaci u onkologicky nemocných pacientů, zvláště těch, kteří trpí průlomovou bolestí. Konjunktivální aplikace specifických antagonistů se může uplatnit při terapii předávkování opioidy u narkomanů. Specifičtí antagonisté konjunktiválně také prozradí osoby, které jsou závislé na opioidech.
Summary:
Hess L. Subconjunctival application of pharmaceuticals from the point of view of the anesthesiologist. Remedia 2020; 30: 72–75.
Subconjunctival application represents a new approach of alternative application of pharmaceuticals. The onset of the effect is very quick because the absorption through conjunctiva is fast. The disadvantage is a relatively small surface of conjunctiva which requires an application of concentrated pharmaceuticals. The application of opioids is very advantageous for this approach of application, especially sufentanil and remifentanil. Sufentanil is present in a very high concentration which enables the described approach of application. Remifentanil is in a lyophilized form and solutions of very high concentration can be prepared. Opioids also have an appropriate pH enabling application without irritating conjunctiva and the whole eye. Equally, the application of specific opioid antagonists – naloxone and naltrexone – is advantageous in the way that it does not cause irritation of the eye. Opioids applied in this way can be part of acute medicine in pain management. Non‑invasive mode predetermines them for the application in oncological patients, especially those suffering from breakthrough pain. Subconjunctival application of specific antagonists can be part of opioid overdose therapy in drug users. Specific antagonists applied subconjunctivally also reveal persons dependent on opioids.
Key words: non‑traditional application of pharmaceuticals, subconjunctival application, opioids and their specific antagonists, alpha2 agonists, ketamine, experimental and clinical experience
Konjunktivální aplikace
Moderní farmakologický výzkum začal
koncem 19. století. Předtím byla většina drog získávána
ze zvířat, rostlin nebo minerálů. Syntetická organická
chemie vyvinula koncem 19. a začátkem 20. století
řadu farmakologicky aktivních látek, např. acylpyrin,
fenobarbital, prokain. Pod vlivem Ehrlicha byla dlouhou dobu věnována
pozornost především vztahu chemické struktury a farmakologických
účinků. Dlouho se podceňovala skutečnost, že farmaka mohou plně
rozvinout svůj účinek jen tehdy, mají li vhodnou adjustaci
(farmaceutické zpracování) a vhodný způsob aplikace. Tím
se totiž může podstatně zvýšit jejich biologická dostupnost.
Po mnoho staletí byla tzv. drug formulation tajemstvím, vědou
a uměním farmaceuta. V současné době slaví renesanci
mnoho netradičních způsobů aplikace farmak. Příkladem může
být transdermální způsob aplikace. Náplast Scopoderm obsahuje
celkem 1,5 mg skopolaminu, který je po dobu 72 hodin
rovnoměrně uvolňován do krevního oběhu a chrání
před nauzeou a zvracením. Plazmatická koncentrace je při
tomto způsobu aplikace velmi nízká a nevyvolává sedaci ani
ospalost. Stejným způsobem jsou aplikovány např. nitráty nebo
fentanyl. Stejně tak se podává antikoncepce u žen nebo
substituční léčba estrogeny. Nazálně se podává premedikace
u dětí, např. midazolam, sufentanil nebo ketamin. Také
transbukální a sublinguální aplikace farmak se používá
k premedikaci. Známé je fentanylové lízátko připravené
profesorem Stanleyem ze Salt Lake City. Uplatní se především
u dětí, ale i u dospělých při tlumení akutní
nebo chronické bolesti. Ve výzkumu jsou další farmaka, např.
etomidát, který navodí po transbukální aplikaci silnou
krátkodobou sedaci. Tracheální způsob aplikace různých farmak
se uplatňuje zejména při resuscitaci.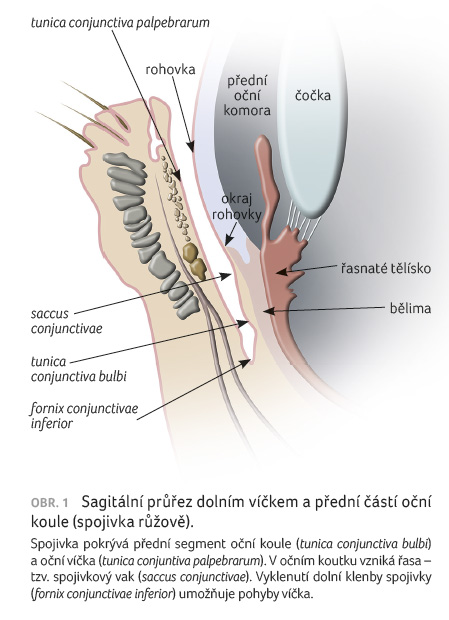
Spojivka (tunica conjunctiva) je slizniční blanka tvořená vícevrstevným kubickým epitelem přecházejícím z vnitřní plochy víček na přední část bělimy. Ve vnitřním koutku oka tvoří spojivka poloměsíčitou řasu s bradavkovitou vyvýšeninou – slzní jahůdkou (caruncula lacrimalis). Proto část farmaka aplikovaného konjunktiválně se dostává slzovody až do nosní dutiny (obr. 1).
Celá řada očních léků je aplikována konjunktiválně. Po vstřebání mají kromě lokálních žádoucích účinků i účinky systémové. Z empirie je známo, že vstřebávání spojivkou je velmi rychlé. O tom svědčí i nešťastné smrtelné příhody veterinárních lékařů, kteří si náhodně vstříkli na spojivku nepatrné množství ultrapotentního opioidu etorfinu. Pokud nebyl ihned aplikován specifický antagonista opioidů naloxon nebo diprenorfin, došlo po několika minutách k depresi dechu a smrti postiženého. Také v našem experimentu zahynul králík za čtyři minuty po dávce etorfinu 33 μg/kg konjunktiválně. V 1 ml kombinovaného přípravku Large Animal Immobilon je 2,45 mg etorfinu. To znamená, že v 0,1 ml je 245 µg. Dávka pro králíka o hmotnosti 3 kg činila tedy přibližně 100 µg, tj. 0,04 ml etorfinu. V 1 ml je přibližně 20 kapek, to znamená, že je to méně než 1 kapka!
Přestup bojových plynů spojivkou
hraje důležitou úlohu ve vojenské toxikologii [1].
Konjunktiválním způsobem dochází i ke vstřebávání jedu tzv. plivajících kober, které žijí v Africe a v Asii. Patří mezi ně zejména kobra černokrká (Naja nigricollis), poddruh kobry indické (Naja naja), kobra obojková (Hemachatus haemachatus) a kobra červená (Naja pallida). Na rozdíl od většiny kober, které mají vyústění jedových žláz skoro u špičky zubů, ústí vývody plivajících kober poměrně vysoko vpředu, skoro vodorovně, nad špičkou zubu a jsou poněkud zúženy. To umožňuje vystříknout paprsek jedu v přímém směru. Použití vysokorychlostní kamery pomohlo přesně určit, jak kobra provádí „plivání“ jedu. Doba od aplikace optického podnětu (obličej) až po aktivaci svalu jedové žlázy trvá 200 milisekund. Kobry se při plivání jedu nacházejí v typickém postavení se vztyčenou horní polovinou těla a rozšířeným krčním límcem. Na přesném zacílení paprsku jedu se podílejí jemné rotační pohyby hlavou, takže cíl je zasažen s poměrně vysokou přesností. Kobry jsou schopné vystříknout jed na vzdálenost 2‒3 metrů. Jed obsahuje četné neurotoxiny, cytotoxiny i kardiotoxiny, které se pravděpodobně podílejí na akutní toxicitě v oku. Bezprostředně dochází k velkému zduření spojivky, zakalení rohovky a zároveň nastupují silné bolesti s možností přechodného nebo i trvalého oslepnutí. Plivání jedu je u kober vrozené, již malé kobry po vylíhnutí jsou schopny vystřikovat jed. Plivání jedu je poměrně bezpečný způsob, jak nepřijít do přímého kontaktu s nepřítelem. Kobra však při lovu kořisti používá běžné uštknutí jedovými zuby.
Konjunktivální aplikace anestetik
Prací zabývajících se konjunktivální aplikací farmak používaných v anesteziologii je dosud velmi málo.
Sufentanil
Farnsworth a kol. z univerzity v Salt Lake City studovali rychlost absorpce a biologickou dostupnost sufentanilu při topické aplikaci do oka [2]. U pěti psů anestezovaných Telazolem v celkové dávce 75 mg aplikovali sufentanil v dávce 2 μg/kg konjunktiválně. Maximální plazmatické koncentrace bylo dosaženo za 5 minut od aplikace. Hodnoty odpovídaly analgetickým koncentracím používaným při operačním tlumení bolesti. Vyšetření oka neukázalo známky zánětu nebo podráždění. Autoři doporučují tuto metodu k tlumení bolesti u onkologických pacientů.
Čínští badatelé testovali oční akutní toxicitu sufentanilu u králíků, kterým podali sufentanil v dávce 5, 7,5 a 10 μg a jako kontrola bylo použito vehikulum [3]. Po sedmi dnech vyhodnocovali oční toxicitu. Při pozorování pouhým okem a štěrbinovou lampou nedošlo k zákalu rohovky, kongesci spojivky, chemóze nebo k sekreci v očích. Ve světelném mikroskopu nebyly nalezeny žádné patomorfologické změny spojivky, rohovky, korneosklerárního přechodu, duhovky, řasnatého tělíska, sítnice nebo zrakového nervu. Uzavírají, že oční aplikace samotného sufentanilu v dávce 5‒10 μg pro sedaci a analgezii je zcela bezpečná.
Ketamin
V poslední době se objevují ojedinělé zprávy o okulárním podání ketaminu např. během oftalmologické chirurgie [4]. Jelikož je pacient zcela zarouškován s výjimkou očí, je přístup do žilního systému nebo na nosní sliznici obtížný. Oční lékař provádějící chirurgický výkon může doplnit celkovou anestezii konjunktivální aplikací ketaminu. Při koncentraci 100 mg/ml je v 0,1 ml obsaženo 10 mg a v 0,2 ml 20 mg, což už je účinná dávka ketaminu při tomto způsobu aplikace. Racemický ketamin však obsahuje různé prezervační látky, které mohou podle mého názoru vést k podráždění oka. Naproti tomu pravotočivý izomer ketaminu (S+ketamin) je bez prezervancií a jeho aplikace nevedla v našich pokusech u králíků k zarudnutí oka.
Xylazin
Velez a kol. popsali farmakologické účinky při náhodném výplachu obou očí roztokem xylazinu (celkem 8 ml v koncentraci 100 mg v 1 ml) [5]. Pacient se dostal do nemocnice za 30 minut po aplikaci. Byl asymptomatický. Do dvou hodin po expozici došlo k výrazné sinusové bradykardii (40‒50 tepů/min), hypotenzi (90/60 torrů) a ke snížené úrovni vědomí. Pacient byl léčen symptomaticky a za 24 hodin po expozici byl propuštěn domů.
Morfin
El Brairy a kol. určovali farmakokinetické parametry morfinu po instilaci do spojivky u novozélandských králíků [6]. Morfin v dávce 1 mg/kg okulárně se velmi rychle vstřebal a jeho plazmatická koncentrace dosáhla účinných analgetických hodnot.
Fentanyl
Zöllner a kol. testovali účinek konjunktiválně aplikovaného fentanylu při poškození rohovky. Jak bylo zjištěno z imunohistochemických vyšetření, obsahuje lidská rohovka periferní opiátové receptory µ i δ a je velmi senzitivní na bolest [7]. Fentanyl v celkové dávce 10 µg aplikovaný konjunktiválně každé čtyři hodiny však neměl požadovaný účinek. Autoři uzavírají, že jsou potřeba další studie týkající se velikosti dávky a způsobu aplikace fentanylu.
Medetomidin a detomidin
Jednostranná aplikace medetomidinu v koncentraci 0,5‒2 % vedla u normotenzních králíků k oboustrannému poklesu nitroočního tlaku s vrcholem redukce za dvě hodiny u ošetřeného oka a za jednu hodinu u neošetřeného oka. V závislosti na dávce došlo u vykapaného oka k mydriáze. Podobných výsledků bylo dosaženo také u kočky. Další derivát agonistů alfa2 receptorů detomidin měl slabší účinek. Výsledky svědčí pro účast alfa2 adrenergních receptorů při regulaci nitroočního tlaku [8].
Naloxon
Konjunktivální instilace naloxonu v dávce 2‒3 mg vedla u drogově závislých léčených metadonem ke vzniku odvykacích příznaků a často k rozšíření zornic na obou očích.
Pouhé dvě kapky naloxonu stačily k rozšíření zornic u osob závislých na opiátech. Průměr zornic byl měřen elektronicky binokulárním pupilometrem [9,10].
Experimentální zkušenosti
Kojunktivální aplikaci farmak jsme testovali na králících, kdy jsme jim aplikovali farmaka sondou s tupým zakončením, aby nedošlo k poranění rohovky. Jako kritérium imobilizace jsme zvolili ztrátu reflexu polohy – obrácení na záda bez schopnosti navrátit se do normální polohy (obr. 2). Kromě toho jsme u každého králíka monitorovali srdeční frekvenci, saturaci hemoglobinu kyslíkem a neinvazivně krevní tlak. Známky iritace oka jsme hodnotili modifikovaným testem z normy ČSN EN ISO 10993 10. Pořizovali jsme také makrofotografie oka a pátrali po známkách jeho poškození.
U králíka jsme testovali tyto
opioidy: fentanyl v dávce 10 μg/kg, alfentanil 50 μg/kg,
remifentanil 50 μg/kg a sufentanil 5 μg/kg a dále
agonistu/antagonistu opioidních receptorů buprenorfin v dávce
50 μg/kg. Deriváty fentanylu mají pH mezi 3,5‒6
a po konjunktivální aplikaci nevyvolávaly žádné
známky podráždění spojivky. Remifentanil v dávce 5 μg/kg
vedl ke ztrátě reflexu polohy v průměru za 2 ± 1 minutu
při vynikající kardiorespirační stabilitě. Sufentanil v dávce
5 μg/kg vedl ke ztrátě reflexu polohy v průměru
za 3,5 ± 2,5 minuty opět při vynikající
kardiorespirační stabilitě. Alfentanil jsme podali v dávce
50 μg/kg a vedl ke ztrátě reflexu polohy v průměru
za 1 minutu 30 vteřin ± 30 vteřin. Délka ztráty
reflexu polohy byla v průměru 17 ± 3,5 minuty.
Kardiorespirační parametry byly ovlivněny nevýznamně. Při
podání buprenorfinu v dávce 50 μg/kg došlo ke ztrátě
reflexu polohy za 6 ± 2,5 minuty opět při vynikající
kardiorespirační stabilitě. K urychlení ztráty reflexu
polohy jsme zkombinovali buprenorfin v dávce 25 μg/kg
s remifentanilem v dávce 5 μg/kg, ke ztrátě
reflexu polohy došlo již za 2 ± 1 minutu
a kardiorespirační stabilita byla výborná.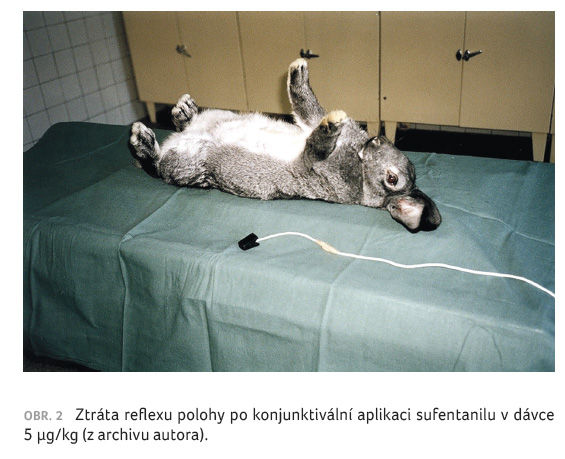
Remifentanil v dávce 10 μg/kg vedl ke ztrátě reflexu polohy v průměru za 3 ± 2 minuty při nevýznamném ovlivnění kardiorespiračních parametrů. Plazmatické koncentrace opioidů remifentanilu a sufentanilu dosahovaly analgetických hodnot.
Z ultrapotentních opioidů jsme měli příležitost testovat etorfin v dávce 0,5 μg/kg, kdy došlo ke ztrátě reflexu polohy v průměru za 3 ± 2,5 minuty. Srdeční frekvence se mírně snížila, saturace hemoglobinu kyslíkem klesla z 98,2 % na 96,4 % v osmé minutě (nejnižší naměřená hodnota). Systolický krevní tlak se klinicky významně nezměnil. Ale již etorfin v dávce 1 μg/kg vedl ke ztrátě reflexu polohy v průměru za 1 minutu 45 vteřin ± 45 vteřin, srdeční frekvence již výrazně klesla, saturace hemoglobinu kyslíkem v jednotlivých případech se snížila pod 90 %. Systolický krevní tlak se v průběhu pokusu prakticky nezměnil. V jednom případě došlo za 10 minut po aplikaci etorfinu k výrazné dechové depresi, která vyžadovala podání specifického antagonisty opioidů naltrexonu. Vyšší dávky etorfinu již vedly k výrazné dechové depresi vyžadující vždy podání specifického antagonisty opioidů. Z dalších farmak jsme testovali pravotočivý izomer ketaminu v dávce 2,5 mg/kg. Ke ztrátě reflexu polohy došlo v průměru za 3,5 ± 2,5 minuty. Opět nebyly kardiorespirační parametry významněji ovlivněny. Peptidový hormon oxytocin v dávce 8 m.j. vedl ke ztrátě reflexu polohy za 2,5 ± 1 minutu 20 vteřin při výborných kardiorespiračních parametrech.
Konjunktivální aplikaci farmak jsme
testovali také na opicích makak rhesus (Macaca
mulatta) v zařízení Biotox Konárovice.
Po odchycení opice do podběráku a její fixaci jsme
podávali farmaka sondou s tupým koncem (olivkou) a po puštění
zvířete do malé pozorovací klece jsme sledovali změny
chování až k nástupu případné imobilizace. Zjistili jsme,
že i tento způsob konjunktivální aplikace je velmi účinný
a při vhodné kombinaci farmak může vést až k imobilizaci
zvířete a ulehnutí na dno klece (obr. 3). Samotné opioidy – remifentanil nebo sufentanil
‒ nebyly s to zvíře imobilizovat, ale navodily výraznou
sedaci. Při podání kombinace S+ketaminu v dávce 0,5 mg/kg
spolu s midazolamem v dávce 0,1 mg/kg a alfa2
agonistou medetomidinem v dávce 25 μg/kg jsme pozorovali
první známky sedace v průměru za 5 ± 3 minuty,
k imobilizaci došlo za 10 ± 4 minuty. Sat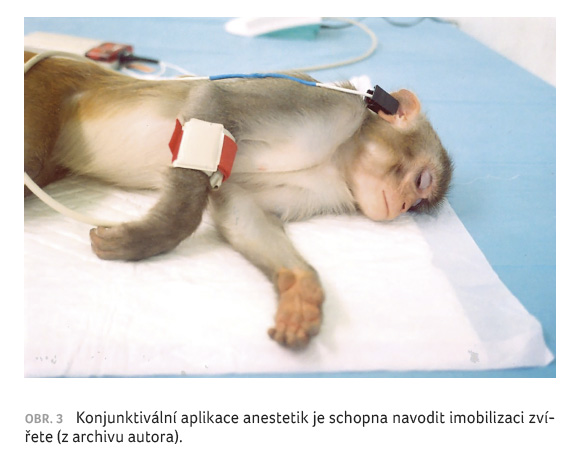 urace
hemoglobinu kyslíkem klesla z výchozích 98 % na 96,5 %.
Srdeční frekvence mírně klesla, systolický krevní tlak se
nezměnil. Dále jsme u makaka navodili imobilizaci kombinací
S+ketamin–medetomidin–alfentanil. K imobilizaci došlo
v průměru za 2 minuty ± 30 vteřin.
Saturace hemoglobinu kyslíkem klesala pozvolna, až činila
u některých jedinců v 10. minutě méně než 90 %.
Potom jsme podali specifického antagonistu opioidů naltrexon
konjunktiválně. Během 2‒3 minut od aplikace došlo
k podstatnému zlepšení dechových funkcí.
urace
hemoglobinu kyslíkem klesla z výchozích 98 % na 96,5 %.
Srdeční frekvence mírně klesla, systolický krevní tlak se
nezměnil. Dále jsme u makaka navodili imobilizaci kombinací
S+ketamin–medetomidin–alfentanil. K imobilizaci došlo
v průměru za 2 minuty ± 30 vteřin.
Saturace hemoglobinu kyslíkem klesala pozvolna, až činila
u některých jedinců v 10. minutě méně než 90 %.
Potom jsme podali specifického antagonistu opioidů naltrexon
konjunktiválně. Během 2‒3 minut od aplikace došlo
k podstatnému zlepšení dechových funkcí.
Rovněž u opic jsme nepozorovali po aplikaci opioidů známky podráždění spojivky a makaci snášeli tuto aplikaci dobře.
V blízké budoucnosti by se mohla
konjunktivální aplikace analgetik vzhledem k jednoduchosti
způsobu a bezbolestnosti uplatnit v navození analgezie
v emergentní medicíně a v polních podmínkách
armády.
Seznam použité literatury
- [1] Bartošová L. Otravy nervově paralytickými látkami: co o nich víme? Československá fyziologie 2006; 55: 66‒75.
- [2] Farnsworth ST, Gautier ME, McJames SW, et al. Ocular Transmucosal obsorption and Toxicity of Sufentanil in Dogs. Anesth Analg 1998; 86: 138‒140.
- [3] Hong BC, Jiang WS, Rong XC. Ocular acute toxicity of sufentanil in rabbits. Ophthalmology 2017; 10: 34‒36.
- [4] Nasal and ocular administration of ketamine to manage pain and for detoxification. European Patent Specification EP000751766B1, 2001.
- [5] Velez L, Shepherd G, Mills LD, Rivera W. Systemic toxicity after an ocular exposure to xylazine hydrochloride. J Emerg Med 2006; 30: 407‒410.
- [6] El‑Brairy AI, El‑Fattah Marrie AH, El Sawalhy A, et al. Pharmacokinetic Parameters of Morphine After Ocular Instillation Versus Intravenous Administration. Med J Cairo UNiv 1994; 1: 195‒206.
- [7] Zöllner Ch, Mousa S, Klinger A, et al. Topical fentanyl in a randomized, double‑blind study in patiens with corneal damage. Clin J Pain 2008; 24: 690‒696.
- [8] Jin Y, Wilson S, Elko EE, Yorio T. Ocular hypotensive effects of medetomidine and its analogs. J Ocul Pharmacol 1991; 7: 285‒296.
- [9] Duncalf D, Jeyaram C, Tarter R, Foldes FF. Ocular absorption of naloxone in narcotic addicts. Int J Addict 1975; 10: 23‒27.
- [10] Ghodse H, Taylor DR, Greaves JL, et al. The opiate addiciton test: a clinical evaluation of a quick test for physical dependence on opiate drugs. Br J Clin Pharmacol 1995; 39: 257‒259.