Lékové interakce antimigrenik (2. část)
Souhrn:
Suchopár J, Suchopár Š, Prokeš M. Lékové interakce antimigrenik (2. část). Remedia 2021; 31: 391–397.
Antimigrenika jsou léčiva, která, až na výjimky, mají obecně poměrně značný potenciál k lékovým interakcím. Klasická antimigrenika působí serotonergně a vzácně mohou přispívat ke vzniku serotoninového syndromu, zejména u pacientů již léčených jinými serotonergními léky nebo užívajících tramadol jako analgetikum. Metabolismus některých z nich je závislý na CYP3A4 nebo MAO‑A, jejichž inhibice může v některých případech vést ke klinicky významnému zvýšení expozice a vzniku nežádoucích účinků nebo toxicity. Nová antimigrenika ze skupiny tzv. gepantů představují v oblasti lékových interakcí jistou výzvu, neboť tyto léky mají poměrně značný počet lékových interakcí, které jsou klinicky významné a vyžadují úpravy dávek nebo intervalu mezi dávkami, resp. četnosti dávek. Biologická léčiva naopak představují bezpečnou alternativu terapie, neboť lékové interakce nemají a je vysoce nepravděpodobné, že by se v budoucnosti na tomto konstatování cokoliv změnilo.
Summary:
Suchopar J, Suchopar S, Prokes M. Drug interactions of antimigraine drugs (part 2). Remedia 2021; 31: 391–397.
Antimigraine drugs are drugs that, with a few exceptions, generally have a relatively high potential for drug interactions. Classical antimigraine drugs have a serotonergic effect and may rarely contribute to serotonin syndrome, especially in patients already treated with other serotonergic drugs such as most antidepressants or taking tramadol as an analgesic. The metabolism of some of them is dependent on CYP3A4 or MAO‑A, the inhibition of which may in some cases lead to a clinically significant increase in exposure and the development of adverse effects or toxicity. New antimigraine drugs from the group of so‑called gepants represent a certain challenge in the field of drug interactions, as these drugs have a high number of drug interactions that are clinically significant and require adjustments of dose, dose interval, or dose frequency. Biological drugs, on the other hand, are a safe alternative to therapy because they do not possess drug‑interaction activity and it is highly unlikely that anything will change in the future.
Key words: drug interactions, antimigraine drugs, ergotamine, dihydroergotamine, triptans, lasmiditan, rimegepant, ubrogepant, fremanezumab, erenumab , galcanezumab.
Lékové interakce ditanů
Zatím jediným v klinické praxi používaným ditanem je lasmiditan, v Evropě však dosud není registrován. Mechanismus účinku lasmiditanu spočívá v selektivním agonistickém efektu na 5 HT1F receptor, z tohoto důvodu nepůsobí vazokonstrikčně [1]. Lasmiditan se podává v dávkách 50 mg nebo 100 mg. Po perorálním podání se rychle vstřebává, maximálních plazmatických koncentrací dosahuje za necelé dvě hodiny. Standardní potrava neovlivňuje biologickou dostupnost lasmiditanu. Podání po tučném jídle vede ke zvýšení biologické dostupnosti o 22 %, přičemž toto zvýšení není klinicky významné. Biotransformace lasmiditanu je téměř kompletní (> 90 %), neprobíhá cestou cytochromu P450 (CYP3A4), flavinové monooxygenázy (FMO) nebo monoaminooxidázy (MAO). Metabolity lasmiditanu nejsou farmakologicky aktivní, jeho biologický poločas činí 5,7 hodiny. Těžká porucha funkce ledvin nemá klinicky významný vliv na expozici lasmiditanu. Vliv těžkého poškození funkce jater nebyl zkoumán.
Farmakokinetické lékové interakce
lasmiditanu
Lasmiditan je in vitro inhibitorem CYP2D6, P glykoproteinu (P gp), proteinu rezistence karcinomu prsu (breast cancer resistance protein, BCRP) a transportního systému organických kationtů (organic cation transporter 1, OCT1) [2]. Inhibice CYP2D6 je slabá a nevede s největší pravděpodobností ke klinicky významným lékovým interakcím, neboť zvýšení expozice citlivému substrátu CYP2D6 dextrometorfanu v důsledku souběžného podávání s lasmiditanem činilo pouze 30 %. Také inhibice OCT1 je slabá, což bylo prokázáno ve studii souběžného podávání lasmiditanu a sumatriptanu, neboť nebyly pozorovány žádné statisticky významné změny farmakokinetických vlastností sumatriptanu. Z důvodu předběžné opatrnosti držitel rozhodnutí o registraci uvádí, že by mělo být vyloučeno souběžné podávání lasmiditanu s citlivými substráty BCRP a P gp. Je třeba mít na paměti, že k citlivým substrátům BCRP patří např. rosuvastatin (a další statiny), metotrexát nebo sulfasalazin. K citlivým substrátům P gp pak patří např. digoxin, dabigatran etexilát nebo cyklosporin. Lasmiditan nezpůsobuje farmakokinetickou lékovou interakci s propranololem, sumatriptanem nebo topiramátem [3−5]. Nemá ani vliv na farmakokinetické vlastnosti midazolamu, tedy citlivého substrátu CYP3A4.
Farmakodynamické lékové interakce
lasmiditanu
Lasmiditan je serotonergní léčivo, dosud však nebyly publikovány žádné informace o serotoninovém syndromu. Držitel rozhodnutí o registraci výslovně na riziko vzniku serotoninového syndromu upozorňuje.
Lasmiditan snižuje tepovou frekvenci, a může tak prohloubit bradykardii navozenou jinými souběžně podávanými léčivy s bradykardizujícím účinkem. Opatrnosti je proto třeba u pacientů již léčených betablokátory, ivabradinem, verapamilem, digoxinem či cholinomimetiky, jako jsou rivastigmin, donepezil nebo galantamin, a při souběžném podávání lasmiditanu s propranololem [3]. Průměrná tepová frekvence poklesla po současném podání lasmiditanu v přítomnosti propranololu z 56,2 tepu/min před podáním lasmiditanu na 47,5 tepu/min za 1,5 hodiny po podání. Snížení tepové frekvence přetrvávalo 2−3 hodiny po podání dávky lasmiditanu (rozmezí 49,1−50,2 tepu/min). Po čtyřech hodinách po podání lasmiditanu se tepová frekvence zvýšila na 58,6 tepu/min.
Lasmiditan má tlumivý účinek, jeho podání může vážným způsobem ovlivnit schopnost řídit motorová vozidla nebo obsluhovat stroje. Byla provedena klinická studie, jejímž cílem bylo kvantifikovat vliv lasmiditanu v dávkách 50−200 mg na schopnosti řídit motorová vozidla, přičemž bylo zjištěno, že bezprostředně a nejméně osm hodin po podání lasmiditanu by pacienti léčení tímto přípravkem neměli řídit. Je logické, že léčivé přípravky, které mají tlumivý účinek (antipsychotika, antidepresiva, hypnotika), mohou zvyšovat tento negativní efekt lasmiditanu. Pokud je to možné, je třeba se takovým kombinacím vyhnout.
Lékové interakce gepantů
V klinické praxi se používají dva gepanty (rimegepant, ubrogepant). Žádný z gepantů však není zatím v Evropě registrován. Mechanismus účinku gepantů spočívá v kompetitivním antagonismu působení CGRP (calcitonine gene related peptide) na receptoru CGRP.
Ubrogepant
Ubrogepant se podává v dávkách 50 mg nebo 100 mg. Po perorálním podání se rychle vstřebává a maximálních plazmatických koncentrací dosahuje za 1,5 hodiny. Podání po jídle nemá prakticky žádný vliv na farmakokinetické vlastnosti ubrogepantu (mírné snížení maximálních plazmatických koncentrací o 22 %, bez vlivu na celkovou expozici), s výjimkou prodloužení času nutného k dosažení maximálních plazmatických koncentrací. Ubrogepant je extenzivně metabolizován, zejména cestou CYP3A4, na neúčinné metabolity, které se vylučují převážně žlučí. Biologický poločas ubrogepantu činí 5−7 hodin. U pacientů s poruchou funkce ledvin, resp. jater je nezbytné upravit dávky ubrogepantu (nepřekračovat jednotlivou dávku 50 mg) a v případě selhání funkce ledvin by podání ubrogepantu mělo být vyloučeno.
Ubrogepant je citlivým substrátem CYP3A4 a dále substrátem polypeptidových transportérů organických aniontů 1B1/1B3 (organic anion transporting polypeptide 1B1/1B3, OATP1B1/1B3), transportéru organických aniontů 1 (OAT1), BCRP a P gp [6]. Ubrogepant představuje slabý inhibitor CYP2C8, CYP2C9, CYP2D6, CYP2C19, MAO A a UDP glukuronyltransferázy 1A1 (UGT1A1), což patrně nevede ke klinicky významným lékovým interakcím [7,8].
K nejvýznamnějším lékovým interakcím dochází s inhibitory CYP3A4. Souběžné podávání silného inhibitoru CYP3A4 ketokonazolu vedlo ke zvýšení expozice ubrogepantu o 865 %, a proto je souběžné podávání silných inhibitorů CYP3A4 kontraindikováno [8]. Souběžné podávání středně silného inhibitoru CYP3A4 verapamilu vedlo ke zvýšení expozice ubrogepantu o 253 %. Při souběžném podávání ubrogepantu se středně silnými inhibitory CYP3A4 je možné podávat jednotlivou dávku ubrogepantu nejvýše 50 mg s tím, že nelze podat dodatečnou dávku a další dávku lze opakovat nejdříve za 24 hodin. Při souběžném podávání slabých inhibitorů CYP3A4 je nutno omezit dávkování ubrogepantu tak, že se užije iniciální dávka 50 mg, nejdříve za dvě hodiny lze užít druhou dávku 50 mg; během 24 hodin se nesmí užít celkem více než 100 mg ubrogepantu.
Podle očekávání vedlo souběžné podávání silného induktoru CYP3A4 ke snížení expozice ubrogepantu o 78 %, což se projevuje snížením účinnosti až selháním terapie [8]. Souběžnému podávání ubrogepantu a silných induktorů CYP3A4 je třeba se vyhnout. Je třeba mít na paměti, že klinicky významná indukce biotransformačních enzymů navozená induktory CYP3A4 může přetrvávat 1−2 týdny i několik měsíců. Kompletní deindukce CYP3A4 trvá přibližně jeden měsíc po ukončení podávání induktorů CYP3A4, v některých případech to může být i šest měsíců. Držitel rozhodnutí o registraci ubrogepantu uvádí, že v případě souběžného podávání středně silných induktorů CYP3A4 má být vždy podána jednotlivá dávka ve výši 100 mg.
Vedle metabolických farmakokinetických lékových interakcí poskytuje ubrogepant pravděpodobně také řadu lékových interakcí založených na ovlivnění jeho transportu. Vzhledem k tomu, že je ubrogepant substrátem P gp a BCRP, je možné, že současné podávání inhibitorů těchto transportních systémů zvýší jeho expozici. I když jsou k dispozici pouze výsledky studií in vitro podpořené výsledky studií provedených s duálními inhibitory CYP3A4/P gp (ketokonazol, verapamil), doporučuje držitel rozhodnutí o registraci ubrogepantu při souběžném podávání silných inhibitorů P gp nebo BCRP omezit dávkování ubrogepantu tak, že se užije iniciální dávka 50 mg, nejdříve za dvě hodiny lze užít druhou dávku 50 mg; během 24 hodin se nesmí užít celkem více než 100 mg ubrogepantu [8].
Držitel rozhodnutí o registraci uvádí mezi těmito inhibitory jako příklady chinidin, karvedilol, eltrombopag a kurkumin, přičemž první dva z nich jsou inhibitory P gp a druhé dva inhibitory BCRP. K tomu je nezbytné doplnit, že inhibitorů P gp a BCRP je velké množství a bohužel nejsou uvedeny nejsilněji působící, například:
- cyklosporin (silný inhibitor P gp i BCRP),
- elbasvir/grazoprevir (silný inhibitor BCRP),
- glekaprevir/pibrentasvir (silný inhibitor P gp i BCRP),
- rifampicin (silný inhibitor BCRP),
- sofosbuvir/velpatasvir/voxilaprevir (silný inhibitor BCRP),
- vedroprevir (silný inhibitor BCRP),
- (aktuálně) ivermektin (silný inhibitor P gp),
- loperamid (silný inhibitor P gp),
- verapamil (silný inhibitor P gp).
Všechny tyto inhibitory mají natolik silnou inhibiční aktivitu, že mohou expozici citlivým substrátům P gp nebo BCRP zvýšit pětinásobně nebo i více. Ubrogepant patří mezi středně citlivé substráty P gp, neboť intestinální inhibice P gp může zvýšit systémovou dostupnost ubrogepantu na přibližně dvojnásobek (právě proto držitel rozhodnutí o registraci doporučuje nepřekračovat denní dávku 100 mg).
Nelze pominout, že grapefruitová šťáva působí jako inhibitor CYP3A4 (a patrně také P gp), a proto lze očekávat, že může při jejím pití docházet ke zvýšení expozice ubrogepantu. Účinek grapefruitové šťávy na metabolismus ubrogepantu závisí na množství vypité grapefruitové šťávy, četnosti jejího pití a jeho posloupnosti.
Rimegepant
Rimegepant se podává v dávkách 75 mg. Po perorálním podání se rychle vstřebává a maximálních plazmatických koncentrací dosahuje za 1,5 hodiny. Podání po tučném jídle vede ke snížení expozice rimegepantu o přibližně třetinu a současně vyvolává prodloužení času nutného k dosažení maximálních plazmatických koncentrací na 2,5 hodiny. Rimegepant je, na rozdíl od ubrogepantu, jen částečně metabolizován (přibližně tři čtvrtiny podaného léčiva se vylučují v nezměněné formě), zejména cestou CYP3A4 a z malé části také cestou CYP2C9, na neúčinné metabolity, které se spolu s mateřskou látkou vylučují převážně močí. Biologický poločas rimegepantu je 11 hodin, což umožňuje podání v jediné denní dávce [9]. U pacientů s mírnou poruchou funkce ledvin, resp. jater není třeba upravit dávky rimegepantu. U pacientů s těžkou poruchou funkce jater nebo ledvin je třeba se podávání rimegepantu vyhnout.
Rimegepant je středně citlivým substrátem CYP3A4, dále je substrátem P gp a BCRP [9]. Na rozdíl od ubrogepantu dochází při souběžném podávání rimegepantu spolu se silným inhibitorem CYP3A4 itrakonazolem ke zvýšení expozice rimegepantu o 400 %. Je však třeba zdůraznit, že se na této lékové interakci významně podílí také inhibice P gp navozená itrakonazolem. To potvrzují výsledky studie zaměřené na průkaz lékové interakce rimegepant−flukonazol. Při této lékové interakci nastává zvýšení expozice rimegepantu pouze o 80 %, neboť flukonazol je slabým inhibitorem P gp, a k lékové interakci tak dochází pouze z důvodu inhibice metabolismu (cestou CYP3A4 a CYP2C9) navozeného flukonazolem. Z výše uvedených důvodů držitel rozhodnutí o registraci rimegepantu uvádí, že v případě podávání silných inhibitorů CYP3A4 je třeba se podání rimegepantu vyhnout a v případě podávání středně silných inhibitorů CYP3A4 musí být mezi jednotlivými dávkami rimegepantu odstup nejméně 48 hodin.
Významně výraznější změny
farmakokinetických parametrů rimegepantu je dosaženo při jeho
souběžném podávání s induktory CYP3A4 (a P gp).
Tak například souběžné podávání rifampicinu a rimegepantu
vede ke snížení expozice rimegepantu o 80 %, což může
vést k poklesu až selhání jeho účinku [9]. Studie
prokazující lékové interakce mezi rimegepantem a středně
silnými induktory CYP3A4 nebyly dosud provedeny. Držitel rozhodnutí
odhaduje, že středně silné induktory CYP3A4 snižují expozice
rimegepantu o přibližně 50 %. Podání rimegepantu při
terapii středně silnými nebo silnými induktory CYP3A4 je třeba
se vyhnout.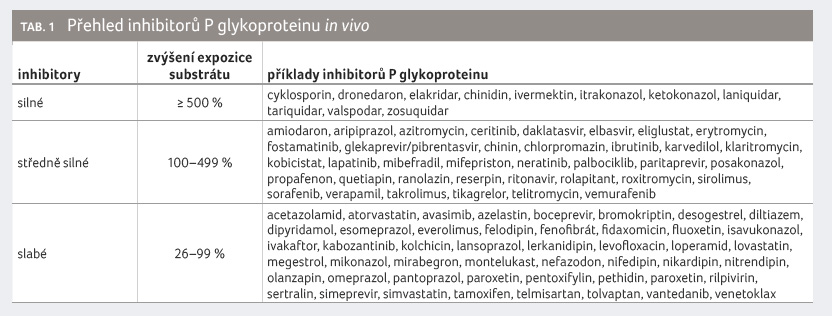
Vedle výše uvedených omezení ještě držitel rozhodnutí o registraci uvádí, že souběžného podávání rimegepantu s inhibitory P gp nebo BCRP je třeba se vyvarovat [10]. Přehled inhibitorů P gp a BCRP uvádíme v tabulce 1 a 2.
Rimegepant je slabým až středně
silným inhibitorem CYP3A4, neboť zvyšuje expozici souběžně
podávanému perorálnímu midazolamu o přibližně
100 % [9]. Rimegepant nezvyšuje expozici sumatriptanu [11].
Lékové interakce
Po 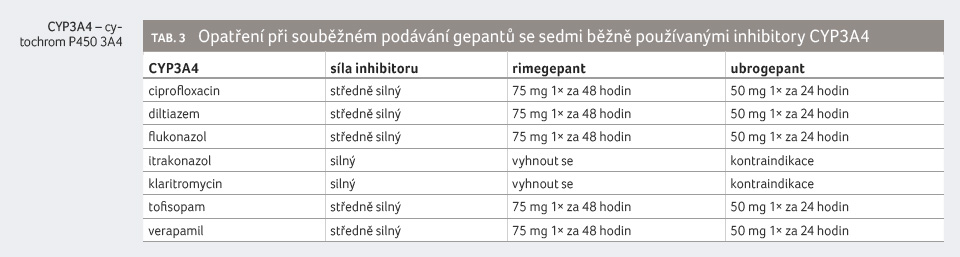 vstupu gepantů na evropský
(český) trh bude problematika lékových interakcí velmi aktuální,
neboť oba gepanty mají značné množství lékových interakcí
s mnoha běžně používanými léčivými přípravky.
Příklady takových lékových interakcí s nejběžněji
používanými inhibitory CYP3A4 jsou uvedeny v tabulce 3
nebo s induktory CYP3A4 v tabulce 4 (tabulky
uvádějí vždy sedm relativně běžně používaných inhibitorů,
resp. induktorů CYP3A4).
vstupu gepantů na evropský
(český) trh bude problematika lékových interakcí velmi aktuální,
neboť oba gepanty mají značné množství lékových interakcí
s mnoha běžně používanými léčivými přípravky.
Příklady takových lékových interakcí s nejběžněji
používanými inhibitory CYP3A4 jsou uvedeny v tabulce 3
nebo s induktory CYP3A4 v tabulce 4 (tabulky
uvádějí vždy sedm relativně běžně používaných inhibitorů,
resp. induktorů CYP3A4).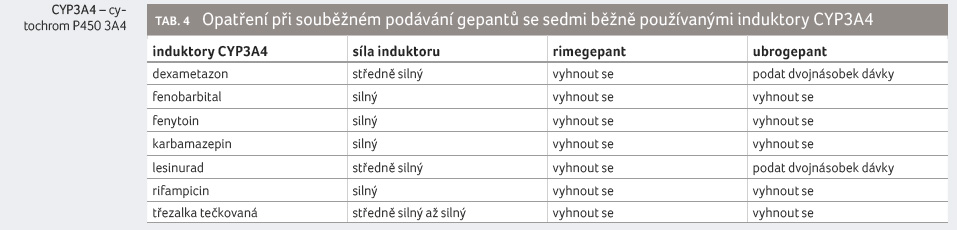
Opatření v případě souběžného podávání gepantů s inhibitory CYP3A4 jsou z klinického hlediska velmi významná. V případě silných inhibitorů CYP3A4 je nezbytné se vyhnout podávání rimegepantu, podávání ubrogepantu je pak kontraindikované. Souběžné podávání silných inhibitorů CYP3A4 a gepantů je tak (v případě Souhrnu údajů o přípravku [SPC] platného v USA) postupem tzv. off label. Jaké znění bude mít SPC obou gepantů po jejich registraci v Evropské unii, zatím není zřejmé. Je však velmi pravděpodobné, že bude velmi obdobné ve smyslu nemožnosti souběžného podávání gepantů a silných inhibitorů CYP3A4.
V případě souběžného podávání středně silných inhibitorů CYP3A4 je nezbytné redukovat dávky ubrogepantu, resp. prodloužit intervaly mezi dávkami. Dokonce při podávání slabých inhibitorů CYP3A4 není možné jednotlivou dávku ubrogepantu zvýšit na 100 mg.
Opatření v případě souběžného podávání gepantů s induktory CYP3A4 jsou z klinického hlediska velmi významná. V případě souběžného podávání silných induktorů CYP3A4 je nezbytné se podání gepantu vyhnout. V případě ubrogepantu a souběžného podávání středně silných inhibitorů CYP3A4 je pak nezbytné obvyklé dávky (50 mg) ubrogepantu zvýšit na dvojnásobek (100 mg).
Lékové interakce monoklonálních
protilátek proti CGRP
Mezi monoklonální protilátky působící na ligand pro CGRP patří eptinezumab (Vyepti, dosud není v Evropě registrován), fremanezumab (Ajovy) a galkanezumab (Emgality).
Eptinezumab je humanizovaný imunoglobulin IgG1κ, jehož biologický poločas činí 27 dnů. Obvyklá dávka je 100 mg aplikovaných nitrožilně jednou za tři měsíce. Fremanezumab je humanizovaný imunoglobulin IgG2Δa/κ, který se váže na obě izoformy CGRP, čímž brání jejich vazbě na receptor pro CGRP. Fremanezumab má biologický poločas 30 dnů. Fremanezumab se podává podkožně v dávkách 225 mg jednou za čtyři týdny nebo 675 mg jednou za tři měsíce. Galkanezumab je humanizovaný imunoglobulin IgG4, jehož biologický poločas činí 27 dnů [12]. Obvyklá doporučená dávka je 120 mg jednou za čtyři týdny s tím, že první dávka činí 240 mg, aplikuje se podkožně.
Fremanezumab ani galkanezumab neovlivňují koncentrace tumor nekrotizujícího faktoru alfa (TNFα), interleukinu 6 (IL 6), interferonu gama (IFNγ) nebo IL 1β, a proto neovlivňují expresi jednotlivých typů enzymů cytochromu P450. Fremanezumab stejně jako galkanezumab nejsou substrátem CYP3A4 ani jiných oxidáz [13,14].
V organismu se tyto biologické léky metabolizují cestou proteáz na peptidy, které jsou dále katabolizovány. Farmakokinetické vlastnosti fremanezumabu nejsou ovlivněny souběžným podáváním jiných antimigrenik (námelové alkaloidy, triptany) nebo analgetik [13]. V případě galkanezumabu žádné studie zaměřené na lékové interakce provedeny nebyly, přesto lze s vysokou pravděpodobností předpokládat, že ani galkanezumab nebude interagovat s běžně užívanými léčivy.
Fremanezumab i galkanezumab patří z hlediska lékových interakcí k bezpečným léčivům.
Lékové interakce monoklonálních protilátek proti receptoru pro CGRP
Mezi monoklonální protilátky působící na receptor pro CGRP patří pouze erenumab (Aimovig). Jedná se o lidský imunoglobulin IgG2, jehož biologický poločas činí 28 dnů [15]. Obvyklá doporučená dávka je 70 mg jednou za čtyři týdny, v případě potřeby je možné dávku zvýšit na 140 mg jednou za čtyři týdny, aplikuje se podkožně. Erenumab neovlivňuje koncentrace TNFα, IL 6, IFNγ nebo IL 1β, a proto neovlivňuje expresi jednotlivých typů enzymů cytochromu P450 [16]. Erenumab není substrátem CYP3A4 ani jiných oxidáz.
V případě erenumabu byly provedeny formální studie zaměřené na lékové interakce. Bylo prokázáno, že aplikace erenumabu nemá vliv na farmakokinetické vlastnosti a účinnost kombinované hormonální kontracepce, konkrétně etinylestradiolu a norgestimátu [17]. Ve studii provedené držitelem rozhodnutí o registraci bylo prokázáno, že aplikace erenumabu nemá vliv na farmakokinetické vlastnosti ani účinek sumatriptanu [16].
Také erenumab patří z hlediska lékových interakcí k bezpečným léčivům.
Závěr
Námelové alkaloidy, včetně kodergokrinu (léčivý přípravek Secatoxin), mají velmi vysoký interakční potenciál. Interagují na podkladě inhibice nebo indukce CYP3A4, přičemž důsledkem inhibice CYP3A4 jsou projevy toxicity těchto léčiv, s případným fatálním zakončením. Vedle řady inhibitorů ze skupiny léků je nezbytné vzít v úvahu řadu inhibitorů CYP3A4 přírodního původu, které mohou mít středně silný, nebo dokonce i silný inhibiční efekt. Jedná se o černý pepř (inhibitorem je piperin), zelený čaj, resp. extrakt ze zeleného čaje (inhibitorem jsou galokatechiny), grapefruitovou šťávu (inhibitorem je zejména naringin), řadu léčivých rostlin (smuteň hořká, dřišťál osinatý, kurkuma dlouhá a další).
Rovněž některé triptany mají značný interakční potenciál. Týká se to zejména eletriptanu, který je citlivým substrátem CYP3A4, podobně jako námelové alkaloidy. Dále pak sumatriptanu a rizatriptanu, které jsou citlivými substráty MAO A. V této souvislosti je nezbytné uvést, že značné množství přírodních látek, resp. extraktů z rostlin používaných jako doplňky stravy má MAO A inhibiční aktivitu. To se týká nejen třezalky tečkované, ale též harmaly mnohodílné nebo rozchodnice růžové. Jiné triptany mají nižší potenciál pro lékové interakce – jde zejména o almotriptan, naratriptan a zolmitriptan. To však neznamená, že tyto triptany nemají žádné lékové interakce, neboť i tato léčiva působí serotonergně a vyvolávají vazokonstrikci.
Lasmiditan má relativně nízký potenciál pro lékové interakce, není substrátem CYP3A4 a nevyvolává vazokonstrikci. Působí však serotonergně a není dosud známo, jakou měrou inhibuje transportní systémy P gp a BCRP in vivo.
Gepanty (rimegepant a ubrogepant) jsou citlivými substráty zejména CYP3A4, a mají proto značné množství lékových interakcí jak s inhibitory, tak s induktory CYP3A4. Část z těchto lékových interakcí je natolik klinicky významná, že souběžné podávání je dokonce považováno za kontraindikované. U další části lékových interakcí je nezbytné upravit dávkování příslušného gepantu. Problematiku lékových interakcí gepantů však nelze považovat za uzavřenou, dá se očekávat, že budou postupně odhalovány další lékové interakce, které vyplývají z vlastností gepantů, tedy interakce na podkladě inhibice či indukce transportních systémů.
Biologická léčiva působící na CGRP nebo na receptor pro CGRP naproti tomu lékové interakce nemají a je vysoce pravděpodobné, že žádné lékové interakce nebudou objeveny ani v budoucnosti. Vlastnosti těchto léčiv takovou možnost prakticky vylučují.
Seznam použité literatury
- [1] Rubio‑Beltrán E, Labastida‑Ramírez A, Haanes KA, et al. Characterization of binding, functional activity, and contractile responses of the selective 5‑HT1F receptor agonist lasmiditan. Br J Pharmacol 2019; 176: 4681–4695.
- [2] CDER Clinical Pharmacology and Biopharmaceutics Review, Application Number 211280Orig1s000, Reyvow® (lasmiditan), 10/2018. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/211280Orig1s000ClinPharmR.pdf
- [3] Tsai M, Case M, Ardayfio P, et al. Effects of Lasmiditan on Cardiovascular Parameters and Pharmacokinetics in Healthy Subjects Receiving Oral Doses of Propranolol. Clin Pharmacol Drug Dev 2020; 9: 629–638.
- [4] FDA Full Prescribing Information: Reyvow® (lasmiditan), 7/2020. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/211280s001lbl.pdf
- [5] Loo LS, Ailani J, Schim J, et al. Efficacy and safety of lasmiditan in patients using concomitant migraine preventive medications: Findings from SAMURAI and SPARTAN, two randomized phase 3 trials. J Headache Pain 2019, 20: 84.
- [6] Szkutnik‑Fiedler D. Pharmacokinetics, Pharmacodynamics and Drug‑Drug Interactions of New Anti‑Migraine Drugs‑Lasmiditan, Gepants, and Calcitonin‑Gene‑Related Peptide (CGRP) Receptor Monoclonal Antibodies. Pharmaceutics 2020; 12: 1180.
- [7] Blumenfeld AM, Edvinsson L, Jakate A, et al. Pharmacology and Pharmacokinetics of Ubrogepant: A Potent, Selective Calcitonin Gene‑Related Peptide Receptor Antagonist for the Acute Treatment of Migraine. J Fam Pract 2020; 69(Suppl 1): S8–S12.
- [8] CDER Clinical Pharmacology and Biopharmaceutics Review, Application Number 211765Orig1s000, Ulbrevy®, 12/2019. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2019/211765Orig1s000ClinPharmR.pdf
- [9] CDER Clinical Pharmacology and Biopharmaceutics Review, Application Number 211765Orig1s000, Nurtec ODT®, 2/2020. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2020/212728Orig1s000ClinPharmR.pdf
- [10] FDA Full Prescribing Information: Nurtec ODT® (rimegepant), Biohaven, 8/2020. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/212728s001lbl.pdf
- [11] Croop R, Ivans A, Anderson MS, et al. Oral rimegepant produces nosignificant effect on blood pressure when administered concomitantly with sc sumatriptan. Headache 2020; 60: 116.
- [12] Lamb YN. Galcanezumab: First Global Approval. Drugs 2018; 78: 1769–1775.
- [13] CDER Clinical Pharmacology and Biopharmaceutics Review, Application Number 761089Orig1s000, Ajovy®, 9/2018. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/761089Orig1s000ClinPharmR.pdf
- [14] CDER Clinical Pharmacology and Biopharmaceutics Review, Application Number 761063Orig1s000, Emgality®, 9/2018. Dostupné na: https://www.accessdata.fda.gov/scripts/cder/daaf/index.cfm?event= overview.process&varApplNo=761063
- [15] Stoker K, Baker DE. Erenumab‑aooe. Hosp Pharm 2018; 53: 363–368.
- [16] CDER Clinical Pharmacology and Biopharmaceutics Review, Application Number 761077Orig1s000, Aimovig®, 5/2018. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2018/761089Orig1s000ClinPharmR.pdf
- [17] Xu Y, Gabriel K, Wang Y, et al. A Multi‑Center, Open‑Label, Pharmacokinetic Drug Interaction Study of Erenumab and a Combined Oral Contraceptive in Healthy Females. CNS Drugs 2019; 33: 513–522.