Perorální topotekan ve druhé linii léčby malobuněčného karcinomu plic
Relabující malobuněčný karcinom plic patří pro svou agresivitu k obtížně léčitelným malignitám. Dosavadní léčebné protokoly ve druhé linii terapie nebyly pro svou toxicitu a neuspokojivou léčebnou odpověď pro nemocné dalším přínosem. Do nedávné doby byl jediným registrovaným léčivem pro tuto indikaci topotekan v intravenózní lékové formě. Nově byl do léčebné praxe zaveden a registrován pro tuto indikaci topotekan ve formě perorální, který přináší stejnou účinnost při srovnatelné hematologické i nehematologické toxicitě, dovoluje léčbu nemocných i s nízkým výchozím klinickým stavem (performance status, PS), je dobře tolerován bez potřeby rutinní antiemetické premedikace a celkově zvyšuje compliance pacienta k léčbě.
Úvod
Malobuněčný karcinom (SCLC) reprezentuje, čerpáno z evropské literatury, zhruba 20–25 % případů rakoviny plic [1]. Jiné zdroje, především ze severoamerického regionu, udávají přibližně 13 %, pravděpodobně v důsledku poklesu kuřáctví [2]. Rozsah nemoci je klasifikován pro limitovanou chorobu jako postižení jednoho hemithoraxu s postižením nebo bez postižení přilehlých uzlin anebo uzlin stejnostranných supraklavikulárních bez pleurálního výpotku, extenzivní nemoc pak překračuje tolerovatelné radiační pole. Malobuněčný karcinom je agresivní nádor s velkou tendencí k vývoji časných regionálních a vzdálených metastáz. Je pokládán za vysoce senzitivní nádor jak k chemoterapii, tak k ozáření. Nicméně všeobecně bylo dosaženo jen malého zlepšení v přežití pacientů v závislosti na medikamentózní léčbě a ozáření. Standardem léčby je kombinace chemoterapie zahrnující cisplatinu nebo karboplatinu a etoposid spolu s konkomitantním nebo sekvenčním ozářením [3]. Tento režim dosahuje obvykle rychlé léčebné odpovědi, a to u 50–80 % pacientů, zvláště v limitovaném stadiu onemocnění. Kompletní remise jsou pozorovány jen u malé části pacientů, doba léčebné odpovědi je krátká s mediánem 6–8 měsíců a dvouleté přežití pacientů s limitovaným onemocněním představuje pouhých 5 %. Extenzivní onemocnění má prognózu obvykle horší [4].
V klinické praxi rozlišujeme onemocnění senzitivní s dobou trvání léčebné odpovědi po ukončené první linii chemoterapie delší než 3 měsíce, nebo rezistentní (také refrakterní) bez léčebné odpovědi či s odpovědí kratší než 3 měsíce. Zatímco u onemocnění senzitivního se můžeme s dočasným úspěchem vrátit k režimu použitému v první linii, tedy nejčastěji k podávání etoposidu a platinového derivátu, u onemocnění rezistentního jsou efekty léčby při tomto léčebném protokolu neuspokojivé. Prodloužení cyklů chemoterapie 1. linie za horizont šesti cyklů neznamená pro pacienta další přínos a je provázeno vysokou toxicitou hematologickou i nehematologickou.
Jiným alternativním režimem po selhání předchozí léčby byl léčebný protokol kombinace cyklofosfamidu, doxorubicinu (adriamycin) a vinkristinu (CAV). Z nežádoucích účinků, kromě hematologických, dominuje v tomto režimu také kardiotoxicita antracyklinu. Několik nerandomizovaných studií zahrnujících přibližně 200 pacientů prokazuje objektivní léčebnou odpověď tohoto režimu ve druhé linii léčby, a to v rozmezí 8–15 % [5, 6].
Inhibitory topoizomeráz
Jedním ze známých mechanismů protinádorového účinku cytostatické léčby je inhibice topoizomeráz I a II. DNA topoizomerázy jsou nukleární enzymy, které mají zásadní význam pro hladký průběh replikace. Dvojspirála DNA prodělává torzi kolem vlastní osy, jež by následně vedla k „překroucení“ šroubovice a ke zlomu v řetězci. Kritické období je ve fázi S, kdy vzniká „replikační vidlička“. Topoizomeráza I se váže na jeden řetězec dvojspirály, který rozpojí, uvolní nadměrnou torzi a přerušený řetězec opět spojí. Dočasné přerušení řetězce umožní zahájení replikačního procesu. Topoizomeráza II se váže na oba řetězce dvojspirály, působí jejich přerušení, vzájemné opětné spojení a umožní separaci chromozomů při mitóze. Obě topoizomerázy tedy ovlivňují tzv. topologii DNA. Při blokádě jejich funkce nedojde k opětnému spojení rozštěpených řetězců a tyto zlomy v DNA mají pro další osud buňky letální účinek [7].
K inhibitorům topoizomerázy I patří např. irinotekan a topotekan, k inhibitorům topoizomerázy II pak tenipozid a etopozid.
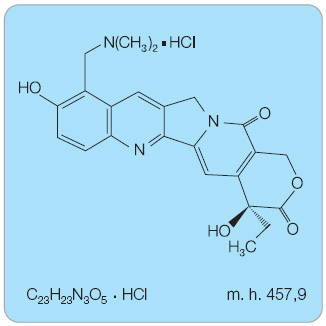 Topotekan je ve vodě rozpustný polosyntetický derivát alkaloidu kamptotecinu používaný ve formě hydrochloridu. Po rozpuštění dochází k hydrolýze biologicky aktivního laktonu na inaktivní formu. Chemický název topotekan hydrochloridu je (S)-10-[(dimethylamino)methyl]-4-ethyl-4,9-dihydroxy-1H-pyrano[3',4': 6,7]indolizino- [1,2-b]chinolin-3,14-(4H,12H)-dion hydrochlorid (obr. 1).
Topotekan je ve vodě rozpustný polosyntetický derivát alkaloidu kamptotecinu používaný ve formě hydrochloridu. Po rozpuštění dochází k hydrolýze biologicky aktivního laktonu na inaktivní formu. Chemický název topotekan hydrochloridu je (S)-10-[(dimethylamino)methyl]-4-ethyl-4,9-dihydroxy-1H-pyrano[3',4': 6,7]indolizino- [1,2-b]chinolin-3,14-(4H,12H)-dion hydrochlorid (obr. 1).
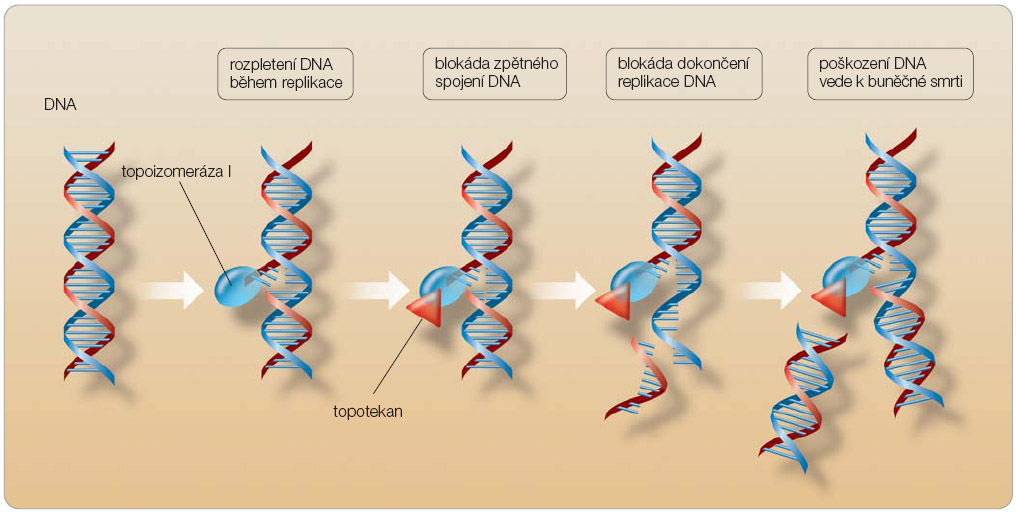 Cytostatická aktivita topotekanu spočívá v inhibici enzymu topoizomerázy I, který hraje důležitou roli při procesu replikace tím, že uvolňuje torzní napětí molekuly DNA před místem větvení. Topotekan inhibuje topoizomerázu I stabilizací kovalentního komplexu mezi enzymem a štěpeným vláknem DNA, což je mezistupeň katalytického procesu. Inhibice topoizomerázy topotekanem vede v buňce k indukci jednovláknových zlomů v DNA (obr. 2).
Cytostatická aktivita topotekanu spočívá v inhibici enzymu topoizomerázy I, který hraje důležitou roli při procesu replikace tím, že uvolňuje torzní napětí molekuly DNA před místem větvení. Topotekan inhibuje topoizomerázu I stabilizací kovalentního komplexu mezi enzymem a štěpeným vláknem DNA, což je mezistupeň katalytického procesu. Inhibice topoizomerázy topotekanem vede v buňce k indukci jednovláknových zlomů v DNA (obr. 2).
Klinické studie s intravenózním topotekanem
Jediná dostupná randomizovaná studie srovnávající režim CAV s intravenózním topotekanem je z roku 1999 [8]. Monoterapie topotekanem prokázala podobný účinek jako kombinovaná léčba CAV, přičemž topotekan poskytl – spolu s menším počtem neutropenií – lepší kontrolu symptomů než režim CAV, a to v kontrole dušnosti, chrapotu, anorexie, únavy, při aktivitách denního života, bolesti, hemoptýze.
Topotekan je dobře tolerován, není spojován s orgánovou toxicitou, zejména s kardiotoxicitou a neurotoxicitou, podávání se obejde bez nutnosti rutinní antiemetické premedikace. Standardním režimem intravenózního chemoterapeutického protokolu je 1,5 mg/m2 topotekanu v monoterapii ve 30minutové infuzi v den 1–5 ve 21denním cyklu.
Několik dalších studií fáze II/III potvrdilo tyto výsledky s ohledem na odpověď, průměrné celkové přežití, průměrný čas do progrese a zlepšení výkonnostního stavu pacienta [9–14].
Perorální léková forma topotekanu
V nedávné době byla uvedena na trh v České republice perorální forma topotekanu v tobolkách. Ty jsou vyráběny ve dvou silách – 0,25 mg a 1 mg [15]. V předchozích letech byly obě lékové formy testovány v klinických studiích [9, 16–18].
Doporučená dávka perorálního topotekanu je 2,3 mg/m2 tělesného povrchu/den podávaná 5 po sobě následujících dnů, s intervalem 21 dnů mezi začátky jednotlivých cyklů.
Farmakokinetika
Topotekan je absorbován rychle, nejvyšších plazmatických koncentrací dosahuje za 1–2 hodiny po perorálním podání. V klinických studiích byla biologická dostupnost perorálního topotekanu přibližně 40 %. Tobolky topotekanu mohou být užity s jídlem nebo bez jídla.
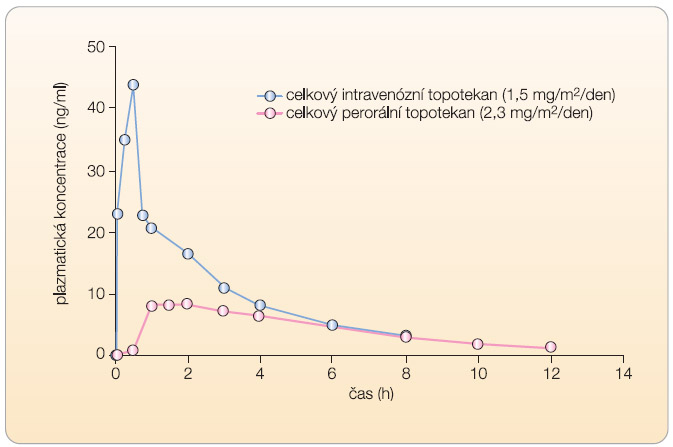 Aktivní složka laktonu topotekanu prochází reverzibilní pH-nezávislou hydrolýzou. Jedná se o farmakologicky aktivní formu laktonu. Při pH ≤ 4 je lakton výlučně přítomen, zatímco při fyziologickém pH převládala forma karboxylátu s otevřeným kruhem hydroxykyseliny. Poměr průměrných AUC (area under curve, plocha pod křivkou) hladin metabolitu a mateřské látky byl méně než 10 % pro topotekan i lakton topotekanu. Rozdíly v plazmatických koncentracích intravenózní a perorální formy topotekanu popisuje graf 1.
Aktivní složka laktonu topotekanu prochází reverzibilní pH-nezávislou hydrolýzou. Jedná se o farmakologicky aktivní formu laktonu. Při pH ≤ 4 je lakton výlučně přítomen, zatímco při fyziologickém pH převládala forma karboxylátu s otevřeným kruhem hydroxykyseliny. Poměr průměrných AUC (area under curve, plocha pod křivkou) hladin metabolitu a mateřské látky byl méně než 10 % pro topotekan i lakton topotekanu. Rozdíly v plazmatických koncentracích intravenózní a perorální formy topotekanu popisuje graf 1.
Topotekan je eliminován především hydrolýzou laktonového kruhu za vzniku karboxylátu s otevřeným kruhem. Kromě hydrolýzy je topotekan vylučován zejména ledvinami. Malá část je metabolizována na N-desmethyl metabolit nacházející se v plazmě, moči a stolici. Celkové opětovné využití topotekanu a jeho metabolitů představovalo po aplikaci 5 denních dávek přípravku 41 % až 76 % (průměrně 57 %) podané perorální dávky. Močí bylo vyloučeno přibližně 20 % celkového topotekanu a 2 % N-desmethyl topotekanu. Stolicí bylo vyloučeno 33 % celkového topotekanu a 1,5 % N-desmethyl topotekanu.
Křížová studie zahrnující 217 pacientů s pokročilými solidními tumory naznačila, že z klinického hlediska nebyla farmakokinetika perorálního topotekanu významně ovlivněna věkem ani pohlavím pacientů. K tomu, aby bylo určeno, zda farmakokinetiku perorálního topotekanu ovlivňuje rasa pacienta, nebylo získáno dostatečné množství údajů.
Topotekan je částečně eliminován ledvinami a porucha funkce ledvin může způsobit zvýšenou expozici topotekanu. Doporučené dávkování pro pacienty užívající perorální topotekan s clearance kreatininu < 60 ml/min nebylo určeno. Zkušenosti s užíváním perorálního nebo intravenózního topotekanu u pacientů s vážně poškozenou funkcí ledvin (clearance kreatininu < 20 ml/min) jsou nedostatečné. V případě těchto pacientů se užívání topotekanu nedoporučuje.
Topotekan je substrátem dvou efluxních přenašečů, ABCB1 (P-glykoprotein, P-gp) a ABCG2 (BCRP). Elakridar (inhibitor ABCB1 a ABCG2) podaný současně s topotekanem zvýšil expozici topotekanu 2,5krát. Ciklosporin A (inhibitor ABCB1, ABCC1 [MRP-1] a CYP3A4) podaný současně s topotekanem zvýšil expozici topotekanu přibližně 2–2,5krát. Pokud je topotekan podáván současně s takovým léčivem, měli by být pacienti pečlivě monitorováni.
Ve studiích in vitro, kde byly použity markery, neovlivnil topotekan činnost lidských cytochromů P-450 (CYP1A2, CYP2A6, CYP2C8/9, CYP2C19 CYP2D6, CYP2E, CYP3A nebo CYP4A) nebo dihydropyrimidin dehydrogenázy. Ve studiích in vivo nebyla hodnocena inhibice enzymů topotekanem [15].
Klinické zkušenosti
Studie fáze II prokázaly zvladatelnou, nekumulativní myelosupresi a lepší nehematologický bezpečnostní profil, dvojnásobnou délku přežití oproti BSC (best supportive care, nejlepší podpůrná léčba), což bylo potvrzeno dalšími studiemi fáze III.
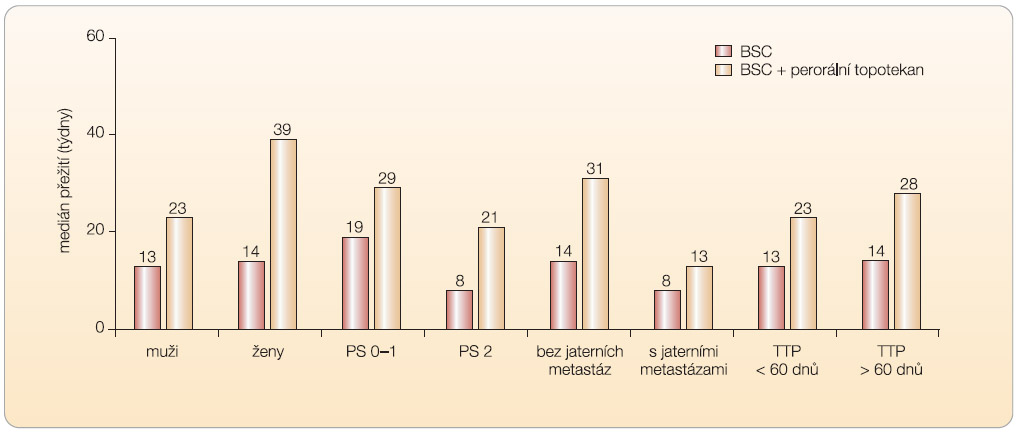 V klinické studii fáze III (n = 141) byl srovnáván perorální topotekan v kombinaci s BSC se samotnou BSC (studie 478) [17]. Topotekan byl podáván perorálně v dávce 2,3
V klinické studii fáze III (n = 141) byl srovnáván perorální topotekan v kombinaci s BSC se samotnou BSC (studie 478) [17]. Topotekan byl podáván perorálně v dávce 2,3 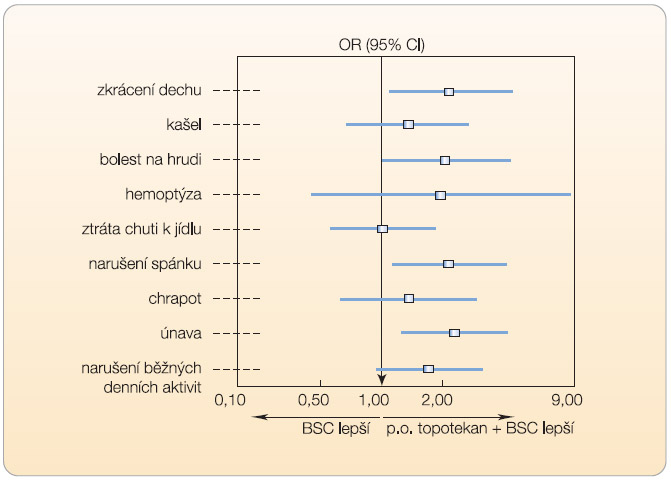 mg/m2/den ve dnech 1–5 každých 21 dnů. Medián přežití ve skupině topotekan + BSC činil 25,9 týdne a ve skupině BSC 13,9 týdne, viz graf 2. Ve skupině pacientů užívajících topotekan byla zaznamenána hematologická toxicita stupně 4 (neutropenie 33 %, trombocytopenie 7 %) a stupně 3/4 (anémie 25 %). Zmírnění symptomů, jako je zkrácení dechu, kašel, bolest na hrudi atd., bylo rovněž významnější ve skupině pacientů, kteří dostávali topotekan (graf 3).
mg/m2/den ve dnech 1–5 každých 21 dnů. Medián přežití ve skupině topotekan + BSC činil 25,9 týdne a ve skupině BSC 13,9 týdne, viz graf 2. Ve skupině pacientů užívajících topotekan byla zaznamenána hematologická toxicita stupně 4 (neutropenie 33 %, trombocytopenie 7 %) a stupně 3/4 (anémie 25 %). Zmírnění symptomů, jako je zkrácení dechu, kašel, bolest na hrudi atd., bylo rovněž významnější ve skupině pacientů, kteří dostávali topotekan (graf 3).
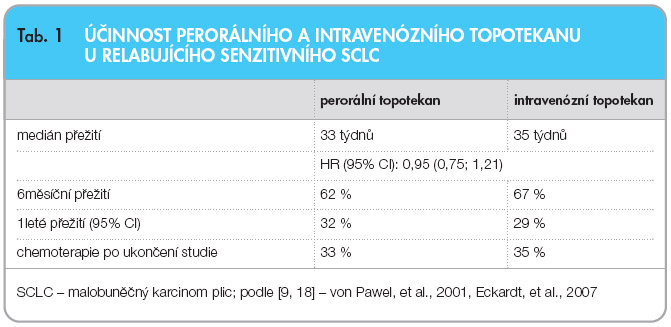 Perorální topotekan byl srovnáván v klinické studii fáze II (065) a fáze III (396) s intravenózním topotekanem se závěrem: účinnost perorálního topotekanu je u relabujícího senzitivního SCLC klinicky srovnatelná s intravenózním topotekanem [9, 18]. Byla prokázána srovnatelná doba do progrese a srovnatelný medián přežívání (tab. 1).
Perorální topotekan byl srovnáván v klinické studii fáze II (065) a fáze III (396) s intravenózním topotekanem se závěrem: účinnost perorálního topotekanu je u relabujícího senzitivního SCLC klinicky srovnatelná s intravenózním topotekanem [9, 18]. Byla prokázána srovnatelná doba do progrese a srovnatelný medián přežívání (tab. 1).
Kontraindikace
Podání topotekanu je kontraindikováno u nemocných, kteří mají v anamnéze výskyt hypersenzitivních reakcí na léčivou látku nebo na kteroukoli pomocnou látku přípravku. Dále pak u pacientů, kteří mají již před zahájením prvního cyklu podání těžký útlum kostní dřeně (výchozí počet neutrofilů < 1,5 x 109/l a/nebo počet trombocytů < 100 x 109/l) [15].
Topotekan má embryotoxické a cytotoxické účinky a během jeho užívání je nutné zabránit otěhotnění. I když není prokázáno, zda topotekan prochází do mateřského mléka, musí se kojení na začátku terapie přerušit [15].
V případě nezvládnutelného zvracení, poruch polykání, nezvládnutelného průjmu a v případě, kdy klinický stav nebo medikamentózní léčba mohou ovlivnit gastrointestinální motilitu a absorpci léčiva, je třeba zvážit podání intravenózní formy topotekanu [15].
Nežádoucí účinky
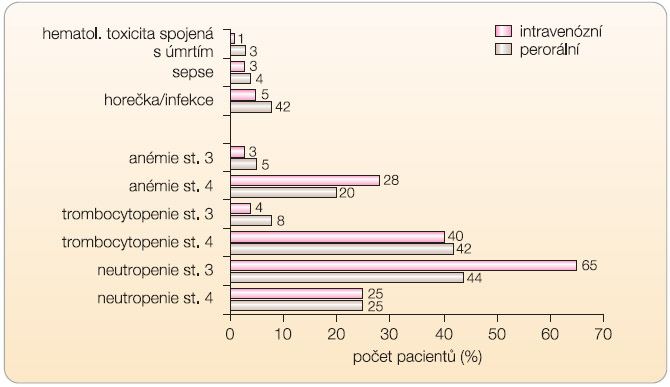 Údaje o bezpečnosti léčby perorálním topotekanem z databáze bezpečnosti (populace 682 léčených pacientů) jsou shrnuty v grafu 4 a 5 [9, 18]. Hematologická toxicita: 10,1 % pacientů vyžadovalo oddálení dávky,
Údaje o bezpečnosti léčby perorálním topotekanem z databáze bezpečnosti (populace 682 léčených pacientů) jsou shrnuty v grafu 4 a 5 [9, 18]. Hematologická toxicita: 10,1 % pacientů vyžadovalo oddálení dávky, ![Graf 5 Nehematologická toxicita po podání topotekanu: integrovaná data ze studií 065/396; podle [9, 18] – von Pawel, et al., 2001, Eckardt, et al., 2007.](https://www.remedia.cz/photo-a-27608---.jpg) 7,3 % pacientů vyžadovalo redukci dávky. Nehematologická toxicita: 2 % pacientů vyžadovala oddálení dávky a 1 % pacientů vyžadovalo redukci dávky. Celkem bylo podáno 2536 cyklů, z toho 2101 (83 %) s dávkou ≥ 2,3 mg/m2/den. Compliance pacientů k léčbě činila 91 %.
7,3 % pacientů vyžadovalo redukci dávky. Nehematologická toxicita: 2 % pacientů vyžadovala oddálení dávky a 1 % pacientů vyžadovalo redukci dávky. Celkem bylo podáno 2536 cyklů, z toho 2101 (83 %) s dávkou ≥ 2,3 mg/m2/den. Compliance pacientů k léčbě činila 91 %.
Závěr
Léčba malobuněčného karcinomu plic ve druhé linii je po vyčerpání předchozí chemoradioterapie obtížná. Nejsou známy spolehlivé prediktivní faktory léčebné odpovědi. Poněkud lepších výsledků je dosahováno v terapii limitovaného stadia onemocnění. Topotekan v intravenózní formě přinesl srovnatelné výsledky přežití, času do progrese nemoci, avšak s lepší hematologickou i nehematologickou toxicitou, bez výraznější orgánové toxicity a s lepší kontrolou symptomů než ostatní dosud používané intravenózní léčebné protokoly. Perorální topotekan zvyšuje compliance pacienta k léčbě a dovoluje, i vzhledem k délce režimu, podávání v domácím prostředí s ambulantními kontrolami laboratorních hodnot a klinického stavu nemocného. Topotekan v obou lékových formách je prozatím jediným registrovaným léčivem malobuněčného karcinomu plic po selhání předchozí léčby.
Seznam použité literatury
- [1] Monnerat C, Le Chevalier T. Chemotherapy for non-small-cell lung carcinoma, a look at the past decade. Annals of Oncology 2000; 11: 773–776.
- [2] Govindan R, Page N, Morgensztern D, et al. Changing epidemiology of small cell lung cancer in the United States over the last 30 years: analysis of the surveillance, epidemiologic, and end-results database. J Clin Oncol 2006; 24: 4539–4544.
- [3] Felip E, Stahel RA, Pavlidis N. ESMO Minimum Clinical Recommendations for diagnosis, treatment and follow-up of small-cell lung cancer (SCLC). Ann Oncol 2005; 16 (suppl. 1): i30–i31.
- [4] Boral AL, Lunch T (JR). Chemotherapy of Small-Cell Lung Cancer. In: Skarin AT (ed). Multimodality Treatment of Lung Cancer. New York: Marcel Dekker, Inc., 2000, 381–403.
- [5] Sculier JP, Klastersky J, Libert P, et al. Cyclophosphamide, doxorubicin and vincristine with amphotericin B in sonicated liposomes as salvage therapy for small cell lung cancer. Eur J Cancer 1990; 26: 919–921.
- [6] Shepherd FA, Evans WK, MacCormick R, et al. Cyclophosphamide, doxorubicin and vincristine in etoposide and cisplatin-resistant small-cell lung cancer. Cancer Treat Rep 1987; 71: 941–944.
- [7] Klener P, et al. Klinická onkologie. Praha, Galén 2002: 178–179.
- [8] von Pawel J, Schiller JH, Shepherd FA, et al. Topotecan versus cyclophosphamide, doxorubicine and vincristine for treatment of recurrent small-cell lung cancer. J Clin Oncol 1999; 17: 658–667.
- [9] von Pawel J, Gatzemeier U, Pujol JL, et al. Phase II Comparator Study of Oral Versus Intravenous Topotecan in Patients With Chemosensitive Small-Cell Lung Cancer. J Clin Oncol 2001; 19: 1743–1749.
- [10] Ardizzoni A. Topotecan in the treatment of recurrent small cell lung cancer: an update. Oncologist 2004; 9 (suppl. 6): 4–13.
- [11] Eckardt R, Gralla R, Palmer MC, et al. Topotecan (T) as second-line therapy in patients (Pts) with small cell lung cancer (SCLC): a phase II study (abstract). Ann Oncol 1996; 7 (suppl. 5): 107.
- [12] Treat J, Huang CH, Lane SR, Levin J. Topotecan in the treatment of relapsed SCLC patients with poor Performance Status: Oncologist 2004; 9: 173–181.
- [13] Gerrits CJ, Schellens JH, Burris H, et al. A comparison of clinical pharmacodynamics of different administration schedules of oral topotecan (Hycamtin). Clin Cancer Res 1999; 5: 69–75.
- [14] Herben VMM, Rosing H, ten Bokkel Hunink WW, et al. Oral topotecan: bioavailability and effect of food co-administration. Br J Cancer 1999; 80: 1380–1386.
- [15] Hycamtin, souhrn údajů o přípravku, SmithKline Beecham plc, 980 Great West Road, Brentford, Middlesex, TW8 9GS, Velká Británie. http:// www.emea.europa.eu/humandocs/Humans/ EPAR/hycamtin/hycamtin.htm
- [16] Léger F, Loos WJ, Fourcade J, et al. Factors affecting pharmacokinetic variability of oral topotecan: population analysis. Br J Cancer 2004; 90: 343–347.
- [17] O'Brien M, Ciuleanu TE, Tsekov H, et al. Phase III Trial Comparing Supportive Care Alone With Supportive Care With oral Topotecan in Patients With Relapsed Small-Cell Lung Cancer. J Clin Oncol 2006; 34: 5441–5447.
- [18] Eckardt JR, von Pawel J, Pujol JL. Phase III Study of Oral Compared with Intravenous Topotecan As Second-Line Therapy in Small-Cell Lung Cancer. J Clin Oncol 2007; 25: 2086–2092.