Stabilita a kompatibilita parenterální výživy
Článek je věnován problematice stability a kompatibility směsí pro parenterální výživu připravovaných v lékárnách. Vzhledem k množství faktorů působících na kvalitativní vlastnosti těchto soustav není možné vždy naprosto spolehlivě určit míru jejich stability. Přesto existuje řada opěrných bodů, podle nichž můžeme nejčastější případy a projevy nestability parenterálních směsí odhadnout. Patří mezi ně zejména kompatibilita fosforečnanů a vápenatých sloučenin, stabilita tukových emulzí a jejich kompatibilita s ostatními složkami přípravku, stabilita a kompatibilita vitaminů a vybraných stopových prvků. Kompatibilita některých léčiv, vitaminů a stopových prvků se základními složkami parenterální výživy a stabilita těchto přípravků je v příspěvku uvedena formou tabulek.
Předpis na složení individuálně připravovaných vaků all-in-one (AIO) sestavuje lékař nutricionista za asistence farmaceuta, který je členem nutričního týmu. Je třeba si uvědomit, že typická směs pro parenterální výživu (PV) obsahuje okolo 50 složek různé stability, které mohou vzájemně interagovat. Vhodné koncentrace infundibilií se volí jak s ohledem na kompatibilitu složek, tak z hlediska výsledné zátěže pacienta objemem vody. Příliš malé koncentrace nutriční složky vedou k podání většího množství vody, jež může být u některých stavů nežádoucí. Zpravidla se užívají 20–40% roztoky glukózy, 5–15% roztoky aminokyselin a 20% tukové emulze. Minerály mohou být přidávány zvlášť ve formě koncentrovaných roztoků (10% roztok NaCl, 7,5% roztok KCl, 13,6% roztok KH2PO4, 10% roztok MgSO4, 10% roztok glukonanu vápenatého, roztoky glukóza-1-fosfátu a K-L-malátu), nebo v komplexních přípravcích se stopovými prvky (např. Elotrace) [1]. Výživa AIO obsahuje rovněž různé typy stabilizujících látek a solubilizujících přísad [2]. Smísením jednotlivých složek dochází ke změnám pH, může docházet ke snížení rozpustnosti některých látek a k různým fyzikálně-chemickým změnám (k oxidaci, Maillardově reakci, kondenzaci, krystalizaci, degradaci až k rozkladu). Vše závisí na tom, jakým tepelným a světelným vlivům je přípravek vystaven, na době skladování, na obsahu katalyzujících látek (stopových prvků) [3]. Určitou roli může hrát obalový materiál, zvláště ten, který propouští kyslík [4].
Jednou z klíčových vlastností parenterálních roztoků je sterilita a apyrogenita. Pro udržení sterility složek a výrobků je třeba věnovat zvláštní pozornost zejména prostředí, ve kterém se směsi AIO připravují, personálu, jeho vzdělání a také jeho oblečení. Příprava směsí AIO se uskutečňuje v pracovním prostoru třídy čistoty A, který je umístěn v prostoru třídy čistoty C. Třída čistoty A je zajištěna laminárním boxem, třída čistoty C vyžaduje aseptickou místnost s obměnou vzduchu přes filtrační jednotku.
Do čistého prostoru personál vstupuje přes personální propusť, materiál vstupuje přes vstupní materiálovou propusť a vystupuje výstupní materiálovou propustí.
Povrchy v pracovním prostoru musí být bez ostrých hran, s odolností k povrchové dezinfekci, povrchy všeho vkládaného materiálu do vstupní materiálové propusti musí být řádně očištěny a dezinfikovány. Vhodná je instalace germicidních zářičů. Lékárna, která vyrábí vaky AIO, musí mít zpracován hygienický režim čistých prostor. Personál tvoří atestovaní farmaceuti a farmaceutické asistentky se znalostí práce v čistých prostorech. Pracují ve speciálních kombinézách s nízkou odlučivostí částic, v rouškách, čepicích a rukavicích [5].
Mezi klíčové pojmy charakterizující jakost PV patří stabilita a kompatibilita. Stabilita je vlastnost zachovat si ve stanovených mezích po určitou dobu a za stanovených podmínek uchovávání definované jakostní znaky. V případě PV ukazuje obecně na degradaci nebo snížení obsahu nutričních složek v čase. Kompatibilita popisuje fyzikální a chemické interakce. Je to termín vyjadřující vzájemnou snášenlivost jednotlivých složek léčivého přípravku. Sledování jakostních fyzikálně-chemických parametrů u vaků AIO je velmi důležité, zejména pro různorodost účinných a pomocných látek, jejich citlivost k různým vnějším vlivům, vzhledem k senzitivitě a též polymorbiditě léčených.
-
koncentrace aminokyselin,
-
pH soustavy,
-
koncentrace glukózy,
-
koncentrace elektrolytů,
-
pořadí plnění.
-
konečná koncentrace aminokyselin větší než 2,5 %,
-
výsledné pH ≥ 5,0,
-
nepřítomnost třívalentních iontů (např. dextran železitý),
-
přidávání tukových emulzí v poslední řadě, až po smísení všech složek.
-
stabilita a kompatibilita přípravků obsahujících současně vápenaté a fosforečné ionty (sloučeniny),
-
stabilita lipidových emulzí po přidání ostatních složek přípravku,
-
stabilita a kompatibilita vitaminů a stopových prvků,
-
stabilita a kompatibilita léčiv aplikovaných spolu se složkami parenterální výživy nebo se systémy AIO.
Sloučeniny vápníku a fosforu patří mezi nejběžnější elektrolyty v parenterální výživě [7]. Pokud jsou přítomny ve vysoké koncentraci nebo v nevhodné formě, může vznikat precipitát CaHPO4. Dihydrogenfosforečnan vápenatý Ca(H2PO4)2 je dobře rozpustný ve vodě (71 mmol/l), kdežto hydrogenfosforečnan vápenatý CaHPO4 je prakticky nerozpustný (1,8 mmol/l) [8]. Riziko precipitace snižují následující faktory [9]:
-
koncentrace aminokyselin ≥ 2,5 %,
-
pH ≤ 6,0,
-
použití organických fosforečnanů a vápenatých sloučenin, např. (glukóza-1-fosfát) [10],
-
koncentrace vápníku a fosforu < 8 mmol/l,
-
vápenatofosforečný součin < 75 mmol/l,
-
přidání cysteinu do směsi.
Nejcitlivější složkou směsi AIO je tuková emulze, jejíž stabilita je ovlivňována iontovou silou elektrolytů a pH. Tukové emulze jsou ve stabilním stavu udržovány vlivem mechanických a elektrostatických odpudivých sil za pomoci emulgátoru. Každá tuková emulze k parenterálnímu použití je sterilním, termodynamicky nestabilním disperzním systémem olejové fáze ve vodě. Její malé částice se připravují vynaložením vysoké mechanické energie na obě fáze, fyzikální nestabilita se odstraňuje použitím emulgátorů, nejčastěji na bázi vaječných fosfatidů. Molekuly emulgátorů se skládají z hydrofilní a hydrofobní části a tvoří hranici mezi olejovou a vodnou fází. Hydrofilní části emulgátoru mají elektrický náboj, a proto olejové globule na povrchu působí svojí odpudivou silou, která je schopna zabraňovat spojování jednotlivých tukových částic. Kromě toho existují v systému slabší vazebné interakce (síly van der Waalsovy), které naopak částice přitahují. Tukové částice vykazují v roztoku Brownův pohyb. Povrchový potenciál (zeta potenciál) tukových částic je utvářen ionizací hydrofilních skupin emulgátoru na jejich povrchu. Zeta potenciál má mít hodnotu alespoň -35 mV a je redukován zejména kationty (s valencí iontů stoupá – je tudíž větší u dvoj- či trojmocných iontů) a značně závisí na pH roztoku (při pH < 5,5 nastává prudká redukce zeta potenciálu). Elektrolyty a stopové prvky v tukové emulzi působí negativně na její stabilitu. Čím vyšší je koncentrace iontů a čím vyšší je mocenství iontů, tím spíše v tukové emulzi dochází k překročení kritické hodnoty zeta potenciálu a k rozpadu směsi. Dvojmocné ionty (Ca2+, Mg2+) také mohou tvořit můstky mezi negativně nabitými fosforečnými skupinami a tím usnadňovat shlukování částic. Kritická koncentrace elektrolytů, která již způsobí shlukování tukových částic, se nazývá kritická agregační koncentrace (critical aggregation number, CAN). Za bezpečnou je považována hodnota CAN < 600 mmol/l [2, 4].
![Graf 1 Distribuce velikosti tukových částic u tříkomorového vaku Kabiven v den smísení všech tří komor; podle [22] – Khýnová, 2009.](https://www.remedia.cz/photo-a-27973---.jpg) Tento stav dekompozice je ireverzibilní. Parenterální tukové emulze mají částice o velikosti obvykle 0,15–0,53 mm [12], což je velikost lidských chylomikronů lymfy a krve v postabsorpčním stavu (graf 1). Částice přesahující 5 mm představují potenciální riziko blokace plicních kapilár [12]. Na tuto skutečnost reflektuje USP 30 článkem 729, který vymezuje limitní množství částic na 0,05 % a méně. Článek v Americkém lékopisu je koncipován jako pojistka minimalizace plicní mikroembolizace během podávání infuze s výživou [13].
Tento stav dekompozice je ireverzibilní. Parenterální tukové emulze mají částice o velikosti obvykle 0,15–0,53 mm [12], což je velikost lidských chylomikronů lymfy a krve v postabsorpčním stavu (graf 1). Částice přesahující 5 mm představují potenciální riziko blokace plicních kapilár [12]. Na tuto skutečnost reflektuje USP 30 článkem 729, který vymezuje limitní množství částic na 0,05 % a méně. Článek v Americkém lékopisu je koncipován jako pojistka minimalizace plicní mikroembolizace během podávání infuze s výživou [13]. K souboru jakostních změn tukové emulze, které negativně ovlivňují stabilitu a mohou zapříčinit patologickou odpověď organismu, patří lipoperoxidace. Té mohou podléhat zvláště tukové emulze připravené ze sójového oleje a obsahující polynenasycené mastné kyseliny, kdy kyslík může působit na dvojné vazby těchto kyselin. V pozdějších fázích se vytvářejí aktivní formy kyslíku, které způsobují tvorbu peroxidických vazeb a způsobují oxidativní stres citlivých buněčných struktur. Lipidové hydroperoxidy vznikající při lipoperoxidaci působí apoptózu T-buněk. Stopové prvky, teplota, světlo a přítomnost kyslíku (prostupujícího přes vak) zvyšují pohotovost k oxidativním procesům, pomocné látky s antioxidačním potenciálem toto riziko zmírňují [14].
Vitaminy a stopové prvky mohou být degradovány UV zářením, vzdušným kyslíkem, sorbovány na povrch vaků, jejich rozklad může být katalyzován nevhodným pH, přítomností některých pomocných látek, stopových prvků apod. 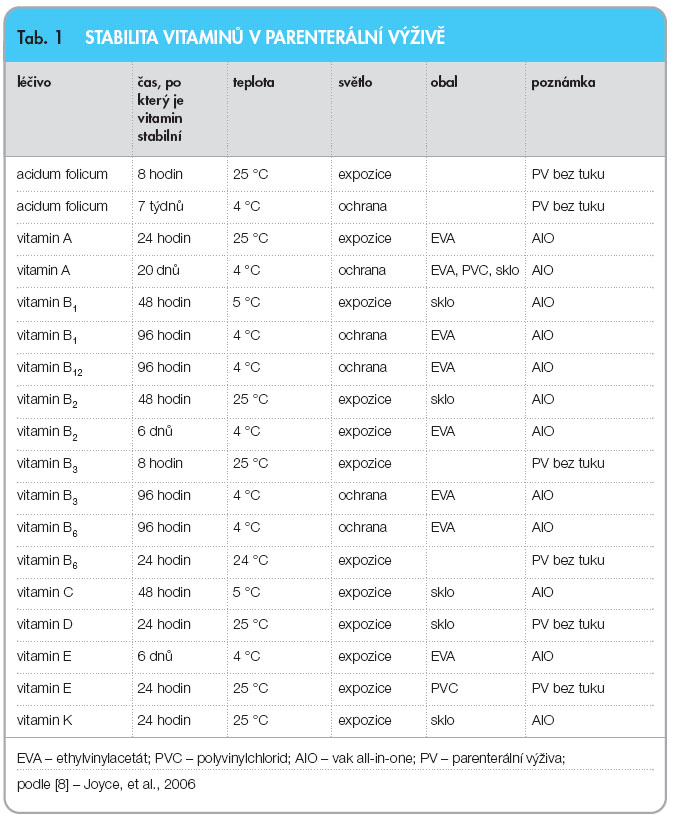 Stabilita vitaminů a stopových prvků v parenterálních směsích s ohledem na teplotu uchovávání, světelné podmínky a druh obalu je podrobně uvedena v tab. 1 a 2. Jednotlivé látky mají navíc určitá specifika. Obecně je možné konstatovat, že vitaminy A, B6 a kyselina listová jsou těmi nejstabilnějšími vitaminy, protože jejich ztráty v průběhu stabilitních studií byly zanedbatelné [15]. Všechny vitaminy zmiňované v tab. 1 jsou citlivé na světlo. Při ochraně před denním světlem jsou ztráty vitaminů mnohonásobně nižší. Jestliže jsou směsi AIO uchovávány při pokojové teplotě, stabilita vitaminů klesá. Vitamin E rychle degraduje, jestliže je přítomen ve směsi se stopovými prvky. Kyselina listová je málo rozpustná ve vodě, lépe se rozpouští v kyselém prostředí, kde je také stabilní, optimální rozsah pH pro kyselinu listovou je 5,5–6,5 [15]. Thiamin se degraduje zejména v přítomnosti
Stabilita vitaminů a stopových prvků v parenterálních směsích s ohledem na teplotu uchovávání, světelné podmínky a druh obalu je podrobně uvedena v tab. 1 a 2. Jednotlivé látky mají navíc určitá specifika. Obecně je možné konstatovat, že vitaminy A, B6 a kyselina listová jsou těmi nejstabilnějšími vitaminy, protože jejich ztráty v průběhu stabilitních studií byly zanedbatelné [15]. Všechny vitaminy zmiňované v tab. 1 jsou citlivé na světlo. Při ochraně před denním světlem jsou ztráty vitaminů mnohonásobně nižší. Jestliže jsou směsi AIO uchovávány při pokojové teplotě, stabilita vitaminů klesá. Vitamin E rychle degraduje, jestliže je přítomen ve směsi se stopovými prvky. Kyselina listová je málo rozpustná ve vodě, lépe se rozpouští v kyselém prostředí, kde je také stabilní, optimální rozsah pH pro kyselinu listovou je 5,5–6,5 [15]. Thiamin se degraduje zejména v přítomnosti 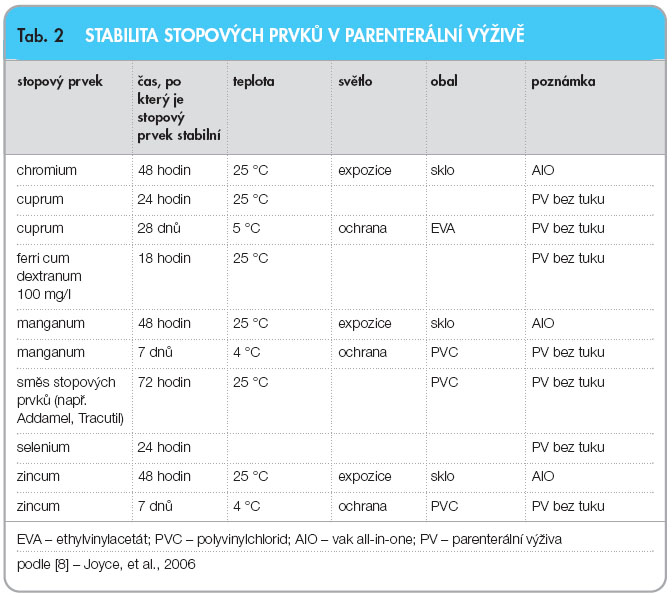 sirných sloučenin, tvoří-li jejich obsah v roztoku více než 0,05 %. U pyridoxinu zřejmá degradace nastává jen při přímém slunečním osvitu. Riboflavin je velmi citlivý na světlo, jeho koncentrace klesá o 80 % za 24 hodin po světelné expozici, v PV s tukem je degradace za stejných podmínek jen asi poloviční [16]. UV záření a denní světlo způsobují degradaci retinolu o 20 % za 24 hodin [17]. Kyselina askorbová je citlivá na přítomnost kyslíku a stopových prvků, např. během třídenního skladování ve vaku, který je propustný pro kyslík, dochází k 70% ztrátám [18]. Produktem rozkladu je kyselina oxalová, jejíž krystaly se mohou ukládat v ledvinách a mozku [19]. U sodné soli kyseliny askorbové je popisována degradace na dehydroaskorbovou kyselinu, což je také přirozený produkt biodegradace [20].
sirných sloučenin, tvoří-li jejich obsah v roztoku více než 0,05 %. U pyridoxinu zřejmá degradace nastává jen při přímém slunečním osvitu. Riboflavin je velmi citlivý na světlo, jeho koncentrace klesá o 80 % za 24 hodin po světelné expozici, v PV s tukem je degradace za stejných podmínek jen asi poloviční [16]. UV záření a denní světlo způsobují degradaci retinolu o 20 % za 24 hodin [17]. Kyselina askorbová je citlivá na přítomnost kyslíku a stopových prvků, např. během třídenního skladování ve vaku, který je propustný pro kyslík, dochází k 70% ztrátám [18]. Produktem rozkladu je kyselina oxalová, jejíž krystaly se mohou ukládat v ledvinách a mozku [19]. U sodné soli kyseliny askorbové je popisována degradace na dehydroaskorbovou kyselinu, což je také přirozený produkt biodegradace [20].
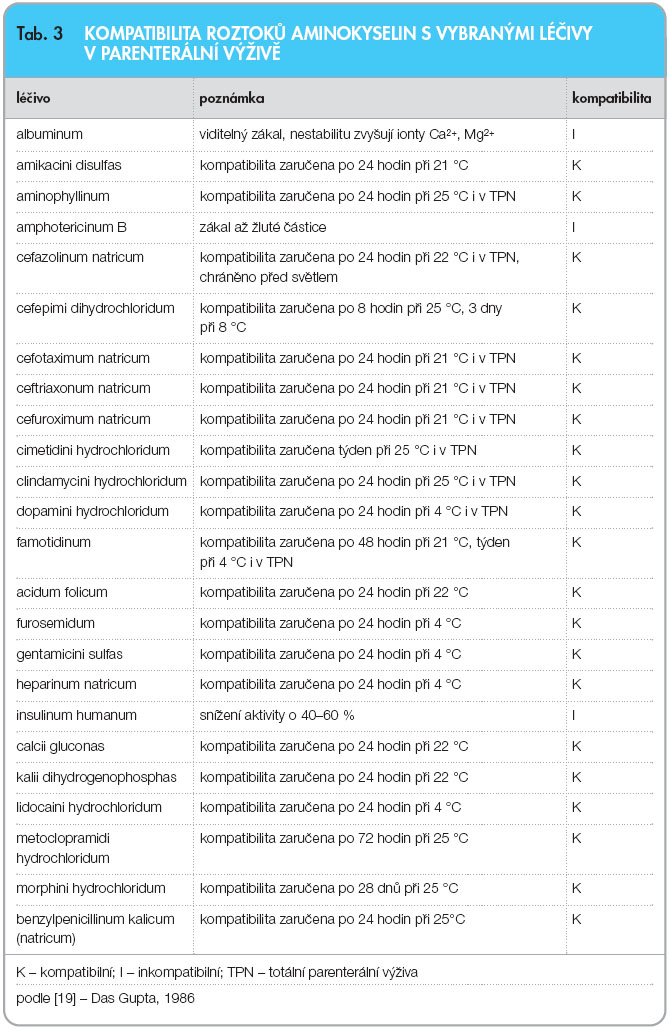 Stabilita a kompatibilita léčiv podávaných spolu se složkami parenterální výživy nebo se systémy AIO představuje komplexní problematiku, která je ovlivňována celou řadou faktorů. U HVLP přípravků uvádí kompatibilitu vaků AIO výrobce. Obecně není doporučováno rutinní přidávání parenterálních léčiv do vaků AIO. Jednoznačně by v tomto případě měly být používány předfiltry velikosti 5 mm nebo 2 mm jako prevence. Zkoumáním takových směsí optickým mikroskopem byla totiž prokázána přítomnost částic skla, pryže nebo plastů většinou o velikosti 3 mm až 40 mm. Předfiltry také odloučí precipitáty a větší tukové částice [20]. U léčiv přidávaných do PV se může rovněž měnit biologická dostupnost (např. heparin) [21].
Stabilita a kompatibilita léčiv podávaných spolu se složkami parenterální výživy nebo se systémy AIO představuje komplexní problematiku, která je ovlivňována celou řadou faktorů. U HVLP přípravků uvádí kompatibilitu vaků AIO výrobce. Obecně není doporučováno rutinní přidávání parenterálních léčiv do vaků AIO. Jednoznačně by v tomto případě měly být používány předfiltry velikosti 5 mm nebo 2 mm jako prevence. Zkoumáním takových směsí optickým mikroskopem byla totiž prokázána přítomnost částic skla, pryže nebo plastů většinou o velikosti 3 mm až 40 mm. Předfiltry také odloučí precipitáty a větší tukové částice [20]. U léčiv přidávaných do PV se může rovněž měnit biologická dostupnost (např. heparin) [21]. 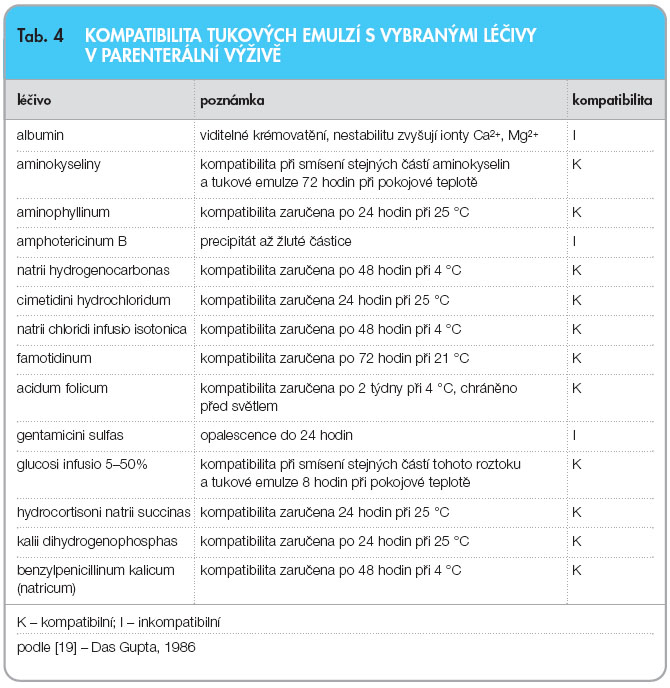 Stabilita tukové emulze s přidanými léčivy je závislá zejména na ovlivnění zeta potenciálu, van der Waalsových sil a pH. U dvoukomorových vaků AIO nebo u magistraliter připravovaných vaků AIO bez tukové složky lze orientačně posuzovat kompatibilitu změnou zabarvení a přítomností precipitátu – destabilizující produkty způsobují nejčastěji žloutnutí roztoku. Z hlediska přítomnosti precipitátu vak pozorujeme ve vzdálenosti asi 30 cm proti matnému bílému a černému pozadí ve světle, jehož intenzita odpovídá 100W žárovce. Hodnotíme celý objem PV a v přípravku nesmí být patrny nerozpustné částice nebo jiné mechanické nečistoty. Kompatibilitu a stabilitu vybraných léčiv v parenterálních roztocích aminokyselin a v tukových emulzích ukazují tab. 3 a 4.
Stabilita tukové emulze s přidanými léčivy je závislá zejména na ovlivnění zeta potenciálu, van der Waalsových sil a pH. U dvoukomorových vaků AIO nebo u magistraliter připravovaných vaků AIO bez tukové složky lze orientačně posuzovat kompatibilitu změnou zabarvení a přítomností precipitátu – destabilizující produkty způsobují nejčastěji žloutnutí roztoku. Z hlediska přítomnosti precipitátu vak pozorujeme ve vzdálenosti asi 30 cm proti matnému bílému a černému pozadí ve světle, jehož intenzita odpovídá 100W žárovce. Hodnotíme celý objem PV a v přípravku nesmí být patrny nerozpustné částice nebo jiné mechanické nečistoty. Kompatibilitu a stabilitu vybraných léčiv v parenterálních roztocích aminokyselin a v tukových emulzích ukazují tab. 3 a 4.
Závěrem lze shrnout, že z hlediska technologického a kvalitativního se výživa AIO vymyká obecnému přístupu k přípravě a kontrole klasických parenterálií v lékárenském provozu. Je nutné rutinně sledovat řadu jakostních parametrů teoretickými výpočty a pružně reagovat na požadavky nutriční substituce v návaznosti na biochemické a klinické výsledky jednotlivých nemocných. Často, a to zejména v neonatologické a pediatrické praxi, se musí volit kompromisní řešení, protože přívod některých nutričních substrátů je limitován jejich množstvím, stabilitou a kompatibilitou.
Seznam použité literatury
- [1] Křemen J, Kotrlíková E, Svačina Š, et al. Enterální a parenterální výživa. Praha; Aesculap, 2009: 54–60.
- [2] Grimm HA. Balanced lipid emulsion – A new concept in parenteral nutrition. Clin Nutr Suppl 2009; 1: 25–30.
- [3] Driscoll DF, Nehne J, Peterss H, et al. Physicochemical stability of intravenous lipid emulsions as all-in-one admixtures intended for the very young. Clin Nut 2003; 22: 489–495.
- [4] Janů M, Vecko M, Masteiková R. Sledování vybraných jakostních parametrů parenterální výživy AIO – pilotní studie. Čes slov Farm 2009; 58: 241–244.
- [5] Janů M. Pracovní náplň oddělení nemocniční lékárny VFN. Prakt lékáren 2006; 1: 25–27.
- [6] Schroder MS. Total parenteral nutrition – problems in compatibility and stability. EJHP Pract 2008; 14: 65–67.
- [7] Chaieb SD, Chumel JC, Jebnoun J, et al. Calcium and phosphate compatibility and stability studies in different neonatal parenteral nutrition mixtures. EJHP Sci 2006; 12: 35–40.
- [8] Joyce CW, McDougal AR, Tofan M, et al. Doubling calcium and phosphate concentrations in neonatal parenteral nutrition solutions using monobasic potassium phosphate, J Am Coll Nutr 2006; 25: 70–77.
- [9] Bing CM, Chamallas SN, Gates JM, et al. Extended stability for parenteral drugs, 3. vydání. ASHP 2005; 21–27.
- [10] Ronchera-Oms CL, Jiménez NV, Peidro J, et al. Stability of parenteral nutrition admixtures containing organic phosphates. Clin Nut 1995,14: 373–380.
- [11] Driscoll DF, Etzler F, Barber TA, et al. Physicochemical assessment of parenteral lipid emulsions: light obscuration versus laser diffraction. Int J Pharm 2001; 219: 21–37.
- [12] Koster VS, Kuks PFM, Lange R, Talsma H. Particle size in parenteral fat emulsions, what are the true limitations? Int J Pharm 1996; 134: 235–238.
- [13] Chapter <729>. Globule Size Distribution in Lipid Injectable Emulsions. Pharm Forum 2004; 30: 2235–2240.
- [14] Pironi L. Peroxidation potential of lipid emulsions after compounding in all-in-one solutions. Nutr 2003; 19: 784–788.
- [15] Allwood MC, Kearney MCJ. Compatibility and Stability of Additives in Parenteral Nutrition Admixtures. Nutr 1998; 14: 697–706.
- [16] Marsden K. 1997. What's new in nutrition: B Complex vitamins. Pharmacy magazine 1997; May: 6.
- [17] Allwood MC, Martin HJ. The photodegradation of vitamins A and E in parenteral nutrition mixtures during infusion. Clin Nut 2000; 19: 339–342.
- [18] Gibbons E, Allwood MC, Neal T, Hardy G. Degradation of dehydroascorbic acid in parenteral nutrition mixtures. J Pharm Biomed Anal 2001; 25: 605–611.
- [19] Das Gupta V. Stability of vitamins in total parenteral nutrient solutions. Am J Hosp Pharm 1986: 43: 2132, 2138, 2143.
- [20] Lawrence A, Trissel. Handbook on injectable drugs. ASHP 2007; 51–98, 669–690, 175.
- [21] Raupp P, von Karies R, Schmidt E, et al. Inkompatibility between fat emulsion and calcium plus heparin in parenteral nutrition of premature babies. Lancet 1988; 1: 700.
- [22] Khýnová L. Stabilita vitamínů ve směsích pro parenterální výživu. Diplomová práce. Hradec Králové 2009: 91.