Subkutánní aplikace léčiv – přehled a výhody podání
Subkutánní podání léčiv představuje parenterální způsob aplikace léčivých látek injekcí, infuzí či implantací do podkožní tkáně, kterým je umožněna aplikace řady látek zejména bílkovinné povahy. Jedná se především o inzulinové přípravky i řadu dalších rekombinačně připravených hormonálních preparátů, antikoagulačních či biologických léčiv v terapii zánětlivých revmatických onemocnění, roztroušené sklerózy či v onkologii. Výhodou je podání pomocí předplněných aplikátorů (stříkaček či per) umožňující téměř bezbolestnou aplikaci dávky samotným pacientem. Pomocí různých technologických postupů či modifikací léčivé látky lze dosáhnout pomalé a rovnoměrné absorpce z podkožní tkáně a docílit tak výhodných farmakokinetických vlastností léčiva.
Úvod
Subkutánní aplikace léčiv představuje méně častou, ale velmi významnou parenterální cestu podání léčivých látek. Jedná se o přívod léčivé látky do podkožní tkáně s krevními a lymfatickými kapilárami, ze kterých se léčivo dále vstřebává [1]. Rychlost absorpce je poměrně nízká a závislá na místě a způsobu aplikace. Je možné ji modifikovat, zrychlení absorpce lze dosáhnout masáží či prohřátím v místě vpichu, popřípadě fyzickou aktivitou, zpomalení pak přísadou vazokonstrikčních látek. Nástup účinku je v porovnání s intramuskulární aplikací pomalejší (15–20 minut po podání).
Subkutánně se aplikují zejména léčivé a aktivní látky, které není možné podávat perorálně. Ve srovnání s intravenózní aplikací léčiv představuje subkutánní podání méně invazivní cestu. Vzhledem k nízké proteolytické aktivitě podkožní tkáně je tak umožněna aplikace řady léčiv povahy peptidů a proteinů. Jedná se především o hormonální přípravky (inzuliny, analoga folikuly stimulujícího hormonu nebo agonisty gonadoliberinu, růstové hormony), interferony, protilátky, antikoagulancia, vakcíny a antigeny v desenzitizační terapii alergie [2].
Fyziologie místa aplikace a limity subkutánního podání léčiv
Subkutánně podaná léčiva mohou mít různou biologickou dostupnost v závislosti na aplikačním místě a jeho fyziologických i fyzikálně-chemických vlastnostech. Jedná se o strukturu extracelulární matrix, vlastnosti intersticiální tekutiny, teplotu, hydrostatický a koloidně osmotický tlak. Extracelulární matrix je tvořena sítí kolagenních vláken prostoupených glykosaminoglykany (kyselinou hyaluronovou a chondroitinsulfátem); pH tekutiny vyplňující podkožní tkáň se pohybuje v rozmezí 7,38–7,45 [1]. U subkutánně podaných přípravků, kde není možné ze stabilitních důvodu docílit stejných hodnot pH, lze upravit hodnotu pH v rozmezí 2,7–9 [3, 4]. Na rychlost absorpce injekčně podané substance má významný vliv i teplota podkožní tkáně; v závislosti na poloze aplikačního místa a stavu pacienta se pohybuje v rozmezí 30–36 °C.
V některých případech může zapříčinit i snížení účinku subkutánně aplikovaných látek. Příkladem je rekombinantní lidský granulocytární kolonie stimulující faktor (granulocyte-colony stimulating factor, G-CSF), který tvoří při teplotě 37 °C biologicky méně aktivní dimery. Řešením je přidat do léčivého přípravku sacharosu, která zabrání jejich tvorbě [5]. Limitujícím parametrem podkožního podání je i objem aplikované dávky z důvodu hydrostatického tlaku uvnitř tkáně. Větší objemy dávek a zvýšení biologické dostupnosti je možné získat přidáním enzymu hyaluronidázy, který usnadní průnik do tkání štěpením β-D-glykosidické vazby v molekule kyseliny hyaluronové [6]. Osmolarita subkutánně aplikovaného přípravku by měla být v rozmezí 200–400 mosmol/l [7].
Po subkutánní aplikaci dochází k vytvoření depa v podkožní tkáni. V závislosti na koncentraci glykosaminu v podkoží a molekulové hmotnosti rozpuštěné látky jsou jednotlivé molekuly léčiva transportovány difuzí. Pomalou difuzí z podkoží přes lymfatický systém do krevního řečiště je vysvětlován i nižší výskyt nežádoucích účinků ve srovnání s intravenózní aplikací [4].
Možnosti prodlouženého působení léčivé látky
Prodloužení účinku je možné dosáhnout snížením rozpustnosti léčiva změnou jeho fyzikálně-chemických vlastností, čímž dojde ke zpomalení absorpce z podkoží. U inzulinových přípravků je nástup a délka účinku ovlivněna přítomností dimerů až dihexamerů v místě aplikace [8–10]. Snížení rozpustnosti tvorbou omezeně rozpustného precipitátu je možné docílit změnou izoelektrického bodu inzulinu (pI 5,2) na pH intersticiální tekutiny vazbou inzulinu s bazickým proteinem. Reakcí inzulinu s protamin sulfátem v přítomnosti zinku vzniká intermediárně působící suspenze humánního NPH (neutral protamine Hagedorn) či isophan inzulinu [11]. Posunu izoelektrického bodu lze dosáhnout i díky změnám ve struktuře molekuly inzulinu (náhrada a adice dvou aminokyselin u syntetického analoga glarginu), kdy ke snížení rozpustnosti a následné precipitaci dochází až při aplikaci do podkoží [12]. Další možností je navázání mastných kyselin na povrch molekuly inzulinu zodpovědné nejen za vytvoření multihexamerů v podkožních tkáních, ale i za reverzibilní vazbu na albumin v místě aplikace. Příkladem je navázání hydrofobní kyseliny myristové u inzulinového analoga detemiru [13, 14] či kyseliny hexadekandiové u degludeku [15]. Nekovalentní vazba inzulinu se zinečnatými ionty fyzikálně stabilizuje krystalickou strukturu a omezuje tak rozpustnost bílkovinné suspenze [16].
Léčiva povahy proteinů mají relativně krátký biologický poločas, což je způsobeno jejich metabolickou degradací a rychlým vylučováním. Farmakokinetické vlastnosti lze ovlivnit tzv. pegylací, tj. navázáním molekuly polyethylenglykolu (PEG) na molekulu bílkoviny. Výhodami této modifikace je zvýšená odolnost vůči proteolýze, delší biologický poločas v důsledku nižší clearance konjugátu, zvýšení rozpustnosti a snížení imunogenicity oproti nemodifikované bílkovině. Farmakokinetika výsledné molekuly je ovlivněna sílou chemické vazby, délkou a strukturou molekuly PEG. Tato technologie je od počátku devadesátých let používána k úpravě řady přípravků (pegylované interferony, pegylovaný G-CSF, certolizumab pegol) [17–19]. Ve fázi klinického zkoušení je bazální analogový inzulin (LY2605541) vytvořený připojením PEG k molekule inzulinu lispro [20].
Prodlouženého uvolňování lze docílit také inkorporací léčiva do biodegradovatelných mikrosfér tvořených kopolymerem kyseliny mléčné a glykolové (PLGA). Příkladem je podání antidiabetika exenatidu (Bydureon®), leuprolidu (Lupron Depot®), oktreotidu (Sandostatin LAR®) či somatropinu (Nutropin Depot®) [20]. Zkoumanou alternativou je vazba proteinu s termosenzitivní látkou ELP (elastin-like polypeptid), která při aplikaci do podkoží vytváří depotní viskózní koacervát [21, 22].
Subkutánně aplikované lékové formy
Subkutánně lze aplikovat přípravky ve formě injekcí, infuzí či implantátů zaváděných do podkoží. Ve formě injekcí a infuzí je možné podávat sterilní vodné roztoky a suspenze obsahující různé pomocné látky, které umožňují formování lékové formy zajišťující stabilitu a ovlivňující biologickou dostupnost léčiva. Z hlediska stability proteinů by bylo optimální volit pH v oblasti izoelektrického bodu, kde je však často problémem jejich rozpustnost [23]. Jako tlumivé přísady se přidávají acetátové, fosfátové nebo citronanové pufry. Pro úpravu pH lze použít hydroxid sodný či kyselinu chlorovodíkovou, které stejně jako glukóza upravují i osmolaritu roztoku a tím snižují bolestivost během injekční aplikace. Pro zvýšení rozpustnosti léčiv se přidávají tzv. kosolventy, mezi něž patří ethanol (do 6 %), glycerol (do 15 %), propylenglykol, PEG, N-methylpyrrolidon (NMP) či dimethylsulfoxid (DMSO) [3, 4]. Jako povrchově aktivní látka se nejčastěji volí neiontový tenzid polysorbát (Tween® 20, 80), který kromě rozpustnosti též zvyšuje stabilitu proteinů. Vícedávkové přípravky obsahují navíc konzervační látky (methylparaben, fenol, p-aminobenzoát, m-kresol či benzylalkohol) [24].
Některé přípravky jsou vyráběny ve formě prášků pro přípravu injekce. Jedná se nejčastěji o lyofilizáty, ke kterým se přidávají pomocné látky zajišťující, aby vysušený produkt byl objemný, pórovitý, izotonický a chránící proteiny při lyofilizaci. Hlavním důvodem je především delší exspirační doba takto ošetřených přípravků. Mezi pomocné látky patří cukry (sacharosa, trehalosa), polyoly (mannitol) a aminokyseliny (histidin, glycin, methionin, prolin). Jako rozpouštědlo se volí voda na injekci či izotonický roztok chloridu sodného. Po rekonstituci musí být přípravek ihned aplikován [23, 24].
Vhodná místa a způsob subkutánní aplikace
Místa, která jsou vhodná pro pro subkutánní podání, představují zevní strana paže v oblasti musculus biceps brachii, oblast břicha v oblasti muscu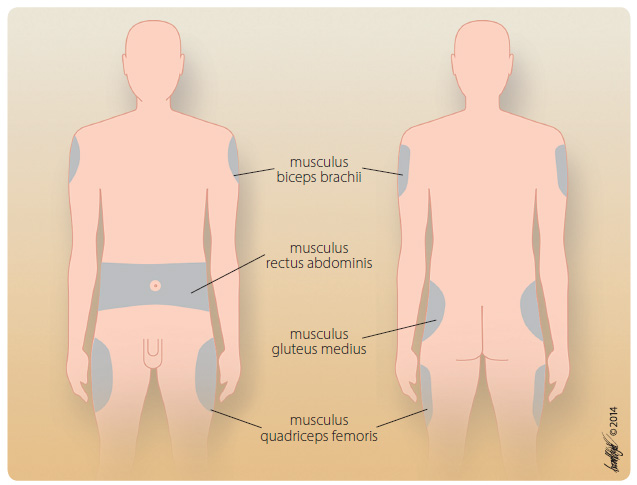 lus rectus abdominis, dorzogluteální část v oblasti musculus gluteus medius či zevní strana stehen v oblasti musculus quadriceps femoris (obr. 1) [25]. Rychlost vstřebání je ovlivněna prokrvením v místě aplikace a tloušťkou tukové vrstvy, která se liší v závislosti na zvoleném aplikačním místě a tělesném indexu pacienta (BMI) [26, 27]. Nejrychleji se přípravek vstřebává z podkoží břicha, kde absorpce není podmíněna zvýšenou fyzickou zátěží, a je tedy nejméně variabilní. Není vhodné aplikovat přípravek na poškozenou, poraněnou, infikovanou, zjizvenou či jinak změněnou kůži či do tvrdnoucích tkání [28, 29].
lus rectus abdominis, dorzogluteální část v oblasti musculus gluteus medius či zevní strana stehen v oblasti musculus quadriceps femoris (obr. 1) [25]. Rychlost vstřebání je ovlivněna prokrvením v místě aplikace a tloušťkou tukové vrstvy, která se liší v závislosti na zvoleném aplikačním místě a tělesném indexu pacienta (BMI) [26, 27]. Nejrychleji se přípravek vstřebává z podkoží břicha, kde absorpce není podmíněna zvýšenou fyzickou zátěží, a je tedy nejméně variabilní. Není vhodné aplikovat přípravek na poškozenou, poraněnou, infikovanou, zjizvenou či jinak změněnou kůži či do tvrdnoucích tkání [28, 29].
Subkutánní injekcí lze aplikovat pouze malé objemy (0,5–2 ml) nedráždivých léčiv, zpravidla pomocí subkutánní injekční stříkačky s objemem 2 ml (stupňování po 0,1 ml) a jehly dlouhé 25–30 mm (s průsvitem 0,5–0,6 mm), speciální inzulinové injekční stříkačky, předplněné injekční stříkačky či pera. Pro subkutánní aplikaci existují též plně automatizované elektronické aplikační systémy. Injektor Easypod™ se používá pro podávání somatropinu. Nastavitelné parametry a zpětné informace zajistí, že budou všechny dávky podány správně. Systém Easypod Connect zpracovává data o adherenci, která je klíčovým bodem v léčbě poruch růstu.
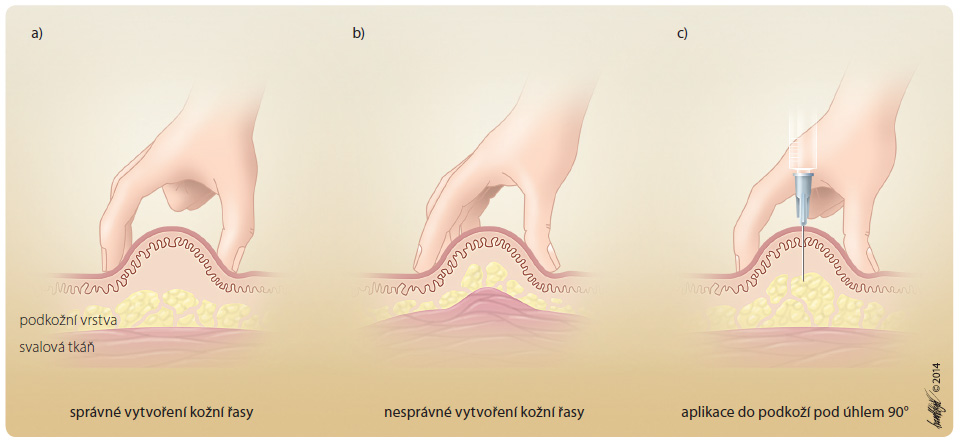
Po dezinfekci v 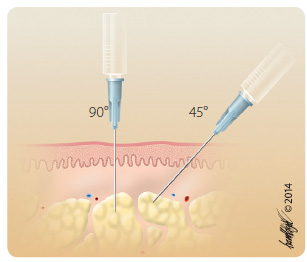 místě aplikace a vytvoření kožní řasy se provádí šikmý vpich pod úhlem 45°. U speciálních inzulinových nebo předplněných injekčních stříkaček s vlisovanou jehlou či injekčních per se dle hmotnosti klienta, místa vpichu a délky jehly vytváří nebo nevytváří kožní řasa a přípravek se zavádí do podkoží většinou pod úhlem 90° tak, aby byl aplikován do podkožní vrstvy (obr. 2 a 3) [29]. Vždy je nutné aplikovat dávku s ohledem na BMI nemocného. Výhodou jednorázových předplněných stříkaček a per je možnost jejich okamžitého použití bez nutnosti natahování předepsané dávky z injekčních lahviček. Dnes jsou tak běžně dostupné nízkomolekulární hepariny s obsahem standardních dávek používaných dle hmotnosti pacienta, řada hormonálních přípravků, monoklonálních protilátek a interferonů. Inzulinové přípravky jsou dostupné ve formě injekčních lahviček (používají se minimálně), zásobníků do inzulinových per nebo předplněných dávkovačů k jednorázovému použití (tab. 1) [30, 31].
místě aplikace a vytvoření kožní řasy se provádí šikmý vpich pod úhlem 45°. U speciálních inzulinových nebo předplněných injekčních stříkaček s vlisovanou jehlou či injekčních per se dle hmotnosti klienta, místa vpichu a délky jehly vytváří nebo nevytváří kožní řasa a přípravek se zavádí do podkoží většinou pod úhlem 90° tak, aby byl aplikován do podkožní vrstvy (obr. 2 a 3) [29]. Vždy je nutné aplikovat dávku s ohledem na BMI nemocného. Výhodou jednorázových předplněných stříkaček a per je možnost jejich okamžitého použití bez nutnosti natahování předepsané dávky z injekčních lahviček. Dnes jsou tak běžně dostupné nízkomolekulární hepariny s obsahem standardních dávek používaných dle hmotnosti pacienta, řada hormonálních přípravků, monoklonálních protilátek a interferonů. Inzulinové přípravky jsou dostupné ve formě injekčních lahviček (používají se minimálně), zásobníků do inzulinových per nebo předplněných dávkovačů k jednorázovému použití (tab. 1) [30, 31].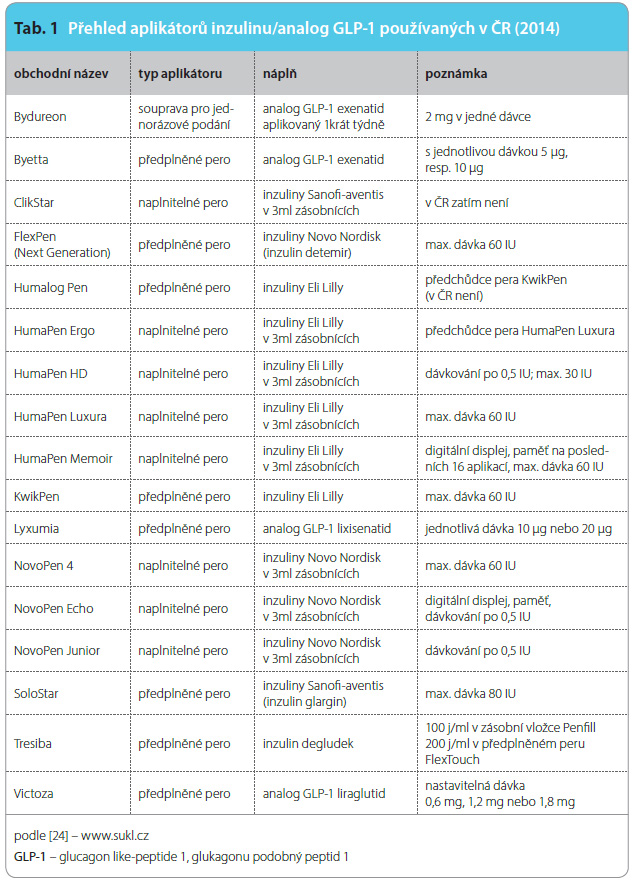
Inzulinové pumpy (CSII – continuous subcutaneous insulin infusion, kontinuální subkutánní inzulinová infuze) představují automatický systém s počítačově ovládanou mechanickou stříkačkou naplněnou inzulinem, který dávkuje nepřetržitě dle nastaveného programu subkutánně aplikovanou kanylou bazální dávku rychle působícího inzulinu a pacient si sám aplikuje prandiální bolusové dávky. Hlavní výhodou je možnost jemného kontinuálního dávkování inzulinu (bolusy po 0,1 IU), které umožňuje předcházet těžkým hypoglykemiím a rannímu vzestupu glykemie.
Formou subkutánní infuze je možné podání infuzního roztoku do podkoží teflonovou či kovovou kanylou (18–22 G), v případě kontinuální aplikace napojenou tenkou hadičkou na infuzní pumpu (lineární dávkovač). V poslední době se využívají spíše teflonové sety, jejichž povrch je méně dráždivý a je možnost odpojení setu v místě zavedení kanyly. Rychlost infuze by neměla přesáhnout 1,5 l/24 h na aplikační místo. Subkutánní infuzí se podávají inzulinové a imunoglobulinové přípravky, řada léků a rehydratačních roztoků. Pravidelnou subkutánní aplikaci léků a tekutin nelze podávat u pacientů s těžkou trombocytopenií, s poruchami koagulace, u pacientů s generalizovanými edémy či extrémní kachexií [32, 33].
Komplikace spojené se subkutánní aplikací injekcí a infuzí
Při porušení sterility léků, při aplikaci za nevhodných aseptických podmínek či při nedostatečné dezinfekci v místě vpichu může dojít k infekci, zánětu, abscesu až nekróze tkáně. Dezinfekce v místě aplikace je často diskutovaným tématem. Při zásadním dodržení aseptických podmínek v případě subkutánních injekcí není dezinfekce ve většině případů nutná, u infuzí je z hlediska nebezpečí nákazy nejčastěji streptokokovou či stafylokokovou infekcí nezbytná [34]. Obvykle se doporučuje dezinfekce pomocí benzododeciniumbromidu a benzalkoniumchloridu či Ethanolum benzino denaturatum. Některé přípravky obsahují jako součást balení i dva alkoholové tampony pro dezinfekci hrdla injekční lahvičky i místa vpichu [24].
Nevhodně zvolená délka injekční jehly či špatná technika vpichu může způsobit řadu nežádoucích účinků. V případě aplikace inzulinu až do svalové hmoty může dojít k rychlému nástupu účinku a následné hypoglykemii, u antikoagulancií k tvorbě hematomů. Nekompletní podání dávky je způsobeno předčasným vytažením jehly z místa aplikace, proto je nutné ponechat jehlu po aplikaci dávky v podkoží přibližně 6 sekund. Zanedbáním aspirace před samotnou aplikací může dojít k vpravení léků do cévy. Při dlouhodobém podávání inzulinu do stejného místa dochází k lipodystrofii, tj. ztrátě tuku v místě aplikace. Proto je nutné místa vpichu pravidelně rotačně střídat a mezi jednotlivými vpichy dodržovat minimální vzdálenosti [27, 35].
V případě subkutánních infuzí může dojít v místě zavedení kanyly k lokální iritaci kůže aplikovaným léčivem, k vytvoření podkožního edému (především při rychlé aplikaci většího objemu tekutin) či k velmi vzácné komplikaci, kterou představuje hematom. Nejčastějším problémem je ovšem možné riziko infekce, proto je třeba zavádět kanyly po vydezinfikování kůže a vyměňovat je jednou za 2 až 3 dny [28, 36].
Subkutánně aplikované léčivé látky
Mezi subkutánně aplikované léčivé látky patří hormonální látky bílkovinné povahy, zejména inzuliny (lidský inzulin a syntetická analoga) nezbytné pro léčbu diabetu mellitu 1. typu, popřípadě 2. typu. Jednotlivé inzulinové přípravky se liší rychlostí nástupu, maximem účinku a délkou působení. Pro jejich odlišení zvolili výrobci i odlišné barvy sekundárních obalů. Krátkodobě působící inzuliny jsou aplikovány ve formě neutrálních čirých roztoků bez přidání látek zpomalujících absorpci, středně a dlouho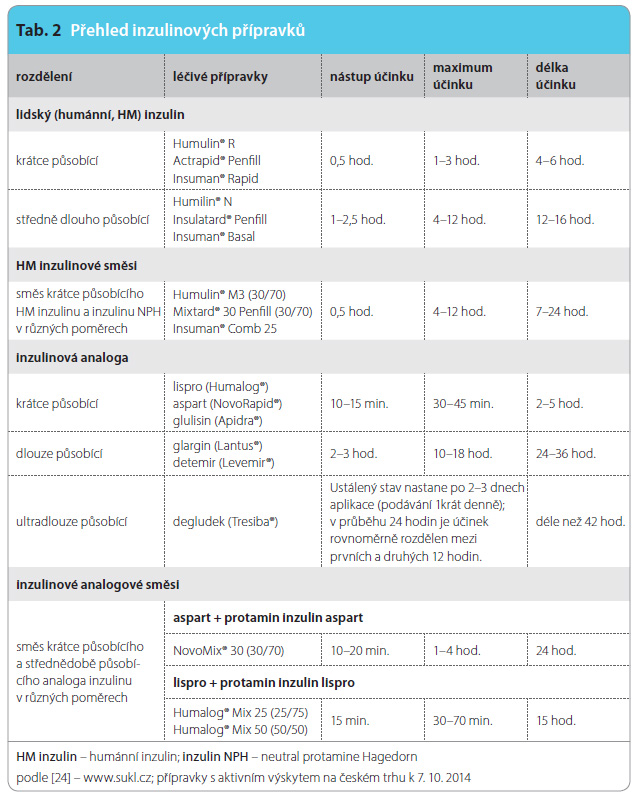 době působící inzuliny (depotní inzuliny) jsou zakalené či mléčně zbarvené suspenzní přípravky určené pouze k subkutánní aplikaci (tab. 2). Inzulin je dávkován v mezinárodních jednotkách (IU) a jeho koncentrace v komerčně dostupných přípravcích je 100 IU/ml [37]. Další významnou skupinu představují gonadotropní hormony povahy glykoproteinů (folitropin, lutropin, choriový gonadotropin) a antagonisté gonadoliberinu (cetrorelix, ganirelix) k léčbě neplodnosti. Každododenní subkutánní injekcí formou injekčního pera je aplikován somatropin k substituční terapii s deficitem růstového hormonu či teriparatid k léčbě osteoporózy aj. [24, 38].
době působící inzuliny (depotní inzuliny) jsou zakalené či mléčně zbarvené suspenzní přípravky určené pouze k subkutánní aplikaci (tab. 2). Inzulin je dávkován v mezinárodních jednotkách (IU) a jeho koncentrace v komerčně dostupných přípravcích je 100 IU/ml [37]. Další významnou skupinu představují gonadotropní hormony povahy glykoproteinů (folitropin, lutropin, choriový gonadotropin) a antagonisté gonadoliberinu (cetrorelix, ganirelix) k léčbě neplodnosti. Každododenní subkutánní injekcí formou injekčního pera je aplikován somatropin k substituční terapii s deficitem růstového hormonu či teriparatid k léčbě osteoporózy aj. [24, 38].
Subkutánní cestou se podávají monoklonální protilátky indikované k léčbě chronických autoimunitních kloubních onemocnění, mezi která patří revmatoidní či psoriatická artritida a ankylozující spondylitida [39, 40]. Jednotlivé látky jsou přehledně shrnuty v tab. 3. K léčbě psoriázy lze podat i protilátku ustekinumab [41]. Nově testovanými látkami k terapii relabující-remitující roztroušené sklerózy jsou ri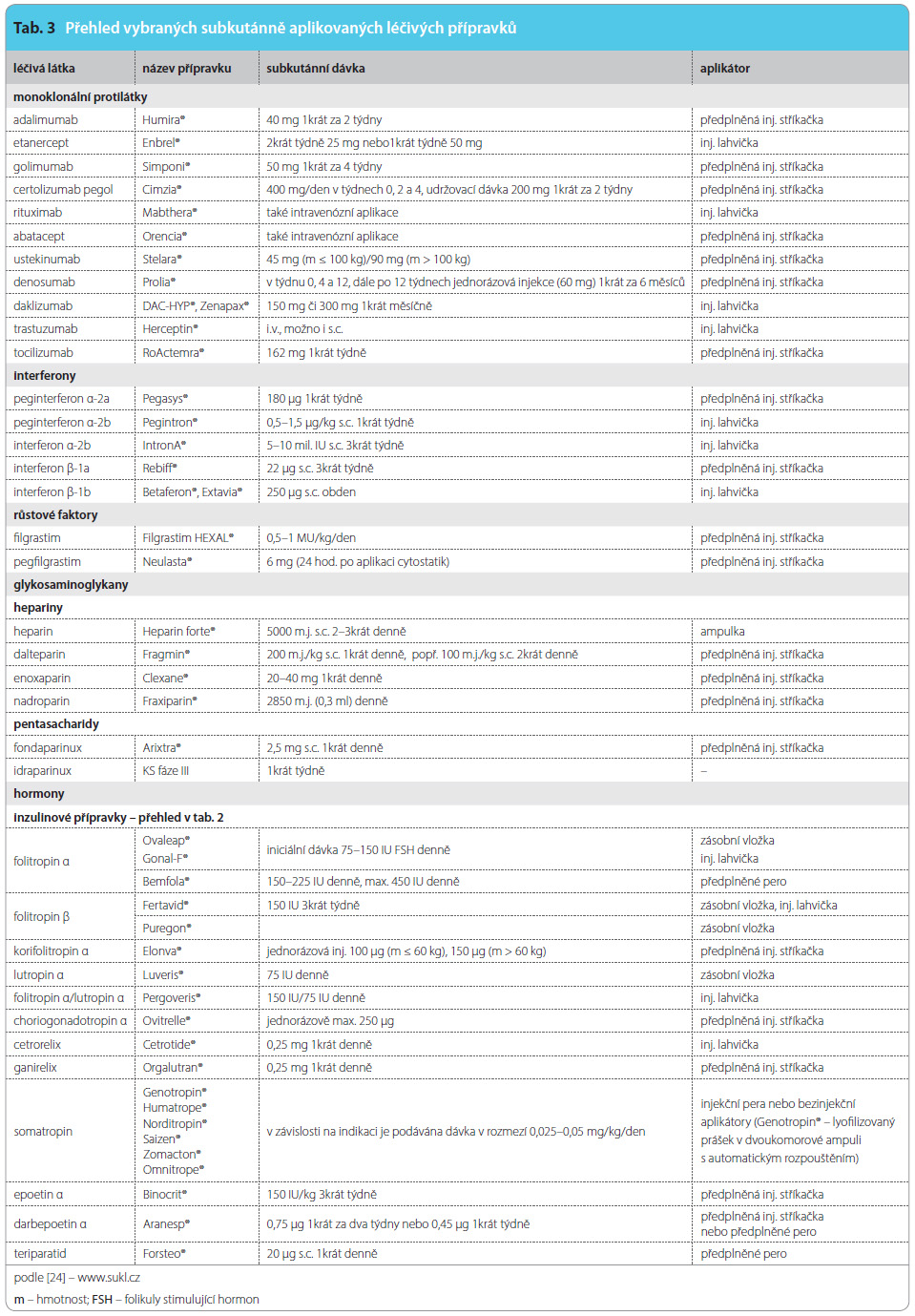 tuximab či daklizumab, humanizovaná monoklonální protilátka proti CD25, která se podává subkutánně jedenkrát měsíčně v dávce 150 mg nebo 300 mg [42–44]. Rituximab, dříve podávaný spíše intravenózně, je široce využívaným léčivem i k léčbě solidních nádorových onemocnění, stejně jako trastuzumab. Novým antiresorpčním léčivem k terapii a úbytku kostní hmoty vzniklé následkem hormonální ablace u mužů s karcinomem prostaty je plně humánní rekombinantní monoklonální protilátka třídy IgG2 denosumab. Je k dispozici v předplněné injekční stříkačce a je podáván jednorázovou podkožní injekcí jednou za 6 měsíců [45]. Z dalších imunomodulačních látek jsou subkutánně aplikovatelné interferony α k léčbě virových hepatitid a karcinomu ledvin (pegylované formy), interferony β jako léky první volby v terapii roztroušené sklerózy či růstové faktory (glykosylovaný G-CSF – filgrastim, pegfilgrastim) využívané v onkologii [24].
tuximab či daklizumab, humanizovaná monoklonální protilátka proti CD25, která se podává subkutánně jedenkrát měsíčně v dávce 150 mg nebo 300 mg [42–44]. Rituximab, dříve podávaný spíše intravenózně, je široce využívaným léčivem i k léčbě solidních nádorových onemocnění, stejně jako trastuzumab. Novým antiresorpčním léčivem k terapii a úbytku kostní hmoty vzniklé následkem hormonální ablace u mužů s karcinomem prostaty je plně humánní rekombinantní monoklonální protilátka třídy IgG2 denosumab. Je k dispozici v předplněné injekční stříkačce a je podáván jednorázovou podkožní injekcí jednou za 6 měsíců [45]. Z dalších imunomodulačních látek jsou subkutánně aplikovatelné interferony α k léčbě virových hepatitid a karcinomu ledvin (pegylované formy), interferony β jako léky první volby v terapii roztroušené sklerózy či růstové faktory (glykosylovaný G-CSF – filgrastim, pegfilgrastim) využívané v onkologii [24].
Důležitou skupinu léků podávaných subkutánně pomocí předplněných injekčních stříkaček představují antitrombotika aplikovaná do anterolaterální či posterolaterální části břišní stěny. Formou injekční suspenze jsou podávány alergenové extrakty k desenzitizační terapii alergie. Mezi subkutánně aplikované očkovací látky patří trojkombinovaná vakcína proti spalničkám, příušnicím a zarděnkám, popřípadě čtyřkombinace obsahující navíc i atenuovaný virus planých neštovic [24].
Dobře snášenou a účinnou alternativou intravenózní imunoglobulinové léčby u pacientů s primárním imunodeficitem je rychlá subkutánní substituční imunoglobulinová léčba aplikovaná pomocí infuzní pumpy či přímým podáním metodou rapid push. Podáváním souběžných infuzí rychlostí nejméně 20 ml/h na místo vpichu je možné zkrátit dobu aplikace na 1–2 hodiny jedenkrát týdně za současného snížení výskytu nežádoucích účinků a v pohodlí domácího podání. Imunoglobulinové přípravky jsou běžn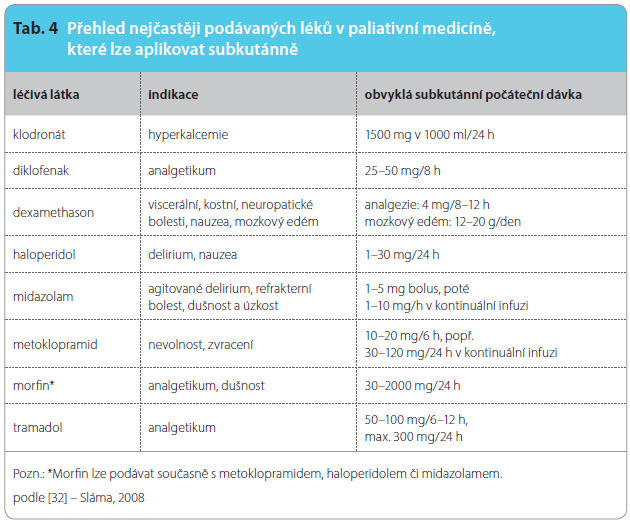 ě dostupné v koncentraci 160 mg/ml. Nyní je pro pacienty v České republice k dispozici i vysoce koncentrovaný imunoglobulin pro subkutánní aplikaci o koncentraci 200 mg/ml [46].
ě dostupné v koncentraci 160 mg/ml. Nyní je pro pacienty v České republice k dispozici i vysoce koncentrovaný imunoglobulin pro subkutánní aplikaci o koncentraci 200 mg/ml [46].
U pacientů v pokročilých stadiích nevyléčitelných nemocí aplikujeme pomocí kontinuální subkutánní infuze řadu léčiv a rehydratačních roztoků (hypodermoklýza). Přehled nejčastěji podávaných léků uvádí tab. 4, v případě dehydratace lze podat fyziologický roztok (0,9% NaCl), 0,45% NaCl či 5% roztok glukózy [47, 48].
Podkožní implantáty pro subkutánní aplikaci
Podkožní implantáty jsou depotní léky, které jsou svým tvarem a velikostí vhodné k implantaci do podkoží pomocí chirurgického zásahu či injekčního podání. Mohou mít povahu silně viskózní kapaliny nebo tuhého tyčinkovitého útvaru nasyceného léčivem [2]. Vyrábějí se z biodegradovatelných i nebiodegradovatelných materiálů, jež je nutno po využití léčiva mikrochirurgicky odstranit. Z biodegradovatelných implantátů na bázi PLGA lze uvést transportní systém Atrigel jako součást přípravku Eligard® (leuprorelin) [3] či Zoladex depot® (goserelin), který má podobu biodegradovatelného válečku. Příkladem vstřebatelného implantátu obsahujícího pouze léčivo bez dalších pomocných látek je přípravek Riselle® (estradiol) [24].
Velmi spolehlivou metodou hormonální antikoncepce jsou depotní nebiodegradovatelné levonorgestrelové či etonogestrelové přípravky zásobníkového typu (tyčinky), zaváděné na období 3–5 let na vnitřní stranu paže. Uvolňování léčiva je řízeno polydimethylsiloxanovou membránou Silastic (Norplant®, Jadelle®) či vrstvou ethylenvinyl-acetátu (Implanon®, Nexplanon®) [49]. Implantát rezervoárového typu Supprelin LA® (histrelin) je tvořen membránou z methakrylátového kopolymeru (technologie Hydron) [50]. V zahraničí je dostupný nebiodegradovatelný implantát v podobě osmoticky řízené pumpy obsahující leuprolin v DMSO (Viadur®) [3].
Závěr
Subkutánní podání představuje významnou cestu aplikace řady léčiv, zejména bílkovinné povahy, která má v současné farmakoterapii své nezastupitelné místo. Některé léčivé látky a rehydratační roztoky, dříve aplikované především intravenózně, jsou dnes podávány do podkoží. Výhodou je méně invazivní způsob aplikace, snížení výskytu nežádoucích účinků a zlepšená compliance pacienta za současného pohodlí podání v prostředí domácí péče.
Seznam použité literatury
- [1] Kinnunen HM, Mrsny RJ. Improving the outcomes of biopharmaceutical delivery via the subcutaneous route by understanding the chemical, physical and physiological properties of the subcutaneous injection site. J Control Release 2014; 182: 22–32.
- [2] Dostálek M, et al. Farmakokinetika. Praha, Grada, 2006.
- [3] Strickley RG. Solubilizing excipients in oral and injectable formulations. Pharmaceutical Research 2004; 21: 201–230.
- [4] Katdare A, Chaubal M. Excipient development for pharmaceutical, biotechnology, and drug delivery systems. New York, CRC Press, 2006.
- [5] Krishnan S, Chi EY, Webb JN, et al. Aggregation of granulocyte colony stimulating factor under physiological conditions: characterization and thermodynamic inhibition. Biochemistry 2002; 41: 6422–6431.
- [6] Frost GI. Recombinant human hyaluronidase (rHuPH20): an enabling platform for subcuta-neous drug and fluid administration. Expert Opin Drug Deliv 2007; 4: 427–440.
- [7] Stranz M, Kastango ES. A review of pH and osmolarity. Int J Pharm Compd 2002; 6: 216–220.
- [8] Piťhová P. Inzulin a novinky v léčbě inzulinem. Interní Med 2006; 1: 9–13.
- [9] Gin H, Hanaire-Broutin H. Reproducibility and variability in the action of injected insulin. Diabetes Metab 2005; 31: 7–13.
- [10] Jeandidier N, Boivin S. Current status and future prospects of parenteral insulin regimens, strategies and delivery systems for diabetes treatment. Adv Drug Delivery Rev 1999; 35: 179–198.
- [11] Guerci B, Sauvanet JP. Subcutaneous insulin: pharmacokinetic variability and glycemic variability. Diabetes Metab 2005; 31: 4S7–4S24.
- [12] Kvapil. Inzulin glargin. Remedia 2007; 17, 133–141.
- [13] Soran H, Younis N. Insulin detemir: a new basal insulin analogue. Diabetes Obes Metab 2006; 8: 26–30.
- [14] Havelund S, Plum A, Ribel U, et al. The mechanism of protraction of insulin detemir, a long-acting, acylated analog of human insulin. Pharm Res 2004; 21: 1498–1504.
- [15] Jonassen I, Havelund S, Hoeg-Jensen T, et al. Design of the Novel Protraction Mechanism of Insulin Degludec, an Ultra-long Acting Basal Insulin. Pharm Res 2012; 29: 2014–2114.
- [16] Honka M. Mechanismy prodloužení účinku inzulinu a jejich klinický význam. Remedia 2013; 23: 17–27.
- [17] Yang T. PEGylation – Successful Approach for Therapeutic Protein Conjugation. Mod Chem Appl 2013; 1: 4.
- [18] Schellekens H, Hennink WE, Brinks V. The immunogenicity of polyethylene glycol: facts and fiction. Pharm Res 2013; 30: 1729–1734.
- [19] Motzer RJ, Rakhit A, Thompson J, et al. Phase II trial of branched peginterferon-α 2a (40 kDa) for patients with advanced renal cell carcinoma. Ann Oncol 2002; 13: 1799–1805.
- [20] Hansen RJ, Cutler JGB, Vick A, et al. LY26055441: Leveraging hydrodynamic size to develop a novel basal insulin. Scientific Sessions of the American Diabetes Association 2012; Poster 896-P.
- [21] Amiram M, Luginbuhl KM, Li X, et al. A depot-forming glucagon-like peptide-1 fusion protein reduces blood glucose for five days with a single injection. J Controlled Release 2013; 172: 144–151.
- [22] MacEwan SR, Chilkoti A. Applications of elastin-like polypeptides in drug delivery. J Controlled Release 2014; 190: 314–330.
- [23] Fusek M, Vítek L, Blahoš J, et al. Biologická léčiva: Teoretické základy a klinická praxe. Praha, Grada 2012.
- [24] http://www.sukl.cz/modules/medication/search.php Navštíveno 10. 8. 2014.
- [25] Mikšová Z, Froňková M, Hernová R, Zajíčková M. Kapitoly z ošetřovatelské péče I. Praha, Grada 2006.
- [26] Ludescher B, Rommel M, Willmer T, et al. Subcutaneous adipose tissue thickness in adults – correlation with BMI and recommendations for pen needle lengths for subcutaneous self-injection. Clin Endocrinol 2011; 75: 786–790.
- [27] Frid A, Hirschb L, Gasparc R, et al. New injection recommendations for patients with diabetes. Diabetes Metab J 2010; 36: S3–S18.
- [28] Heinemann L, Krinelke L. Insulin infusion set: the achilles heel of continuous subcutaneous insulin infusion. J Diabetes Sci Technol 2012; 6: 954–964.
- [29] Hunter J. Subcutaneous injection technique. Nursing Standard 2008; 22: 21, 41–44.
- [30] Kožnarová R. Dávkovače inzulinu a inzulinové pumpy. Remedia 2006; 16: 186–191.
- [31] Kudlová P, Chlup R. Pomůcky k aplikaci inzulinu. Interní Med 2006; 6: 302–306.
- [32] Sláma O. Podkožní aplikace léků a tekutin v paliativní medicíně. Paliat med liec Boles 2008; 1: 64–66.
- [33] Štastná V, Soukupová K, Kučerová H. Naše zkušenosti se subkutánní rehydratací. Čes Ger Rev 2009; 7: 46–48.
- [34] Van Faassen I, Razenberg PP, Simoons-Smit AM, van der Veen EA. Carriage of Staphylococcus aureus and inflamed infusion sites with insulin-pump therapy. Diabetes Care 1989; 12: 153–155.
- [35] Sandra W. How to prevent and manage lipohypertrophy at injection sites. Brit J Prim Care Nurs 2008; 5: 296–298.
- [36] Jirkovská A. Léčba diabetu inzulinovou pumpou. Interní Med 2014; 1: 10–14.
- [37] Škrha J. Inzulinová analoga. Remedia 2006; 16: 164–169.
- [38] Lebl J, Zapletalová J. Léčba růstovým hormonem v pediatrii. Historie a současnost. Klin Farmakol Farm 2011; 25: 18–23.
- [39] Ciferská H, Horák P, Strojil J, Skácelová M. Biologická terapie v revmatologii. Klin Farmakol Farm 2010; 24: 197–206.
- [40] Suchý D, Mayer O. Biologická léčba revmatoidní artritidy. Klin Farmakol Farm 2005; 19: 182–185.
- [41] Nevoralová Z. Celková léčba lupénky. Dermatol praxi 2013; 7: 160–164.
- [42] Vachová M. Éra nových léků v terapii roztroušené sklerózy. Neurol pro Praxi 2009; 10: 305–308.
- [43] Schippling S, Martin R. Spotlight on Anti-CD25: Daclizumab in MS. Int MSJ 2008; 15: 94–98.
- [44] Horáková D. Roztroušená skleróza a úloha praktického lékaře. Med Pro Praxi 2008; 5: 378–382.
- [45] Hrdý P, Novosad P. Denosumab. Prakt lékáren 2011; 7: 158–159.
- [46] Chapel H, Gardulf A. Subcutaneous immunoglobulin replacement therapy: the European Experience. Curr Opin Allergy Clin Immunol 2013; 13: 623–629.
- [47] Sasson M, Shvartzman P. Hypodermoclysis an alternative infusion technique 2001; 64: 1575–1578.
- [48] Sláma O, Kabelka L, Vorlíček J, et al. Paliativní medicína pro praxi. Praha, Galén, 2007.
- [49] Grentzer J, McNicholas C, Peipert JF. Use of the etonogestrel-releasing contraceptive implant. Expert Rev Obstet Gynecol 2013; 8: 337–344.
- [50] http://www.rxlist.com/script/main/hp.asp Navštíveno: 10. 8. 2014.