Terapeutické monitorování psychofarmak z pohledu klinického farmaceuta: doporučení versus praxe
Souhrn:
Tašková I. Terapeutické monitorování psychofarmak z pohledu klinického farmaceuta: doporučení versus praxe. Remedia 2020; 30: 650–656.
Terapeutické monitorování léčiv (therapeutic drug monitoring, TDM) se v České republice již zařadilo mezi běžná vyšetření, a to zejména v některých oborech. Tato metoda se stala jedním ze základních nástrojů individualizované léčby. Využívá stanovení koncentrace léčiva v krevní plazmě nebo séru k dávkové optimalizaci tak, aby bylo dosaženo maximální účinnosti léku s co nejnižším rizikem toxicity. Je prokázáno, že mezi pacienty při podání stejné dávky existuje ve farmakokinetice léčiv velká interindividuální variabilita. Součástí vyšetření TDM by měla být vždy i interpretace výsledku, ke které je potřeba znát mnoho proměnných. Psychiatrická onemocnění jsou v populaci velmi rozšířená a psychofarmaka patří k často předepisovaným léčivům, a to nejen v oboru psychiatrie. Metody TDM bývá v praxi rutinně využíváno pro optimalizaci dávek stabilizátorů nálady, méně pak při podávání antipsychotik a antidepresiv. Víme, že u velké části pacientů užívajících psychofarmaka se nedostaví optimální odezva na farmakoterapii i přes podávání vyšších dávek nebo mají při běžném dávkování výrazné nežádoucí účinky. Je chybou, že zejména v těchto případech nevyužíváme metody TDM častěji. Tento článek si klade za cíl seznámit čtenáře s praktickými aspekty TDM v běžném provozu psychiatrické nemocnice, a to z pohledu klinického farmaceuta.
Summary:
Taskova I. Therapeutic drug monitoring of psychotropic drugs from the perspective of a clinical pharmacist: guidelines versus practice. Remedia 2020; 30: 650–656.
Therapeutic drug monitoring (TDM) has become the basic tool of personalized medicine. TDM is used mainly for optimizing individual dosage regimen so as to achieve the maximum efficacy of the drug with the lowest possible risk of toxicity. TDM in psychiatry is routinely used for dose optimization of mood stabilizers, less so for antipsychotics, and antidepressants. We know that a large proportion of patients taking antipsychotics or antidepressants does not respond optimally to pharmacotherapy despite higher doses or has significant side effects at normal doses. It is a mistake, especially in these cases, not to use TDM method more often. The aim of the article is to introduce practical aspects of TDM in psychiatry from the perspective of a clinical pharmacist working in the psychiatric hospital.
Key words: psychotropic drugs, TDM, psychiatric hospital, clinical pharmacy
Úvod
Terapeutické monitorování léčiv (therapeutic drug monitoring, TDM) se v České republice již zařadilo mezi běžná vyšetření, a to v mnoha lékařských oborech. Používá se u řady léčiv (lithium, valproát, gentamicin, vankomycin, cyklosporin atd.) a je i součástí doporučených postupů pro klinickou praxi. Dnes také existují pracoviště klinické farmakologie a farmacie, která se zabývají interpretací výsledků odběrů lékových hladin a mají k dispozici software k farmakokinetickému modelování a optimalizaci lékových hladin. Metoda TDM využívá stanovení koncentrace léčiva v krevní plazmě nebo séru k dávkové optimalizaci tak, aby bylo dosaženo maximální účinnosti léku s co nejnižším rizikem toxicity. Je prokázáno, že mezi pacienty existuje při podání stejné dávky velká interindividuální variabilita ve farmakokinetice léčiv, a udává se až dvacetinásobný rozdíl v plazmatické koncentraci jejich ustálených lékových hladin (css). Pacienti se liší schopností léčivo absorbovat, distribuovat, metabolizovat a eliminovat, protože jsou odlišní svou genetickou výbavou, věkem, komorbiditami, současně podávanou medikací atd. [1,2]. Snažíme se tedy na základě naměřených hodnot plazmatických koncentrací, s ohledem na výše zmíněné faktory, stanovit optimální dávku léčiva pro konkrétního pacienta v konkrétním čase, což je hlavním principem personalizované medicíny, na kterou se dnes klade velký důraz. Součástí vyšetření TDM by měla být vždy i interpretace výsledku, ke které je potřeba znát mnoho proměnných (farmakokinetika léčiva, aktuální stav pacienta – komorbidity, stav eliminačních orgánů, laboratorní hodnoty, farmakologická anamnéza, čas odběru vzorku atd.) [3].
Psychiatrická onemocnění jsou dnes v populaci velmi rozšířená a psychofarmaka patří k často předepisovaným léčivům, a to nejen v oboru psychiatrie. TDM bývá v praxi rutinně využíváno pro optimalizaci dávek stabilizátorů nálady, které mají v psychiatrii specifické postavení, jelikož velkou část z nich představují léčiva využívaná také v neurologii (karbamazepin, valproát, lamotrigin, gabapentin, pregabalin, topiramát), a i proto máme v jejich případě k metodě TDM lepší přístup a k dispozici více dat. Méně je využíváno pro antipsychotika, a ještě v menší míře pro antidepresiva. Víme, že u části pacientů užívajících psychofarmaka se nedostaví optimální odezva na farmakoterapii i přes podávání vyšších dávek nebo že při běžném dávkování trpí výraznými nežádoucími účinky. Je chybou, že zejména v těchto případech nevyžíváme metody TDM častěji.
TDM – základní pojmy
a principy
Základním předpokladem pro racionalitu provedení vyšetření TDM je korelace účinku léčiva s jeho plazmatickou koncentrací, která je v případě většiny psychofarmak relevantnější než korelace účinku s jejich dávkou. Dále z četných farmakokinetických studií vyplývá, že i koncentrace psychofarmak v mozku koreluje lépe s plazmatickou koncentrací než s podanou dávkou [2].
Pro každý lék, ke kterému
existuje metodika měření plazmatické koncentrace, je stanoveno
doporučené terapeutické rozmezí vymezené spodní
hranicí – minimální terapeutická koncentrace, pod
níž hrozí neúčinnost léčiva, a horní hranicí –
maximální terapeutická koncentrace, nad níž výrazně
vzroste riziko výskytu nežádoucích účinků a toxicity.
Tyto hodnoty vycházejí z farmakokinetických studií, jsou
orientační a není možné je v praxi dogmaticky
aplikovat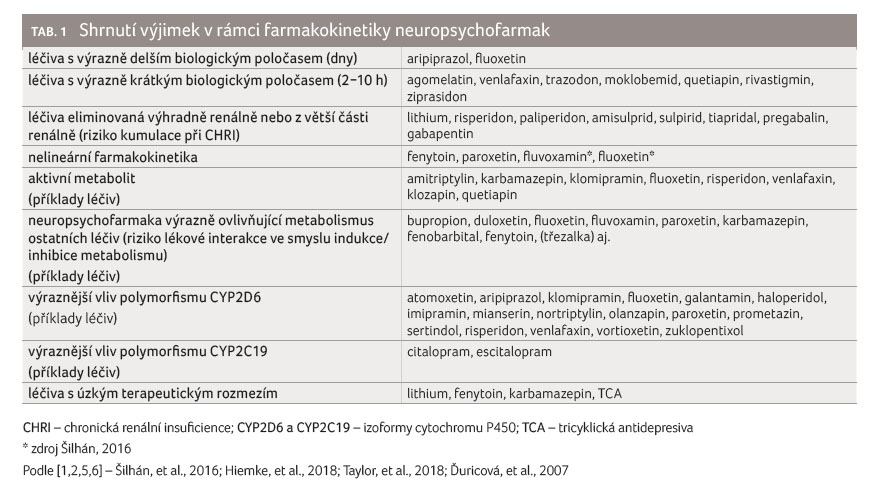 na každého pacienta. Pro některé léky může být
toto terapeutické rozmezí velmi úzké, což znamená, že krátce
po dosažení terapeutické hladiny léčiva se malým přídavkem
dávky může hladina dostat do oblasti abnormálních hodnot.
Příklady takových léčiv najdeme v tabulce 1. Pro
každé léčivo máme dále stanovenu i tzv. alert hodnotu,
která by neměla být překročena, a v případě jejího
dosažení má být lékař indikující vyšetření TDM okamžitě
informován laboratoří, aby mohl zareagovat odnětím léku či
snížením jeho dávky. Pohybuje li se plazmatická koncentrace
léčiva nad alert hodnotou, hrozí pacientovi již závažné
projevy toxicity. Stanovení této hodnoty vychází z hlášení
intoxikací, anebo je arbitrárně stanovena na dvojnásobek
maximální terapeutické koncentrace. Ve výjimečných
případech je možné i přes dosažení alert hodnoty dávku
ponechat, a to za předpokladu, že pacient dávku dobře
toleruje a snížení by prokazatelně vedlo k dekompenzaci
stavu. Nicméně je potřeba tento postup řádně dokumentovat
a odběr na stanovení hladin následně opakovat. Tato
situace nastává v naší praxi zcela ojediněle.
na každého pacienta. Pro některé léky může být
toto terapeutické rozmezí velmi úzké, což znamená, že krátce
po dosažení terapeutické hladiny léčiva se malým přídavkem
dávky může hladina dostat do oblasti abnormálních hodnot.
Příklady takových léčiv najdeme v tabulce 1. Pro
každé léčivo máme dále stanovenu i tzv. alert hodnotu,
která by neměla být překročena, a v případě jejího
dosažení má být lékař indikující vyšetření TDM okamžitě
informován laboratoří, aby mohl zareagovat odnětím léku či
snížením jeho dávky. Pohybuje li se plazmatická koncentrace
léčiva nad alert hodnotou, hrozí pacientovi již závažné
projevy toxicity. Stanovení této hodnoty vychází z hlášení
intoxikací, anebo je arbitrárně stanovena na dvojnásobek
maximální terapeutické koncentrace. Ve výjimečných
případech je možné i přes dosažení alert hodnoty dávku
ponechat, a to za předpokladu, že pacient dávku dobře
toleruje a snížení by prokazatelně vedlo k dekompenzaci
stavu. Nicméně je potřeba tento postup řádně dokumentovat
a odběr na stanovení hladin následně opakovat. Tato
situace nastává v naší praxi zcela ojediněle.
Podstatné je, až na výjimky (akutní stavy, intoxikace), stanovovat plazmatické koncentrace léčiv až v momentě dosažení ustáleného stavu (steady state, css), který nastává zhruba po uplynutí pěti biologických poločasů po zahájení medikace nebo po změně dávky. Je potřeba zohlednit i lékovou formu, která může měnit farmakokinetiku samotného léčiva (např. depotní přípravky antipsychotik, tablety s prodlouženým uvolňováním) [2,4].
U lineární farmakokinetiky platí, že dvojnásobné navýšení dávky zvýší plazmatickou koncentraci zhruba dvojnásobně. Mezi neuropsychofarmaky jsou ale i některá léčiva s nelineární farmakokinetikou a u nich je velmi vhodné plazmatické koncentrace monitorovat (viz tabulku 1).
V praxi se odběr vzorků na stanovení hladin léčiv nejčastěji realizuje v době, kdy dosahují jejich nejnižší koncentrace (údolní, trough), tj. právě před podáním další dávky, z důvodů plochosti křivky (závislosti koncentrace na čase) v tomto úseku, kde jsou hodnoty koncentrace nejméně variabilní [2]. Toto pravidlo platí i pro TDM depotních přípravků.
Specifika farmakokinetiky psychofarmak
Většina psychofarmak jsou malé lipofilní molekuly. Jedná se tedy o látky s dobrou absorpcí z gastrointestinálního traktu (tj. s dobrou biologickou dostupností), se snadným přechodem přes hematoencefalickou bariéru, s velkým distribučním objemem (Vd), s lineární farmakokinetikou a velká část z nich je metabolizována játry (nejčastěji za pomoci cytochromu P450, UDP glukuronyltransferázy aj.) zpravidla na neaktivní metabolity. Existují ale i výjimky (např. delší/kratší biologický poločas, existence aktivního metabolitu, významná renální eliminace apod.), které je potřeba znát, abychom dokázali výsledky TDM správně interpretovat (více viz tabulku 1) [2,5].
Dalším důležitým faktorem, jehož znalost je podstatná pro správnou interpretaci výsledků TDM vyšetření, je existence genetického polymorfismu u některých forem cytochromu P450, a to u CYP2D6 a CYP2C19. Jedinci v populaci mohou mít tedy různě funkční (aktivní) alely. V rámci cytochromu CYP2D6 bylo identifikováno na 70 variantních alel. Výsledkem je, že v aktivitě těchto izoforem existuje velká interindividuální variabilita, na jejímž základě lze rozdělit populaci na pomalé, intermediární, rychlé a ultrarychlé metabolizátory.
Pomalí metabolizátoři jsou nositeli dvou deficitních alel, proto jsou vystaveni vyššímu riziku toxicity, pokud užívají léčiva, která se primárně metabolizují touto cestou, neboť následně dochází ke kumulaci mateřské látky. Dále hrozí selhání terapie u léčiv, která se tímto způsobem aktivují z proléčiva. A opačně platí, že u ultrarychlých metabolizátorů hrozí neúčinnost léčiv, která jsou metabolizována výhradně jednou ze dvou zmíněných izoforem, a toxicita, pokud jsou touto izoformou aktivována z proléčiva. Izoforma CYP2D6 se podílí na metabolizaci asi 30 % léčiv. Polymorfismem CYP2D6 může být tedy ovlivněna i účinnost mnoha antidepresiv a antipsychotik (viz tabulku 1) [6]. Jsou i další enzymy, které zřejmě polymorfismus vykazují (např. UDP glukuronyltransferáza), jeho klinický význam však není jednoznačný [2].
TDM v psychiatrii a jeho
využití v praxi
Terapeutické monitorování psychofarmak se již zařadilo do spektra dostupných vyšetření jak v nemocniční, tak v ambulantní sféře. Na druhou stranu potenciál této metody v oblasti psychiatrie stále nebývá plně využit. Exaktních metod je v psychiatrii nedostatek, TDM k nim však rozhodně patří. Zkušené oko a ucho psychiatra nemůže stačit k tomu, aby mohly být zodpovězeny všechny otázky ohledně účinnosti farmakoterapie. Dále je mnoho psychofarmak podáváno profylakticky, tudíž jediným zjevným důkazem neúčinnosti medikace může být relaps onemocnění. Bez provedení TDM je obtížné rozlišit, zda relaps nastal z důvodu neúčinnosti léku, nebo zda nebylo pouze dosaženo dostatečné lékové hladiny, aby se mohl stát účinným.
Psychofarmaka jsou v praxi používána zhruba od 50. let minulého století a dnes máme k dispozici širokou paletu účinných léčiv. Ke každému z nich existuje rozsah doporučeného dávkování (minimální/úvodní až maximální dávka) a léčíme pacienty dle evidence based medicine (EBM), tj. řídíme se odbornými doporučeními, která vyplývají z výsledků velkých randomizovaných studií kontrolovaných placebem (randomized controlled trials, RCTs). V rámci těchto guidelines máme při terapii pacientů s různými diagnózami (nejen v psychiatrii) zahajovat léčbu nejdříve tzv. léčivy první volby, což jsou látky, které mají dle EBM u pacientů s danou diagnózou nejvyšší efektivitu a současně nejméně rizik (nežádoucích účinků). Například v případě léčby unipolární deprese jsou jednou z možností léčiv první volby a v praxi často preferovanou skupinou antidepresiv inhibitory zpětného vychytávání serotoninu (SSRI) [5,7−9]. I přes prokázanou účinnost a dobrou snášenlivost, které byly u této skupiny léčiv doloženy mnoha RCTs, se zdá, že odpověď na ně nemusí být vždy optimální a je reálně nižší, než bychom čekali [10]. Například ve studii STAR*D odpovědělo na monoterapii citalopramem (první volba v této studii) remisí pouze 28 % pacientů a alespoň 50% redukce symptomatiky bylo dosaženo pouze u 47 % pacientů [5,11]. Z dostupných dat tedy vyplývá, že velká část pacientů (30−50 %) s diagnózou deprese (ale např. i schizofrenie) neodpovídá optimálně na léčbu psychofarmaky podávanými ve standardních dávkách [12].
Příčin, proč tomu tak je, může být více, např. non compliance pacienta (viz dále), nicméně výše zmíněná farmakokinetická interindividuální variabilita zde může hrát také významnou roli. Metoda TDM nám může u těchto pacientů pomoci nastavit optimální dávku. Pokud by bylo TDM využíváno v oblasti neuropsychofarmak častěji, mohli bychom se v některých případech vyhnout unáhleným změnám farmakoterapie a označení účinného léčiva první volby za lék bez efektu, nebo naopak za špatně tolerovaný. Tento postup může ve výsledku vést ke vzniku neracionálních kombinací méně účinných léčiv, k polyfarmacii nebo k tvorbě preskripčních kaskád, kdy se za účelem zvládnutí nežádoucího účinku jednoho léku předepisují další léčiva.
Účinnost léčby v kombinaci
Situace může být i zcela opačná. Pacient na terapii antipsychotiky dobře zareaguje a pomocí TDM může být stanovena optimální individuální terapeutická hladina, která bude sloužit jako referenční pro tohoto konkrétního pacienta. Může se stát, že do medikace bude přidán lék s interakčním potenciálem, který by mohl plazmatickou koncentraci tohoto léčiva např. snižovat, a pak by bylo možné dávku psychofarmaka upravit (i off label) tak, aby hladina léku byla nadále co nejblíže té referenční. Tato možnost bývá v praxi opomíjena.
Symptomy psychiatrických onemocnění jsou velmi komplexní, rozdílné u jednotlivých pacientů a v čase měnlivé. Výsledkem léčby těžkých, resp. obtížně kompenzovatelných stavů bývá medikace s velkým počtem psychofarmak neboli (psycho)polyfarmacie. Nemusí se vždy jednat o neracionální postup, jen je nutné ohlídat rizika a postupovat s rozvahou, znát indikaci každého léčiva a racionalitu medikace neustále přehodnocovat. Při kombinační terapii pak vzniká prostor pro lékové interakce (farmakokinetické i farmakodynamické) a dále narůstá riziko nežádoucích účinků. V oblasti lékových interakcí lze TDM velmi dobře využít pro objektivizaci dopadu konkrétní lékové interakce u konkrétního pacienta. Například máme zkušenost, že při současném užívání karbamazepinu a quetiapinu dosahují plazmatické koncentrace quetiapinu v důsledku indukce CYP3A4 karbamazepinem téměř nulové hodnoty, i přesto se však tato kombinace v medikaci pacientů vyskytuje relativně často (viz kazuistiku 1). Pokud mluvíme o lékových interakcích, ne vždy to nutně musí znamenat interakci léčiva s jiným léčivem. Specifickou interakcí, která si v oblasti psychofarmak zaslouží naši pozornost, je ovlivnění plazmatických koncentrací klozapinu (a olanzapinu) kouřením tabákových výrobků. Hořením cigarety nebo doutníku (stejně tak při grilování masa) vznikají polycyklické aromatické uhlovodíky (PAH), které jsou induktory enzymu CYP1A2. Touto cestou se majoritně metabolizuje klozapin (i olanzapin) a kouření tabákových výrobků může významně snižovat jejich plazmatické koncentrace. Problém nastává i tehdy, jestliže takový pacient náhle přestane kouřit. V tomto případě by ideálně měl být asi týden před prvním plánovaným dnem bez cigaret odebrán vzorek pro zjištění sérové koncentrace klozapinu (jako reference). Poté, co pacient přestane kouřit, by měla být dávka klozapinu snížena asi na 75 % (tedy o 25 %) a po týdnu by opět měla být pro kontrolu odebrána hladina. Nárůst sérové koncentrace klozapinu lze očekávat asi za 7−10 dní po ukončení kouření [5,13].
Bezpečnost léčby
Další oblastí pro uplatnění TDM je výskyt nežádoucích účinků, zejména závislých na dávce. V případě antipsychotik se jedná o tyto nežádoucí účinky: prodloužení intervalu QTc, sedace, extrapyramidová symptomatika, elevace hodnot prolaktinu, ortostatická hypotenze a anticholinergní účinky [14]. Při výskytu nežádoucích účinků je vždy možné ověřit, zda se pacient nepohybuje v toxických hladinách, případně stanovit sérovou koncentraci, při níž se tyto nežádoucí účinky vyskytly. Při podávání kombinovaného režimu také může nastat situace, kdy není jasné, které léčivo za nežádoucím účinkem stojí, např. v případě výrazného prodloužení intervalu QTc a současného podávání dvou léčiv s vyšším rizikem prodloužení QTc (risperidon a quetiapin). I zde může být TDM podkladem pro rozhodování o úpravě lékového režimu.
Mezi pacienty máme také populace, u kterých již předem musíme předpokládat odchylky ve farmakokinetice (děti, pacienti starší 65 let, těhotné ženy, pacienti kachektičtí nebo obézní, s poruchami eliminačních orgánů, se srdečním selháním, kriticky nemocní aj.). U těchto pacientů není nikdy chybou provést odběr vzorků na stanovení lékových hladin pro potvrzení, že se nacházejí v terapeutickém rozmezí (viz kazuistiku 2) [1,2].
Non adherence
Non adherence je velkým problémem moderní medicíny. Až 50 % pacientů své léky neužívá dle doporučení lékaře. Psychiatrie se v tomto ohledu neliší. Naopak, zdá se, že psychiatričtí pacienti mají míru non adherence ještě vyšší (kolem 60 %) [5,15]. Důvody, pro které naši pacienti léky neužívají, jsou nejčastěji: popírání nemoci, kognitivní deficit (nepochopení instrukcí, zapomínání), vliv onemocnění (bludy, halucinace – např. hlasy nabádající k neužívání medikace), výskyt nežádoucích účinků (zejm. sexuální nežádoucí účinky, akatizie a hmotnostní přírůstek) nebo obavy z nežádoucích účinků a ze vzniku závislosti na lécích aj. [5]. TDM lze tedy využít k ověření adherence především v ambulantní sféře, kde je tato metoda jediným efektivním způsobem kontroly nad užíváním perorální medikace pacientem. Nicméně i během hospitalizace někteří pacienti zvládnou léky vydané sestrou neužívat.
Další situací, která souvisí s compliance, je ověření užívání medikace pomocí TDM při příjmu k hospitalizaci u léčiv, u nichž je doporučena titrace de novo při vynechání dávek po určité období. Jedná se o klozapin a lamotrigin, jež je nezbytné začít znovu titrovat dle doporučeného schématu, pokud jejich užívání bylo přerušeno i v řádu dní (klozapin 2 dny, lamotrigin zhruba 7 dní). Na tvrzení, že pacient léky poctivě užíval až do příjmu, se nedá mnohdy spolehnout, jelikož hrozí závažné až fatální nežádoucí účinky, hlavně při náhlém nasazení vysoké dávky nebo při rychlé titraci (klozapin − agranulocytóza, lamotrigin – Stevensův–Johnsonův syndrom) [16,17].
Intoxikace
I v období po intoxikaci léky lze TDM využít. Pokud psychiatrický pacient záměrně požije větší množství léku (často psychofarmak) a má projevy intoxikace, zpravidla je po pobytu na JIP (jednotka intenzivní péče) přeložen ke stabilizaci psychického stavu na psychiatrické oddělení akutní péče. Pacient se často nachází v závažném stavu ve smyslu dekompenzace psychiatrického onemocnění (deprese, psychóza) a je potřeba ho zaléčit. Otázka, která se nabízí, zní, kdy bude možné opět začít psychofarmaka podávat. Často jsou také informace o intoxikaci nekompletní nebo nepřesné (počet užitých tablet, čas užití, zda pacient léky vyzvracel/částečně vyzvracel apod.). V tomto případě je více než vhodné provedení TDM, jelikož se po intoxikaci, především v případě požití většího množství tablet, může farmakokinetika léčiva dočasně změnit a stát se nelineární (saturační), což znamená, že léčivo není dočasně eliminováno za pět biologických poločasů, jako je tomu u lineární farmakokinetiky, a vyšší plazmatické koncentrace léčiva mohou přetrvávat déle, než bychom čekali [18].
Forenzní indikace
Forenzní důvody mohou být další,
a nikoliv poslední indikací k provedení TDM. Pod tímto
pojmem si lze představit situaci, kdy je pacientovi soudně nařízena
léčba (ambulantní nebo ústavní) a TDM je efektivní metodou
k ověření plnění této léčby pacientem (užívání
léků). Druhá modelová situace pro využití TDM ve forenzní
oblasti souvisí s podáním léčiv off label, tj.
použití léčivého přípravku jiným způsobem, než jak je
uvedeno v souhrnu údajů o přípravku (SPC) − nejčastěji
se jedná o jinou indikaci nebo dávku. Je možné pacientovi
podat léky i ve vyšších než maximálních doporučených
dávkách nebo v jiné indikaci, pokud přínos tohoto podávání
bude větší než riziko. Nicméně je potřeba všechna možná
rizika řádně monitorovat a vše precizně zdokumentovat. TDM
představuje optimální metodu pro ověření bezpečnosti podávání
léčiv off label (viz kazuistiku 3).
Souhrn možných situací využití TDM je uveden v tabulce 2.
EBM pro TDM v oblasti psychiatrie
Silná data, která by dokládala přínos metody TDM v psychiatrii, prozatím chybějí, stejně tak data z oblasti nákladové efektivity. Nicméně je možné předpokládat, že například snížením míry non adherence, která prokazatelně vede k častějším rehospitalizacím, by mohla metoda TDM nepřímo snížit vysoké náklady na hospitalizaci těchto pacientů. Například v případě klozapinu platí, že pokles plazmatické koncentrace je významným prognostickým faktorem relapsu. Konkrétně ve studii Gaertera a kol. (2001) pokles plazmatické koncentrace klozapinu (o 40 % po dobu delší než 12 % času z pětiletého období) prokazatelně souvisel s vysokým rizikem rehospitalizace [10,19].
Doporučené postupy
psychiatrické péče Psychiatrické společnosti ČLS JEP [20]
přehledně rozdělují psychofarmaka dle stupně doporučení
k provedení TDM. Monitorování lékové hladiny je povinné
pro lithium a rozhodně je doporučeno pro mnoho dalších
psychofarmak (viz tabulku 3).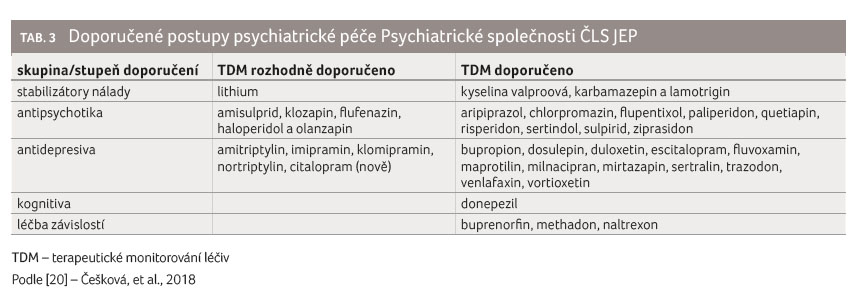
Autoři českých doporučených postupů vycházeli při jejich tvorbě v oblasti TDM mimo jiné z dokumentu Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology [2], jehož aktualizovaná verze vyšla v roce 2018 a je volně dostupná na internetu. Tento dokument je velmi kvalitním a komplexním přehledem na téma TDM v oblasti psychiatrie a rozděluje psychofarmaka do čtyř kategorií podle stupně důkazů klinické užitečnosti této metody (dle EBM):
1 – TDM rozhodně doporučeno při titraci dávek a ve specifických klinických situacích – data pro referenční rozmezí pocházejí z RCTs, kde jasně koreloval efekt nebo výskyt nežádoucího účinku s plazmatickou koncentrací;
2 – TDM doporučeno při titraci dávek a ve specifických klinických situacích – data pro referenční rozmezí pocházejí z publikovaných údajů o závislosti efektu nebo výskytu nežádoucího účinku na plazmatické koncentraci;
3 – TDM užitečné ve specifických situacích – data pro referenční rozmezí byla vypočtena na základě naměřených plazmatických koncentrací při podávání doporučených dávek;
4 – TDM potenciálně užitečné ve specifických situacích – plazmatické koncentrace nekorelují s efektem (např. v důsledku specifického farmakologického efektu), nebo naopak lze efekt sledovat přímo (sanace spánku po podání hypnotika).
Je tedy jasné, jak bychom měli postupovat, ale jaká je situace v naší praxi? U stabilizátorů nálady je TDM v Psychiatrické nemocnici Bohnice dobře etablováno, odebírá se u všech pacientů opakovaně, lze mluvit svým způsobem i o rutinní praxi. Jiná situace platí pro ostatní skupiny psychofarmak. Navzdory silnému doporučení k monitorování lékových hladin se u léčiv ze skupiny antipsychotik provádí TDM častěji u klozapinu a olanzapinu, dále také u risperidonu a jeho aktivního metabolitu paliperidonu, případně u aripiprazolu, zatímco u amisulpridu, flufenazinu a haloperidolu je spíše okrajovou záležitostí. Ještě sporadičtěji jsou měřeny hladiny antidepresiv, donepezil monitorován nebývá.
TDM a nejčastější chyby
V českých doporučeních [20] (viz výše) je velmi hezky formulováno, že TDM by mělo být využíváno, pokud klinik dokáže zformulovat konkrétní otázku, na kterou má vyšetření odpovědět. Neměla by nastat situace, že TDM je provedeno u pacienta, který je stabilní při dávce v doporučeném terapeutickém rozmezí a bez nežádoucích účinků, a po zjištění supraterapeutické plazmatické koncentrace vyvstane otázka „Co dál?“. Snížení dávky by mohlo vést k dekompenzaci stavu, ovšem jsou cítit i určité rozpaky nad volbou pokračovat u pacienta v léčbě dávkou, která vede k dosažení vyšší než doporučené hladiny léčiva. Samotná výsledná hodnota plazmatické koncentrace by nikdy neměla být jediným důvodem k úpravě dávky. Další nejčastější chyby při TDM jsou shrnuty v tabulce 4.
Závěr
Terapeutické monitorování léčiv v oboru psychiatrie má v dnešní době již své jisté místo. Ačkoliv je toto vyšetření dostupné jak pro ambulantní, tak pro nemocniční oblast, potenciál této metody stále nebývá plně využit. Jedním z důvodů, proč tomu tak je, by mohla být i cena: ačkoliv není výrazně vysoká, může z pohledu podfinancování oboru psychiatrie stále bránit častějšímu využívání TDM. Další překážkou, konkrétně v naší nemocnici, je časová prodleva mezi odběrem a doručením výsledků (u některých psychofarmak), která mnohdy představuje i pět dní. Ve většině takových případů se musíme při pochybnostech rozhodovat bez znalosti výsledku TDM, který nám správnost našeho rozhodnutí zpětně pouze potvrdí, nebo vyvrátí. Dalším problémem může být nedostatečná informovanost kliniků o potenciálu TDM. Je potřeba se v této oblasti neustále vzdělávat tak, aby metoda TDM mohla být racionálně využívána ku prospěchu našich pacientů.
Je důležité mít vždy před vlastním odběrem plazmatické koncentrace zformulovaný důvod, proč se vyšetření provádí, a dále je dobré mít na paměti, že výsledná hodnota plazmatické koncentrace léčiva není bez interpretace výsledku odborníkem plnohodnotnou informací. Ne vždy je odborník na interpretaci (nejčastěji klinický farmakolog) pro zdravotnické zařízení dostupný. Pak nezbývá než interpretovat hladiny se zapojením vlastních znalostí, případně lze výsledek konzultovat s klinickým farmaceutem, který má potřebné znalosti o farmakokinetice léčiv, a měl by tedy být schopen výsledek v kontextu pacientských dat interpretovat a navrhnout úpravu medikace.
Seznam použité literatury
- [1] Šilhán P, Kacířová I, Hýža M, et al. Terapeutické monitorování hladin léčiv v psychiatrii – možnosti využití v praxi. Psychiatr praxi 2016; 17: 10−14.
- [2] Hiemke C, Bergemann N, Clement HW, et al. Consensus Guidelines for Therapeutic Drug Monitoring in Neuropsychopharmacology: Update 2017. Pharmacopsychiatry 2018; 51: 9−62.
- [3] Tesfaye H. Terapeutické monitorování léčiv v současném pojetí. Remedia 2014; 24: 52−57.
- [4] Lincová D, Farghali H, et al. Základní a aplikovaná farmakologie. Praha: Galén, 2007. ISBN 978‑80‑7262‑373‑0
- [5] Taylor D, Barnes TRE, Young AH. The Maudsley Prescribing Guidelines in Psychiatry, 13. vydání. London: Wiley Blackwell, 2018. ISBN 978‑1‑119‑44260‑8
- [6] Ďuricová J, Grundmann M. CYP2D6 a jeho klinický význam. Klin Farmakol Farm 2007; 21: 133–136.
- [7] Simon G. Unipolar major depression in adults: Choosing initial treatment. UpToDate. 2019. Dostupné na: www.uptodate.com
- [8] Raboch J, Červený R. Deprese. Doporučené diagnostické a terapeutické postupy pro všeobecné praktické lékaře. Novelizace 2018. Dostupné na: www.svl.cz
- [9] Raboch J, Uhlíková P, Hellerová P, et al. Doporučené postupy psychiatrické péče IV. Deprese u dospělých. 2014. ISBN 978‑80‑260‑5792‑5
- [10] Hiemke C. Therapeutic drug monitoring in neuropsychopharmacology: does it hold its promises? Eur Arch Psychiatry Clin Neurosci 2008; 285(Suppl 1): 21−27.
- [11] Kupfer JD, Frank E, Phillips ML. Major depressive disorder: new clinical, neurobiological, and treatment perspectives. Lancet 2012; 379: 1045−1055.
- [12] Kacířová I, Grundmann M, Uřinovská R. Obecné zásady terapeutického monitorování hladin psychofarmak. Klin Farmakol Farm 2012; 26: 131−134.
- [13] Al‑Jaffar H. What are the clinically significant drug interactions with tobacco smoking? Medicines Q&As 2020. NHS. Dostupné na: www.sps.nhs.uk
- [14] Stroup TS, Gray N. Management of common adverse effects of antipsychotic medications. World Psychiatry 2018; 17: 341−356.
- [15] Gonzales JM, Williams JW, Hitchcock Noël P, et al. Adherence to Mental Health Treatment in a Primary Care Clinic. J Am Board Fam Pract 2005; 18: 87−96.
- [16] Souhrn údajů o přípravku Clozapin Desitin. Dostupné na: www.sukl.cz
- [17] Souhrn údajů o přípravku Lamictal. Dostupné na: www.sukl.cz
- [18] Roberts DM, Buckley NA. Pharmacokinetic considerations in clinical toxicology: clinical applications. Clinical pharmacokinetics 2007; 46: 897−939.
- [19] Gaertner I, Gaertner HJ, Vonthein R, Dietz K. Therapeutic Drug Monitoring of Clozapine in Relaps Prevention: A Five‑Year Prospective Study. J Clin Psychopharmacol 2001; 21: 305−310.
- [20] Češková E, Šilhán P, Kacířová I, et al. Terapeutické monitorování léčiv v psychiatrii. Doporučené postupy psychiatrické péče V. Psychiatrická společnost ČLS JEP 2018.
