Abemaciklib
Souhrn:
Brančíková D. Abemaciklib. Remedia 2019; 29: 310–314.
Abemaciklib patří mezi inhibitory cyklin‑dependentních kináz (CDK) 4 a 6. Cílovou skupinou pro léčbu jsou premenopauzální i postmenopauzální pacientky s metastatickým hormon-dependentním, HER2 (humánní epidermální receptor 2) negativním nádorem prsu. Abemaciklib prokázal účinek v monoterapii, avšak lepší výsledky měl v kombinaci s aromatázovým inhibitorem nebo s fulvestrantem, u premenopauzálních žen rovněž v kombinaci s analogem LHRH (hormon uvolňující luteinizační hormon). Doporučen je k perorálnímu užívání ve formě tablet 2× denně 150 mg v plné dávce, v případě toxicity lze dávku redukovat až na 50 mg 2× denně. V registrační studii MONARCH 3 při kombinaci s letrozolem nebo anastrozolem bylo dosaženo mediánu přežití bez progrese (progression free survival, PFS) 28,2 měsíce oproti 14,8 měsíce v rameni s placebem (poměr rizik [HR] 0,540; 95% interval spolehlivosti [CI] 0,418‒0,698; p < 0,000002). Ve studii MONARCH 2 při kombinaci s fulvestrantem v dávce 500 mg oproti kombinaci s placebem u pacientek s primární nebo sekundární hormonální rezistencí bylo PFS 16,4 měsíce oproti 9,3 měsíce v rameni s placebem (HR 0,553; 95% CI 0,449‒0,681; p = 0,0000001). Mezi nejčastější nežádoucí účinky patří průjem (závažnost stupně 3 byla zaznamenána pouze v 11,7 % případů), neutropenie stupně 3 s výskytem ve 22,9 % případů a stupně 4 u 2,5 % pacientek. Není nutná redukce dávky u starších pacientů ani při lehké hepatální či renální nedostatečnosti, opatrnosti je třeba až při jaterním selhání stupně C podle Childova‒Pughova skóre. Výhodu abemaciklibu oproti ostatním inhibitorům CDK4/6 představuje jeho malá molekula prostupující hematoencefalickou bariérou, velmi dobrá efektivita i profil nežádoucích účinků s absencí kardiotoxicity. Nevýhodou je velmi častý výskyt průjmů.
Summary:
Brancikova D. Abemaciclib. Remedia 2019; 29: 310–314.
Abemaciclib belongs to cyclin‑dependent kinase (CDK) inhibitors, specifically kinases 4 and 6. The main target group for treatment is pre‑ and post‑menopausal patients with metastatic, hormone‑dependent, HER‑negative breast cancer. Abemaciclib demonstrated an effect as monotherapy but better results were achieved in combination treatment with an aromatase inhibitor or fulvestrant, and in combination with an luteinising hormone releasing hormone analogue in case of pre‑menopausal women. It is recommended as oral treatment taken twice daily in full dose of 150mg; in case of toxicity, a reduction is possible down to 50mg. According to the MONARCH 3 registration study in combination with letrozole or anastrozole, PFS median of 28.2 months versus 14.8 months in the placebo arm was achieved (HR 0.540; 95% CI 0.418‒0.698; p < 0.000002). In MONARCH 2 study in combination with 500mg fulvestrant versus placebo in patients with primary or secondary hormone resistance, PFS was 16.4 months versus 9.3 in the placebo arm (HR 0.553; 95% CI 0.449‒0.681; p = 0.0000001). The most common side effects are diarrhea (only 11.7% of grade 3), neutropenia grade 3 reached 22.9% and grade 4 in 2.5% of patients. No dose reduction is required in elderly patients, even with mild hepatic or renal insufficiency; caution is only necessary from liver failure C according to Child‒Pugh score. The advantage of abemaciclib over other CDK 4/6 inhibitors is a small molecule permeating the blood‑brain barrier, very good efficacy and a side effect profile that lacks cardiotoxicity. The disadvantage is the very frequent occurrence of diarrhea.
Key words: abemaciclib, cyclin‑dependent kinases 4 and 6, metastatic breast tumor.
Abemaciklib patří mezi inhibitory
cyklin dependentních kináz (CDK) 4 a 6. Hlavní cílovou
skupinu pro léčbu představují premenopauzální
i postmenopauzální pacientky trpící metastatickým
hormon-dependentním, HER2 negativním nádorem prsu. Léčivý
přípravek je k dispozici pod názvem Verzenios
v síle 150 mg, 100 mg a 50 mg, označení dle
klasifikace ATC: abemaciklib
(L01XE50),
protinádorový lék ze skupiny cílené
léky, Inhibitory
proteinové kinázy.
Indikace
Abemaciklib je indikován k léčbě žen s lokálně pokročilým nebo metastatickým karcinomem prsu pozitivním na hormonální estrogenní receptory (ER) a negativním na receptor typu 2 pro lidský epidermální růstový faktor (HER2) v kombinaci s inhibitorem aromatázy nebo s fulvestrantem jako počáteční endokrinní terapie, indikován je rovněž u žen, které již dříve dostávaly endokrinní terapii. U žen před menopauzou nebo u perimenopauzálních žen je doporučeno endokrinní léčbu kombinovat s agonistou hormonu uvolňujícího luteinizační hormon (LHRH) [1].
Dávkování
V kombinaci s endokrinní terapií je indikována dávka abemaciklibu 150 mg dvakrát denně a je doporučeno podávat ji nepřetržitě do progrese choroby nebo do stavu neúnosné toxicity. První redukce dávky představuje 100 mg 2× denně a další možná redukce je na 50 mg 2× denně. Užití tablety je možné nezávisle na jídle, ale nevhodná je kombinace s grapefruitem nebo grapefruitovou šťávou. Doporučuje se užívat lék každý den přibližně ve stejnou dobu a tablety se nemají před spolknutím žvýkat, drtit ani půlit. U dětí není bezpečné dávkování stanoveno, u starší populace není redukce dávky nutná, stejně tak u pacientů s renálním selháním s lehkou a střední retencí sodíku. U jaterního selhání stupně C podle Childova‒Pughova skóre se doporučuje redukce dávky na užívání jednou denně, u pacientek s těžkým renálním selháním, u nichž je plánována dialýza, se doporučuje pečlivé sledování výskytu nežádoucích účinků a dle něj eventuální přerušení nebo ukončení léčby.
Zařazení do současné palety
léčiv
Abemaciklib je třetím CDK inhibitorem, jehož podávání má být zvažováno u pacientek s metastatickým hormon-dependentním nádorem prsu v kombinaci s nesteroidním inhibitorem aromatázy. Uvedená skupina má srovnatelný protinádorový efekt, ale liší se profilem nežádoucích účinků.
Výhodou abemaciklibu je jeho malá molekula pronikající hematoencefalickou bariérou. V klinickém sledování byl prokázán dobrý efekt i u pacientek s mutacemi PIK3CA, v monoterapii a rovněž při podávání pacientkám s triplet pozitivním tumorem (ER+ HER+ PR+) [2]. Další výhodou je také zkušenost s léčbou abemaciklibem v kombinaci s anastrozolem v případě intolerance letrozolu. Naproti tomu je třeba dbát na profil nežádoucích účinků, neboť průjmy, byť méně závažné, se vyskytovaly až u 81,3 % léčených. Výskyt ostatních typů nežádoucích účinků, především kardiologických, je velmi nízký.
Mechanismus účinku‚ farmakodynamický efekt
Cyklin dependentní kinázy 4 a 6
společně s cyklinem D patří mezi hlavní regulátory
buněčného růstu a hrají jednu z hlavních rolí
v kancerogenezi (proliferaci nádorových buněk prsu)
a ve vzniku endokrinní rezistence [3].
Buňky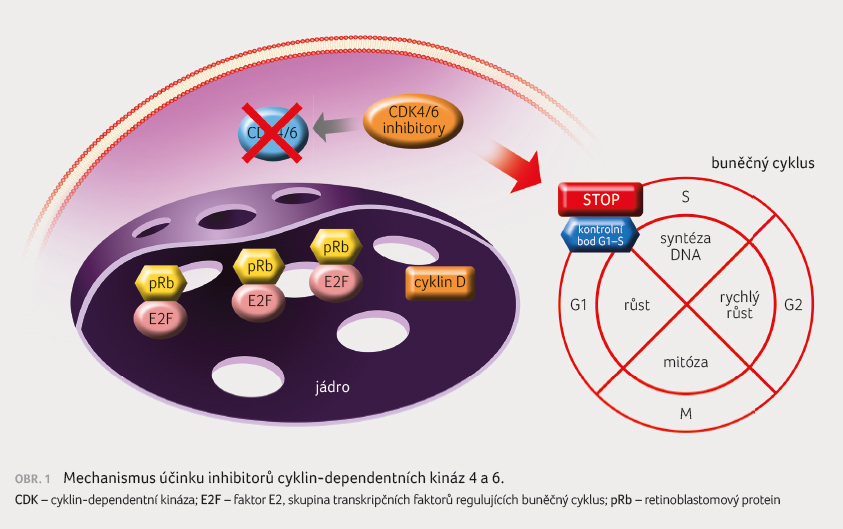 lidského karcinomu prsu MCF 7 exprimují funkční ER
a rostou v reakci na stimulaci estrogeny. Pro jejich
růst je klíčová zvýšená stimulace přechodu fází buněčného
cyklu G1/S spojeného se zvýšenou expresí cyklinu D1,
s aktivací CDK a s fosforylací proteinu
retinoblastomu [4], obrázek 1. Abemaciklib
(LY2835219) patřící mezi inhibitory CDK4/6 je strukturně odlišný
od jiných duálních inhibitorů (např. palbociklib,
ribociklib) a vykazuje vyšší selektivitu pro CDK4 ve srovnání
s CDK6. V souladu s aktivitou proti CDK4/6 abemaciklib
inhibuje fosforylaci retinoblastomového proteinu a vede
k zástavě fáze G1 v buněčných liniích schopných
tvorby retinoblastomového proteinu [5].
V modelu xenoimplantátu kolorektálního karcinomu používaného
k vývoji integrovaného farmakokinetického/farmakodynamického
modelu může být abemaciklib podáván perorálně v kontinuálním
režimu pro dosažení trvalé inhibice cíle a demonstruje
nejen trvanlivou inhibici buněčného cyklu, ale také
protinádorovou aktivitu [6]. Inhibice
růstu nádoru je pozorována u mnoha dalších modelů lidského
nádorového xenotransplantátu, včetně nemalobuněčného
karcinomu plic, melanomu, glioblastomu a lymfomu z plášťových
buněk. Abemaciklib se distribuuje přes hematoencefalickou bariéru
a prodlužuje přežití v modelu intrakraniálního
glioblastomu [7], což naznačuje
potenciální účinnost proti primárním a metastatickým
nádorům centrálního nervového systému. Preklinické důkazy
prokázaly důležitost nepřetržité inhibice CDK4/6 pro podporu
trvalého zastavení růstu vedoucího k apoptóze nebo
senescenci, zatímco krátkodobá inhibice způsobila jen dočasnou
zástavu fáze G1. Abemaciklib je čtrnáctkrát účinnější
proti komplexu CDK4/cyklin D1 než vůči komplexu
CDK6/cyklin D3 [8].
lidského karcinomu prsu MCF 7 exprimují funkční ER
a rostou v reakci na stimulaci estrogeny. Pro jejich
růst je klíčová zvýšená stimulace přechodu fází buněčného
cyklu G1/S spojeného se zvýšenou expresí cyklinu D1,
s aktivací CDK a s fosforylací proteinu
retinoblastomu [4], obrázek 1. Abemaciklib
(LY2835219) patřící mezi inhibitory CDK4/6 je strukturně odlišný
od jiných duálních inhibitorů (např. palbociklib,
ribociklib) a vykazuje vyšší selektivitu pro CDK4 ve srovnání
s CDK6. V souladu s aktivitou proti CDK4/6 abemaciklib
inhibuje fosforylaci retinoblastomového proteinu a vede
k zástavě fáze G1 v buněčných liniích schopných
tvorby retinoblastomového proteinu [5].
V modelu xenoimplantátu kolorektálního karcinomu používaného
k vývoji integrovaného farmakokinetického/farmakodynamického
modelu může být abemaciklib podáván perorálně v kontinuálním
režimu pro dosažení trvalé inhibice cíle a demonstruje
nejen trvanlivou inhibici buněčného cyklu, ale také
protinádorovou aktivitu [6]. Inhibice
růstu nádoru je pozorována u mnoha dalších modelů lidského
nádorového xenotransplantátu, včetně nemalobuněčného
karcinomu plic, melanomu, glioblastomu a lymfomu z plášťových
buněk. Abemaciklib se distribuuje přes hematoencefalickou bariéru
a prodlužuje přežití v modelu intrakraniálního
glioblastomu [7], což naznačuje
potenciální účinnost proti primárním a metastatickým
nádorům centrálního nervového systému. Preklinické důkazy
prokázaly důležitost nepřetržité inhibice CDK4/6 pro podporu
trvalého zastavení růstu vedoucího k apoptóze nebo
senescenci, zatímco krátkodobá inhibice způsobila jen dočasnou
zástavu fáze G1. Abemaciklib je čtrnáctkrát účinnější
proti komplexu CDK4/cyklin D1 než vůči komplexu
CDK6/cyklin D3 [8].
Farmakokinetické vlastnosti
Absorpce abemaciklibu je pomalá s časem dosažení maximální plazmatické koncentrace osm hodin a s absolutní biologickou dostupností přibližně 45 %. Po opakovaném podávání dvakrát denně bylo dosaženo ustáleného stavu během pěti dnů. Vazba na plazmatické bílkoviny je velmi silná (průměrně v 98 %). Koncentrace abemaciklibu a jeho aktivních metabolitů v mozkomíšním moku jsou srovnatelné s plazmatickými koncentracemi nevázané formy. Metabolizován je hlavně játry, kde je biotransformován pomocí cytochromu P450 (CYP)3A4, a tyto cirkulující hydroxylované metabolity jsou stejně biologicky aktivní a účinné jako abemaciklib. Průměrný plazmatický eliminační poločas abemaciklibu činil 24,8 hodiny. Po jediné perorální dávce přípravku bylo přibližně 81 % abemaciklibu vyloučeno ve stolici a 3,4 % v moči.
Klinické zkušenosti
V randomizované, dvojitě zaslepené registrační studii fáze III MONARCH 3 byl zkoušen abemaciklib ve srovnání s placebem společně s nesteroidními inhibitory aromatáz u 493 žen s ER pozitivním HER2 negativním nádorem prsu nepředléčených pro lokálně pokročilé nebo metastatické onemocnění. Pacientky dostávaly abemaciklib v dávce 150 mg 2× denně nebo placebo společně s 1 mg anastrozolu denně, nebo s 2,5 mg letrozolu denně. U nemocných v rameni s abemaciklibem byl zaznamenán signifikantně prodloužený interval do progrese (progression free survival, PFS) ‒ poměr rizik (HR) 0,54; 95% interval spolehlivosti (CI) 0,418‒0,689; p = 0,000002 –, a bylo tedy dosaženo primárního cíle studie. U pacientek s měřitelnou lézí činila objektivní odpověď 61 % v rameni s abemaciklibem a 45,5 % v rameni s placebem (p = 0,003). Nejčastější nežádoucí reakci v rameni s abemaciklibem představoval průjem (82,3 %), avšak většinou nízkého stupně závažnosti (stupeň 1 u 42,5 % nemocných). V uvedeném rameni bylo zachyceno více závažnějších nežádoucích účinků, a to neutropenie stupně 3/4 u 23,8 % pacientek oproti placebové větvi, kde se neutropenie vyskytla pouze u 1,2 % pacientek. Dalšími byly závažný průjem stupně 3 u 9,5 % pacientek ze skupiny s abemaciklibem oproti 1,2 % ve skupině s placebem, leukopenie stupně 3/4 u 8,6 % pacientek léčených abemaciklibem oproti 0,6 % ze skupiny s placebem [9]. Studie fáze III MONARCH 2 hodnotila pacientky s ER pozitivním HER2 negativním pokročilým nebo metastatickým nádorem prsu, které byly hormonálně rezistentní. Celkem 17 % premenopauzálních pacientek v této studii dostávalo agonistu GnRH (hormon uvolňující gonadotropin), u 25 % pacientek došlo k progresi během prvních dvou let adjuvantní endokrinní terapie nebo během prvních šesti měsíců této léčby první linie pro metastatický karcinom prsu, 59 % pacientek dostávalo (neo)adjuvantní léčbu a u 38 % došlo k selhání terapie při podávání hormonů v první linii léčby metastatického onemocnění. V rameni s kombinací abemaciklib a fulvestrant bylo zaznamenáno prodloužení mediánu PFS ve srovnání s placebovým ramenem o 7,1 měsíce (HR 0,553; 95% CI 0,499‒0,681; p < 0,001). Pacientky v rameni s abemaciklibem s měřitelným onemocněním dosáhly objektivní míry odpovědi ve 48,1 % ve srovnání s 21,3 % v rameni s placebem [10].
Nežádoucí účinky
Při léčbě abemaciklibem nebyly kromě hypersenzitivity zaznamenány žádné absolutní ani relativní kontraindikace. Na rozdíl od jiných inhibitorů CDK4/6 byl nejběžnějším nežádoucím účinkem léčby abemaciklibem ve studiích MONARCH 2 a 3 průjem, nejčastěji nízkého stupně, který byl většinou dobře regulován léčbou loperamidem. Redukce dávek léčiva byla provedena od stupně 2 nežádoucích reakcí. V rámci klinických studií byl medián doby do nástupu první příhody průjmu přibližně 6‒8 dní a medián trvání průjmu činil 9‒12 dní (stupeň 2) a 6‒8 dní (stupeň 3). Průjem může být spojen s dehydratací, proto je v případě výskytu nutno sledovat stav pacienta i iontogramu a zahájit eventuálně symptomatickou léčbu a rehydrataci. Ve studii MONARCH 3 bylo doporučeno pozastavení podávání abemaciklibu, dokud se tíže průjmu nesnížila alespoň na stupeň 1. Antidiaroika (např. loperamid) byla doporučena při prvním výskytu průjmu, přičemž u většiny (83,8 %) pacientů s počátečním průjmem 2. nebo 3. stupně nedošlo k následné události stejné nebo vyšší závažnosti [11].
Ve studiích MONARCH 2 a 3 se u většiny nemocných nevyskytla závažná neutropenie a ve studiích MONARCH 2, resp. 3 bylo neutropenických celkem 46 %, resp. 43,7 % pacientek v ramenech s abemaciklibem, většinou s reverzibilním charakterem a onemocněním nezávažného stupně. Na základě centrální laboratorní analýzy ze studie MONARCH 3 byly všechny stupně neutropenie obecně pozorovány v prvních dvou cyklech léčby a neutropenie stupně 3 a 4 během pozdějších cyklů (obvykle < 5 % v daném cyklu). Infekce se vyskytly u 39,1 % pacientů v rameni s abemaciklibem a u 28,6 % v rameni s placebem, přičemž většina z nich byla stupně 1 a 2 (33,3 % v rameni s abemaciklibem, 25,5 % v rameni s placebem).
Žilní tromboembolické příhody byly zachyceny celkem u 16 (4,9 %) nemocných v rameni s abemaciklibem a jen jedna (0,6 %) ve skupině s placebem. Většina pacientek (11 ze 16) v rameni s abemaciklibem léčbu nepřerušila.
Ve skupině s abemaciklibem byla rovněž zaznamenána vyšší míra zvýšených hodnot jaterních transamináz, které byly obvykle zvládnuty snížením nebo vynecháním dávky a kompletně se normalizovaly po přerušení léčby. Zvýšené hodnoty alaninaminotransferázy (ALT) byly pozorovány u 47,6 % pacientek (stupeň 3: 6,4 %, stupeň 4: 0,6 %) v rameni se zkoušenou látkou oproti 25,2 % (stupeň 3: 1,9 %, bez stupně 4) v rameni s placebem. Zvýšení aktivity aspartátaminotransferázy (AST) bylo pozorováno u 36,7 % pacientek (stupeň 3: 3,8 %, bez stupně 4) v rameni s abemaciklibem oproti 23,2 % (stupeň 3: 0,6 %, bez stupně 4) v rameni s placebem. Je třeba sledovat hodnoty ALT a AST, a to před zahájením léčby přípravkem Verzenios, každé dva týdny během prvních dvou měsíců léčby a poté jednou měsíčně po dobu dvou měsíců.
Vzestup hodnoty kreatininu byl častější u ramene s abemaciklibem, který zvyšuje koncentrace kreatininu v séru cestou inhibice renální tubulární sekrece bez ovlivnění glomerulární funkce [11].
Lékové interakce
Abemaciklib je primárně metabolizován CYP3A4, a proto souběžné podávání abemaciklibu s inhibitory CYP3A4 může zvýšit jeho plazmatické koncentrace. Nelze li se vyhnout souběžnému podání, je doporučeno dávku abemaciklibu snížit na 100 mg nebo 50 mg 2× denně dle toxicity. Z běžných léčiv se toto opatření dotýká především klaritromycinu, itrakonazolu, ketokonazolu, lopinaviru/ritonaviru, posakonazolu nebo vorikonazolu.
Těhotenství a kojení –
bezpečnost podání
Při testech u potkanů a psů byl abemaciklib teratogenní a způsobil sníženou hmotnost plodu při expozicích matky dávkám abemaciklibu podobajícím se doporučené dávce u člověka. Studie na zvířatech prokázaly reprodukční toxicitu. Nedoporučuje se podávání přípravku v těhotenství a u žen v reprodukčním věku, které nepoužívají antikoncepci.
Závěr
Abemaciklib má oproti ostatním inhibitorům CDK výhodu nízkého počtu kardiálních a hematologických nežádoucích účinků, což oceňujeme především u pacientů užívajících antiarytmika. Malá molekula prostupující hematoencefalickou bariérou může být výhodou z hlediska metastáz v CNS, a prospěch z ní pravděpodobně budou mít rovněž nemocné s prokázanou mutací PIK3CA, kde abemaciklib prokázal efekt bez ohledu na mutaci. Otázkou zůstává podání u pacientek s triplet pozitivním tumorem s pozitivitou receptorů i HER2 neu, u nichž by mohl obohatit škálu léčebných možností. Účinnost však bude nutné potvrdit v dalších cílených studiích.
Seznam použité literatury
- [1] SPC Verzenios, 2019. Dostupné na: http://www.ema.europa.eu/documents/pip‑decision/p/0124/2019
- [2] Patnaik A, Rosen LS, Tolaney SM, et al. Efficacy and safety of abemaciclib, an inhibitor of CDK4 and CDK6, for patients with breast cancer, non‑small cell lung cancer, and other solid tumors. Cancer Discov 2016; 6: 740‒753.
- [3] Sherr CJ, Beach D, Shapiro GI. Targeting CDK4 and CDK6: From discovery to therapy. Cancer Discov 2016; 6: 353‒367.
- [4] Foster JS, Henley DC, Bukovsky A, et al. Multifaceted regulation of cell cycle progression by estrogen: Regulation of Cdk inhibitors and Cdc25A independent of cyclin D1‑Cdk4 function. Mol Cell Biol 2001; 21: 794‒810.
- [5] Gelbert LM, Cai S, Lin X, et al. Preclinical characterization of the CDK4/6 inhibitor LY2835219: in‑vivo cell cycle‑dependent/independent anti‑tumor activities alone/in combination with gemcitabine. Invest New Drugs 2014; 32: 825–837.
- [6] Tate SC, Cai S, Ajamie RT, et al. Semi‑mechanistic pharmacokinetic/pharmacodynamic modeling of the antitumor activity of LY2835219, a new cyclin‑dependent kinase 4/6 inhibitor, in mice bearing human tumor xenografts. Clin Cancer Res 2014; 20: 3763–3774.
- [7] Raub TJ, Wishart GN, Kulanthaivel P, et al. Brain exposure of two selective dual CDK4 and CDK6 inhibitors and the antitumor activity of CDK4 and CDK6 inhibition in combination with temozolomide in an intracranial glioblasttoma Xenograft. Drug Metab Dispos 2015; 43: 1360–1371.
- [8] Torres‑Guzmán R, Calsina B, Hermoso A, et al. Preclinical characterization of abemaciclib in hormone receptor positive breast cancer. Oncotarget 2017; 8: 69493‒69507.
- [9] Johnston S, Martin M, Di Leo A, et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. npj Breast Cancer 2019; 5: 5.
- [10] Sledge GW Jr, Toi M, Neven P, et al. MONARCH 2: Abemaciclib in combination with fulvestrant in women with HR+/HER2‒ advanced breast cancer who had progressed while receiving endocrine therapy. J Clin Oncol 2017; 35: 2875‒2884.
- [11] Matthew P, Goetz, Masakazu Toi, et al. MONARCH 3: Abemaciclib As Initial Therapy for Advanced Breast Cancer. J Clin Oncol 2017; 35: 3638‒3646.