Aflibercept v současné léčbě solidních nádorů
V souhrnném článku autoři podrobně popisují cílený biologický lék – blokátor angiogeneze aflibercept (VEGF trap). V přehledném sdělení jsou uvedeny chemické a fyzikální vlastnosti afliberceptu, mechanismus účinku na molekulární úrovni, farmakodynamika a farmakokinetika. Dále se autoři zabývají potenciálním klinickým významem a postavením tohoto nového přípravku ve spektru současných protinádorových léků, a to především u metastatického kolorektálního karcinomu (mCRC), kde bylo dosaženo nejlepších výsledků. V článku nechybí popis bezpečnostního profilu léku, jeho možné nežádoucí účinky a z toho vyplývající indikace a kontraindikace. Aflibercept představuje jako nový blokátor angiogeneze další možnosti účinné cílené protinádorové léčby, zejména v kombinaci s režimem FOLFIRI u nemocných s pokročilým mCRC, kteří jsou rezistentní na léčbu režimem obsahujícím oxaliplatinu nebo u nich po této léčbě došlo k progresi onemocnění.
Úvod
Česká republika zaujímá v celosvětových statistikách přední místo ve výskytu kolorektálního karcinomu (colorectal cancer, CRC). Z hlediska incidence jsme v Evropě na třetím místě, celosvětově na místě pátém [1]. Nepříznivý je fakt, že více než 50 % nových pacientů s CRC je diagnostikováno v pokročilém stadiu onemocnění (stadium III a IV), což významně zhoršuje prognózu pacientů a dosažené výsledky léčby. U poloviny všech nemocných s CRC se v průběhu onemocnění objeví vzdálené metastázy vyžadující systémovou protinádorovou léčbu [2].
Základními chemoterapeutickými režimy v léčbě metastatického kolorektálního karcinomu (metastatic colorectal cancer, mCRC) jsou FOLFOX (oxaliplatina v kombinaci s 5-fluorouracilem – 5-FU – a leukovorinem) a FOLFIRI (irinotekan v kombinaci s 5-FU a leukovorinem). V současné době již toto základní schéma onkologické léčby významně obohacuje tzv. cílená léčba monoklonálními protilátkami bevacizumabem, panitumumabem a cetuximabem. Tyto protilátky jsou namířeny buď proti vaskulárnímu endotelovému růstovému faktoru (VEGF – bevacizumab), nebo u nemocných s divokým typem genu RAS se uplatňují monoklonální protilátky proti receptoru pro epidermální růstový faktor (anti-EGFR – cetuximab, panitumumab). Spektrum cílené léčby pro pacienty s mCRC rozšiřují nově registrované léky regorafenib a aflibercept.
Především u nemocných s mutovaným genem RAS představuje základ cílené onkologické léčby bevacizumab. Jedná se o první biologické agens, které bylo využito k blokádě angiogeneze v kombinaci s chemoterapií u nemocných s mCRC [3]. Bevacizumab je humanizovaná monoklonální protilátka, která se váže na cirkulující vaskulární endotelový růstový faktor A (vascular endothelial growth factor A, VEGF-A). Dochází tak k blokádě intracelulární signální dráhy, jejíž vedení do buněčného jádra zprostředkovává ligand VEGF-A pomocí receptorů označených jako VEGFR-1 a VEGFR-2. Tím, že bevacizumab blokuje pouze VEGF-A, může u této protilátky dojít ke vzniku nádorové rezistence navzdory faktu, že bevacizumab prokázal v klinických studiích léčebnou odpověď v první i druhé linii léčby mCRC, pokud byla provedena změna (switch) chemoterapie (FOLFOX a FOLFIRI a jejich rotace během první a druhé linie paliativní léčby). Slibným lékem léčby mCRC v kombinaci s chemoterapií režimem FOLFIRI (irinotekan/5-FU/leukovorin) u pacientů, u nichž selhala léčba obsahující oxaliplatinu, je nový blokátor angiogeneze aflibercept [4].
Farmakologická skupina
Aflibercept patří do farmakoterapeutické skupiny cytostatika, jiná cytostatika, ATC kód L01XX44.
Chemické a fyzikální vlastnosti
Aflibercept (VEGF trap, tzn. „VEGF-past”) je rekombinantní, plně humánní, solubilní fúzní protein, který se skládá z extracelulární domény lidského VEGFR-1 a VEGFR-2 a z Fc části fragmentu lidského imunoglobulinu IgG1. Aflibercept se vyrábí technologií rekombinantní DNA, a to buněčnými liniemi savčích expresních buněk získaných z ovarií křečíka čínského [5]. Následně je protilátka purifikována za pomoci standardních chromatografických a filtračních metod. Aflibercept je dimerní glykoprotein s molekulární hmotností proteinové části 97 kilodaltonů (kDa), glykosylace zvyšuje celkovou molekulární hmotnost o 15 %, na hodnotu 115 kDa. Roztok pro použití v onkologii je čirý, bezbarvý až světle žlutý a je hyperosmolární.
Mechanismus účinku, farmakodynamika
Neoangiogeneze (vznik nových cév) je nezbytnou podmínkou růstu a metastazování nádoru. VEGF je hlavním angiogenním faktorem, který je produkován nádorem od časného stadia jeho vývoje. Zatímco fyziologická angiogeneze je řízena celou řadou proangiogenních a antiangiogenních faktorů, cévní síť v nádoru vzniká pod převažujícím vlivem VEGF. Endotelové buňky těchto cév jsou plně závislé na trvalé stimulaci pomocí VEGF.
Vaskulární endotelový růstový faktor A a B (VEGF-A, VEGF-B) a placentární růstový faktor (placental growth factor, PlGF) patří do rodiny angiogenních faktorů VEGF. VEGF-A působí prostřednictvím dvou receptorových tyrosinkináz – VEGFR-1 a VEGFR-2, které jsou přítomny na povrchu endotelových buněk. PlGF a VEGF-B se vážou pouze na VEGFR-1, který je rovněž přítomen na povrchu leukocytů. VEGF-A, VEGF-B a PlGF působí jako silné mitogenní a chemotaktické faktory a jako faktory cévní permeability pro endotelové buňky.
Zablokování signální dráhy VEGF-VEGFR proto vede k zániku převažující části nádorových cév. Angiogenní signální cestu je možno blokovat více způsoby [6]. Jednou z možností je vychytání VEGF volným (cirkulujícím) receptorem, respektive jeho extracelu![Obr. 1 Mechanismus účinku afliberceptu; volně podle [5, 7] – Holash, et al., 2002; Wang, et al., 2012. VEGF – vaskulární endotelový růstový faktor, vascular endothelial growth factor; VEGFR – receptor pro vaskulární endotelový růstový faktor; PlGF – placentární růstový faktor, placental growth factor](https://www.remedia.cz/photo-a-29979---.jpg) lární doménou navázanou na vhodný nosič. Takto funguje aflibercept. Aflibercept působí jako falešný (decoy) receptor, který váže VEGF-A a příbuzné ligandy PlGF a VEGF-B s vyšší afinitou, než mají přirozené receptory. Aflibercept tak blokuje všechny izoformy VEGF-A, VEGF-B a PlGF, čímž brání aktivaci VEGFR-1 a VEGFR-2 nepřítomností těchto volných ligandů, viz obr. 1. Tímto způsobem dochází ke snížené proliferaci endotelových buněk a tím k inhibici růstu nových cév, které zásobují nádor kyslíkem a živinami. Výsledkem je majoritní blokáda nádorové angiogeneze [7, 8].
lární doménou navázanou na vhodný nosič. Takto funguje aflibercept. Aflibercept působí jako falešný (decoy) receptor, který váže VEGF-A a příbuzné ligandy PlGF a VEGF-B s vyšší afinitou, než mají přirozené receptory. Aflibercept tak blokuje všechny izoformy VEGF-A, VEGF-B a PlGF, čímž brání aktivaci VEGFR-1 a VEGFR-2 nepřítomností těchto volných ligandů, viz obr. 1. Tímto způsobem dochází ke snížené proliferaci endotelových buněk a tím k inhibici růstu nových cév, které zásobují nádor kyslíkem a živinami. Výsledkem je majoritní blokáda nádorové angiogeneze [7, 8].
Farmakokinetické vlastnosti
Farmakokinetické vlastnosti afliberceptu byly odvozeny z populační farmakokinetické analýzy dat získaných od 1507 pacientů s různými typy pokročilých malignit. Farmakokinetické studie prokázaly, že poločas eliminace volného afliberceptu je 1–3 dny, poločas eliminace komplexu VEGF s navázaným afliberceptem je 18 dní. Distribuční objem volného afliberceptu v rovnovážném stavu činí přibližně 8 litrů [9].
Studie s eskalací dávkování afliberceptu byly provedeny u pacientů s pokročilým CRC v kombinaci s irinotekanem, leukovorinem a 5-FU. Eskalace afliberceptu 3 mg/kg, 4 mg/kg, 5 mg/kg a 6 mg/kg byly aplikovány jako DLTs (dose limiting toxicities, toxicity limitované dávkou). Jako doporučená byla dle DLTs stanovena dávka 4 mg/kg afliberceptu v kombinaci s chemoterapií FOLFIRI a aplikací každé dva týdny.
Z hlediska biotransformace afliberceptu nebyly provedeny žádné studie, protože se jedná o protein. Lze předpokládat, že aflibercept je degradován na malé peptidy a jednotlivé aminokyseliny. Eliminace z organismu je primárně zajištěna navázáním na endogenní VEGF za vzniku stabilního inaktivního komplexu. Stejně jako u jiných velkých proteinů se předpokládá, že jak volný, tak i vázaný aflibercept bude metabolizován, byť pomaleji, dalšími biologickými mechanismy, jako je například proteolytické štěpení [9]. Proteiny s vysokou molekulární hmotností nejsou odstraňovány renální cestou, proto se očekává, že renální eliminace afliberceptu bude minimální [10].
Podání u starších pacientů
Věk neměl žádný vliv na farmakokinetiku volného afliberceptu. Studie zaměřené speciálně na posouzení farmakokinetiky u starších pacientů nebyly prováděny [11].
Porucha funkce jater a ledvin
U nemocných s mírnou nebo středně závažnou poruchou funkce jater nebyl zjištěn žádný vliv na clearance afliberceptu. Pro pacienty se závažnou poruchou funkce jater nejsou k dispozici žádné údaje, protože doposud nebyly provedeny žádné formální studie u těchto nemocných [11].Populační farmakokinetická analýza (1507 nemocných s různými typy pokročilých malignit) neodhalila žádné klinicky významné rozdíly v clearance nebo systémové expozici (area under curve, AUC) volného afliberceptu u nemocných se středně závažnou a mírnou poruchou funkce ledvin léčených dávkou 4 mg/kg afliberceptu oproti celkové studované populaci [9]. U pacientů se závažnou poruchou funkce ledvin nelze činit žádné závěry vzhledem k velmi omezenému množství dostupných údajů.
Klinické zkušenosti
In vivo aflibercept signifikantně inhiboval růst a nádorovou angiogenezi u celé řady nádorových linií (např. melanom, rhabdomyosarkom, gliom, neuroblastom) na myším xenograftovém modelu [12, 13]. Lockhart a kol. publikovali iniciální klinickou studii fáze I, do níž byli zařazeni nemocní po vyčerpání protinádorové léčby. Jednalo se o 47 pacientů s pokročilými solidními tumory a Hodgkinovou chorobou. Aflibercept byl aplikován v monoterapii v dávkovém rozmezí od 0,3 mg/kg do 7,0 mg/kg každé dva týdny a limitacemi dávky se ukázaly být ulcerace rekta a proteinurie [7, 14]. Jako optimální pro klinické studie fáze II a III byla následně stanovena dávka 4 mg/kg afliberceptu podávaná každé 2 týdny. Byly provedeny další klinické studie fáze I, kdy byl aflibercept kombinován s celou řadou léků (cisplatina, gemcitabin, docetaxel, pemetrexed, temozolomid) [15]. Nejlepších výsledků bylo dosaženo u nemocných s pokročilým CRC. V kombinaci s chemoterapií FOLFOX a s irinotekanem byly u pacientů s pokročilými CRC zaznamenány parciální léčebné odpovědi [16]. Následně proběhly klinické studie fáze II, kde byl aflibercept testován u ovariálního karcinomu, sarkomů ženských pohlavních orgánů, maligního melanomu a u maligního glioblastomu [15]. Ve zmíněných klinických studiích s afliberceptem nebylo dosaženo očekávaných výsledků.
Studie fáze II u pacientů s mCRC
U pacientů s mCRC byla provedena studie fáze II AFFIRM (Study of Aflibercept a Modified FOLFOX6 as First-Line in Patients with Metastatic Colorectal Cancer). Jak je z názvu zjevné, předmětem klinické studie bylo podání afliberceptu v kombinaci s modifikovaným režimem FOLFOX6 v první linii léčby. Celkem 236 tzv. chemonaivních nemocných bylo randomizovaně rozděleno v poměru 1 : 1 do dvou ramen – se samotnou chemoterapií FOLFOX6 a s kombinovanou léčbou afliberceptem a chemoterapií FOLFOX6. Zde však aflibercept nenaplnil očekávání. Primárním cílem studie byla doba přežití pacientů bez známek progrese onemocnění (progression-free survival, PFS) ve 12. měsíci po zařazení do studie. Výsledky byly následující: v rameni se samotnou chemoterapií FOLFOX6 bylo bez známek choroby ve 12. měsíci 21,2 % nemocných, v rameni s léčbou afliberceptem a chemoterapií FOLFOX6 pak 25,8 % nemocných. Sekundární cíle nebyly splněny – PFS dosahovala v rameni se samotnou chemoterapií 8,8 měsíce, v rameni s kombinací afliberceptu a chemoterapie FOLFOX6 pak 8,5 měsíce. Celkové léčebné odpovědi (overall response rate, ORR) bylo v rameni se samotnou chemoterapií dosaženo u 45,9 % nemocných a v rameni s kombinovanou léčbou u 49,1 % nemocných. Celkové přežití (overall survival, OS) představovalo v rameni se samotnou chemoterapií 22,3 měsíce, v kombinovaném rameni s afliberceptem 19,5 měsíce [17]. Jednalo se tedy o nesignifikantní výsledky, které prozatím vylučují podání afliberceptu v první linii.
Studie fáze III
Z klinických studií fáze III (dvojitě slepé, placebem kontrolované) stojí za zmínku klinická studie fáze III VANILLA u pacientů s pokročilým adenokarcinomem pankreatu v první linii paliativní léčby s rameny gemcitabin plus aflibercept versus gemcitabin plus placebo [18]; dále je to klinická studie fáze III VITAL pro druhou linii paliativní léčby pacientů s pokročilým nemalobuněčným karcinonem plic rezistentním k platině s rameny docetaxel plus aflibercept versus docetaxel plus placebo [19]. Přínosná byla rovněž klinická studie fáze III VENICE u pacientů s metastatickým kastračně rezistentním adenokarcinomem prostaty s rameny docetaxel/prednison plus aflibercept versus docetaxel/prednison plus placebo [20].
Studie fáze III u pacientů s mCRC
Nadějné výsledky klinických studií fáze II s použitím afliberceptu v kombinaci s režimem FOLFIRI v léčbě pacientů s pokročilým mCRC, u nichž došlo při chemoterapii založené na bázi 5-FU, leukovorinu a oxaliplatiny k progresi onemocnění, se staly podkladem multicentrické klinické studie fáze III VELOUR, která byla zároveň studií registrační [21]. Cílem klinické dvojitě slepé, randomizované, multicentrické a placebem kontrolované studie fáze III nazvané VELOUR bylo srovnání kombinace chemoterapie režimem FOLFIRI s afliberceptem a kombinace chemoterapie FOLFIRI s placebem u pacientů po předchozí progresi pokročilého mCRC. ![Obr. 2 Uspořádání klinické studie VELOUR; podle [21] – Tabernero, et al., 2014. ECOG – Eastern Cooperative Oncology Group; HR – hazard ratio, poměr rizik; mCRC – metastatic colorectal cancer, metastatický kolorektální karcinom; OS – overall survival, celkové přežití; ORR – overall response rate, celková léčebná odpověď; PFS – progression-free survival, bezpříznakové přežití](https://www.remedia.cz/photo-a-29980---.jpg)
Nemocní s progresí mCRC po chemoterapii založené na bázi oxaliplatiny, 5-FU a leukovorinu byli randomizovaně rozděleni v poměru 1 : 1 do ramene s afliberceptem plus FOLFIRI (rameno aflibercept) a do ramene placebo plus FOLFIRI (kontrolní rameno). Stratifikace probíhala dle výkonnostního stavu (WHO 0–1 versus WHO 2) a předchozí aplikace bevacizumabu (ano versus ne). Nemocní starší 18 let v dobrém výkonnostním stavu (WHO 0–2) byli léčeni afliberceptem podávaným v dávce 4 mg/kg intravenózně (i.v.) v den 1 v jednohodinové infuzi ve dvoutýdenních intervalech. Režim FOLFIRI sestával z dávky irinotekanu 180 mg/m2 i.v. 90 minut podávané souběžně s infuzí leukovorinu 400 mg/m2 i.v. 120 minut, následně s bolusovým podáním 5-FU v dávce 400 mg/m2 i.v. následovaným kontinuální 46hodinovou infuzí 5-FU v dávce 2400 mg/m2 i.v. ve dvoutýdenních intervalech. Pro dostatečnou statistickou sílu bylo požadováno zařazení 1200 nemocných a dosažení 863 událostí. Zařazeno bylo 1401 nemocných, z toho bylo 1226 nemocných randomizovaně rozděleno do dvou ramen studie – do kontrolního ramene s placebem bylo zařazeno 614 nemocných, do ramene s afliberceptem 612 nemocných, viz obr. 2.
M![Graf 1 Kaplanovy-Meierovy křivky celkového přežití (v měsících) v jednotlivých léčebných skupinách (ITT populace); podle [11] – www.sukl.cz. Režim FOLFIRI: irinotekan 180 mg/m2 i.v. 90 minut podávaný souběžně s infuzí leukovorinu 400 mg/m2 i.v. 120 minut, následně s bolusovým podáním 5-FU v dávce 400 mg/m2 i.v. následovaným kontinuální 46hodinovou infuzí 5-FU v dávce 2400 mg/m2 i.v. ve dvoutýdenních intervalech. HR – poměr rizik, hazard ratio; ITT – intention to treat; OS – overall survival, celkové přežití](https://www.remedia.cz/photo-a-29981---.jpg) edián dávkové denzity v rameni s afliberceptem dosahoval 83 %, v rameni s placebem 92 %. Oddálení léčebných cyklů bylo zaznamenáno u 77,7 % nemocných v rameni s afliberceptem a u 69,4 % nemocných v rameni s placebem. Medián follow-up ve studii dosahoval 22,28 měsíce. Celkové přežití bylo signifikantně prodlouženo v rameni s afliberceptem oproti kontrolnímu rameni – 13,50 měsíce versus 12,06 měsíce (poměr rizik, hazard ratio, HR: 0,817; p = 0,0032). Dvouleté přežití bylo rovněž častější v rameni s afliberceptem (28,0 %) oproti kontrolnímu rameni (18,7 %). Rovněž hodnota PFS byla signifikantně vyšší v rameni s afliberceptem a dosahovala 6,9 měsíce; naproti tomu v kontrolním rameni s placebem dosahovala PFS 4,7 měsíce
edián dávkové denzity v rameni s afliberceptem dosahoval 83 %, v rameni s placebem 92 %. Oddálení léčebných cyklů bylo zaznamenáno u 77,7 % nemocných v rameni s afliberceptem a u 69,4 % nemocných v rameni s placebem. Medián follow-up ve studii dosahoval 22,28 měsíce. Celkové přežití bylo signifikantně prodlouženo v rameni s afliberceptem oproti kontrolnímu rameni – 13,50 měsíce versus 12,06 měsíce (poměr rizik, hazard ratio, HR: 0,817; p = 0,0032). Dvouleté přežití bylo rovněž častější v rameni s afliberceptem (28,0 %) oproti kontrolnímu rameni (18,7 %). Rovněž hodnota PFS byla signifikantně vyšší v rameni s afliberceptem a dosahovala 6,9 měsíce; naproti tomu v kontrolním rameni s placebem dosahovala PFS 4,7 měsíce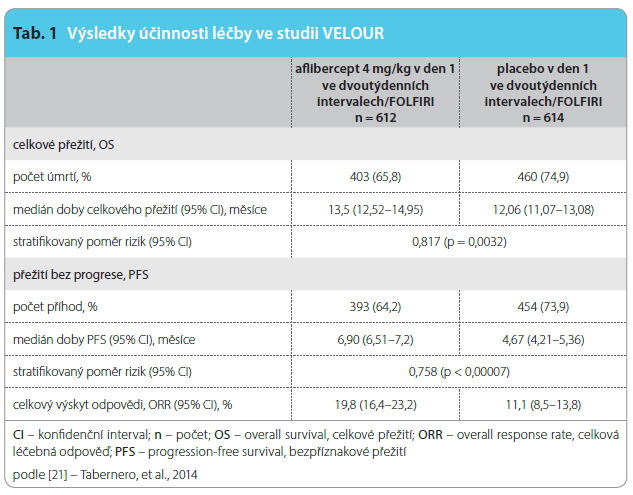 (HR: 0,758; p < 0,00007). Rovněž i dosažené počty ORR byly vyšší v rameni s afliberceptem oproti kontrolnímu rameni s placebem (19,8 % vs. 11,1 %; p < 0,001) viz graf 1, tab. 1. Zde je ale nutno uvést, že celkem 165 nemocných bylo vyřazeno z analýzy hodnocení léčebné odpovědi pro neměřitelnou chorobu během výchozího hodnocení (rameno s afliberceptem 13,2 % a kontrolní rameno 13,7 %) [21].
(HR: 0,758; p < 0,00007). Rovněž i dosažené počty ORR byly vyšší v rameni s afliberceptem oproti kontrolnímu rameni s placebem (19,8 % vs. 11,1 %; p < 0,001) viz graf 1, tab. 1. Zde je ale nutno uvést, že celkem 165 nemocných bylo vyřazeno z analýzy hodnocení léčebné odpovědi pro neměřitelnou chorobu během výchozího hodnocení (rameno s afliberceptem 13,2 % a kontrolní rameno 13,7 %) [21].
Indikace
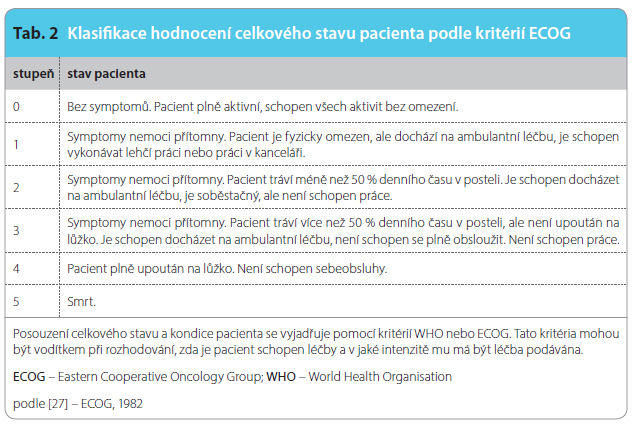
Z onkologického hlediska je aflibercept v kombinaci s chemoterapií režimem FOLFIRI (irinotekan/5-FU/leukovorin) indikován k léčbě dospělých pacientů s mCRC, který je rezistentní k léčbě režimem obsahujícím oxaliplatinu nebo po této léčbě progredoval. Podmínkou je výkonnostní stav pacientů hodnocený stupněm 0–1dle ECOG (Eastern Cooperative Oncology Group), tab. 2.
Zařazení do současné palety léčiv
U nemocných s mCRC jsou v první linii léčby většinou podávány chemoterapeutické režimy založené na oxaliplatině. Je to dáno možnou reindukcí léčby první linie, obecně nižší toxicitou v průběhu aplikace a relativně vyšším počtem léčebných odpovědí [22]. Léčba druhé linie je definována změnou struktury režimu první linie. Složení chemoterapie ve druhé linii je tedy závislé na typu chemoterapie v první linii. Pokud tedy použijeme v první linii režim FOLFOX (oxaliplatina, 5-FU, leukovorin), nejčastěji se ve druhé linii používá režim FOLFIRI (irinotekan, 5-FU, leukovorin) [23]. Pokud není tato chemoterapie ve druhé linii kombinována s cílenou léčbou, je její účinnost velmi nízká. Kombinace s anti-EGFR protilátkami jsou účinné pouze u nemocných s nemutovaným genem RAS.
Pro velkou skupinu pacientů s mutací genu RAS tedy nemáme kromě možnosti reindukce bevacizumabu skutečně účinnou cílenou léčbu druhé linie [24, 25]. Alternativu k bevacizumabu tak představuje ve druhé linii léčby aflibercept, který v kombinaci s režimem FOLFIRI prokázal signifikantní prodloužení PFS i OS [26], a stává se novou terapeutickou možností pro výše definované pacienty.
Kontraindikace
Léčba je kontraindikována při hypersenzitivitě na léčivou látku aflibercept nebo na kteroukoli pomocnou látku přípravku. Léčba je rovněž kontraindikována při nesnášenlivosti jakékoliv látky z cytostatické kombinace režimu FOLFIRI.Aflibercept je registrován také v oftalmologické indikaci, ale u přípravku Zaltrap® je vzhledem k hyperosmotickým vlastnostem kontraindikováno oftalmologické/intravitreální podání.
Nežádoucí účinky
Účinnost a bezpečnost afliberceptu byla hodnocena v randomizované, dvojitě zaslepené, placebem kontrolované studii u pacientů s mCRC, kteří byli dříve léčeni terapií na bázi oxaliplatiny s předchozí léčbou bevacizumabem nebo bez bevacizumabu (studie VELOUR, fáze III). Profil nežádoucích účinků byl shodný s předchozími zjištěními (studie fáze I a II) a nebyla pozorována žádná nová toxicita [21].
Nežádoucí účinky se projevily u 99,2 % nemocných ve skupině léčené afliberceptem s chemoterapií a u 97,9 % nemocných v kontrolním rameni. K nežádoucím účinkům stupně 3–4 došlo u 83,5 % nemocných, respektive u 62,5 % nemocných. Profil nežádoucích účinků byl shodný s předchozími zjištěními a nebyla pozorována žádná nová toxicita.
Nejčastěji hlášenými nežádoucími účinky stupně 3–4 ve skupině léčené afliberceptem oproti skupině s placebem byly neutropenie (36,7 % vs. 29,5 %), průjem (19,3 % vs. 7,8 %), hypertenze (19,3 % vs. 1,5 %), astenie (16,8 % vs. 10,6 %), stomatitida/ulcerace (13,8 % vs. 5 %), infekce (12,3 % vs. 6,9 %), palmární a plantární erytrodysestezie (2,8 % vs. 0,5 %), proteinurie (7,8 % vs. 1,2 %), neutropenické komplikace (5,7 % vs. 2,8 %), tromboembolické komplikace (7,9 % vs. 6,3 %) a bolesti břicha (5,4 % vs. 3,3 %).
Kvůli nežádoucím účinkům ukončilo léčbu 26,8 % nemocných ve skupině s afliberceptem a 12,1 % nemocných v kontrolní skupině s chemoterapií. Nejčastějšími nežádoucími účinky (všech stupňů) vedoucími k ukončení terapie byly astenie (3,8 % vs. 1,3 %), infekce (3,4 % vs. 1,7 %), průjem (2,3 % vs. 0,7 %) a hypertenze (2,3 % vs. 0 %). Kvůli progresi nemoci ukončilo léčbu více pacientů v kontrolní větvi oproti rameni s afliberceptem (71,2 % vs. 49,8 %).
Bezpečnostní profil režimu aflibercept plus FOLFIRI ve studii VELOUR ukázal, že nežádoucí účinky byly všeobecně reverzibilní, zvládnutelné při užití současných klinických metod a doporučení. Nežádoucí účinky neovlivnily schopnost nemocných podstoupit léčbu, nevedly k redukci souhrnné expozice chemoterapii a nezamezily pacientům možnost užití další systémové protinádorové léčby [21]. Vzhledem k vyššímu riziku krvácení a zhoršenému hojení ran by měla být léčba afliberceptem dočasně přerušena aspoň na 4 týdny před elektivní operací a zahájena minimálně za 4 týdny po rozsáhlé operaci, dokud nedojde k úplnému zhojení operační rány.
Lékové interakce
Populační farmakokinetická analýza a srovnání mezi studiemi neodhalily žádnou farmakokinetickou lékovou interakci mezi afliberceptem a chemoterapeutickým režimem FOLFIRI. Nebyly provedeny žádné studie, které by se zaměřovaly na jiné lékové interakce afliberceptu. Riziko vzniku interakcí se současně užívanými léky však nelze vyloučit.
Těhotenství, kojení a plodnost
Nejsou k dispozici žádná data o používání afliberceptu u gravidních žen. Aflibercept se nemá používat během gravidity, pokud to není jednoznačně nevyhnutelné. Tento přípravek může závažně poškodit plod, protože brání tvoření nových cév. Není známo, zda aflibercept přechází v průběhu laktace do mateřského mléka. Aflibercept může mít vliv na plodnost mužů i žen, v průběhu fertilního věku je nutno užívat účinnou antikoncepci.
Dávkování a způsob podání
Aflibercept se podává formou intravenózní infuze po dobu jedné hodiny. Vzhledem k hyperosmolaritě (1000 mOsmol/kg) není možné používat přípravek neředěný, např. formou nitrožilního bolusu. Doporučená dávka přípravku je 4 mg/kg tělesné hmotnosti, s následnou terapií režimem FOLFIRI. Předepsaný režim FOLFIRI zahrnuje irinotekan 180 mg/m2 ve formě nitrožilní infuze trvající 90 minut a kyselinu folinovou (DL, racemická směs) 400 mg/m2 ve formě nitrožilní infuze trvající 2 hodiny ve stejnou dobu v den 1 za použití Y‑linky, s následným podáním nitrožilního bolusu 5‑FU v dávce 400 mg/m² a následně 5-FU 2400 mg/m² ve formě konti-nuální nitrožilní infuze trvající 46 hodin.Tato léčba je považována za jeden léčebný cyklus. Léčba se opakuje každé dva týdny a probíhá do progrese onemocnění či do výskytu neakceptovatelné toxicity léčby.
Stabilita
Po naředění v infuzním vaku byla chemická a fyzikální stabilita po otevření před použitím (in-use stability) prokázána na dobu 24 hodin při teplotě 2 °C až 8 °C a na dobu 8 hodin při teplotě 25 °C.
Závěr
Aflibercept představuje jako nový blokátor angiogeneze další možnosti účinné cílené protinádorové léčby, zejména v kombinaci s režimem FOLFIRI u nemocných s pokročilým mCRC, kteří jsou rezistentní na léčbu režimem obsahujícím oxaliplatinu nebo u nich po této léčbě došlo k progresi nádorového onemocnění.
Práce byla podpořena projektem ED2.1.00/03.0076 Evropského fondu pro regionální rozvoj.
Seznam použité literatury
- [1] Zavoral M, Suchanek S, Majek O, et al. Colorectal cancer screening: 20 years of development and recent progress. World J Gastroenterol 2014; 20: 3825–3834.
- [2] Abdalla EK, Bauer TW, Chun YS, et al. Locoregional surgical and interventional therapies for advanced colorectal cancer liver metastases: expert consensus statements. HPB (Oxford) 2013; 15: 119–130.
- [3] Hurwitz H. Integrating the anti-VEGF-A humanized monoclonal antibody bevacizumab with chemotherapy in advanced colorectal cancer. Clin Colorectal Cancer 2004; 4 (Suppl 2): S62–68.
- [4] Prenen H, Vecchione L, Van Cutsem E. Role of targeted agents in metastatic colorectal cancer. Target Oncol 2013; 8: 83–96.
- [5] Holash J, Davis S, Papadopoulos N, et al. VEGF-Trap: a VEGF blocker with potent antitumor effects. Proc Natl Acad Sci USA 2002; 99: 11393–11398.
- [6] Mittal K, Ebos J, Rini B. Angiogenesis and the tumor microenvironment: vascular endothelial growth factor and beyond. Semin Oncol 2014; 41: 235–251.
- [7] Wang TF, Lockhart AC. Aflibercept in the treatment of metastatic colorectal cancer. Clin Med Insights Oncol 2012; 6: 19–30.
- [8] Zatloukal P. Biologická léčba nemalobuněčného karcinomu plic. Onkologie 2009; 3: 292–296.
- [9] Gaya A, Tse V. A preclinical and clinical review of aflibercept for the management of cancer. Cancer Treat Rev 2012; 38: 484–493.
- [10] Teng LS, Jin KT, He KF, et al. Clinical applications of VEGF-trap (aflibercept) in cancer treatment. J Chin Med Assoc 2010; 73: 449–456.
- [11] European Medicines Agency, Zaltrap (aflibercept) EU Summary of Product Charakteristics. http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002532/WC500139484.pdf Navštíveno 3. 11. 2014.
- [12] Kim ES, Serur A, Huang J, et al. Potent VEGF blockade causes regression of coopted vessels in a model of neuroblastoma. Proc Natl Acad Sci U S A 2002; 99: 11399–11404.
- [13] Huang J, Soffer SZ, Kim ES, et al. Vascular remodeling marks tumors that recur during chronic suppression of angiogenesis. Mol Cancer Res 2004; 2: 36–42.
- [14] Lockhart AC, Rothenberg ML, Dupont J, et al. Phase I study of intravenous vascular endothelial growth factor trap, aflibercept, in patients with advanced solid tumors. J Clin Oncol 2010; 28: 207–214.
- [15] Patricia A, Tang MD, Malcom J, et al. Aflibercept in the Treatment of Patients with Metastatic Colorectal Cancer. Ther Adv Gastroenterol 2013; 6: 459–473.
- [16] Limentani SA Jr, Purdham A. A phase I dose escalation and pharmacokinetic (PK) study of intravenous (IV) aflibercept (VEGF Trap) plus FOLFOX4 in patient (pts) with advanced solid tumor. J Clin Oncol 2008; 26: abstract 3556.
- [17] US National Institute of Health. Study of Aflibercept And Modified FOLFOX6 As First-Line Treatment In Patients With Metastatic Colorectal Cancer (AFFIRM). Available from: http://www.clinicaltrial.gov/ct2/show/NCT00851084
- [18] US National Institute of Health. Aflibercept compared placebo in term of efficacy patients treated with gemcitabine for metastatic pancreatic cancer (VANILLA). Available from: http://www.clinicaltrial.gov/ct2/show/NCT00574275
- [19] US National Institute of Health. A study of aflibercept versus placebo with second-line docetaxel for locally advanced or metastatic non-small-lung cancer (VITAL). Available from: http://www.clinicaltrial.gov/ct2/show/NCT00532155
- [20] Tannock IK, Fizazi K, Ivanov S, et al. Aflibercept versus placebo in combination with docetaxel and prednisone for treatment of men with metastatic castration-resistant prostate cancer (VENICE): a phase 3, double-blind randomised trial. Lancet Oncol 2013; 14: 760–768.
- [21] Tabernero J, Van Cutsem E, Lakomý R, et al. Aflibercept versus placebo in combination with fluorouracil, leucovorin and irinotecan in the treatment of previously treated metastatic colorectal cancer: prespecified subgroup analyses from the VELOUR trial. Eur J Cancer 2014; 50: 320–331.
- [22] Petera J. ESMO doporučení pro léčbu metastatického kolorektálního karcinomu. Colorectal News 2013; 2: 5–10.
- [23] Schmoll HJ, Van Cutsem E, Stein A, et al. ESMO Consensus Guidelines for management of patients with colon and rectal cancer. A personalized approach to clinical decision making. Ann Oncol 2012; 23: 2479–2516.
- [24] Kubicka S, Greil R, André T, et al. ML18147 study investigators including AIO, GERCOR, FFCD, UNICANCER GI, TTD, BGDO, GEMCAD, and AGMT groups. Bevacizumab plus chemotherapy continued beyond first progression in patients with metastatic colorectal cancer previously treated with bevacizumab plus chemotherapy: ML18147 study KRAS subgroup findings. Ann Oncol 2013; 24: 2342–2349.
- [25] Chibaudel B, Tournigand C, André T, et al. Therapeutic strategy in unresectable metastatic colorectal cancer. Ther Adv Med Oncol 2012; 4: 75–89.
- [26] Rodriguez M. Ziv-aflibercept use in metastatic colorectal cancer. J Adv Pract Oncol 2013; 4: 348–352.
- [27] Oken MM, Creech RH, Tormey DC, et al. Toxicity And Response Criteria Of The Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649–655.