Albiglutid – agonista GLP 1 s prodlouženým účinkem
Souhrn:
Farmakoterapie diabetu prochází v posledních letech velmi dynamickým rozvojem. Nově zaváděná léčiva potvrzují význam cíleného ovlivnění nových systémů a vedle ovlivnění hodnot glykovaného hemoglobinu často přinášejí i další výhody. Takovým léčivem je i albiglutid, agonista GLP 1 s prodlouženou dobou působení, jehož stručná charakteristika je pojednána v rámci tohoto článku.
Key words: albiglutide – diabetes mellitus – GLP-1 agonist – incretins.
Summary:
The pharmacotherapy of diabetes has been undergoing a very dynamic development during last years. Recently approved drugs confirm the importance of targeted modulation of new systems and, apart from the decrease of glycated hemoglobin, also bring other benefits. Such a drug is albiglutide, a GLP-1 agonist with the prolonged action. Its characteristics are briefly discussed in this article.
Charakteristika
Již v lednu 2014 Komise pro humánní léčivé přípravky (CHMP) při Evropské lékové agentuře (EMA) přijala pozitivní stanovisko podporující registraci albiglutidu – nové léčivé látky k terapii diabetu 2. typu. Albiglutid (ATC kód: A10BX13; CAS: 782500‑75‑8) je agonista glukagonu podobného peptidu 1 (GLP‑1) využívaný k léčbě diabetu 2. typu. Po chemické stránce jde o fúzní dimer s lidským albuminem, jenž je rezistentní vůči dipeptidylpeptidáze 4 (DPP-4). Jeho sumární molekulový vzorec je C3232H5032N864O979S41 a molekulová hmotnost 72,970 kDa.
Mechanismus účinku a farmakodynamické vlastnosti
Albiglutid má z 97 % homologickou sekvenci aminokyselin s endogenním GLP‑1 [1]. Popisovaná rezistence k proteolytickému štěpení DPP‑4 je dána substitucí alaninu za glycin v pozici 8 (obr. 1). Důsledkem této kompozice je již uvedený výrazně delší biologický poločas ve srovnání s endogenním GLP‑1 [2].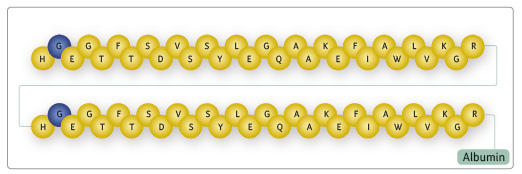
Albiglutid díky své analogii s GLP‑1 působí na jeho receptorech jako agonista, respektive je řazen mezi inkretinová mimetika [3]. V závislosti na hodnotě glykemie tak zvyšuje uvolňování inzulinu a potlačuje nadměrnou sekreci glukagonu. Mimoto rovněž zpomaluje vyprazdňování žaludku, s čímž souvisí i snížená chuť k jídlu daná vyšším pocitem zasycení (obr. 2) [4].
Farmakokinetické vlastnosti
Absorpce
Absolutní biologická dostupnost albiglutidu po subkutánním podání nebyla stanovena. Ve studiích s opicemi však dosahovala hodnot v rozmezí 50–81 % a u myší 38 % a více – lze proto předpokládat i vysokou biologickou dostupnost u člověka [1]. Po jednorázovém subkutánním podání 30 mg albiglutidu u diabetiků 2. typu je maximální plazmatické koncentrace (cmax) odpovídající 1,74 μg/ml dosahováno za 3–5 dní (tmax), přičemž hodnota plochy pod křivkou (AUC) činí 465 μg.h/ml. Při doporučeném pravidelném podávání 1× týdně je ustálené plazmatické koncentrace dosaženo za 3–5 týdnů [1].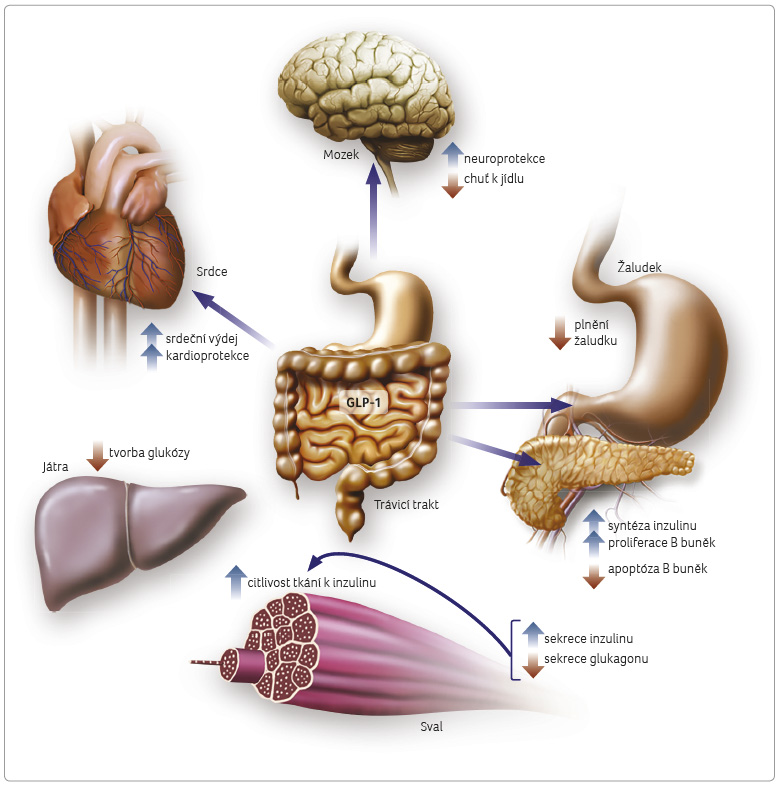
Distribuce
Průměrná hodnota distribučního objemu (Vd) albiglutidu je 11 litrů. Rozsah jeho vazby na bílkoviny plazmy nebyl stanoven [1].
Biotransformace
Vzhledem ke své struktuře podstupuje albiglutid degradaci obdobnou přirozenému albuminu, z velké části v endotelu, tj. cestou proteolýzy na menší peptidy a aminokyseliny.
Exkrece
Průměrná clearance (CL) albiglutidu odpovídá 67 ml/h a hodnota biologického poločasu (t1/2) přibližně 5 dnům, byť u diabetiků může být vzhledem ke zhoršené činnosti ledvin tato doba poněkud delší, a sice 6–7 dní [5].
Speciální populace
Z výsledků dosud realizovaných kinetických studií nevyplývá jakkoliv klinicky významné ovlivnění farmakokinetiky albiglutidu věkem nemocných, jejich pohlavím, rasou ani tělesnou hmotností. U nemocných se sníženou činností jater nebyla kinetika hodnocena. U nemocných s mírnou a středně těžkou ledvinnou nedostatečností není třeba úpravy dávky, nicméně jeho podávání není doporučováno u osob s těžkou renální insuficiencí z důvodu zvýšené systémové expozice o 30–40 % (pozn.: ve Spojených státech amerických není úprava dávky doporučována ani u těchto nemocných) [1].
Indikace
Albiglutid je určen k léčbě dospělých diabetiků 2. typu ke zlepšení kontroly glykemie jako monoterapie v případě, že nemedikamentózní postupy (dieta plus cvičení) nevedou k odpovídající kontrole glykemie u osob, u kterých není možná léčba metforminem z důvodu jeho kontraindikace nebo nesnášenlivosti. Určen je rovněž do kombinace s jinými antidiabetiky, včetně bazálního inzulinu, a to tehdy, jestliže předchozí léčba není provázena adekvátní kontrolou glykemie.
Kontraindikace
Léčivé přípravky s obsahem albiglutidu nesmějí být podávány při známé přecitlivělosti na albiglutid a/nebo na kteroukoliv z obsažených látek.
Těhotenství a laktace
Vzhledem k nedostatku klinických zkušeností s albiglutidem v populaci těhotných a kojících žen se stejně tak jako u žen ve fertilním věku neužívajících současně účinnou kontracepci podávání přípravku nedoporučuje. Před plánovaným otěhotněním je vzhledem k pozvolné eliminaci albiglutidu z organismu vhodné ukončit jeho podávání nejméně jeden měsíc předem.
Lékové interakce
Farmakokinetické interakce
Pravděpodobnost tohoto typu interakcí je považována za nízkou. Dle výsledků hodnocení na animálních modelech albiglutid nikterak neovlivňuje celkové množství cytochromu P450 ani aktivitu jeho izoforem 1A, 2B, 2E, 3A a 4A [6].
Albiglutid s odkazem na svůj mechanismus účinku výrazně zpomaluje evakuaci žaludku, a může tedy ovlivňovat rozsah absorpce současně perorálně podaných léčivých látek, zejména u těch s nízkým terapeutickým indexem. V rámci tří studií fáze I nebyla současným podáváním albiglutidu jakkoliv klinicky významně ovlivněna farmakokinetika digoxinu, warfarinu ani ethinylestradiolu/norethisteronu [7]. V jedné studii však bylo zaznamenáno významné ovlivnění kinetiky simvastatinu, a sice pokles jeho plochy pod křivkou (AUC) o 40 %, zkrácení biologického poločasu (t1/2) ze 7 hodin na 3,5 hodiny a zvýšení jeho maximální plazmatické koncentrace o 18 %. Klinický význam této interakce je však nejasný [1].
Farmakodynamické interakce
Vzhledem k tomu, že užití akarbózy je kontraindikováno u osob s obstrukcí střeva, při jejím současném podávání s albiglutidem je žádoucí zvýšená opatrnost.
Klinické zkušenosti
Albiglutid byl testován v sérii studií fáze III klinického hodnocení s názvem HARMONY. Komplexní program zahrnuje celkem osm studií (HARMONY 1–8) s hodnocením primárních cílových ukazatelů za období 26 a 32 týdnů a za jeden a dva roky. Celkem bylo do tohoto hodnocení zapojeno více než 5 000 pacientů, z nichž bylo více než 2 000 léčeno albiglutidem s celkovou expozicí v trvání 7 500 pacientoroků.
Albiglutid byl v programu HARMONY hodnocen při léčbě diabetu 2. typu samostatně nebo v kombinaci s dalšími běžně užívanými antidiabetiky včetně inzulinu. Klinické hodnocení zahrnulo pacienty v různých stadiích onemocnění, včetně skupiny pacientů s poruchou funkce ledvin. Primárním cílovým ukazatelem ve všech studiích byla kompenzace diabetu hodnocená jako změna hodnot glykovaného hemoglobinu (HbA1c) oproti výchozím hodnotám vůči placebu nebo aktivním komparátorům včetně jiného agonisty receptoru GLP‑1, derivátu sulfonylurey, thiazolidindionu, bazálního inzulinu (prandiálního pouze v kombinaci s bazálním) a inhibitoru DPP‑4. Sekundární cílové parametry pak zahrnovaly změnu glykemie nalačno a změny hmotnosti ve srovnání s výchozími hodnotami a dále podíl pacientů dosahujících předem stanovených glykemických cílů.
Program klinického hodnocení HARMONY
Ve studii HARMONY 1 byl albiglutid přidán k pioglitazonu (s metforminem nebo bez metforminu) a srovnán s placebem [8]. Studie trvala 52 týdnů a po této době došlo u pacientů léčených albiglutidem k významnému snížení hodnot glykovaného hemoglobinu ve srovnání s výchozí hodnotou (–0,8 % albiglutid vs. –0,1 % placebo, p < 0,05). Nebyl pozorován žádný rozdíl ve změně hmotnosti (+0,3 kg při léčbě albiglutidem a +0,5 kg u placeba, NS).
Studie HARMONY 2 posuzovala během 52 týdnů léčby albiglutid v monoterapii vůči placebu [9]. Hodnota HbA1c poklesla ve srovnání s placebem o 0,8 % při dávce 30 mg a o 1,0 % při dávce 50 mg albiglutidu (p < 0,05). Pokles hmotnosti činil ve všech skupinách včetně placebové méně než 1 kg a rozdíly mezi skupinami nebyly významné.
Nejčastěji používané skupiny antidiabetik byly s albiglutidem porovnány ve studii HARMONY 3 [10]. Albiglutid byl přidán k metforminu a porovnán s placebem, glimepiridem a sitagliptinem. Po dvou letech léčby snížil albiglutid hodnoty HbA1c významně více, než bylo pozorováno v ostatních skupinách (p < 0,05), přičemž rozdíl vůči placebu byl 0,9 %, proti sitagliptinu 0,4 % a proti glimepiridu 0,3 %. U pacientů, kterým byl podáván albiglutid, placebo a sitagliptin, došlo ke snížení tělesné hmotnosti, naopak u pacientů léčených glimepiridem došlo k jejímu zvýšení a rozdíl mezi albiglutidem a glimepiridem (2,4 kg) byl statisticky významný (p < 0,05).
Ve studii HARMONY 4 byl albiglutid během 52 týdnů porovnán s bazálním inzulinem u pacientů, kteří byli v přibližně 82 % léčeni metforminem a derivátem sulfonylurey (ostatní jen metforminem) [11]. Účinnost albiglutidu byla srovnatelná s účinností inzulinu glargin (–0,7 % vs. –0,8 %) a bylo tak splněno kritérium non‑inferiority pro albiglutid. Podobně jako ve studii HARMONY 3 byl pozorován rozdíl v hmotnosti při podávání albiglutidu a komparátoru (glargin), který tentokrát představoval 2,6 kg (p < 0,05).
HARMONY 5 byla další ze série klinických studií, která testovala albiglutid u pacientů léčených metforminem a glimepiridem [12]. Těmto pacientům (n = 685) byl po dobu 52 týdnů podáván albiglutid v dávce 30 mg/týden, placebo nebo pioglitazon v dávce 30 mg/den s možností titrace dávky podle klinické potřeby. Po jednom roce léčby snížil albiglutid hodnotu glykovaného hemoglobinu statisticky významně ve srovnání s placebovou skupinou, o 0,9 % (p < 0,001). Nicméně ve srovnání s pioglitazonem nesplnil kritéria non‑inferiority (pioglitazon snížil HbA1c o 0,25 % více než albiglutid). U pacientů léčených albiglutidem poklesla tělesná hmotnost ve srovnání se vstupní hodnotou o 0,4 kg, zatímco pacienti léčení pioglitazonem průměrně 4,4 kg přibrali. Rozdíl mezi albiglutidem a pioglitazonem činil 4,9 kg a byl statisticky významný (p < 0,05).
Ve studii HARMONY 6 byl albiglutid testován po přidání k bazálnímu inzulinu glargin a srovnán s prandiálním inzulinem lispro po 26 týdnech léčby u 563 pacientů [13]. V obou větvích studie bylo možno navyšovat dávku podle klinické potřeby. Pacienti dále mohli být léčeni metforminem, thiazolidindiony nebo akarbózou. Hodnoty HbA1c poklesly při léčbě albiglutidem o 0,82 % a při léčbě inzulinem lispro o 0,66 %. Rozdíl mezi oběma větvemi představoval 0,16 % (p < 0,001) a bylo splněno kritérium pro non‑inferioritu. Hmotnost pacientů poklesla při léčbě albiglutidem o 0,7 kg, zatímco pacienti léčení inzulinem lispro 0,8 kg přibrali, rozdíl mezi oběma skupinami byl statisticky významný. Výskyt hypoglykemií byl přibližně dvojnásobný ve skupině pacientů léčených inzulinem lispro, na druhou stranu ve skupině pacientů s albiglutidem se zase častěji vyskytovala nauzea.
Albiglutid byl přidán ke standardní antidiabetické léčbě metforminem, derivátem sulfonylurey nebo thiazolidindionem a porovnán s liraglutidem ve studii HARMONY 7 trvající 32 týdnů [14]. Pacienti byli léčeni albiglutidem (n = 404) v dávce 30 mg jednou týdně (s automatickým navýšením na 50 mg v 6. týdnu) nebo liraglutidem (n = 408, v dávce 0,6 mg jednou denně s automatickou titrací na 1,2 mg ve druhém a 1,8 mg ve třetím týdnu).
Pokles hodnot HbA1c byl statisticky významně vyšší při léčbě liraglutidem (o 0,99 %) než při léčbě albiglutidem (o 0,78 %) a albiglutid nesplnil kritéria pro non‑inferioritu. Podobně byl pozorován nižší pokles hmotnosti při podávání albiglutidu než při podávání liraglutidu (–0,6 kg vs. –2,2 kg, p < 0,05). Pacienti léčení albiglutidem měli více nežádoucích reakcí v místě vpichu než pacienti léčení liraglutidem, kteří zase naopak zaznamenávali častěji nežádoucí gastrointestinální účinky.
Nefropatie je častou komplikací diabetu, která zároveň nezřídka omezuje možnosti farmakoterapie i její efekt. HARMONY 8 byla studie zaměřená právě na pacienty s postižením funkce ledvin [15]. Trvala 26 týdnů a porovnávala albiglutid se sitagliptinem na pozadí běžné farmakoterapie diabetu metforminem, thiazolidindionem nebo derivátem sulfonylurey, případně kombinací těchto léků. Metformin nebyl podáván pacientům s glomerulární filtrací nižší než 60 ml/min a dávka sitagliptinu byla redukována na polovinu nebo čtvrtinu u pacientů se středním a těžkým postižením funkce ledvin. Po 26 týdnech došlo k většímu poklesu hodnoty HbA1c ve skupině s albiglutidem než ve skupině s léčbou sitagliptinem (–0,8 % vs. –0,5 %, p < 0,05) a podobně byl při podávání albiglutidu zaznamenán vyšší pokles hmotnosti (–0,8 kg vs. –0,19 kg, p < 0,05). V extenzi sledování bylo do 52. týdne nutné dříve podávat „rescue” medikaci u pacientů léčených sitagliptinem.
Ačkoliv se numericky více nežádoucích účinků vyskytlo při léčbě albiglutidem, autoři uvádějí, že tolerabilita albiglutidu byla „téměř podobná” se sitagliptinem.
Kardiovaskulární bezpečnost albiglutidu
V metaanalýze, do které bylo zahrnuto všech osm studií HARMONY a jedna studie fáze IIb, byla hodnocena kardiovaskulární bezpečnost albiglutidu [16]. Pro nízký počet kardiovaskulárních příhod je však nutné přistupovat k výsledkům této metaanalýzy s rezervou. Počet pacientů, kteří byli léčeni albiglutidem a kteří prodělali kardiovaskulární příhodu (52 případů), byl prakticky shodný s počtem pacientů léčených placebem nebo aktivním komparátorem (53 případů) – poměr rizik (HR) 0,99; 95% interval spolehlivosti (CI) 0,65–1,49. Počet pacientů s výskytem primárního cílového ukazatele (4bodový MACE) se mezi oběma rameny studie nelišil (56 příhod v obou porovnávaných skupinách). Protože horní mez intervalu spolehlivosti poměru rizik překročila hranici 1,3 definovanou americkým Úřadem pro kontrolu potravin a léčiv (FDA) jako jeden z požadavků na průkaz bezpečnosti, bude kardiovaskulární bezpečnost albiglutidu testována v dedikované studii HARMONY Outcomes v rizikové skupině pacientů.
Zařazení do současné palety léčiv
Přínos tohoto přípravku spočívá ve spolehlivé kontrole glykemie u diabetiků 2. typu již léčených jinými antidiabetiky včetně inzulinu. Hlavní výhody tohoto léčiva zahrnují zejména z hlediska farmakokinetiky delší biologický poločas, a tedy i déletrvající účinek, z pohledu farmakodynamických účinků pak neutrální vliv na tělesnou hmotnost. V souladu s výsledky dosud realizovaných klinických studií lze předpokládat, že zavedení tohoto přípravku do běžné praxe rozšíří paletu antidiabetik s dostatečně prokázanou účinností i s příznivým bezpečnostním profilem.
Nežádoucí účinky
V rámci klinických studií byly nejčastěji zaznamenány trávicí potíže (nevolnost a průjem) a reakce v místě vpichu včetně vyrážky, erytému nebo svědění. Méně často byly zaznamenány případy pankreatitidy.
Závěr
Albiglutid je agonista receptoru GLP‑1 určený k aplikaci 1× týdně. Jde o bezpečnou a účinnou látku, která zatím není v České republice používána. V klinických studiích prokazuje albiglutid nižší efekt na hodnoty HbA1c než jiný agonista GLP‑1 (liraglutid) nebo zástupce skupiny thiazolidindionů (pioglitazon). Ve srovnání s intenzifikovaným inzulinovým režimem byla prokázána non‑inferiorita albiglutidu. Konzistentním nálezem v klinických studiích je pokles hmotnosti pacientů při léčbě albiglutidem. Díky aplikaci 1× týdně může být albiglutid považován za pohodlnou variantu léčby diabetu 2. typu.
Seznam použité literatury
- [1] Blair HA, Keating GM. Albiglutide: a review of its use in patients with type 2 diabetes mellitus. Drugs 2015; 75: 651–663.
- [2] Bush MA, Matthews JE, De Boever EH, et al. Safety, tolerability, pharmacodynamics and pharmacokinetics of albiglutide, a long acting glucagon like peptide 1 mimetic, in healthy subjects. Diabetes Obes Metab 2009; 11: 498–505.
- [3] Trujillo JM, Nuffer W. Albiglutide: a new GLP 1 receptor agonist for the treatment of type 2 diabetes. Ann Pharmacother 2014; 48: 1494–1501.
- [4] Baggio LL, Huang Q, Brown TJ, et al. A recombinant human glucagon like peptide (GLP) 1 albumin protein (albugon) mimics peptidergic activation of GLP 1 receptor dependent pathways coupled with satiety, gastrointestinal motility, and glucose homeostasis. Diabetes 2004; 53: 2492–2500.
- [5] Matthews JE, Stewart MW, De Boever EH, et al. Pharmacodynamics, pharmacokinetics, safety, and tolerability of albiglutide, a long acting glucagon like peptide 1 mimetic, in patients with type 2 diabetes. J Clin Endocrinol Metab 2008; 93: 4810–4817.
- [6] Young MA, Wald JA, Matthews JE, et al. Clinical pharmacology of albiglutide, a GLP 1 receptor agonist. Postgrad Med 2014; 126: 84–97.
- [7] Bush M, Scott R, Watanalumlerd P, et al. Effects of multiple doses of albiglutide on the pharmacokinetics, pharmacodynamics, and safety of digoxin, warfarin, or a low dose oral contraceptive. Postgrad Med 2012; 124: 55–72.
- [8] Reusch, J, Stewart MW, Perkins CM, et al. Efficacy and safety of once weekly glucagon like peptide 1 receptor agonist albiglutide (HARMONY 1 trial): 52 week primary endpoint results from a randomized, double blind, placebo controlled trial in patients with type 2 diabetes mellitus not controlled on pioglitazone, with or without metformin. Diabetes Obes Metab 2016; 16: 1257–1264.
- [9] Nauck MA, Stewart MW, Perkins CM, et al. Efficacy and safety of once weekly GLP 1 receptor agonist albiglutide (HARMONY 2): 52 week primary endpoint results from a randomised, placebo controlled trial in patients with type 2 diabetes mellitus inadequately controlled with diet and exercise. Diabetologia 2016; 59: 266–274.
- [10] Ahrén B, Johnson SL, Stewart M, et al. HARMONY 3: 104 Week Randomized, Double Blind, Placebo and Active Controlled Trial Assessing the Efficacy and Safety of Albiglutide Compared With Placebo, Sitagliptin, and Glimepiride in Patients With Type 2 Diabetes Taking Metformin. Diabetes Care 2014; 37: 2141–2148.
- [11] Weissman PN, Carr MC, Ye J, et al. HARMONY 4: randomised clinical trial comparing once weekly albiglutide and insulin glargine in patients with type 2 diabetes inadequately controlled with metformin with or without sulfonylurea. Diabetologia 2014; 57: 2475–2484.
- [12] Home, PD, Shamanna P, Stewart M, et al. Efficacy and tolerability of albiglutide versus placebo or pioglitazone over 1 year in people with type 2 diabetes currently taking metformin and glimepiride: HARMONY 5. Diabetes Obes Metab 2015; 17: 179–187.
- [13] Rosenstock J, Fonseca VA, Gross JL, et al. Advancing basal insulin replacement in type 2 diabetes inadequately controlled with insulin glargine plus oral agents: a comparison of adding albiglutide, a weekly GLP 1 receptor agonist, versus thrice daily prandial insulin lispro. Diabetes Care 2014; 37: 2317–2325.
- [14] Pratley RE, Nauck MA, Barnett AH, et al. Once weekly albiglutide versus once daily liraglutide in patients with type 2 diabetes inadequately controlled on oral drugs (HARMONY 7): a randomised, open label, multicentre, non inferiority phase 3 study. Lancet Diabetes Endocrinol 2014; 2: 289–297.
- [15] Leiter LA, Carr MC, Stewart M, et al. Efficacy and safety of the once weekly GLP 1 receptor agonist albiglutide versus sitagliptin in patients with type 2 diabetes and renal impairment: a randomized phase III study. Diabetes Care 2014; 37: 2723–2730.
- [16] Fisher M, Petrie MC, Amery PD, et al. Cardiovascular safety of albiglutide in the Harmony programme: a meta analysis. Lancet Diabetes Endocrinol 2015; 3: 697–703.