Dapagliflozin
Dapagliflozin je vysoce selektivní inhibitor transportéru SGLT2 (sodium glucose co-transporter 2), který je zodpovědný za renální reabsorpci glukózy. Inhibice SGLT2 pomocí dapagliflozinu vede ke zvýšení exkrece glukózy ledvinami a k následnému snížení glykemie a zlepšení kompenzace diabetu. Dapagliflozin je v současné době v Evropě schválen pro podávání u diabetiků 2. typu v monoterapii (při intoleranci metforminu), případně v kombinaci s jinými antidiabetiky včetně inzulinu. Podávání dapagliflozinu vede nejen ke zlepšení kompenzace diabetu, ale také k mírnému poklesu tělesné hmotnosti a ke snížení krevního tlaku. Výhodou je zcela unikátní mechanismus účinku komplementární k působení jiných typů antidiabetické léčby a také fakt, že podávání dapagliflozinu nevede k vyvolání hypoglykemie. Cílem tohoto článku je shrnout základní farmakokinetické a farmakodynamické údaje o dapagliflozinu a jeho současné postavení a perspektivy v léčbě diabetes mellitus 2. typu.
Farmakologická skupina
Léčiva k léčbě diabetes mellitus, jiná léčiva snižující hladinu glukózy v krvi kromě inzulinů. ATC kód: A10BX09.
Mechanismus účinku
Dapa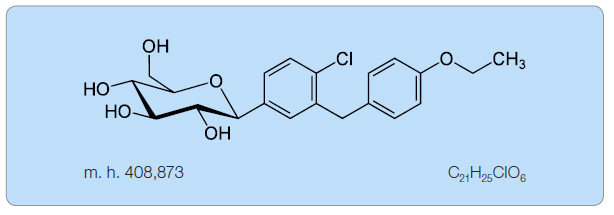 gliflozin (obr. 1) je velmi účinný (Ki 0,55 nM) selektivní a reverzibilní inhibitor společného transportéru pro sodík a glukózu (sodium glucose co-transporter 2, SGLT2) [1], který je selektivně exprimován v ledvinách [2]. V dalších více než sedmdesáti tkáních včetně jater, příčně pruhovaných svalů, tukové tkáně, prsou, močového měchýře a mozku jeho exprese nebyla prokázána. SGLT2 je hlavním transportérem zodpovědným za reabsorpci glukózy z glomerulárního filtrátu zpět do krevního oběhu (takto je za normálních podmínek reabsorbováno až 180 g glukózy denně) [2, 3]. Reabsorpce glukózy z glomerulárního filtrátu probíhá u diabetes mellitus 2. typu (DM2T) i při hyperglykemii. U experimentálních modelů diabetu je exprese SGLT2 dokonce zvýšena ve srovnání se zdravými zvířaty [4].
gliflozin (obr. 1) je velmi účinný (Ki 0,55 nM) selektivní a reverzibilní inhibitor společného transportéru pro sodík a glukózu (sodium glucose co-transporter 2, SGLT2) [1], který je selektivně exprimován v ledvinách [2]. V dalších více než sedmdesáti tkáních včetně jater, příčně pruhovaných svalů, tukové tkáně, prsou, močového měchýře a mozku jeho exprese nebyla prokázána. SGLT2 je hlavním transportérem zodpovědným za reabsorpci glukózy z glomerulárního filtrátu zpět do krevního oběhu (takto je za normálních podmínek reabsorbováno až 180 g glukózy denně) [2, 3]. Reabsorpce glukózy z glomerulárního filtrátu probíhá u diabetes mellitus 2. typu (DM2T) i při hyperglykemii. U experimentálních modelů diabetu je exprese SGLT2 dokonce zvýšena ve srovnání se zdravými zvířaty [4].
Dapagliflozin snižuje plazmatické koncentrace glukózy jak nalačno, tak postprandiálně inhibicí SGLT2 (obr. 2), která vede k poklesu reabsorpce glukózy v ledvinách a ke zvýšení jejího vylučování močí [5]. Toto vylučování glukózy (gl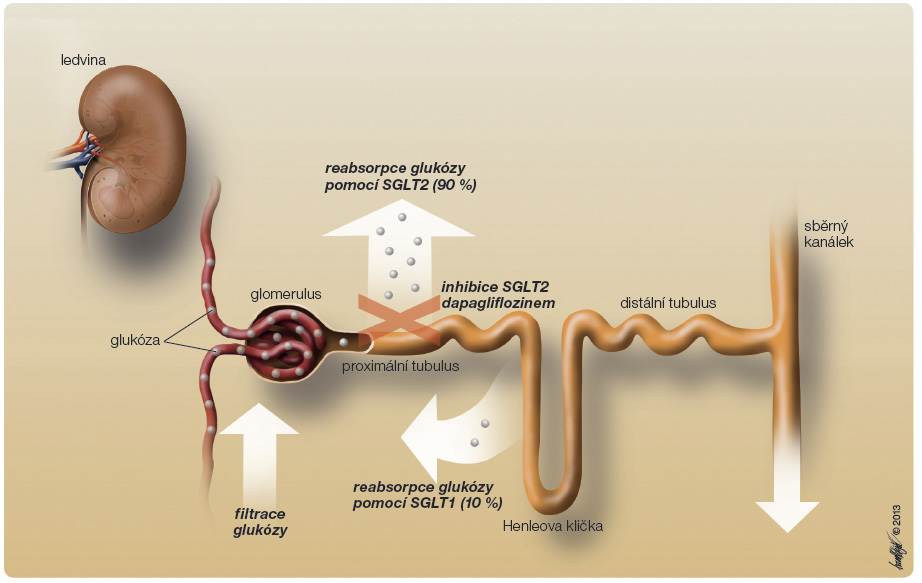 ukosurický účinek), které lze pozorovat po podání první dávky, přetrvává po celý 24hodinový dávkový interval a udržuje se po dobu trvání léčby. Množství glukózy odstraněné tímto mechanismem ledvinami závisí na koncentraci glukózy a hodnotě glomerulární filtrace (GFR). Obvykle se toto množství pohybuje mezi 40–80 g glukózy denně [6]. Dapagliflozin nemá vliv na endogenní tvorbu glukózy jako reakci na hypoglykemii a účinkuje nezávisle na sekreci a účinku inzulinu.
ukosurický účinek), které lze pozorovat po podání první dávky, přetrvává po celý 24hodinový dávkový interval a udržuje se po dobu trvání léčby. Množství glukózy odstraněné tímto mechanismem ledvinami závisí na koncentraci glukózy a hodnotě glomerulární filtrace (GFR). Obvykle se toto množství pohybuje mezi 40–80 g glukózy denně [6]. Dapagliflozin nemá vliv na endogenní tvorbu glukózy jako reakci na hypoglykemii a účinkuje nezávisle na sekreci a účinku inzulinu.
Glykosurie navozená dapagliflozinem je spojena s mírným snížením tělesné hmotnosti, lehkým zvýšením diurézy a přechodně též natriurézy [7]. Dapagliflozin neinhibuje jiné transportéry pro glukózu důležité pro transport glukózy do periferních tkání a je více než 1400krát selektivnější pro SGLT2 než pro SGLT1, hlavní transportér v zažívacím traktu zodpovědný za absorpci glukózy ve střevě [8].
Farmakodynamické účinky
V experimentálních studiích vedlo podávání dapagliflozinu u diabetických potkanů k signifikantnímu zvýšení exkrece glukózy ledvinami, snížení glykemie nalačno i ke zlepšení kompenzace diabetu [9]. U zdravých dobrovolníků a u pacientů s DM2T bylo po podávání dapagliflozinu pozorováno zvýšené vylučování glukózy močí [10]. U subjektů s DM2T bylo pozorováno vylučování přibližně 70 g glukózy do moči za den (odpovídající energetické hodnotě 280 kcal/den) po podávání dapagliflozinu v dávce 10 mg denně po dobu 12 týdnů [11]. Podobné účinky byly pozorovány u pacientů s DM2T, kterým byl podáván dapagliflozin 10 mg po dobu dvou let [12]. Kromě metabolických účinků byla zvýšená exkrece glukózy do moči po podávání dapagliflozinu spojena s mírným zvýšením celkového objemu moči [11]. Toto zvýšení bylo při podávání dávky 10 mg denně po 12 týdnech trvalé a dosahovalo přibližně 375 ml/den. Zvýšení objemu moči bylo doprovázeno malým a přechodným zvýšením vylučování sodíku do moči, které nemělo za následek změny sérových koncentrací sodíku.
Přechodně (po dobu 3–7 dnů) bylo zvýšeno též vylučování kyseliny močové, které bylo doprovázeno trvalým snížením sérové koncentrace kyseliny močové [13]. Po 24 týdnech se snížení sérové koncentrace kyseliny močové pohybovalo v rozmezí –48,3 až –18,3 μmol/l.
Základní farmakokinetické vlastnosti
Základní farmakokinetické vlas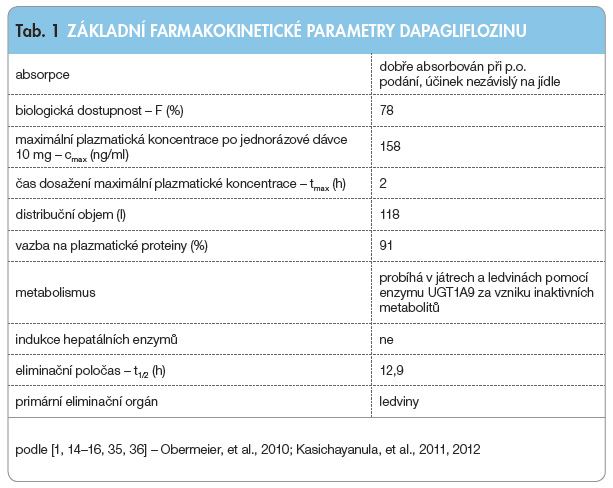 tnosti dapagliflozinu jsou uvedeny v tab. 1.
tnosti dapagliflozinu jsou uvedeny v tab. 1.
Farmakokinetika u zvláštních populací
Pacienti s DM2T s mírným, středně závažným a závažným poškozením funkce ledvin měli v rovnovážném stavu (dapagliflozin 20 mg denně po dobu 7 dnů) vyšší expozici dapagliflozinu v průměru o 32 %, 60 % a 87 % oproti pacientům s DM2T bez poškození ledvin [14]. Vylučování glukózy ledvinami za 24 hodin v rovnovážném stavu představovalo u subjektů s normální funkcí ledvin, respektive s mírným, středně závažným nebo závažným poškozením ledvin 85 g, 52 g, 18 g, respektive 11 g glukózy/den [15]. Vliv hemodialýzy na expozici dapagliflozinu není znám.
U pacientů s mírným nebo středně závažným poškozením funkce jater (Child-
-Pugh třída A a B) byla průměrná hodnota cmax, respektive AUC (plocha pod křivkou plazmatických koncentrací) dapagliflozinu až o 12 %, respektive o 36 % vyšší než u zdravých kontrolních subjektů [15]. Tyto rozdíly nebyly považovány za klinicky významné. U subjektů se závažným poškozením funkce jater (Child-Pugh třída C) byla průměrná hodnota maximální koncentrace, respektive AUC dapagliflozinu až o 40 %, respektive až o 67 % vyšší než u zdravých kontrolních subjektů.
Nebylo zjištěno klinicky významné zvýšení expozice dapagliflozinu pouze na základě věku u pacientů až do 70 let [17]. Lze však očekávat zvýšení expozice v důsledku snížení funkce ledvin v závislosti na věku. Ve věkové kategorii nad 70 let není dostatek údajů k formulaci závěrů o expozici u těchto pacientů. U pediatrické populace nebyla farmakokinetika studována.
Odhaduje se, že průměrná hodnota plochy pod křivkou dapagliflozinu je u žen o 22 % vyšší než u mužů [18]. Neexistují klinicky relevantní rozdíly v systémové expozici mezi bělochy, černochy a Asiaty. Bylo zjištěno, že expozice dapagliflozinu klesá se zvyšující se tělesnou hmotností. Rozdíly v expozici však nejsou považovány za klinicky významné.
Klinické zkušenosti
Bylo provedeno 11 dvojitě zaslepených randomizovaných kontrolovaných klinických studií u 5693 subjektů s DM2T za účelem zhodnocení účinnosti a bezpečnosti dapagliflozinu, který byl v těchto studiích podáván celkem 3939 subjektům. V deseti studiích byla doba léčby 24 týdnů, v 5 studiích s prodlouženým sledováním (follow-up) v rozmezí od 24 do 78 týdnů (až do celkové doby trvání studie 102 týdnů), jedna studie trvala 52 týdnů. Průměrná doba trvání diabetu se pohybovala v rozmezí 1,4 až 16,9 roku; 51 % subjektů mělo mírné poškození ledvin a 12 % středně závažné poškození ledvin; 51 % subjektů byly ženy, 84 % subjektů běloši, 10 % Asiaté, 3 % černoši a 3 % subjektů jiné rasy; 80 % subjektů mělo index tělesné hmotnosti (BMI) ≥ 27.
Dávkován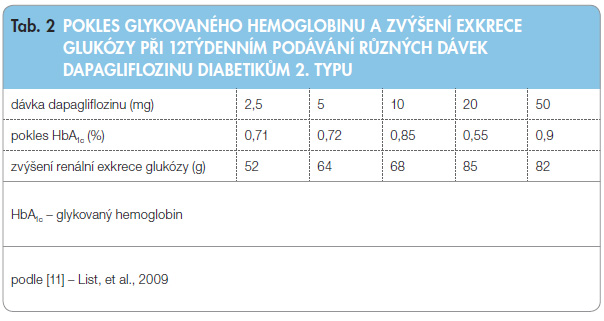 í dapagliflozinu bylo určeno na základě studií se zdravými dobrovolníky i pacienty s DM2T [10, 19]. Vliv na pokles hodnot glykovaného hemoglobinu (HbA1c) a míru exkrece glukózy při 12týdenním podávání různých dávek dapagliflozinu diabetikům 2. typu ukazuje tab. 2. Došlo ke snížení glykemie nalačno a k poklesu hmotnosti (o 2,5–3,4 % výchozí hodnoty ve srovnání se snížením o 1,2 % u placebové skupiny) [11].
í dapagliflozinu bylo určeno na základě studií se zdravými dobrovolníky i pacienty s DM2T [10, 19]. Vliv na pokles hodnot glykovaného hemoglobinu (HbA1c) a míru exkrece glukózy při 12týdenním podávání různých dávek dapagliflozinu diabetikům 2. typu ukazuje tab. 2. Došlo ke snížení glykemie nalačno a k poklesu hmotnosti (o 2,5–3,4 % výchozí hodnoty ve srovnání se snížením o 1,2 % u placebové skupiny) [11].
Při podávání dapagliflozinu v dávce 10 mg nebo 20 mg denně pacientům neuspokojivě kompenzovaným při léčbě inzulinem v kombinaci s inzulin-senzitizujícími léky poklesla signifikantně glykemie nalačno i hladina HbA1c (o 0,7 %, respektive 0,78 %) [20]. Snížila se také tělesná hmotnost pacientů o 4,5 kg, respektive o 4,3 kg ve srovnání s poklesem o 1,9 kg u placebové skupiny. Podobných výsledků bylo dosaženo v jiné 24týdenní studii publikované v loňském roce [21]. V analýze zaměřené na srovnání účinnosti dapagliflozinu u pacientů s delším a kratším trváním diabetu byla zjištěna srovnatelná antidiabetická účinnost u obou podskupin a mírně vyšší vliv na snížení hmotnosti u pacientů s delším trváním diabetu [17].
Ve studiích fáze III bylo studováno podání dapagliflozinu v monoterapii i jeho kombinace s dalšími antidiabetiky [22–25]. V monoterapii vedlo podávání dapagliflozinu v dávkách 2,5 mg, 5 mg a 10 mg ke snížení glykemie nalačno, hodnot HbA1c (o 0,58 %, 0,77 % a 0,89 %) i ke snížení hmotnosti, které se však v tomto případě signifikantně nelišilo od snížení tělesné hmotnosti pacientů v placebové skupině [26]. Nesignifikantní rozdíl v tělesné hmotnosti byl vysvětlován výrazným vlivem edukace u pacientů s prvozáchytem diabetu.
Numericky podobné poklesy HbA1c i glykemie nalačno byly dosaženy v jiné studii s přidáním dapagliflozinu k metforminu. Zde došlo navíc i ke snížení tělesné hmotnosti o 2,2 kg, 3,0 kg a 2,9 kg ve srovnání s poklesem o 0,9 kg u skupiny s placebem [27]. Rovněž přidání dapagliflozinu k léčbě pacientů neuspokojivě kompenzovaných při monoterapii glimepiridem signifikantně snížilo glykemii nalačno i hodnotu HbA1c (dávkově závislý pokles o 0,58–0,82 %) [28]. Poklesla i tělesná hmotnost, byť méně výrazně než při podávání kombinace s metforminem.
Noninferiorita dapagliflozinu k derivátu sulfonylurey glipizidu byla prokázána v 52týdenní studii, kde byly oba léky přidány pacientům neuspokojivě kompenzovaným při monoterapii metforminem [29]. V obou skupinách došlo ke srovnatelnému poklesu hodnoty HbA1c (o 0,52 %), avšak léčba dapagliflozinem snížila tělesnou hmotnost o 3,2 kg, zatímco léčba glipizidem vedla k jejímu zvýšení o 1,4 kg.
V řadě studií bylo při podávání dapagliflozinu popsáno též mírné snížení krevního tlaku (o 2–5 mm Hg u systolic-
kého, respektive o 1–3 mm Hg u diastolického tlaku) [20, 26–28]. Nežádoucí účinky dapagliflozinu jsou podrobněji diskutovány níže. Zde pouze shrneme, že podávání dapagliflozinu neovlivnilo funkci jater [20, 27] ani hladiny 1,25-dihydroxyvitaminu D a 25-hydroxyvitaminu D [11]. Signifikantně ovlivněna nebyla ani funkce ledvin s výjimkou mírného zvýšení hladin hořčíku v některých studiích [26]. Popsáno bylo mírné zvýšení hladin parathormonu a fosforu při nezměněných hladinách kalcia [11].
Zařazení do současné palety léčiv
Dapagliflozin je prvním lékem z nové terapeutické skupiny inhibitorů SGLT2. Za jeho výhodu lze považovat fakt, že působí zcela odlišným mechanismem účinku než jiné antidiabetické léky, a že jej tedy lze kombinovat prakticky se všemi ostatními antidiabetiky [30]. Navíc jeho podávání nevyvolává hypoglykemii a vede k mírnému poklesu tělesné hmotnosti a krevního tlaku [31, 32].
Dapagliflozin je tedy možné podávat u širokého spektra diabetiků 2. typu – od nemocných v iniciálním stadiu této choroby až po pacienty s delším trváním diabetu. Účinky dapagliflozinu jsou komplementární k jiným typům antidiabetické léčby, navíc jeho vliv na snížení hmotnosti a mírný diuretický účinek může částečně potlačit retenci tekutin a vzestup hmotnosti vyskytující se u některých pacientů léčených inzulinem. Jedná se nepochybně o další lék, který umožní individualizaci léčby u pacientů s DM2T tak, jak je zdůrazňována v současných doporučeních [33].
Indikace
Dapagliflozin je indikován k léčbě dospělých pacientů starších 18 let s DM2T ke zlepšení kontroly glykemie jako:
- monoterapie, pokud dieta a fyzická aktivita samotné neposkytují adekvátní kontrolu glykemie u pacientů, u kterých je podávání metforminu nevhodné v důsledku intolerance;
- součást kombinované léčby v kombinaci s jinými léčivými přípravky, které snižují hladinu glukózy včetně inzulinu, pokud tyto léčivé přípravky spolu s dietou a fyzickou aktivitou neposkytují adekvátní kontrolu glykemie.
Kontraindikace
Léčba dapagliflozinem je kontraindikována při hypersenzitivitě na léčivou látku nebo na kteroukoli pomocnou látku.
Zvláštní upozornění a opatření pro použití
Dapagliflozin by neměl být podáván pacientům s diabetes mellitus 1. typu nebo k léčbě diabetické ketoacidózy. Nedoporučuje se podávat jej pacientům se středně závažným až závažným poškozením funkce ledvin (pacienti s clearance kreatininu: ClCr < 60 ml/min nebo s odhadovanou rychlostí glomerulární filtrace: eGFR < 60 ml/min/1,73 m2). Dapagliflozin nebyl studován u závažného poškození ledvin nebo v konečném stadiu renálního selhání.
Monitorování funkce ledvin se při léčbě dapagliflozinem doporučuje provádět:
- před zahájením jeho podávání a dále alespoň jednou za rok;
- před zahájením souběžné léčby přípravky, které mohou snižovat funkci ledvin, a dále v pravidelných intervalech;
- při funkci ledvin, která se blíží středně závažnému poškození ledvin, alespoň 2–4krát za rok.
- Pokud dojde ke snížení funkce ledvin pod hodnoty ClCr 60 ml/min nebo eGFR 60 ml/min/1,73 m2, je třeba léčbu dapagliflozinem přerušit.
U pacientů s poškozením jater jsou pouze omezené zkušenosti z klinického hodnocení. U pacientů se závažným poškozením jater je expozice dapagliflozinu zvýšená.
Nedoporučuje se podávat dapagliflozin pacientům, kterým jsou podávána kličková diuretika, nebo pacientům s objemovou deplecí, např. kvůli akutnímu onemocnění (např. gastrointestinální onemocnění). Opatrnosti je zapotřebí u pacientů, u kterých může pokles krevního tlaku vyvolaný dapagliflozinem představovat riziko, např. pacienti se známým kardiovaskulárním onemocněním, pacienti léčení antihypertenzivy s anamnézou hypotenze nebo starší pacienti. U pacientů, u kterých je zjištěna objemová deplece, se doporučuje dočasné přerušení léčby dapagliflozinem až do doby, než dojde ke korekci objemové deplece. Léčebné zkušenosti u pacientů ve věku 75 let jsou omezené. Zahajování léčby dapagliflozinem v této populaci se nedoporučuje.
Zkušenosti ve třídě I–II podle NYHA (New York Heart Association) jsou omezené a ve třídě III–IV podle NYHA neexistují žádné zkušenosti z klinického hodnocení s dapagliflozinem. Jako preventivní opatření se nedoporučuje podávat dapagliflozin pacientům souběžně léčeným pioglitazonem, a to z důvodu souvislosti mezi léčbou pioglitazonem a karcinomem močového měchýře, a to i přesto, že kauzální vztah mezi léčbou dapagliflozinem a karcinomem močového měchýře je nepravděpodobný. Dostupné epidemiologické údaje pro pioglitazon předpokládají malé zvýšení rizika vzniku karcinomu močového měchýře u pacientů s DM2T léčených pioglitazonem [34].
Při léčbě dapagliflozinem byly pozorovány zvýšené hodnoty hematokritu; z tohoto důvodu se doporučuje věnovat zvýšenou pozornost pacientům s již zvýšeným hematokritem.
Nebyly studovány kombinace dapagliflozinu a inhibitorů dipeptidylpeptidázy 4 (DPP-4) nebo analog glukagonu podobného peptidu 1 (GLP-1).
Nežádoucí účinky
Celkový výskyt nežádoucích příhod (při krátkodobém podávání) u subjektů hodnocení, kterým byl podáván dapagliflozin v dávce 10 mg, byl podobný jako u placeba. Několik nežádoucích příhod vedlo k přerušení léčby. Jejich rozložení bylo ve studijních skupinách vyvážené. Nejčastěji hlášenými nežádoucími příhodami vedoucími k přerušení léčby u pacientů léčených dapagliflozinem 10 mg byla zvýšená koncentrace kreatininu v krvi (0,4 %), infekce močových cest (0,3 %), nauzea (0,2 %), závrať (0,2 %) a rash (0,2 %). U jednoho ze subjektů hodnocení, kterému byl podáván dapagliflozin, byla hlášena nežádoucí příhoda s postižením jater a diagnostikována jako lékově navozená hepatitida a/nebo autoimunní hepatitida. Nejčastěji hlášeným nežádoucím účinkem byla hypoglykemie, která závisela na typu základní léčby v každé studii. Frekvence lehkých hypoglykemií byla podobná ve všech léčebných skupinách, včetně placeba, s výjimkou studií s přidanou sulfonylureou a s přidaným inzulinem. Kombinovaná léčba se sulfonylureou a s přidáním k inzulinu vykazovala mírně vyšší frekvenci hypoglykemie. K mírně vyšší frekvenci hypoglykemie tedy docházelo pouze v případě kombinace s léky, které samy frekvenci hypoglykemie zvyšují, zatímco v monoterapii dapagliflozinem byla její frekvence srovnatelná s placebem.
Lékové interakce
Farmakodynamické interakce
Dapagliflozin může zvyšovat diuretický účinek thiazidů a kličkových diuretik a může zvyšovat riziko dehydratace a hypotenze. Inzulin a inzulinová sekretagoga, např. deriváty sulfonylurey, mohou způsobit hypoglykemii. Ke snížení rizika hypoglykemie v kombinaci s dapagliflozinem může být vhodné snížení jejich dávky.
Farmakokinetické interakce
Metabolismus dapagliflozinu probíhá především konjugací s glukuronidem zprostředkovanou UDP-glukuronosyltransferázou 1A9 (UGT1A9). Ve studiích in vitro dapagliflozin neinhiboval cytochrom P 450 izoformy CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 nebo CYP3A4, ani neindukoval CYP1A2, CYP2B6 nebo CYP3A4. Z tohoto důvodu se předpokládá, že dapagliflozin neovlivňuje metabolickou clearance jiných souběžně podávaných léčivých přípravků metabolizovaných těmito enzymy.
Interakční studie, které byly provedeny u zdravých subjektů za použití především jednodávkového plánu studií, předpokládají, že farmakokinetika dapagliflozinu není ovlivněna metforminem, pioglitazonem, sitagliptinem, glimepiridem, voglibosou, hydrochlorothiazidem, bumetanidem, valsartanem nebo simvastatinem [35]. V interakčních studiích provedených se zdravými subjekty při použití především jednodávkového plánu studií neovlivňoval dapagliflozin farmakokinetiku metforminu, pioglitazonu, sitagliptinu, glimepiridu, hydrochlorothiazidu, bumetanidu, valsartanu, digoxinu (substrát pro P-glykoprotein) nebo warfarinu (S-warfarin, substrát pro CYP2C9) nebo antikoagulační účinek warfarinu měřený pomocí INR (International Normalised Ratio). Kombinace jedné dávky dapagliflozinu 20 mg a simvastatinu (substrát pro CYP3A4) vedla k 19% zvýšení AUC pro simvastatin a ke 31% zvýšení AUC pro kyselinu simvastatinu [36]. Zvýšení expozice simvastatinu a jeho kyselině není považováno za klinicky relevantní.
Při souběžném podávání dapagliflozinu a rifampicinu (induktor různých aktivních transportérů a enzymů metabolizujících léčiva), respektive dapagliflozinu a kyseliny mefenamové (inhibitor UGT1A9), byly pozorovány mírné změny systémové expozice dapagliflozinu bez klinicky významného vlivu na 24hodinovou exkreci glukózy. Nedoporučuje se upravovat dávkování. Neočekává se klinicky relevantní vliv v kombinaci s jinými induktory (jako jsou např. karbamazepin, fenytoin, fenobarbital).
Vliv kouření, diety, rostlinných přípravků a pití alkoholu na farmakokinetiku dapagliflozinu nebyl studován, studovány nebyly ani interakce u pediatrické populace.
Těhotenství a kojení
Nejsou dostupné údaje o použití dapagliflozinu u těhotných žen. Studie na laboratorních potkanech prokázaly vývojovou toxicitu na ledviny v období, které odpovídá druhému a třetímu trimestru těhotenství u lidí. Z tohoto důvodu se nedoporučuje podávat dapagliflozin v průběhu druhého a třetího trimestru těhotenství. Jakmile je zjištěno těhotenství, měla by se léčba dapagliflozinem přerušit. Dapagliflozin by se neměl podávat v období kojení.
Ovlivnění pozornosti
Dapagliflozin nemá žádný vliv nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje. Pacienti by měli být upozorněni na riziko vzniku hypoglykemie, pokud je dapagliflozin podáván souběžně s deriváty sulfonylurey nebo s inzulinem.
Dávkování
Doporučená dávka je 10 mg dapagliflozinu jednou denně v monoterapii i jako součást kombinované léčby s jinými léčivými přípravky snižujícími glykemii včetně inzulinu. Pokud je dapagliflozin podáván v kombinaci s inzulinem nebo inzulinovými sekretagogy, např. s deriváty sulfonylurey, lze uvažovat o snížení dávky inzulinu nebo izulinového sekretagoga, aby se snížilo riziko hypoglykemie.
U pacientů s mírným poškozením funkce ledvin není nutná úprava dávkování, pacientům se středně závažným až závažným poškozením funkce ledvin se podávání dapagliflozinu nedoporučuje (viz výše).
U pacientů s mírným nebo středně závažným poškozením funkce jater není nutné upravovat dávku. U pacientů se závažným poškozením jater se doporučuje podat zahajovací dávku 5 mg. Pokud je dobře tolerována, lze ji zvýšit na
10 mg.
Všeobecně se nedoporučuje upravovat dávku podle věku. Je třeba vzít v úvahu funkci ledvin a riziko objemové deplece. Zahajování léčby u pacientů ve věku 75 let se v důsledku omezených terapeutických zkušeností nedoporučuje. Bezpečnost a účinnost dapagliflozinu u dětí ve věku od 0 do 18 let nebyla dosud stanovena. Nejsou dostupné žádné údaje.Dapagliflozin se podává perorálně jednou denně, kdykoliv v průběhu dne, s jídlem nebo mimo jídlo. Tablety se polykají celé.
Práce je podporována RVO-VFN64165/2012.
Seznam použité literatury
- [1] Obermeier M, Yao M, Khanna A, et al. In vitro characterization and pharmacokinetics of dapagliflozin (BMS-512148), a potent sodium-glucose cotransporter type II inhibitor, in animals and humans. Drug Metab Dispos 2010; 38: 405–414.
- [2] Abdul-Ghani MA, DeFronzo RA. Inhibition of renal glucose reabsorption: a novel strategy for achieving glucose control in type 2 diabetes mellitus. Endocr Pract 2008; 14: 782–790.
- [3] Bakris GL, Fonseca VA, Sharma K, Wright EM. Renal sodium-glucose transport: role in diabetes mellitus and potential clinical implications. Kidney Int 2009; 75: 1272–1277.
- [4] Freitas HS, Anhe GF, Melo KF, et al. Na(+)--glucose transporter-2 messenger ribonucleic acid expression in kidney of diabetic rats cor-relates with glycemic levels: involvement of hepatocyte nuclear factor-1alpha expression and activity. Endocrinology 2008; 149: 717–724.
- [5] Brooks AM, Thacker SM. Dapagliflozin for the treatment of type 2 diabetes. Ann Pharmacother 2009; 43: 1286–1293.
- [6] Kipnes M. Dapagliflozin: an emerging treatment option in type 2 diabetes. Expert Opin Investig Drugs 2009; 18: 327–334.
- [7] Whaley JM, Tirmenstein M, Reilly TP, et al. Targeting the kidney and glucose excretion with dapagliflozin: preclinical and clinical evidence for SGLT2 inhibition as a new option for treatment of type 2 diabetes mellitus. Diabetes Metab Syndr Obes 2012; 5: 135–148.
- [8] Hummel CS, Lu C, Liu J, et al. Structural selectivity of human SGLT inhibitors. Am J Physiol Cell Physiol 2012; 302: C373–382.
- [9] Han S, Hagan DL, Taylor JR, et al. Dapagliflozin, a selective SGLT2 inhibitor, improves glucose homeostasis in normal and diabetic rats. Diabetes 2008; 57: 1723–1729.
- [10] Komoroski B, Vachharajani N, Boulton D, et al. Dapagliflozin, a novel SGLT2 inhibitor, induces dose-dependent glucosuria in healthy subjects. Clin Pharmacol Ther 2009; 85: 520–526.
- [11] List JF, Woo V, Morales E, et al. Sodium-glucose cotransport inhibition with dapagliflozin in type 2 diabetes. Diabetes Care 2009; 32: 650–657.
- [12] Bailey CJ, Gross JL, Hennicken D, et al. Dapagliflozin add-on to metformin in type 2 diabetes inadequately controlled with metformin: a randomized, double-blind, placebo-controlled 102-week trial. BMC Med 2013; 11: 43.
- [13] Musso G, Gambino R, Cassader M, Pagano G. A novel approach to control hyperglycemia in type 2 diabetes: sodium glucose co-transport (SGLT) inhibitors: systematic review and meta-analysis of randomized trials. Ann Med 2012; 44: 375–393.
- [14] Kasichayanula S, Chang M, Hasegawa M, et al. Pharmacokinetics and pharmacodynamics of dapagliflozin, a novel selective inhibitor of sodium--glucose co-transporter type 2, in Japanese subjects without and with type 2 diabetes mellitus. Diabetes Obes Metab 2011; 13: 357–365.
- [15] Kasichayanula S, Liu X, Benito MP, et al. The influence of kidney function on dapagliflozin exposure, metabolism, and efficacy in healthy subjects and in patients with type 2 diabetes mellitus. Br J Clin Pharmacol 2012 Dec 4. doi: 10.1111/bcp.12056. [Epub ahead of print].
- [16] Kasichayanula S, Liu X, Zhang W, et al. Influence of hepatic impairment on the pharmacokinetics and safety profile of dapagliflozin: an open-label, parallel-group, single-dose study. Clin Ther 2011; 33: 1798–1808.
- [17] Zhang L, Feng Y, List J, et al. Dapagliflozin treatment in patients with different stages of type 2 diabetes mellitus: effects on glycaemic control and body weight. Diabetes Obes Metab 2010; 12: 510–516.
- [18] Maurer TS, Ghosh A, Haddish-Berhane N, et al. Pharmacodynamic model of sodium-glucose transporter 2 (SGLT2) inhibition: implications for quantitative translational pharmacology. AAPS J 2011; 13: 576–584.
- [19] Komoroski B, Vachharajani N, Feng Y, et al. Dapagliflozin, a novel, selective SGLT2 inhibitor, improved glycemic control over 2 weeks in patients with type 2 diabetes mellitus. Clin Pharmacol Ther 2009; 85: 513–519.
- [20] Wilding JP, Norwood P, T‘Joen C, et al. A study of dapagliflozin in patients with type 2 diabetes receiving high doses of insulin plus insulin sensitizers: applicability of a novel insulin-independent treatment. Diabetes Care 2009; 32: 1656–1662.
- [21] Wilding JP, Woo V, Soler NG, et al. Dapagliflozin 006 Study G: Long-term efficacy of dapagliflozin in patients with type 2 diabetes mellitus recei-ving high doses of insulin: a randomized trial. Ann Intern Med 2012; 156: 405–415.
- [22] Anderson SL, Marrs JC. Dapagliflozin for the treatment of type 2 diabetes. Ann Pharmacother 2012; 46: 590–598.
- [23] Clar C, Gill JA, Court R, Waugh N. Systematic review of SGLT2 receptor inhibitors in dual or triple therapy in type 2 diabetes. BMJ Open 2012; 2: doi: 10.1136/bmjopen-2012-001007.
- [24] Gerich JE, Bastien A. Development of the sodium-glucose co-transporter 2 inhibitor dapagliflozin for the treatment of patients with type 2 diabetes mellitus. Expert Rev Clin Pharmacol 2011; 4: 669–683.
- [25] Ghosh RK, Ghosh SM, Chawla S, Jasdanwala SA. SGLT2 inhibitors: a new emerging therapeutic class in the treatment of type 2 diabetes mellitus. J Clin Pharmacol 2012; 52: 457–463.
- [26] Ferrannini E, Ramos SJ, Salsali A, et al. Dapagliflozin monotherapy in type 2 diabetic patients with inadequate glycemic control by diet and exercise: a randomized, double-blind, placebo-controlled, phase 3 trial. Diabetes Care 2010; 33: 2217–2224.
- [27] Bailey CJ, Gross JL, Pieters A, et al. Effect of dapagliflozin in patients with type 2 diabetes who have inadequate glycaemic control with metformin: a randomised, double-blind, placebo-controlled trial. Lancet 2010; 375: 2223–2233.
- [28] Strojek K, Yoon KH, Hruba V, et al. Effect of dapagliflozin in patients with type 2 diabetes who have inadequate glycaemic control with glimepiride: a randomized, 24-week, double-blind, placebo-controlled trial. Diabetes Obes Metab 2011; 13: 928–938.
- [29] Nauck MA, Del Prato S, Meier JJ, et al. Dapagliflozin versus glipizide as add-on therapy in patients with type 2 diabetes who have inadequate glycemic control with metformin: a randomized, 52-week, double-blind, active-controlled noninferiority trial. Diabetes Care 2011; 34: 2015–2022.
- [30] Škrha J. Diabetologie. Praha, Galén 2009, 417 s.
- [31] Bhartia M, Tahrani AA, Barnett AH. SGLT-2 inhibitors in development for type 2 diabetes treatment. Rev Diabet Stud 2011; 8: 348–354.
- [32] Katsiki N, Papanas N, Mikhailidis DP. Dapagliflozin: more than just another oral glucose-lowering agent? Expert Opin Investig Drugs 2010; 19: 1581–1589.
- [33] Inzucchi SE, Bergenstal RM, Buse JB, et al. Management of Hyperglycemia in Type 2 Diabetes: A Patient-Centered Approach: Position Statement of the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2012; 35: 1364–1379.
- [34] Zhu Z, Shen Z, Lu Y, et al. Increased risk of bladder cancer with pioglitazone therapy in patients with diabetes: a meta-analysis. Diabetes Res Clin Pract 2012; 98: 159–163.
- [35] Kasichayanula S, Liu X, Shyu WC, et al. Lack of pharmacokinetic interaction between dapagliflozin, a novel sodium-glucose transporter 2 inhibitor, and metformin, pioglitazone, glimepiride or sitagliptin in healthy subjects. Diabetes Obes Metab 2011; 13: 47–54.
- [36] Kasichayanula S, Chang M, Liu X, et al. Lack of pharmacokinetic interactions between dapagliflozin and simvastatin, valsartan, warfarin, or digoxin. Adv Ther 2012; 29: 163–177.