Dostarlimab
Souhrn
Mouková L. Dostarlimab. Remedia 2023; 33: 177–182.
Dostarlimab je monoklonální protilátka proti receptoru programované buněčné smrti 1 (PD‑1) určená pro monoterapii dospělých pacientek s deficientní opravou chybného párování bazí (dMMR) či vysokou mikrosatelitovou nestabilitou (MSI‑H) u recidivujícího nebo pokročilého karcinomu endometria, který progredoval v průběhu předchozí chemoterapie obsahující platinové deriváty či po ní. Americký Úřad pro kontrolu potravin a léčiv (FDA) schválil indikaci na základě rychlosti odpovědi na léčbu a jejího trvání. Pokračující schválení této indikace je podmíněno dalšími studiemi prokazujícími a dokumentujícími klinický přínos léčby dostarlimabem.
Klíčová slova: anti‑PD‑1 protilátka – dostarlimab – imunoterapie – karcinom endometria.
Summary
Moukova L. Dostarlimab. Remedia 2023; 33: 177–182.
Dostarlimab is a PD‑1 monoclonal antibody indicated in the monotherapy of adult patients with deficient correction of bad base pairing (dMMR, mismatch repair deficient) or high microsatellite instability (MSI‑H, microsatellite instability high) in recurrent or advanced endometrial cancer that has progressed during or after prior platinum derivative chemotherapy. The FDA (Food and Drug Administration) approved the indication based on tumor response rate and duration of response. Continued approval of this indication is subject to further studies demonstrating and documenting clinical benefit.
Key words: anti‑PD‑1 antibody – dostarlimab – immunotherapy – endometrial cancer.
Úvod
Karcinom endometria představuje šestý nejrozšířenější nádor u žen. V roce 2021 to bylo více než 400 000 nových případů [1]. K rizikovým faktorům rozvoje karcinomu endometria patří časné menarche, pozdní menopauza, obezita, expozice tamoxifenu a nuliparita. V počátečních stadiích je volena primárně chirurgická terapie s eventuální adjuvantní radioterapií a chemoterapií. U pokročilých či recidivujících stadií onemocnění je primárně aplikována radioterapie, chemoterapie, ev. hormonální a cílená léčba dle histologie, lokalizace nemoci a jejího rozsahu [2]. Pacientky s pokročilým a recidivujícím onemocněním mají velmi nepříznivou prognózu s pětiletým přežitím méně než 20 % při omezených možnostech léčby. Chemoterapie je u pokročilých stavů založena na platinových derivátech. Očekávaný medián přežití bez progrese (progression‑free survival, PFS) je 13 měsíců [1,3]. V současné době na základě molekulárního testování karcinomu endometria detekujeme polymerázu ε (POLE), která může být mutovaná či ultramutovaná, dále vysokou mikrosatelitovou nestabilitu (microsatellite instability high, MSI‑H), nízký či vysoký počet kopií. MSI‑H je fenotyp deficitních proteinů v dráze opravy chybného párování bazí (mismatch repair, MMR), což vede k akumulaci vysoké mutační zátěže. Mutace se mohou vyskytovat buď sporadicky, nebo dědičně (např. Lynchův syndrom). Nádory, u kterých nejsou deficientní MMR (dMMR) nebo MSI‑H, jsou považovány za mikrosatelitově stabilní (MSS) [2]. Karcinomy endometria, u nichž je prokázána vysoká míra MSI‑H/dMMR, mají 100–1 000násobný nárůst počtu mutací. Exprimují vysoké množství neoantigenů s neschopností opravit chyby v replikaci DNA, což je činí imunogenními. MSI‑H/dMMR se nachází u 13–30 % recidivujících malignit endometria. Mutace, které způsobují dMMR karcinomy endometria, jsou většinou somatické (90 %), přičemž 5–10 % případů zahrnuje alterace zárodečné linie [1,4]. Zhoubné nádory endometria s mutacemi dMMR mohou upregulovat expresi ligandů 1 a 2 receptoru programované buněčné smrti 1 (programmed cell death ligand, PD‑L1 a PD‑L2), které jsou přítomny na T buňkách a při aktivaci omezují proliferaci a produkci cytokinů. Tyto ligandy se váží na PD‑1, který působí jako imunologický kontrolní bod a potlačuje protinádorovou imunitní odpověď. Dostarlimab je monoklonální protilátka, která se váže na receptor PD‑1 a blokuje jeho interakci s PD‑L1 a PD‑L2, což umožňuje nerušené pokračování protinádorové imunitní odpovědi. Mechanismus opravy chybného párování bazí je zásadním krokem při zachování genomové integrity. Podílí se na procesech mitotické a meiotické rekombinace, přeuspořádání genu pro imunoglobulin, na apoptóze a dalších. Testování na dMMR nebo MSI‑H pomáhá identifikovat pacienty, kteří pravděpodobně reagují na inhibitory PD‑1 [1,4,5]. Pacienti s nádory MSI‑H/dMMR mohou být predisponováni k odpovědi na léky anti‑PD‑1 a anti‑PD‑L1 [1].
Farmakologická skupina
Dostarlimab (Jemperli) je humanizovaná monoklonální protilátka izotypu IgG4 (imunoglobulin G4) produkovaná technologií rekombinantní DNA v buňkách vaječníků čínského křečka, která váže PD‑1 na T buňky, blokuje interakce s jeho ligandy PD‑L1 a PD‑L2 a aktivuje imunitní reakce. Jedná se o imunoterapii podporující přirozené protinádorové reakce těla během léčby karcinomu endometria [1].
Indikace
Přípravek je indikován jako monoterapie k léčbě dospělých pacientek s rekurentním nebo pokročilým karcinomem endometria s dMMR či MSI‑H, u něhož došlo k progresi v průběhu předchozí léčby režimem obsahujícím platinu nebo po ní [1,6].
Dávkování
Dostarlimab se podává intravenózně po dobu 30 minut. Každé tři týdny se podává dávka 500 mg ve čtyřech cyklech. Poté je ponechán opět interval tři týdny a pokračuje se s dávkou 1 000 mg každých šest týdnů až do progrese onemocnění nebo do nepřijatelné toxicity. Jakmile se vyskytnou určité nežádoucí účinky, lékař může léčbu přerušit či úplně ukončit. Výdej přípravku je vázán na lékařský předpis a jeho aplikace probíhá pod dohledem specialisty na onkologické onemocnění. Snížení dávky se nedoporučuje [1,6–9].
Mechanismus účinku
PD‑1 je kontrolní receptor imunitního systému (checkpoint), který snižuje schopnosti aktivovaných efektorových T buněk. Ovlivňuje proliferaci, tvorbu cytokinů, cytotoxickou aktivitu pomocí interakce s jeho ligandy (PD‑L1 a PD‑L2), obrázek 1 [10]. Bylo prokázáno, že díky upregulaci PD‑L1 nádorové buňky unikají imunitnímu systému a interferují s imunitními odpověďmi specifickými pro malignitu. Dosavadní preklinické a klinické studie prokázaly, že léčba založená na vazbě na receptor PD‑1 či na ligand s následným narušením interakce receptor–ligand může posílit protinádorovou imunitu a výrazně zlepšit přežití u řady onkologických malignit [11]. U pokročilých karcinomů endometria s MSI‑H nebo dMMR ve studiích vykazovaly inhibitory PD‑1 dostarlimab a pembrolizumab míru odpovědi 49–57 % a inhibitory PD‑L1 avelumab a durvalumab míru odpovědi v rozmezí 27–43 % [2]. Doposud bylo americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) schváleno šest inhibitorů PD‑1 a PD‑L1 pro klinické použití. Dne 17. 8. 2021 byl dostarlimab FDA schválen ve výše zmiňovaných indikacích u pokročilého a recidivujícího karcinomu endometria [1], následně proběhlo schválení Evropskou lékovou agenturou (European Medicines Agency, EMA).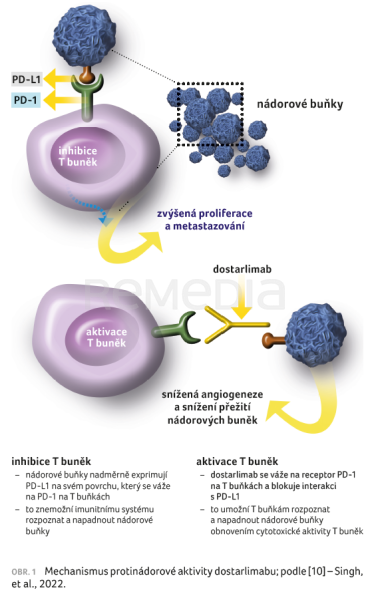
Farmakokinetické vlastnosti
Těžký řetězec dostarlimabu se účastní interakce mezi PD‑1 a dostarlimabem, lehký řetězec je převážně zodpovědný za sterické blokování vazby PD‑L1. Ve snaze zabránit tvorbě polovičních protilátek byl v každém těžkém řetězci protilátky substituován serin za prolin (S228P), aby se podpořila stabilizace disulfidových vazeb mezi dvěma těžkými řetězci. K dosažení vysoké afinity způsobuje dostarlimab konformační přeuspořádání v BC, C’D a FG smyčkách PD‑1. Tím, že zabírá konkávní povrch na těžkém řetězci prostřednictvím četných interakcí, hraje zbytek R86 v C’D smyčce PD‑1 zásadní roli ve vazbě dostarlimabu. Tato struktura s vysokým rozlišením by mohla být užitečná při vývoji lepších biologik proti PD‑1 nebo účinných kombinovaných metod imunoterapie nádorových onemocnění. Vzhledem k tomu, že izotypy IgG4 vyvolávají mírné efektorové funkce, jako jsou buněčná cytotoxicita závislá na protilátkách (ADCC) a cytotoxicita závislá na komplementu (CDC), byl dostarlimab navržen tak, aby se zabránilo depleci T buněk reagujících na nádor [12–14].
Klinické zkušenosti
Na základě různych in vitro funkčních testovacích metod využívajících primární lidské T buňky bylo zjištěno, že dostarlimab zlepšuje aktivaci T buněk. Zatímco dostarlimab zlepšil aktivaci T buněk v systémech závislých na antigenu, neměl žádné přímé nespecifické účinky na odpovědi T buněk, jak je patrné z nedostatku produkce cytokinů v nepřítomnosti antigenu. Jeho protinádorová účinnost byla spojena se snížením počtu regulačních T buněk spojených s nádorem a zvýšením počtu CD8+ T buněk infiltrujících nádor [15]. Dostarlimab se váže na lidský receptor PD‑1 s vysokou afinitou, s vazebnou afinitou (KD) 300 pM. Preklinické nálezy pro předchozí schválené léčby anti‑PD‑1, jako jsou nivolumab, pembrolizumab a cemiplimab, mají podobný vazebný profil a jsou modalitami IgG4. Dostarlimab byl vybrán pro svůj izotyp IgG4, aby vytvořil nejspolehlivější a nejúčinnější terapii. Protilátky anti‑PD‑L1 (atezolizumab, avelumab a durvalumab) jsou všechny modalitami IgG1 a jejich chronické podávání může být spojeno se zvýšenými imunologickými nežádoucími účinky [1].
Studie GARNET
GARNET (NCT02715284) je jednoramenná otevřená studie fáze I s intravenózním dostarlimabem u pokročilých solidních nádorů, která byla prováděna na 123 pracovištích. Ve studii byly dvě kohorty pacientek s endometriálním karcinomem. Kohorta A1 zahrnovala pacientky s onemocněním dMMR/MSI‑H a kohorta A2 pacientky se stabilním onemocněním (MMRp [proficient]/MSS). Pacientky dostávaly dostarlimab v dávce 500 mg každé tři týdny po čtyři cykly, poté dostarlimab v dávce 1 000 mg každých šest týdnů až do progrese onemocnění. Primárními cílovými parametry byly míra objektivní odpovědi (objective response rate, ORR) a trvání odpovědi podle kritérií RECIST (Response Evaluation Criteria in Solid Tumours) verze 1.1, jak bylo analyzováno zaslepeným nezávislým centrálním hodnocením. Studie byla zahájena v roce 2017 a v kohortě A1 bylo 129 pacientek, v kohortě A2 161 pacientek s pokročilým karcinomem endometria. Medián doby sledování byl 16,3 měsíce (mezikvartilové rozpětí [IQR] 9,5–22,1) pro kohortu A1 a 11,5 měsíce (IQR 11,0–25,1) pro kohortu A2. V kohortě A1 představovala ORR 43,5 % (95% interval spolehlivosti [CI] 34,0–53,4 %) s 11 kompletními odpověďmi a 36 částečnými odpověďmi. V kohortě A2 představovala ORR 14,1 % (95% CI 9,1–20,6 %) se třemi kompletními odpověďmi a s 19 částečnými odpověďmi. Mediánu trvání odpovědi nebylo dosaženo v žádné kohortě. V kombinovaných kohortách se vyskytovala většina nežádoucích účinků souvisejících s léčbou (treatment‑related adverse event, TRAE) stupně 1–2 (75,5 %), nejčastěji únava (17,6 %), průjem (13,8 %) a nauzea (13,8 %). TRAE stupně ≥ 3 se vyskytly u 16,6 % pacientů a 5,5 % nemocných ukončilo léčbu dostarlimabem kvůli TRAE. Dostarlimabu nelze připsat žádné úmrtí ve studii. Lék prokázal trvalou protinádorovou aktivitu u pokročilého či recidivujícího karcinomu endometria v dMMR/MSI‑H (ORR 43,5 %) i MMRp/MSS (ORR 14,1 %) se zvládnutelným bezpečnostním profilem [16,17].
Další klinická hodnocení
Dostarlimab prokázal potenciál jako anti‑PD‑1 terapie v různých klinických studiích, včetně RUBY (NCT03981796), FIRST (NCT03602859), IOLite (NCT03307785) a MOONSTONE (NCT03307785) a několika dalších, kde je testován buď jako monoterapie, nebo v kombinaci pro různé typy nádorů (NCT03955471) [1,18,19].
Kontraindikace
Za kontraindikaci léčby dostarlimabem se považuje hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku [6,9].
Upozornění a opatření
Před podáním přípravku je nutné být zvýšeně obezřetný, pokud má pacient problémy s imunitním systémem, plícemi či dýcháním, s játry či ledvinami, se silnou vyrážkou a další zdravotní problémy [9]. Pro zajištění bezpečného užívání léku je nutné nežádoucí účinky sledovat a zavčas léčit. Na začátku léčby a v jejím průběhu se provádějí hematologické a klinické biochemické testy, včetně jaterních testů, funkčního vyšetření ledvin a štítné žlázy [6].
Nežádoucí účinky
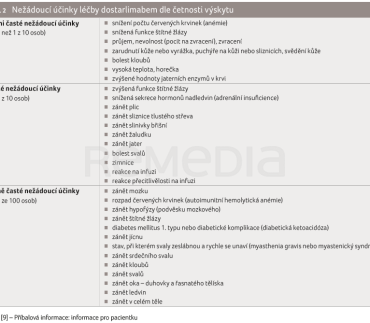
 Studie GARNET sledovala bezpečnost, snášenlivost a protinádorovou účinnost monoterapie dostarlimabem u pacientek s pokročilými solidními malignitami s dMMR. Pacientky vykazovaly progresi onemocnění během chemoterapie na bázi platiny nebo po ní a neměly více než dvě linie chemoterapie pokročilého nebo recidivujícího onemocnění. Většina TRAE doložená u 104 pacientek zahrnutých do analýzy bezpečnosti byla stupně 1 nebo 2. Nejčastěji hlášenými TRAE jakéhokoliv stupně (10 %) byly astenie, průjem, únava a nauzea. TRAE stupně 3 nebo vyššího byly zaznamenány v 11,5 % případů (n = 12), přičemž nejčastěji hlášeným TRAE byla anémie ve 2,9 % (n = 3). Alespoň jednu významnou TRAE prodělalo 10 pacientek (9,6 %). Nejčastěji hlášeným závažným TRAE byla kolitida (1,9 %). Dvě osoby byly vyřazeny z výzkumu pro zvýšenou hodnotu transamináz. Nebyla zdokumentována žádná úmrtí související s léčbou dostarlimabem. Pneumonitida byla zjištěna u jedné pacientky, ale neobjevily se infekce třetího a vyššího stupně [1]. Nežádoucí účinky dle onemocnění a možných příznaků a dle četnosti výskytu shrnují tabulka 1 a tabulka 2 [9].
Studie GARNET sledovala bezpečnost, snášenlivost a protinádorovou účinnost monoterapie dostarlimabem u pacientek s pokročilými solidními malignitami s dMMR. Pacientky vykazovaly progresi onemocnění během chemoterapie na bázi platiny nebo po ní a neměly více než dvě linie chemoterapie pokročilého nebo recidivujícího onemocnění. Většina TRAE doložená u 104 pacientek zahrnutých do analýzy bezpečnosti byla stupně 1 nebo 2. Nejčastěji hlášenými TRAE jakéhokoliv stupně (10 %) byly astenie, průjem, únava a nauzea. TRAE stupně 3 nebo vyššího byly zaznamenány v 11,5 % případů (n = 12), přičemž nejčastěji hlášeným TRAE byla anémie ve 2,9 % (n = 3). Alespoň jednu významnou TRAE prodělalo 10 pacientek (9,6 %). Nejčastěji hlášeným závažným TRAE byla kolitida (1,9 %). Dvě osoby byly vyřazeny z výzkumu pro zvýšenou hodnotu transamináz. Nebyla zdokumentována žádná úmrtí související s léčbou dostarlimabem. Pneumonitida byla zjištěna u jedné pacientky, ale neobjevily se infekce třetího a vyššího stupně [1]. Nežádoucí účinky dle onemocnění a možných příznaků a dle četnosti výskytu shrnují tabulka 1 a tabulka 2 [9].
 Reakce související s podáním infuze dostarlimabu může být podobná alergické reakci a objevit se během několika minut či hodin, ale také pozdně, za 24 hodin [9]. Dle závažnosti nežádoucího účinku je nutné léčbu přerušit či trvale ukončit a zahájit podávání kortikosteroidů (např. prednisonu v dávce 1–2 mg/kg/den). Při zmírnění stupně závažnosti na 1 či méně je třeba dávku kortikosteroidů snižovat a pokračovat v medikaci ještě jeden měsíc či déle [6].
Reakce související s podáním infuze dostarlimabu může být podobná alergické reakci a objevit se během několika minut či hodin, ale také pozdně, za 24 hodin [9]. Dle závažnosti nežádoucího účinku je nutné léčbu přerušit či trvale ukončit a zahájit podávání kortikosteroidů (např. prednisonu v dávce 1–2 mg/kg/den). Při zmírnění stupně závažnosti na 1 či méně je třeba dávku kortikosteroidů snižovat a pokračovat v medikaci ještě jeden měsíc či déle [6].
Karta pacienta
Všichni lékaři předepisující přípravek Jemperli musejí pacientky informovat o kartě pacienta s vysvětlením, co mají dělat v případě vzniku imunitně podmíněných nežádoucích účinků. Lékař musí tuto kartu poskytnout každé léčené pacientce [6,9].
Lékové interakce
Kortikosteroidy (např. prednison) oslabující imunitní systém mohou ovlivňovat léčbu dostarlimabem. Na druhou stranu v průběhu léčby mohou kortikosteroidy potlačit nežádoucí účinky dostarlimabu [9]. Farmakokinetické interakce dostarlimabu s léčivými látkami s malou molekulou se nepředpokládají [6].
Fertilita, těhotenství a kojení
Je doporučeno, aby ženy ve fertilním věku během léčby dostarlimabem a ještě čtyři měsíce po podání poslední dávky používaly účinnou antikoncepci. U gravidních žen je k dispozici málo údajů. Podávání dostarlimabu v graviditě může svým mechanismem účinku poškozovat plod. Reprodukční studie a studie sledující vývoj plodu na zvířatech nebyly s dostarlimabem provedeny. Inhibice cesty PD‑1/PD‑L1 může vést ke zvýšenému riziku rozvoje imunitně zprostředkovaného odmítnutí vyvíjejícího se plodu s následkem jeho úmrtí. Lidské imunoglobuliny (IgG4) procházejí placentární bariérou, a dostarlimab tak může přecházet z matky na vyvíjející se plod [6,9]. Dosud není známo, zda se dostarlimab či jeho metabolity vylučují do lidského mateřského mléka, proto se nemá podávat během kojení a pacientky nemají kojit ještě alespoň čtyři měsíce po poslední dávce dostarlimabu [6].
Zvláštní skupiny pacientek
U pacientek ve věku 65 let a starších se nedoporučuje provádět žádnou úpravu dávkování. U pacientek ve věku 75 let a starších jsou k dispozici pouze omezené údaje. U pacientek s lehkou až středně těžkou poruchou funkce ledvin se úprava dávkování nedoporučuje. V případě pacientek s těžkou poruchou funkce ledvin nebo pacientek s konečným stadiem onemocnění ledvin podstupujících dialýzu jsou k dispozici jen omezené údaje. U pacientek s lehkou poruchou funkce jater se úprava dávkování nedoporučuje. U pacientek se středně těžkou poruchou funkce jater jsou k dispozici pouze omezené údaje a u pacientek s těžkou poruchou funkce jater nejsou k dispozici žádné údaje. Bezpečnost a účinnost přípravku Jemperli u dětí a dospívajících ve věku do 18 let nebyly dosud stanoveny [6,9].
Léková forma
Přípravek Jemperli je k dispozici ve formě 500mg koncentrátu pro infuzní roztok. Jedna injekční lahvička s 10 ml koncentrátu pro infuzní roztok obsahuje účinnou látku dostarlimabum 500 mg. Uchovává se v chladničce při teplotě 2–8 ºC [6].
Vyjádření EMA
Přípravku Jemperli byla udělena podmíněná registrace a společnost, která přípravek na trh dodává, musí předložit údaje z probíhající studie jeho účinnosti, v jejímž rámci jsou pacientky sledovány po dobu nejméně 12 měsíců. Studie se zaměřuje na podávání dostarlimabu v kombinaci s jinými protinádorovými léčivými přípravky a na porovnání s podáváním těchto jiných protinádorových léčivých přípravků samostatně [8].
Zařazení do současné palety léčiv (vyjádření SÚKL)
Léčivému přípravku Jemperli zatím nebyla přiznána úhrada a není standardně hrazen z prostředků veřejného zdravotního pojištění. Tímto není vyloučena možnost aplikace ustanovení § 16 zákona o veřejném zdravotním pojištění [20].
Závěr
Pokročilé a recidivující karcinomy endometria mají přes veškerou dostupnou dosavadní léčbu nepříznivou prognózu. Zařazení detekce molekulárních subtypů karcinomu endometria do běžného testování v případě pacientek s deficientní opravou chybného párování bazí či s vysokou mikrosatelitovou nestabilitou přináší velkou naději na zlepšení kvality života a prodloužení délky přežití díky využití monoklonálních protilátek proti PD‑1. V současné době stále probíhají studie. Je nutné si ale i uvědomit, že zasahováním do dráhy PD‑1/PD‑L1 se odstraňuje zásadní inhibiční odpověď imunitního systému, která může vést k závažným imunitně zprostředkovaným nepříznivým nežádoucím účinkům. Tyto reakce se mohou objevit v jakémkoliv orgánovém systému a kdykoliv po zahájení léčby. Pacienti užívající dostarlimab by měli být pečlivě sledováni z hlediska známek základní imunitně zprostředkované reakce a v případě podezření na ně by měli být okamžitě vyšetřeni a léčeni.
Literatura
[1] Costa B, Vale N. Dostarlimab: A Review. Biomolecules 2022; 12: 1031.
[2] Green AK, Feinberg J, Makker V. A Review of Immune Checkpoint Blocade Therapy in Endometrial Cancer. Am Soc Clin Oncol Educ Book 2020; 40: 1–7.
[3] Giannone G, Castaldo D, Tuninetti V, et al. Management of Metastatic Endometrial Cancer: Physicians’ Choices Beyond the First Line. A MITO Survey. Front Oncol 2022; 12: 880008.
[4] Rüschoff J, Baretton G, Bläker H, et al. MSI Testing: What’s New? What Should Be Considered? Pathologe 2021; 42: 110–118.
[5] Le DT, Durham JN, Smith KN, et al. Mismatch Repair Deficiency Predicts Response of Solid Tumors to PD‑1 Blockade. Science 2017; 357: 409–413.
[6] Souhrn údajů o přípravku Jemperli. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/jemperli‑epar‑product‑information_en.pdf
[7] https://www.linkos.cz/lekar‑a‑multidisciplinarni‑tym/personalizovana‑onkologie/modra‑kniha‑cos/aktualni‑vydani‑modre‑knihy/29‑16‑zhoubny‑novotvar‑tela‑delozniho‑c54/
[8] EMA/134553/2021; EMEA/H/C/005204. Dostupné na: https://www.ema.
europa.eu/en/documents/overview/jemperli‑epar‑medicine‑overview_cs.pdf
[9] Příbalová informace: informace pro pacientku. JEMPERLI 500 mg koncentrát pro infuzní roztok. Dostupné na: https://www.gskkompendium.cz/pil‑jemperli‑500mg
[10] Singh V, Sheikh A, Abourehab MAS, Kesharwani P. Dostarlimab as a Miracle Drug: Rising Hope against Cancer Treatment. Biosensors 2022; 12: 617.
[11] Yu X, Gao R, Li Y, Zeng C. Regulation of PD‑1 i T cells for cancer immunotherapy. Eur J Pharmacol 2020; 881: 173240.
[12] Kumar S, Ghosh S, Sharma G, et al. Preclinical characterization of dostarlimab, a therapeutic anti‑PD‑1 antibody with potent activity to enhance immune function in in vitro cellular assays and in vivo animal models. MAbs 2021; 13: 1954136.
[13] Bowers PM, Neben TY, Tomlinson GL, et al. Humanization of Antibodies Using Heavy Chain Complementarity‑Determining Region 3 Grafting Coupled with in Vitro Somatic Hypermutation. J Biol Chem 2013; 288: 7688–7696.
[14] Park UB, Jeong TJ, Gu N, et al. Molecular Basis of PD‑1 Blockade by Dostarlimab, the FDA‑Approved Antibody for Cancer Immunotherapy. Biochem Biophys Res Commun 2022; 599: 31–37.
[15] Sullivan MR, Ugolini GS, Sarkar S, et al. Quantifying the Efficacy of Checkpoint Inhibitors on CD8+ Cytotoxic T Cells for Immunotherapeutic Applications via Single‑Cell Interaction. Cell Death Dis 2020; 11: 979.
[16] Oaknin A, Gilbert L, Tinker AV, et al. Safety and antitumor activity of dostarlimab in patients with advanced or recurrent DNA mismatch repair deficient/microsatellite instability‑high (dMMR/MSI‑H) or proficient/stable (MMRp/MSS) endometrial cancer: interim results from GARNET – a phase I, single‑arm study. J Immunother Cancer 2022; 10: e003777.
[17] Oaknin A, Tinker V, Gilber L, et al. Clinical Activity and Safety of the Anti‑Programmed Death 1 Monoclonal Antibody Dostarlimab for Patients With Recurrent or Advanced Mismatch Repair‑Deficient Endometrial Cancer: A Nonrandomized Phase 1 Clinical Trial. JAMA Oncol 2020; 6: 1766–1772.
[18] Yi M, Zheng X, Niu M, et al. Combination Strategies with PD‑1/PD‑L1 Blockade: Current Advances and Future Directions. Mol Cancer 2022; 21: 28.
[19] Mirza MR, Chace DM, Slomovitz BM, et al. Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med 2023; 388: 2145–2158.
[20] SÚKL – Souhrn k hodnotící zprávě 16. 1. 2023. Dostupné na: https://www.sukl.cz/leciva/souhrny‑k‑hz‑2023