Eslikarbazepin
Eslikarbazepin acetát (ESL) je nové antiepileptikum stabilizující napěťově řízený sodíkový kanál. Na rozdíl od svých strukturálně příbuzných předchůdců – karbamazepinu a oxkarbazepinu – není ESL metabolizován na 10,11-epoxykarbamazepin, čímž není tolik náchylný k enzymatické indukci či autoindukci a současně má méně nežádoucích účinků. Eslikarbazepin má výhodnou lineární, na dávce závislou farmakokinetiku a relativně nízkou vazbu na plazmatické bílkoviny. Je indikován k přídatné léčbě dospělých pacientů s parciálními záchvaty se sekundární generalizací nebo bez ní. Jeho doporučené dávkování v udržovací léčbě po titraci je 800–1200 mg/den podávaných v jedné denní dávce.
Farmakologická skupina
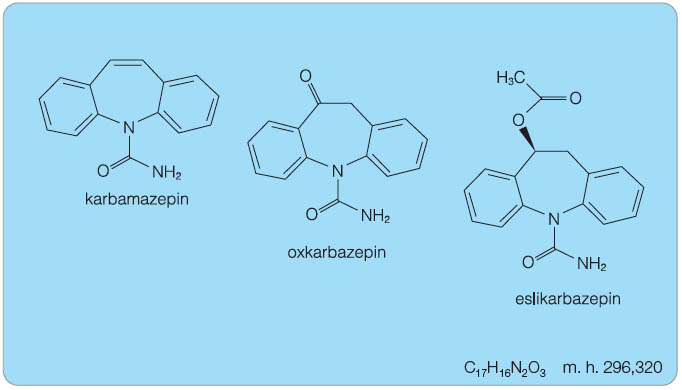 Eslikarbazepin acetát (ESL) patří do farmakologické skupiny antiepileptik. Podobně jako karbamazepin (CBZ) a oxkarbazepin (OXC) je derivátem karboxamidu (obr. 1). ATC kód: N03AF04 [1].
Eslikarbazepin acetát (ESL) patří do farmakologické skupiny antiepileptik. Podobně jako karbamazepin (CBZ) a oxkarbazepin (OXC) je derivátem karboxamidu (obr. 1). ATC kód: N03AF04 [1].
Chemické a fyzikální vlastnosti
Chemicky je eslikarbazepin (S)-10-acet-oxy-10,11-dihydro-5H-dibenz[b,f]azepin-5-karboxamid.
Sumární vzorec: C17H16N2O3
Relativní molekulová hmotnost: 296,320
Mechanismus účinku, farmakodynamika
ESL je nové antiepileptikum z řady blokátorů sodíkových kanálů. Jeho přesné mechanismy účinku však nejsou dosud zcela známy. Elektrofyziologické studie in vitro svědčí pro to, že ESL i jeho metabolity stabilizují inaktivovanou fázi napěťově řízených sodíkových kanálů, brání jejich návratu do aktivované fáze, a redukují tak patologické repetitivní neuronální výboje [2–6]. Byla prokázána jeho funkční selektivita k epileptickým neuronům s rychlými výboji oproti neuronům, které vykazují normální aktivitu [4, 6, 7]. Naopak nebyla prokázána vazba eslikarbazepinu na benzodiazepinové, GABA či glutamátové receptory [2, 3].
Farmakokinetický i farmakodynamický profil ESL stejně jako mechanismus účinku se liší od jiných známých a v praxi často používaných blokátorů sodíkových kanálů. Jeho molekulární odlišnost od CBZ i OXC by měla vést k redukci vzniku toxických metabolitů bez ztráty zásadní farmakologické aktivity.
Farmakokinetické vlastnosti
Po perorálním podání je ESL, nezávisle na jídle, absorbován v gastrointestinálním traktu [8]. Následně je rychle a ve velké míře transformován na svůj hlavní aktivní metabolit eslikarbazepin. Minoritními metabolity ESL jsou R-likarbazepin (5 %) a oxkarbazepin (1 %) [9]. Maximální plazmatické koncentrace eslikarbazepinu je dosaženo za 2–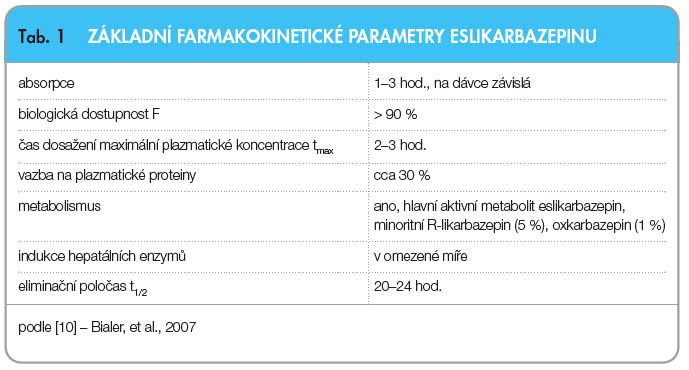 3 hodiny po podání dávky a rovnovážných koncentrací v plazmě je dosaženo za 4–5 dnů při podávání jedenkrát denně (tab. 1). Hlavní metabolickou drahou eslikarbazepinu je glukuronidace. ESL není metabolizován na 10,11-epoxykarbamazepin, čímž není tolik náchylný k enzymatické indukci či autoindukci. ESL není induktorem CYP-450, je možným induktorem CYP3A4 a slabým induktorem UDP-glukuronyltransferáz [10].
3 hodiny po podání dávky a rovnovážných koncentrací v plazmě je dosaženo za 4–5 dnů při podávání jedenkrát denně (tab. 1). Hlavní metabolickou drahou eslikarbazepinu je glukuronidace. ESL není metabolizován na 10,11-epoxykarbamazepin, čímž není tolik náchylný k enzymatické indukci či autoindukci. ESL není induktorem CYP-450, je možným induktorem CYP3A4 a slabým induktorem UDP-glukuronyltransferáz [10].
Eslikarbazepin má výhodnou lineární, na dávce závislou farmakokinetiku, bez vlivu pohlaví či věku. Současně má relativně nízkou, na koncentraci nezávislou vazbu na plazmatické bílkoviny (cca 30 %). Tato vazba nebyla v provedených analýzách významně ovlivněna přítomností warfarinu, diazepamu, digoxinu, fenytoinu a tolbutamidu. Vazba warfarinu, diazepamu, digoxinu, fenytoinu a tolbutamidu nebyla významně ovlivněna přítomností eslikarbazepinu [10].
Metabolity ESL jsou odstraňovány ze systému renální exkrecí, zčásti v nezměněné formě a zčásti ve formě jejich glukuronidového konjugátu. Biologickou dostupnost ESL lze považovat za vysokou, neboť množství jeho metabolitů vyloučených močí odpovídá více než 90 % dávky eslikarbazepin acetátu.
Klinické zkušenosti
Randomizované studie kontrolované placebem
Klinická účinnost a bezpečnost léčby eslikarbazepin acetátem byla před jeho uvedením na trh hodnocena ve třech randomizovaných, dvojitě zaslepených, placebem kontrolovaných multicentrických studiích (RCT) fáze III (BIA-2093-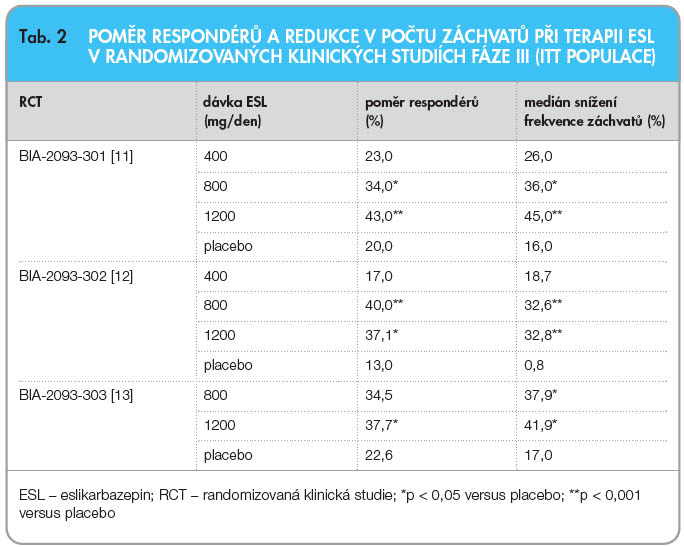 301, BIA-2093-302, BIA-2093-303) [11–14]. Do těchto RCT bylo zařazeno celkem 1049 dospělých pacientů s parciální epilepsií, kteří užívali před vstupem do studie 1–3 antiepileptika a splňovali vstupní kritérium minimální frekvence 4 záchvatů za 4 týdny. Design všech tří studií byl identický – po 8týdenní „baseline“ periodě následovala 2týdenní fáze titrační a po ní 12týdenní fáze s udržovací léčbou (obě zaslepené). Proto bylo možné následně provést souhrnné zpracování dat. Ve dvou RCT byly nezávisle testovány tři cílové dávky ESL – 400 mg/den, 800 mg/den a 1200 mg/den, v jedné studii pak pouze dávky 800 mg/den a 1200 mg/ den. Většina pacientů užívala současně s ESL ještě dvě konkomitantní antiepileptika (64–75 %), k jednomu antiepileptiku byl ESL přidán u 19–34 % pacientů a ke třem antiepileptikům byl přidán u 0,5–8,1 % subjektů. Karbamazepin užívalo současně s ESL 47–69 % pacientů.
301, BIA-2093-302, BIA-2093-303) [11–14]. Do těchto RCT bylo zařazeno celkem 1049 dospělých pacientů s parciální epilepsií, kteří užívali před vstupem do studie 1–3 antiepileptika a splňovali vstupní kritérium minimální frekvence 4 záchvatů za 4 týdny. Design všech tří studií byl identický – po 8týdenní „baseline“ periodě následovala 2týdenní fáze titrační a po ní 12týdenní fáze s udržovací léčbou (obě zaslepené). Proto bylo možné následně provést souhrnné zpracování dat. Ve dvou RCT byly nezávisle testovány tři cílové dávky ESL – 400 mg/den, 800 mg/den a 1200 mg/den, v jedné studii pak pouze dávky 800 mg/den a 1200 mg/ den. Většina pacientů užívala současně s ESL ještě dvě konkomitantní antiepileptika (64–75 %), k jednomu antiepileptiku byl ESL přidán u 19–34 % pacientů a ke třem antiepileptikům byl přidán u 0,5–8,1 % subjektů. Karbamazepin užívalo současně s ESL 47–69 % pacientů.
![Graf 1 Podíl respondérů v souhrnné analýze tří randomizovaných klinických studií s eslikarbazepinem (ESL) v průběhu udržovací fáze (ITT populace); podle [11–13] – Elger, et al., 2009; Ben-Menachem, et al., 2010; Gil-Nagel, et al., 2009.](https://www.remedia.cz/photo-a-28482---.jpg) Výsledky účinnosti léčby eslikarbazepinem v jednotlivých RCT jsou detailně uvedeny v tab. 2. V souhrnné analýze bylo zjištěno 43,5 % respondérů (tj. pacientů, u nichž došlo k ≥ 50% snížení frekvence záchvatů oproti stavu před léčbou) při dávkování ESL 1200 mg/den, 36,3 % při dávkování 800 mg/den, 22,9 % při dávce 400 mg/den a 21,5 % ve skupině pacientů léčených placebem [14]. V porovnání s placebem byla účinnost ESL statisticky signifikantně vyšší při dávce 800 mg/ den (p = 0,0001) a 1200 mg/den (p < 0,0001), viz graf 1.
Výsledky účinnosti léčby eslikarbazepinem v jednotlivých RCT jsou detailně uvedeny v tab. 2. V souhrnné analýze bylo zjištěno 43,5 % respondérů (tj. pacientů, u nichž došlo k ≥ 50% snížení frekvence záchvatů oproti stavu před léčbou) při dávkování ESL 1200 mg/den, 36,3 % při dávkování 800 mg/den, 22,9 % při dávce 400 mg/den a 21,5 % ve skupině pacientů léčených placebem [14]. V porovnání s placebem byla účinnost ESL statisticky signifikantně vyšší při dávce 800 mg/ den (p = 0,0001) a 1200 mg/den (p < 0,0001), viz graf 1.
Obdobně signifikantní rozdíly byly zjištěny při sledování změny ve frekvenci záchvatů v jednotlivých hodnocených skupinách; u pacientů léčených dávkou 1200 mg/den byl medián procentuální redukce v počtu záchvatů 38,8 %, ve skupině léčené dávkou 800 mg/den představoval 35,4 %, ve skupině se 400 mg ESL na den 23,4 % a v placebové skupině byl 14,6 %. Podobně jako při hodnocení podílu respondérů byl i v této analýze prokázán statisticky vysoce signifikantní rozdíl v účinnosti ESL v dávkách 800 mg/den a 1200 mg/den oproti placebu (p < 0,0001).
Otevřené studie
Role prospektivních RCT je v současnosti při stanovení účinnosti jakéhokoli léku zcela nezastupitelná. Jedině tyto mohou poskytnout nezvratitelné důkazy o schopnosti farmaka významně ovlivnit sledované onemocnění. Na druhé straně existuje řada limitací praktických a etických, kvůli nimž jsou RCT zcela nevhodné při studiu dlouhodobého efektu léků. Jednou z poměrně spolehlivých možností ověření dlouhodobé účinnosti sledovaných antiepileptik je pečlivá analýza výsledku otevřených (pokračujících) fází původních RCT.
![Graf 2 Medián procentuální redukce záchvatů v průběhu 12 měsíců léčby (pokračující fáze studií); podle [15–17] – Halasz, et al., 2010; Gabbai, et al., 2008; Lopes-Lima, et al., 2008.](https://www.remedia.cz/photo-a-28483---.jpg) Analýza dat ze tří otevřených pokračujících studií s eslikarbazepinem hodnotila jeho účinnost a bezpečnost celkem u 833 pacientů [15–17]. Po 12 měsících setrvalo v léčbě eslikarbazepinem 612 pacientů (73,5 %). Tento „retention-rate“, tedy procento pacientů léčených po dané období sledovaným lékem, se v jednotlivých studiích pohyboval mezi 68,6 % a 78,5 %. Ve shodě s analýzou stability procentuální redukce záchvatů uvedené
Analýza dat ze tří otevřených pokračujících studií s eslikarbazepinem hodnotila jeho účinnost a bezpečnost celkem u 833 pacientů [15–17]. Po 12 měsících setrvalo v léčbě eslikarbazepinem 612 pacientů (73,5 %). Tento „retention-rate“, tedy procento pacientů léčených po dané období sledovaným lékem, se v jednotlivých studiích pohyboval mezi 68,6 % a 78,5 %. Ve shodě s analýzou stability procentuální redukce záchvatů uvedené ![Graf 3 Průměrné skóre QOLIE-31 před léčbou a na konci jednoho roku léčby nebo v případě předčasného ukončení léčby ESL (ITT populace, n = 255); podle [15] – Halasz, et al., 2010.](https://www.remedia.cz/photo-a-28484---.jpg) výsledky potvrdily setrvalý pozitivní efekt eslikarbazepinu u významné části dlouhodobě léčených pacientů (graf 2). Poměrně vysoký byl v otevřených studiích s ESL podíl pacientů zcela bez záchvatů – v posledním sledovaném období byla remise pozorována u 11–18 % léčených jedinců.
výsledky potvrdily setrvalý pozitivní efekt eslikarbazepinu u významné části dlouhodobě léčených pacientů (graf 2). Poměrně vysoký byl v otevřených studiích s ESL podíl pacientů zcela bez záchvatů – v posledním sledovaném období byla remise pozorována u 11–18 % léčených jedinců.
V detailní analýze dat z otevřené fáze studie BIA-2093-301 byl prokázán statisticky vysoce signifikantní efekt léčby ESL na celkovou kvalitu života léčených jedinců, hodnocenou formou dotazníku QOLIE-31 (p < 0,0001), viz graf 3 [15]. Z klinického hlediska je nadějné prokázané signifikantní zlepšení depresivních symptomů po 12 měsících léčby eslikarbazepinem u pacientů, kteří před zahájením léčby trpěli mírnou až těžkou depresivní symptomatologií; hodnoceno škálou MADRS, souhrnná analýza dat z otevřené pokračující fáze všech tří RCT (p < 0,0001) [18]. Medián dávky v otevřených pokračujících studiích byl 800 mg/den.
Zařazení do současné palety léčiv
Medikamentózní léčba epilepsie se vyznačuje poměrně vysokou účinností. Iniciální monoterapie lékem první volby vede ke kompletnímu vymizení záchvatů téměř u poloviny pacientů. V případě přetrvávajících záchvatů pak záměna původního antiepileptika za jiné (opět v monoterapii) vede k remisi u dalších cca 13 % léčených jedinců [19].
Pokud ani tento krok nepostačuje k vymizení záchvatů, pak je doporučováno zahájení kombinované farmakoterapie přidáním druhého antiepileptika ke stávajícímu léku v tzv. přídatné (či add-on) terapii. Protože se k tomuto postupu uchylujeme u pacientů více či méně rezistentních již na dvě antiepileptika, je vcelku logicky úspěšnost add-on terapie nižší. Přesto je možné u významné části pacientů správně vedenou add-on terapií dosáhnout velmi dobré kontroly onemocnění a zajistit tak maximální možnou kvalitu jejich života.
V add-on terapii se v současnosti standardně používají tzv. nová antiepileptika. Těch je na trhu celá řada, přičemž se jednotlivé preparáty navzájem liší svými mechanismy účinku, indikacemi a nežádoucími účinky. Zatímco většina nových léčiv se zaměřuje na nové molekulární cíle, ESL navazuje na desetiletími ověřenou vysokou účinnost karbamazepinu. CBZ je i po téměř půlstoletí svého působení na trhu stále jedním z nejúčinnějších antiepileptik, lékem první volby ve většině rozvinutých zemí, a některými epileptology je dokonce považován za nezbytný lék k potvrzení farmakorezistence u konkrétního pacienta. Současně je však CBZ, a v menší míře i OXC, zatížen významným výskytem nežádoucích účinků (především charakteru ospalosti, závratí, dvojitého vidění, hyponatremie, rashe apod.), které jsou většinou spojovány s jeho aktivním metabolitem 10,11-epoxykarbamazepinem. Podobně v praxi nepříznivý je vysoký potenciál karbamazepinu k farmakokinetickým interakcím s jinými antiepileptiky i jinými léky, související především s jeho schopností indukovat izoenzymy cytochromu P-450.
Ambicí vědců, kteří se podíleli na vývoji eslikarbazepinu, bylo zachovat excelentní antikonvulzivní efekt karbamazepinu a současně se vyhnout jeho zmíněným nevýhodám. V takovém případě může ESL znamenat nejen další rozšíření terapeutického armamentária, ale především novou naději pro zhruba třetinu pacientů s epilepsií, kteří jsou rezistentní na většinu v současnosti používaných antiepileptik. Zvláště přínosný může být ESL pro ty pacienty, kteří mohou mít nebo již mají přínos z protizáchvatového efektu karbamazepinu, avšak u nichž brání dosažení maximální účinnosti jeho špatná snášenlivost či nepříznivé farmakokinetické interakce.
Indikace
Eslikarbazepin je indikován k přídatné léčbě dospělých pacientů s parciálními záchvaty (se sekundární generalizací i bez ní).
Kontraindikace
Hypersenzitivita na léčivou látku, jiné deriváty karboxamidu (např. karbamazepin, oxkarbazepin) nebo na kteroukoli pomocnou látku. Známý atrioventrikulární (AV) blok druhého nebo třetího stupně.
Nežádoucí účinky
Dle provedených analýz sdružených dat z pivotních studií má ESL příznivý profil snášenlivosti. Méně než 5 % pacientů léčených eslikarbazepinem ukončilo léčbu pro nežádoucí účinky v titrační fázi. Během celé studie ukončilo léčbu pro nežádoucí účinky související s eslikarbazepinem 13,7 % pacientů.
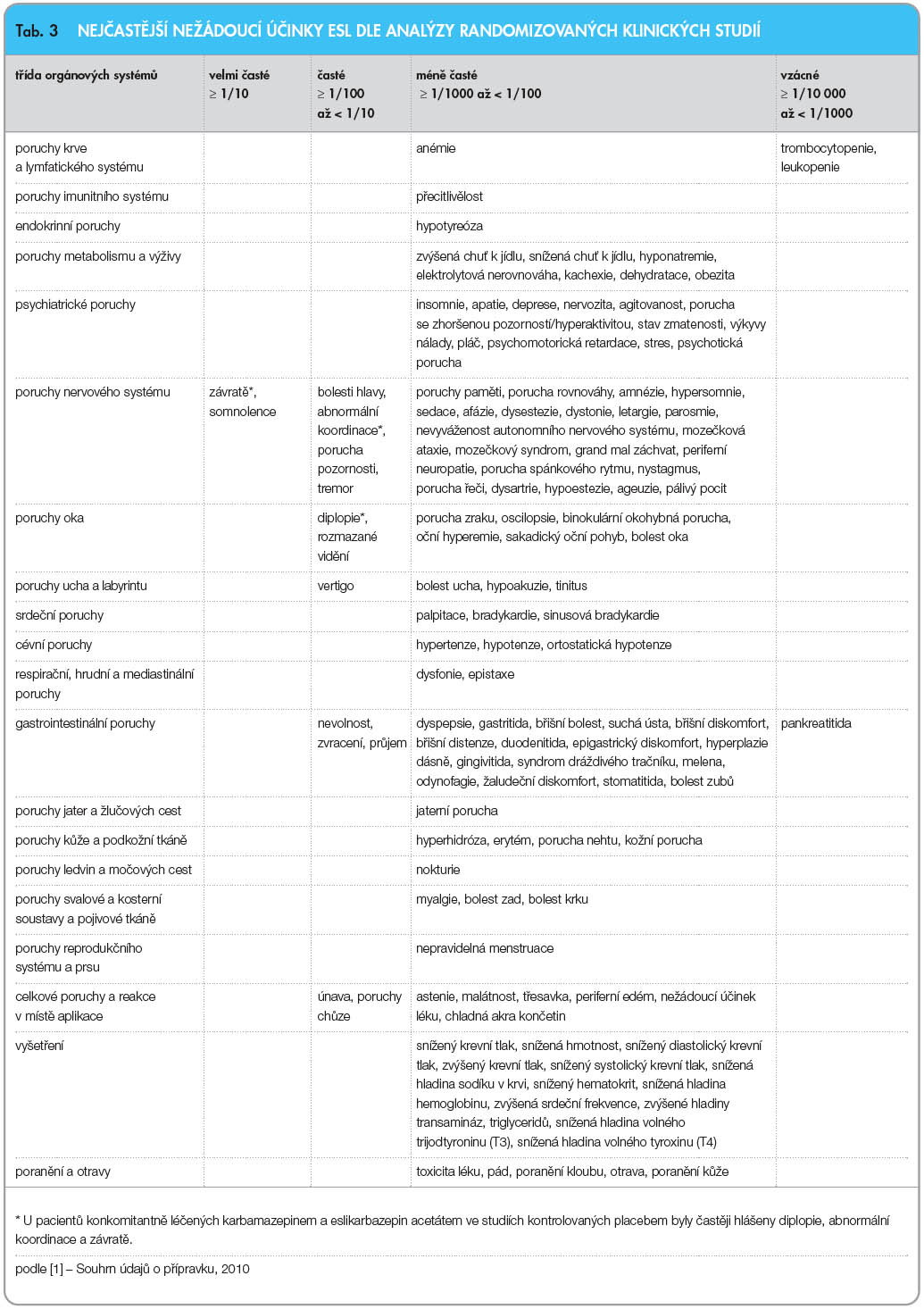 V randomizovaných klinických studiích byla většina nežádoucích účinků souvisejících s léčbou mírná nebo střední. Nejčastěji se vyskytovaly závratě, ospalost, bolesti hlavy, diplopie, rozmazané vidění, poruchy koordinace, tremor, poruchy chůze a nevolnost. V tab. 3 jsou uvedeny všechny nežádoucí účinky, které se objevily ve studiích s větší četností než při podávání placeba a vyskytly se u více než jednoho pacienta. Při podávání ESL bylo zjištěno prodloužení PR intervalu; u léčených pacientů se mohou vyskytnout nežádoucí účinky s tím spojené – AV blok, synkopa, bradykardie.
V randomizovaných klinických studiích byla většina nežádoucích účinků souvisejících s léčbou mírná nebo střední. Nejčastěji se vyskytovaly závratě, ospalost, bolesti hlavy, diplopie, rozmazané vidění, poruchy koordinace, tremor, poruchy chůze a nevolnost. V tab. 3 jsou uvedeny všechny nežádoucí účinky, které se objevily ve studiích s větší četností než při podávání placeba a vyskytly se u více než jednoho pacienta. Při podávání ESL bylo zjištěno prodloužení PR intervalu; u léčených pacientů se mohou vyskytnout nežádoucí účinky s tím spojené – AV blok, synkopa, bradykardie.
Nebyla pozorována hyponatremie, významnější změny hmotnosti, anafylaktické reakce, těžké kožní reakce, těžké srdeční arytmie či útlum kostní dřeně.
Lékové interakce
Eslikarbazepin má obecně nízký sklon k interakcím s nejčastěji používanými antiepileptiky. Nicméně pro svůj (in vitro zjištěný) potenciál slabě indukovat CYP3A4 a UDP-glukuronyltransferázu může mít ESL indukční účinek na metabolismus léčiv, jejichž hlavním způsobem odbourávání je metabolizace CYP3A4 nebo konjugace pomocí UDP-glukuronyltransferáz.
Ve studii na zdravých subjektech mělo konkomitantní podávání ESL v dávce 1200 mg jedenkrát denně a fenytoinu za následek snížení expozice aktivnímu metabolitu, eslikarbazepinu, průměrně o 31–33 % a zvýšení expozice fenytoinu průměrně o 31–35 % [20]. Na základě individuální odpovědi může být tedy vhodné zvýšení dávky ESL a snížení dávky fenytoinu při jejich současném podávání.
Dále byly provedeny dvě studie in vivo zaměřené na interakce ESL s novějšími antiepileptiky. V první z nich, otevřené studii se zdravými dospělými dobrovolníky a vícečetnými dávkami podávanými jednou denně, byla studována interakce ESL a topiramátu, ve druhé, obdobně designované studii pak interakce ESL a lamotriginu [21, 22]. Výsledky neprokázaly signifikantní farmakokinetické interakce mezi studovanými antiepileptiky (byl pozorován pouze 18% pokles expozice topiramátu a 15% pokles expozice lamotriginu). Na základě uvedených výsledků se nezdá být nutné upravovat dávkování při uvedených kombinacích léčiv.
V randomizovaných klinických studiích fáze III konkomitantní léčba karbamazepinem významně zvyšovala výskyt některých nežádoucích účinků (diplopie, poruchy koordinace a závratě) a následná analýza populační farmakokinetiky naznačila karbamazepinem navozené zvýšení clearance eslikarbazepinu a vice versa [14].
Konkomitantní podávání ESL s valproátem nebo levetiracetamem se nezdálo ovlivňovat expozici eslikarbazepinu, ale nebylo ověřeno klasickými studiemi interakce. Z důvodu předpokládaných nepříznivých farmakodynamických interakcí se nedoporučuje kombinovaná léčba ESL a OXC.
ESL může snižovat účinnost hormonálních kontraceptiv. Při podávání ESL v dávce 1200 mg/den ženám užívajícím kombinovanou perorální antikoncepci bylo prokázáno snížení systémové expozice levonorgestrelu o 37 % a ethinylestradiolu o 42 %. Nebyly zjištěny signifikantní farmakokinetické interakce mezi ESL a warfarinem, přesto je třeba věnovat zvýšenou pozornost monitorování INR během prvních týdnů po zahájení nebo ukončení konkomitantní léčby ESL s warfarinem. Nebyl prokázán účinek ESL na farmakokinetiku digoxinu. Na základě strukturálního vztahu mezi ESL a tricyklickými antidepresivy je však možná interakce mezi ESL a inhibitory monoaminooxidázy [1, 7, 10, 23, 24].
Těhotenství a kojení
Údaje o podávání ESL těhotným ženám nejsou k dispozici. Pokud ženy užívající eslikarbazepin acetát otěhotní nebo plánují otěhotnět, je nutné jeho podávání důkladně přehodnotit.
Není známo, zda je u člověka ESL vylučován do mateřského mléka. Studie na zvířatech vylučování eslikarbazepinu však zjistily. Vzhledem k tomu, že riziko pro kojené dítě nelze vyloučit, mělo by být kojení u žen s ESL přerušeno [1].
Ovlivnění pozornosti
Poruchy pozornosti patří mezi poměrně časté nežádoucí účinky ESL, zejména při zahájení léčby (četnost jejich výskytu byla v klinických studiích ≥ 1/100 až < 1/10). Relevantní studie hodnotící schopnost řídit nebo obsluhovat stroje po podání ESL však nebyly provedeny. Vzhledem k možnému výskytu nežádoucích účinků ESL s vlivem na řízení a obsluhu strojů (poruchy pozornosti, dvojité či rozmazané vidění, závratě apod.) je nutné pacienta před zahájením léčby na případná rizika upozornit.
Dávkování
ESL musí být přidán ke stávající antiepileptické medikaci.
Doporučené dávkování je 400–1200 mg/ den podávaných v jedné denní dávce. Léčba se zahajuje dávkou 400 mg/den, po 1–2 týdnech je nutné zvýšit dávku na 800 mg/den. Na základě individuální odpovědi je dále možné zvýšit dávku ESL na 1200 mg/den jedenkrát denně.
U pacientů s renálním postižením je nutné dávkování ESL upravit podle clearance následujícím způsobem: Clcr > 60 ml/ min – úprava dávkování není nutná; Clcr 30–60 ml/min – počáteční dávka 400 mg jednou za dva dny po dobu dvou týdnů a poté jednou denně dávka 400 mg. Na základě individuální odpovědi může být dávka ještě zvýšena. Je-li Clcr < 30 ml/min, podávání ESL se nedoporučuje.
U pacientů s mírným až středním postižením jater není nutná úprava dávkování, u pacientů s těžkým hepatálním postižením se podávání ESL nedoporučuje [1].
Seznam použité literatury
- [1] SPC. Souhrn údajů o přípravku. Zebinix (eslicarbazepine acetate), Eisai, 15. 12. 2010.
- [2] Ambrosio AF, Silva AP, Araujo I, et al. Neuro-toxic/neuroprotective profile of carbamazepine, oxcarbazepine and two new putative antiepileptic drugs, BIA 2-093 and BIA 2-024. Eur J Pharmacol 2000; 406: 191–201.
- [3] Ambrosio AF, Silva AP, Malva JO, et al. Inhibition of glutamate release by BIA 2-093 and BIA 2-024, two novel derivatives of carbamazepine, due to blockade of sodium but not calcium channels. Biochem Pharmacol 2001; 61: 1271–1275.
- [4] Bonifácio MJ, Sheridan RD, Parada A, et al. Interaction of the novel anticonvulsant, BIA 2-093, with voltage-gated sodium channels: comparison with carbamazepine. Epilepsia 2001; 42: 600–608.
- [5] Parada A, Soares-da-Silva P. The novel anticonvulsant BIA 2-093 inhibits transmitter release during opening of voltage-gated sodium channels: a comparison with carbamazepine and oxcarbazepine. Neurochem Int 2002; 40: 435–440.
- [6] Almeida L, Soares-da-Silva P. Eslicarbazepine acetate (BIA 2-093). Neurotherapeutics 2007; 4: 88–96.
- [7] Rauchenzauner M, Luef G. Update on treatment of partial onset epilepsy: role of eslicarbazepine. Neuropsychiatric Disease and Treatment 2010; 6: 723–730.
- [8] Maia J, Vaz-da-Silva M, Almeida L, et al. Effect of food on the pharmacokinetic profile of eslicarbazepine acetate (BIA 2-093). Drugs R D 2005; 6: 201–206.
- [9] Alves G, Figueiredo I, Castel-Branco M, et al. Enantioselective HPLC-UV method for determination of eslicarbazepine acetate (BIA 2-093) and its metabolites in human plasma. Biomed Chromatogr 2007; 21: 1127–1134.
- [10] Bialer M, Johannessen SI, Kupferberg HJ, et al. Progress report on new antiepileptic drugs: a summary of the Eigth Eilat Conference (EILAT VIII). Epilepsy Res 2007; 73: 1–52.
- [11] Elger C, Halasz P, Maia J, et al. Efficacy and safety of eslicarbazepine acetate as adjunctive treatment in adults with refractory partial-onset seizures: A randomized, double-blind, placebo-controlled, parallel-group Phase III study. Epilepsia 2009; 50: 454–463.
- [12] Ben-Menachem E, Gabbai AA, Hufnagel A, et al. Eslicarbazepine acetate as adjunctive therapy in adult patients with partial epilepsy. Epilepsy Res 2010; 89: 278–285.
- [13] Gil-Nagel A, Lopes-Lima J, Almeida L, et al. Efficacy and safety of 800 and 1200 mg eslicarbazepine acetate as adjunctive treatment in adults with refractory partial-onset seizures. Acta Neurol Scand 2009; 120: 281–287.
- [14] Elger C, French J, Halász P, et al. Evaluation of eslicarbazepine acetate as add-on treatment in patients with partial-onset seizures: Pooled analysis of three double-blind phase III clinical studies. American Epilepsy Society 62nd Annual Meeting 2008, Seattle, WA. Epilepsia 2008; 49 (Suppl. 7): 1–498.
- [15] Halasz P, Cramer JA, Hodoba D, et al. Long-term efficacy and safety of eslicarbazepine acetate: Results of a 1-year open-label extension study in partial-onset seizures in adults with epilepsy. Epilepsia 2010; 51: 1963–1969.
- [16] Gabbai AA, Ben Menachem E, Maia J, et al. Long-term treatment of partial epilepsy with eslicarbazepine acetate (ESL): results of a one-year open-label extension of study BIA-2093-302. Poster presented at 62nd American Epilepsy Society Meeting, Seattle, 5-9 December 2008.
- [17] Lopes-Lima J, Gil-Nagel A, Maia J, et al. Long-term treatment of partial epilepsy with eslicarbazepine acetate (ESL): results of a one-year open-label extension of study BIA-2093-303. Poster presented at 62nd American Epilepsy Society Meeting, Seattle, 5-9 December 2008.
- [18] Cramer J, Hodoba D, Ben-Menachem E, et al. Depressive symptoms improve with 1-year eslicarbazepine acetate treatment: A pooled analysis of three open-label extensions of phase III studies in patients with partial-onset seizures. Poster presented at 9th European Congress on Epileptology, Rhodes, Greece, June 27th–July 1st 2010.
- [19] Kwan P, Brodie MJ. Early identification of refractory epilepsy. N Engl J Med 2000; 342: 314–319.
- [20] Johannessen Landmark C, Patsalos PN. Drug interactions involving the new second- and third-generation antiepileptic drugs. Expert Review of Neurotherapeutics 2010; 10: 119–140.
- [21] Nunes T, Sicard E, Almeida L, et al. Pharmacokinetic interaction study between eslicarbazepine acetate and topiramate in healthy subjects. Curr Med Res Opin 2010; 26: 1355–1362.
- [22] Almeida L, Nunes T, Sicard E, et al. Pharmacokinetic interaction study between eslicarbazepine acetate and lamotrigine in healthy subjects. Acta Neurol Scand 2010; 121: 257–264.
- [23] Vaz-da-Silva M, Almeida L, Falcao A, et al. Effect of eslicarbazepine acetate on the steady-state pharmacokinetics and pharmacodynamics of warfarin in healthy subjects during a three-stage, open-label, multiple-dose, single-period study. Clin Ther 2010; 32: 179–192.
- [24] Fontes-Ribeiro C, Macedo T, Nunes T, et al. Dosage form proportionality and food effect of the final tablet formulation of eslicarbazepine acetate: Randomized, open-label, crossover, single-centre study in healthy volunteers. Drugs R D 2008; 9: 447–454.