Fingolimod
Fingolimod je první perorální lék pro léčbu remitentní roztroušené sklerózy. Jde o první modulátor sfingosin-1-fosfátového (S1P) receptoru, který se váže na S1P receptor na lymfocytech a cestou snížení jeho exprese brání lymfocytům opustit lymfatickou tkáň a dostat se do cirkulace. Tím je redukována infiltrace centrálního nervového systému autoagresivními lymfocyty. Dvě velké klinické studie fáze III prokázaly vyšší efektivitu dvou dávek fingolimodu jak ve srovnání s placebem, tak i ve srovnání se standardní léčbou interferonem beta-1a. Mezi nežádoucí účinky patří přechodná bradykardie při zahájení léčby, proto je doporučeno monitorování srdeční frekvence a krevního tlaku po dobu 6 hodin po podání první dávky. Během léčby je třeba věnovat pozornost infekcím, jaterním funkcím a oftalmologickým změnám.
Farmakologická skupina
Fingolimod je selektivní imunosupresivum (dle SPC), ATC kód: L04AA27, nicméně mluvíme o něm jako o imunomodulátoru s potenciálně imunosupresivními vlastnostmi. Není cytotoxický a většina komponent imunitní odpovědi zůstává po dobu léčby nedotčena (aktivace, proliferace a efektorové funkce T buněk a B buněk). Paměťová imunitní odpověď v periferních tkáních a orgánech závislá na lokálních periferních efektorových T lymfocytech není inhibována, protože tyto buňky nerecirkulují skrze lymfatické uzliny, a proto nejsou zadrženy fingolimodem. Fingolimod neinhibuje humorální imunitu k systémovým virovým infekcím a netlumí vývoj virus-specifických cytotoxických T buněk v lymfatických uzlinách. Nicméně, schopnost zvýšeného počtu aktivovaných efektorových lymfocytů vrátit se z uzlin do místa infekce je fingolimodem snížena, čímž je imunitní odpověď závislá na těchto buňkách oslabena. Tím je možné vysvětlit zvýšenou incidenci infekcí, jako jsou infekce dolních cest dýchacích a kožní infekce pozorované ve studii fáze II při podávání dávek 1,25 mg a 5 mg. Vyšší incidence periferních infekcí již nebyla pozorována ve studiích fáze III s dávkami 0,5 mg a 1,25 mg.
Chemické a fyzikální vlastnosti
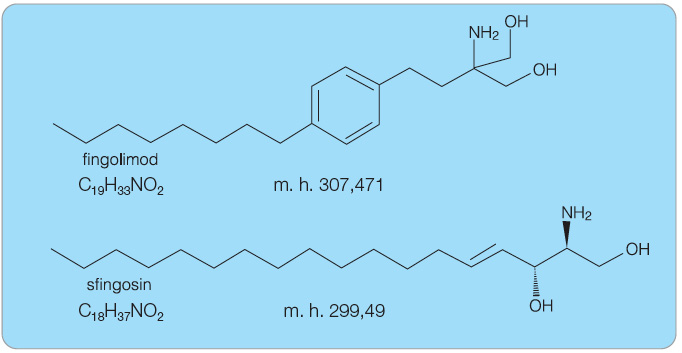 Perorální fingolimod (FTY720) je strukturální analog přirozeného sfingosinu a je fosforylován sfingosin kinázou-2 na biologicky aktivní fingolimod fosfát, strukturálně téměř totožný se sfingosin-1-fosfátem, který se váže na sfingosin-1-fosfátové receptory. Chemicky se jedná o 2-amino-2-[2-(4-octylfenyl)ethyl]propan-1,3-diol, viz obr. 1. Fingolimod je bílý až bíle krystalický prášek volně rozpustný ve vodě.
Perorální fingolimod (FTY720) je strukturální analog přirozeného sfingosinu a je fosforylován sfingosin kinázou-2 na biologicky aktivní fingolimod fosfát, strukturálně téměř totožný se sfingosin-1-fosfátem, který se váže na sfingosin-1-fosfátové receptory. Chemicky se jedná o 2-amino-2-[2-(4-octylfenyl)ethyl]propan-1,3-diol, viz obr. 1. Fingolimod je bílý až bíle krystalický prášek volně rozpustný ve vodě.
Sumární vzorec: C19H33NO2
Relativní molekulová hmotnost: 307,471
Mechanismus účinku, farmakodynamika
Perorální fingolimod má unikátní mechanismus účinku, moduluje sfingosin-1-fosfátové (S1P) receptory na lymfocytech a nervových buňkách.
![Obr. 2 Mechanismus účinku fingolimodu: A) vstup lymfocytů do lymfatických uzlin a zpět do cirkulace; B) ovlivnění migrace lymfocytů lymfatickými uzlinami fingolimodem; podle [3, 4] – Brinkmann, et al., 2002; Brinkmann, et al., 2004.](https://www.remedia.cz/photo-a-28539---.jpg) S1P byl původně považován pouze za meziprodukt metabolismu. Nicméně studie před 20 lety identifikovaly specifické G-proteinové (G protein-coupled) receptory pro S1P (S1P1-5), které jsou spojeny s odlišnými a překrývajícími se signálními kaskádami a účastní se několika biologických procesů včetně recirkulace lymfocytů, neurogeneze, funkcí nervových buněk, endoteliálních buněk, vazoregulace a embryonálního vývoje kardiovaskulárního a nervového systému [1, 2].
S1P byl původně považován pouze za meziprodukt metabolismu. Nicméně studie před 20 lety identifikovaly specifické G-proteinové (G protein-coupled) receptory pro S1P (S1P1-5), které jsou spojeny s odlišnými a překrývajícími se signálními kaskádami a účastní se několika biologických procesů včetně recirkulace lymfocytů, neurogeneze, funkcí nervových buněk, endoteliálních buněk, vazoregulace a embryonálního vývoje kardiovaskulárního a nervového systému [1, 2].
Fingolimod se váže na S1P1 na lymfocytech, čímž internalizuje a degraduje receptor S1P1 a působí tak jako funkční antagonista, viz obr. 2 a 3 [3–7].
![Obr. 3 Fingolimod zadržuje v lymfatických uzlinách pouze lymfocyty, které migrují přes lymfatické orgány; podle [5–7] – Westermann, Pabst, 1992; Mehling, et al., 2008; Mehling, et al., 2008.](https://www.remedia.cz/photo-a-28540---.jpg) Perorální fingolimod zabraňuje vycestování lymfocytů z lymfatických uzlin. Jsou zadrženy pouze lymfocyty, které pravidelně cestují (cirkulují) skrze lymfatické orgány, a to včetně prozánětlivých Th17 lymfocytů, které jsou zapojeny do patogeneze roztroušené sklerózy (RS). Fingolimod neovlivňuje periferní efektorové paměťové T lymfocyty, protože tyto nerecirkulují skrz lymfatické uzliny [6, 7].
Perorální fingolimod zabraňuje vycestování lymfocytů z lymfatických uzlin. Jsou zadrženy pouze lymfocyty, které pravidelně cestují (cirkulují) skrze lymfatické orgány, a to včetně prozánětlivých Th17 lymfocytů, které jsou zapojeny do patogeneze roztroušené sklerózy (RS). Fingolimod neovlivňuje periferní efektorové paměťové T lymfocyty, protože tyto nerecirkulují skrz lymfatické uzliny [6, 7].
V imunitním systému S1P1 působí vycestování lymfocytů z lymfatické uzliny překonáním retenčního signálu zprostředkovaného CCR7, který je exprimován naivními a centrálně paměťovými lymfocyty T a B (efektorové paměťové T lymfocyty jej neexprimují) [8–10]. Fingolimod tak vede k redistribuci, nikoli k depleci lymfocytů, periferní hladiny cirkulujících naivních a centrálně paměťových T lymfocytů klesají relativně k periferně cirkulujícím efektorovým paměťovým T lymfocytům. Redistribuce lymfocytů snižuje infiltraci centrálního nervového systému (CNS) autoreaktivními lymfocyty.
Specifická retence centrálně paměťových T lymfocytů je považována za klíčový mechanismus terapeutického efektu fingolimodu. Autoimunitní děje v CNS u RS jsou zprostředkovány patogenními T lymfocyty a B lymfocyty. Expozice T lymfocytů autoantigenu nastává v lymfatických uzlinách, a proto je migrace těchto buněk nebo jejich prekurzorů z uzlin do CNS rozhodujícím krokem v imunopatogenezi RS [11]. Prozánětlivé Th17 lymfocyty, klíčový mediátor zánětu u RS, primárně patří k poolu centrálně paměťových T lymfocytů. Jsou bohatě zastoupeny v likvoru. Spolu se snížením počtu těchto lymfocytů u pacientů léčených fingolimodem je také významně snížen počet Th17 lymfocytů ve srovnání s pacienty léčenými interferonem beta [12–15].
Fingolimod překračuje hematoencefalickou bariéru a výsledkem je i biologicky aktivní koncentrace v CNS. Je pravděpodobné, že fingolimod interaguje přímo s receptory pro S1P na neuronech, oligodendrocytech, astrocytech a jejich progenitorech. V modelu autoimunitní encefalomyelitidy na hlodavcích prokázal fingolimod jak terapeutický, tak profylaktický efekt, docílil nejen potlačení zánětu, ale i ochrany integrity hematoencefalické bariéry a indukce strukturální a funkční obnovy parenchymu CNS [16–19].
Redistribuce lymfocytů způsobená fingolimodem není spojena se změnou jejich funkcí. Produkce cytokinů T lymfocyty není postižena. Navíc paměťové efektorové T lymfocyty jsou stále přítomny v cirkulaci a zůstávají funkční [6]. Jsou zodpovědné za imunitní dohled v periferních tkáních. To, že jsou ušetřeny a je zachována jejich funkční kapacita, zajišťuje imunitní odpověď v periferii i u pacientů léčených fingolimodem [1, 6, 8, 9, 12, 20–22].
Modulační účinek na lymfocytární receptory S1P1 je plně reverzibilní a po přerušení léčby dochází k návratu exprese receptorů S1P1. Během 4–6 hodin po prvním podání fingolimodu v dávce 0,5 mg klesá počet lymfocytů přibližně na 75 % výchozích hodnot v periferní krvi. Při pokračování v této denní dávce počet lymfocytů dále klesá až na 30 % výchozích hodnot po 2 týdnech léčby. Poté zůstává jejich počet stabilní s minimálním rozptylem. Po přerušení léčby dochází během dnů ke zvýšení počtu lymfocytů v periferii a typicky se vrací k normálním hodnotám během 1–2 měsíců.
Farmakokinetické vlastnosti
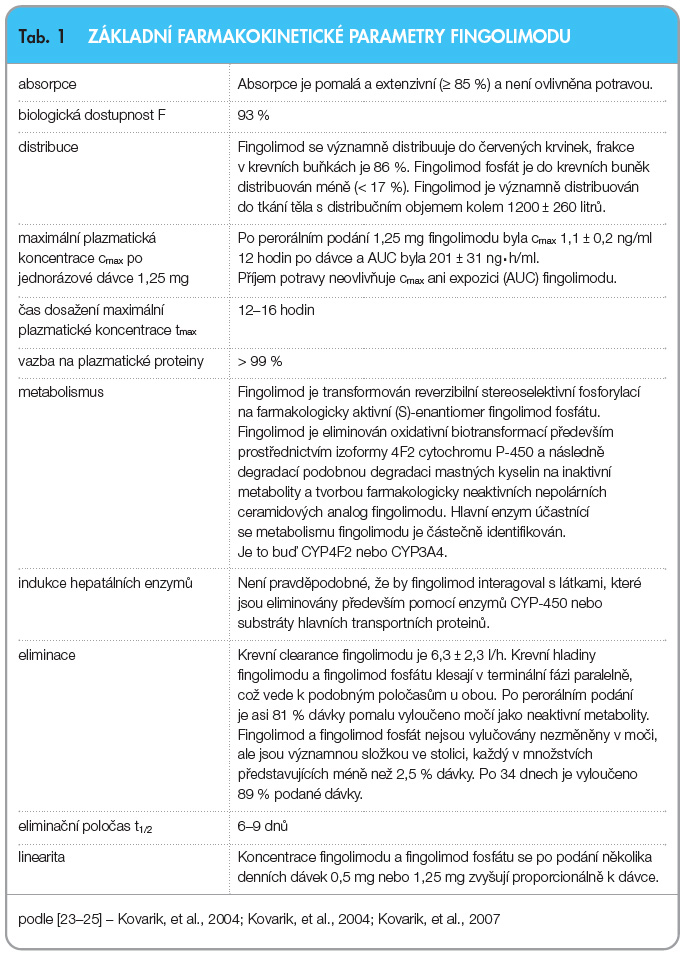
Základní farmakokinetické vlastnosti fingolimodu jsou shrnuty v tab. 1 [23–25]. Farmakologicky aktivním metabolitem zodpovědným za účinnost je fingolimod fosfát.
Klinické zkušenosti
 Druhá fáze klinického zkoušení byla zahájena v roce 2003 jako mezinárodní multicentrická šestiměsíční studie, v níž bylo 281 pacientů randomizováno do tří ramen s léčbou 5 mg fingolimodu jednou denně, 1,25 mg fingolimodu jednou denně nebo placebem. Primárním cílem studie byl počet gadolinium vychytávajících lézí na T1 vážených obrazech MR prováděných jednou měsíčně. Věk pacientů ve studii byl přibližně 38 let, 70 % zařazených pacientů tvořily ženy, doba trvání RS byla 8,5 roku, jejich průměrné EDSS bylo kolem 2,6. Studii ukončilo 255 pacientů, bylo dosaženo primárního cíle (kumulativní počet gadolinium vychytávajících lézí byl 14,8 u skupiny léčené placebem, 8,4 u skupiny léčené fingolimodem 1,25 mg a 5,7 u skupiny s fingolimodem 5 mg) a významně vyšší procento pacientů léčených fingolimodem nemělo žádnou novou gadolinium enhancující lézi (77–82 %) oproti placebu (47 %; p < 0,001). Celkem 250 pacientů pokračovalo ve 30měsíční extenzi studie zaměřené na ověření účinnosti a bezpečnosti léčby. Pacienti původně léčení placebem byli randomizováni k podávání jedné z dávek fingolimodu (1,25 mg nebo 5 mg). Během 15.–24. měsíce byli na doporučení nezávislého Výboru pro monitorování bezpečnosti všichni pacienti převedeni na podávání dávky 1,25 mg, protože vyšší dávka nepřinášela vyšší efekt, ale bylo s ní spojeno více vedlejších účinků. Poslední pacient ukončil 36. měsíc podávání terapie v dubnu 2007. Extenze potvrdila efekt léčby, roční počet relapsů byl u skupiny od počátku léčené fingolimodem 0,2 (u placebové skupiny v prvních 6 měsících studie 0,77). Počet gadolinium enhancujících lézí u pacientů léčených od počátku fingolimodem byl na počátku studie 3,2, po 6 měsících 1,4 a po 3 letech studie 0,2 [26, 27].
Druhá fáze klinického zkoušení byla zahájena v roce 2003 jako mezinárodní multicentrická šestiměsíční studie, v níž bylo 281 pacientů randomizováno do tří ramen s léčbou 5 mg fingolimodu jednou denně, 1,25 mg fingolimodu jednou denně nebo placebem. Primárním cílem studie byl počet gadolinium vychytávajících lézí na T1 vážených obrazech MR prováděných jednou měsíčně. Věk pacientů ve studii byl přibližně 38 let, 70 % zařazených pacientů tvořily ženy, doba trvání RS byla 8,5 roku, jejich průměrné EDSS bylo kolem 2,6. Studii ukončilo 255 pacientů, bylo dosaženo primárního cíle (kumulativní počet gadolinium vychytávajících lézí byl 14,8 u skupiny léčené placebem, 8,4 u skupiny léčené fingolimodem 1,25 mg a 5,7 u skupiny s fingolimodem 5 mg) a významně vyšší procento pacientů léčených fingolimodem nemělo žádnou novou gadolinium enhancující lézi (77–82 %) oproti placebu (47 %; p < 0,001). Celkem 250 pacientů pokračovalo ve 30měsíční extenzi studie zaměřené na ověření účinnosti a bezpečnosti léčby. Pacienti původně léčení placebem byli randomizováni k podávání jedné z dávek fingolimodu (1,25 mg nebo 5 mg). Během 15.–24. měsíce byli na doporučení nezávislého Výboru pro monitorování bezpečnosti všichni pacienti převedeni na podávání dávky 1,25 mg, protože vyšší dávka nepřinášela vyšší efekt, ale bylo s ní spojeno více vedlejších účinků. Poslední pacient ukončil 36. měsíc podávání terapie v dubnu 2007. Extenze potvrdila efekt léčby, roční počet relapsů byl u skupiny od počátku léčené fingolimodem 0,2 (u placebové skupiny v prvních 6 měsících studie 0,77). Počet gadolinium enhancujících lézí u pacientů léčených od počátku fingolimodem byl na počátku studie 3,2, po 6 měsících 1,4 a po 3 letech studie 0,2 [26, 27].
Výsledky byly ověřeny dvěma rozsáhlými multicentrickými mezinárodními randomizovanými studiemi fáze III, studií TRANSFORMS (Trial Assessing Injectable Interferon versus FTY720 Oral in Relapsing-Remitting Multiple Sclerosis) [28] a FREEDOMS (FTY720 Research Evaluating Effects of Daily Oral therapy in Multiple Sclerosis) [29].
V roční studii TRANSFORMS byl účinek fingolimodu podávaného ve dvou dávkách (1,25 mg a 0,5 mg) porovnáván s účinkem standardní terapie lékem první volby pro remitentní RS interferonem beta-1a v dávce 30 mg i.m. 1krát týdně. Primárním cílem zde byl roční počet relapsů, sekundárními cíli byl počet nových a zvětšujících se lézí na T2 vážených obrazech MR a progrese disability potvrzená po 3 měsících. Studii dokončilo 1153 pacientů (89 %). Jejich charakteristika byla stejná jako u studie fáze II, polovina pacientů byla již léčena některým z interferonů a 15 % bylo léčeno glatiramer acetátem. Přesto byl roční počet relapsů u všech pacientů kolem 1,5 Ī 0,8, medián 1,0 (šlo tedy převážně o pacienty neodpovídající na léčbu interferonem). Roční počet relapsů během studie byl významně nižší u pacientů léčených fingolimodem: 0,20 (95% interval spolehlivosti – CI: 0,16–0,26) ve skupině léčené 1,25 mg a 0,16 (95% CI: 0,12–0,21) ve skupině léčené 0,5 mg oproti skupině léčené interferonem (0,33; 95% CI: 0,26–0,42; p < 0,001). Vyšetření MR potvrdilo klinické výsledky, fingolimod po 1 roce podávání významně snížil i stupeň atrofie mozku o 31 % oproti interferonu. V disabilitě nebyly shledány v takto krátké studii žádné rozdíly.
Studie FREEDOMS byla dvouletá a hodnotila dávku fingolimodu 1,25 mg a 0,5 mg oproti placebu. Primárním cílem byl roční počet relapsů, sekundárním cílem doba do progrese disability. Studii dokončilo 1033 z 1272 pacientů (81,2 %). Základní charakteristiky zařazených pacientů odpovídají populaci pacientů zařazených do studie fáze II. Roční počet relapsů byl 0,18 při léčbě 0,5 mg fingolimodu, 0,16 při léčbě 1,25 mg fingolimodu a 0,40 při léčbě placebem (p < 0,001). Během 12 měsíců před zahájením studie byl počet relapsů u všech pacientů 1,5 Ī 0,8, medián 1,0. Fingolimod v obou dávkách (0,5 mg a 1,25 mg) signifikantně redukoval riziko progrese disability během 24 měsíců. Kumulativní pravděpodobnost progrese disability (potvrzené po 3 měsících) byla 17,7 % u fingolimodu 0,5 mg, 16,6 % u fingolimodu 1,25 mg a 24,1 % u placebové skupiny. Obě dávky fingolimodu prokázaly schopnost ovlivnit pozitivně oproti placebu všechny sledované parametry MR: počet nových nebo zvětšujících se lézí na T2 vážených obrazech, počet gadolinium enhancujících lézí i ztrátu objemu mozkové tkáně (p < 0,001 pro všechna srovnání po 24 měsících).
Zařazení do současné palety léčiv
Fingolimod je první perorální přípravek k léčbě remitentní roztroušené sklerózy [30]. Dosavadní léky první volby (interferon beta, glatiramer acetát) jsou parenterální a jejich účinek není u většiny pacientů dostatečný – v klinických studiích dosahoval kolem 30 % oproti placebu. Fingolimod naproti tomu snížil roční počet relapsů o 54 % oproti placebu a o 52 % oproti interferonu beta-1a i.m. Adherence pacienta k injekční léčbě je po letech podávání většinou problematická [31]. Pro eskalaci léčby se donedávna používala cytostatika (mitoxantron, cyklofosfamid) s řadou vedlejších účinků. Od roku 2006 (v ČR od roku 2008) je k dispozici první monoklonální protilátka v neurologii – natalizumab – s dvojnásobným efektem oproti lékům první volby (redukce počtu relapsů o 68 % oproti placebu), s možností dosažení dlouhodobé remise a u některých pacientů zlepšení neurologického nálezu. Podávání natalizumabu je však časově ohraničeno u pa-cientů s pozitivními protilátkami proti JC viru, vyvolavateli progresivní multifokální leukoencefalopatie (PML), která se při podávání natalizumabu vyskytuje u jednoho pacienta na 1000 případů. Promořenost populace JC virem je asi 50–60 %. Při pozitivitě protilátek, léčbě delší než 24 měsíců a předchozí léčbě cytostatiky se incidence PML zvyšuje na 7,8 na 1000 léčených. Pokračování v léčbě je pak otázkou zvážení přínosu a rizika pacientem i ošetřujícím lékařem. Fingolimod lze v tomto případě použít po 2–3 měsících, kdy je natalizumab již odstraněn z organismu.
Indikace
EMA registrovala v březnu 2011 fingolimod v podobné indikaci jako natalizumab, tedy jako eskalační léčbu a jako léčbu u rychle progredující RS.
Přípravek je indikován v monoterapii jako léčba modifikující průběh onemoc-nění (DMT, disease modifying therapy) u vysoce aktivní relabující-remitentní for-my roztroušené sklerózy u následujících skupin dospělých pacientů:
- U pacientů, kteří mají vysoce aktivní formu onemocnění i přes terapii interferonem beta. Za tyto pacienty mohou být považováni ti, kteří nedostatečně reagovali na plnou a adekvátní léčbu (běžně nejméně jeden rok léčby) interferonem beta. Pacienti by měli mít během léčby nejméně jeden relaps v předchozím roce a minimálně 9 T2-hyperintenzních lézí na kraniálním skenu NMR nebo minimálně jednu gadolinium enhancující lézi. Jako „non-respondér“ může být též označen pacient s nezměněným nebo zvýšeným počtem relapsů nebo s probíhajícími závažnými relapsy ve srovnání s předchozím rokem.
- U pacientů s rychle progredující závažnou relabující-remitentní formou roztroušené sklerózy definovanou 2 nebo více těžkými relapsy během jednoho roku a s 1 nebo více gadolinium enhancujícími lézemi na NMR mozku nebo s významně zvýšeným výskytem T2 lézí ve srovnání s předchozím vyšetřením NMR.
Tato pravidla použití jsou jiná, než jak je na základě stejných klinických studií stanovil FDA, což vnáší do rozhodovacích algoritmů poněkud zmatek. V USA může být fingolimod použit jako lék první volby, není tedy předem nutno zkoušet injekční léky. Stejně jako je tomu u natalizumabu, je výsledná indikace odlišná od vstupních kritérií pro klinické studie, v nichž byl efekt léku studován. V obou případech byla studována populace pacientů se dvěma relapsy v posledních dvou letech bez ohledu na předléčení jakýmkoli lékem první volby. Postregistrační sledování pacientů léčených fingolimodem přispěje ke shromáždění dlouhodobých bezpečnostních dat, která nejspíše povedou ke změně indikačních omezení.
Kontraindikace
Kromě hypersenzitivity na účinnou látku či pomocné látky přípravku je podávání fingolimodu kontraindikováno při stavech imunodeficience, stavech se zvýšeným rizikem oportunní infekce, při závažných aktivních infekcích a známém aktivním maligním onemocnění.
Nežádoucí účinky
Nejčastějšími hlášenými nežádoucími účinky ve studiích s fingolimodem podáváným v dávce 0,5 mg byly virové chřipkové infekce, nazofaryngitidy, únava, bolest v zá-dech, průjmy, bronchitis a nauzea. Nejběžnějšími laboratorními abnormalitami byly lymfopenie a zvýšené hodnoty jaterních testů.
Lymfopenie souvisí s mechanismem účinku fingolimodu, po prvním měsíci byl počet lymfocytů v krevním obraze redukován o 73 % při použití fingolimodu 0,5 mg a o 76 % při dávce fingolimodu 1,25 mg.
Infekce. Celkový počet infekcí byl podobný ve skupině pacientů léčených fingolimodem (69 %) i placebem (72 %), závažné infekce se vyskytly v 1,6 % a 2,6 %. Infekce dolních cest dýchacích byly u pacientů léčených fingolimodem častější (9,6 % u pa-cientů léčených dávkou 0,5 mg, 11,4 % u pacientů s dávkou 1,25 mg a 6 % u pa-cientů dostávajících placebo).
Herpetické infekce byly hlášeny v přibližně stejném procentu u pacientů ve skupině fingolimodu i placeba (5,5–8,7 % pacientů), ve studii FREEDOMS se vyskytl herpes zoster u 7 pacientů ze skupiny lé-čené dávkou 0,5 mg finoglimodu, u 3 ze skupiny léčené 1,25 mg a u 4 ve skupině placeba. Ve studii TRANSFORMS zemřeli dva pacienti léčení fingolimodem v dávce 1,25 mg na herpetické infekce. V jednom případě šlo o diseminovanou primoinfekci virem varicella-zoster v době kortikosteroidní léčby ataky, v druhém případě šlo o herpetickou encefalitidu vyvolanou virem herpes simplex, kdy iniciální příznaky byly považovány za ataku, léčeny kortikosteroidy a léčba acyklovirem byla zahájena až týden po manifestaci příznaků.
Bradyarytmie. Bradykardii způsobuje fingolimod ovlivněním podtypů receptorů pro S1P přítomných na atriálních myocytech. Po podání první dávky fingolimodu 0,5 mg se snížila srdeční frekvence o maximálně 8 pulsů za minutu, po podání první dávky fingolimodu 1,25 mg bylo zaznamenáno snížení o 10 pulsů. Zpomalení frekvence se objevuje již během 2. hodiny po první dávce léku, maxima dosahuje 4. až 5. hodinu a v 6. hodině se frekvence vrací k normě, do 24 hodin se upravuje. V praxi to znamená, že pacient by měl být prvních 6 hodin po požití iniciální dávky sledován a měl by hlásit eventuální příznaky související se zpomalením srdečního rytmu. Bradykardii vyvinulo po fingolimodu v dávce 0,5 mg 9 pacientů, po dávce 1,25 mg 14 pacientů, během 24 hodin došlo k úpravě, u většiny pacientů bez léčby. Dva pa-cienti léčení dávkou 0,5 mg, 6 pacientů léčených 1,25 mg fingolimodu a 3 pacienti ze skupiny placeba vyvinuli atrioventrikulární blok 1. až 2. stupně. Při dlouhodobém podávání nebyly zaznamenány žádné další efekty na srdeční frekvenci ani na atrioven-trikulární převod.
Krevní tlak. Léčba fingolimodem byla spojena se vzestupem systolického krevního tlaku o 2 mm Hg a diastolického o 1 mm Hg, změna se projevila přibližně po dvou měsících léčby. Hypertenze byla hlášena u 6,1 % pacientů léčených fingolimodem oproti 3,8 % pacientů léčených placebem.
Makulární edém. Makulární edém se vyskytl u 0,4 % pacientů léčených fingolimodem 0,5 mg a u 1,1 % léčených fingolimodem 1,25 mg, většinou v prvých 3–4 měsících, někdy s příznaky rozmazaného vidění a zhoršení zrakové ostrosti, jindy zcela bezpříznakově. Po ukončení léčby fingolimodem došlo ke spontánnímu zlepšení nebo vymizení makulárního edému. Incidence makulárního edému je zvýšena u pacientů s RS (0,6 %) a s anamnézou uveitidy (17 %).
Jaterní transaminázy. Zvýšení hodnot jaterních testů bylo pozorováno ve studii FREEDOMS u 8,5 % pacientů léčených fingolimodem 0,5 mg a u 12,5 % léčených 1,25 mg (a u 1,7 % pacientů léčených placebem), většinou během 3–4 měsíců. Po ukončení léčby se hladiny transamináz normalizovaly do 2 měsíců.
Respirační funkce. Hodnoty usilovně vydechnutého objemu za 1 vteřinu (FEV1) a difuzní kapacita pro oxid uhelnatý (DLCO) při léčbě fingolimodem mírně klesají, tato změna mizí po ukončení léčby.
Nádorová onemocnění. Ve studii fáze II se vyskytly 3 kožní karcinomy, proto bylo pravidelné kožní vyšetření zavedeno v pokračovací studii i ve studiích fáze III. V pokračovací studii byly zjištěny další 4 kožní nádory, dva maligní melanomy, jeden nádor ze skvamózních buněk a jeden bazaliom. Ve studii TRANSFORMS to bylo 10 kožních nádorů (5 bazaliomů, z toho jeden u pacienta léčeného interferonem, 3 melanomy a jeden nádor ze skvamózních buněk u pacienta léčeného interferonem). U pacientů léčených fingolimodem se vyskytly 4 nádory prsu. Ve studii FREEDOMS se vyskytlo celkem 11 kožních nádorů, 7 u pa-cientů léčených fingolimodem.
Lékové interakce
Fingolimod je metabolizován převážně CYP4F2, na jeho metabolismu se mohou podílet i jiné enzymy, např. CYP3A4. Současné podávání ketokonazolu vede k 1,7ná-sobnému vzestupu expozice fingolimodu a fingolimod fosfátu [32]. Opatrnosti je třeba i u látek, které mohou inhibovat CYP3A4 (inhibitory proteáz, azolová antimykotika, některé makrolidy). U látek vyvolávajících bradykardii je třeba zvýšené opatrnosti pro aditivní efekt na srdeční frekvenci (především antiarytmika třídy Ia a III) [33]. Současné podávání kortikosteroidů, cyklosporinu či hormonálních kontraceptiv nevedlo ke změnám expozice jednotlivým látkám. Současně s fingolimodem by se neměly podávat látky s antineoplastickým, imunosupresivním nebo imunomodulačním účinkem. Vakcinace během léčby fingolimodem a dva měsíce po ní může být méně účinná. Vakcinace živými či oslabenými vakcínami může vést k riziku infekcí.
Těhotenství a kojení
Před zahájením léčby fingolimodem musí být k dispozici negativní těhotenský test a pacientky musí být poučeny o nutné účinné antikoncepci během léčby a dva měsíce po jejím ukončení, protože studie na zvířatech prokázaly reprodukční toxicitu fingolimodu včetně ztráty plodu a orgánových defektů. Fertilita není ovlivněna. Fingolimod je vylučován do mateřského mléka ve 2–3krát vyšší koncentraci, než je přítomna v plazmě matky, proto kojení není slučitelné s léčbou fingolimodem.
Ovlivnění pozornosti
Fingolimod nemá vliv na pozornost, po první dávce se však může objevit brady-arytmie, proto je třeba zvýšené opatrnosti při zahajování léčby.
Dávkování
Denní dávka je 0,5 mg v jedné tobolce, přípravek může být užíván s jídlem nebo na lačno. Při vynechání dávky se pokračuje další dávkou. Při přerušení léčby na více než 2 týdny je při znovuzahájení nutno opět monitorovat srdeční činnost po dobu 6 hodin.
Doporučení pro klinickou praxi
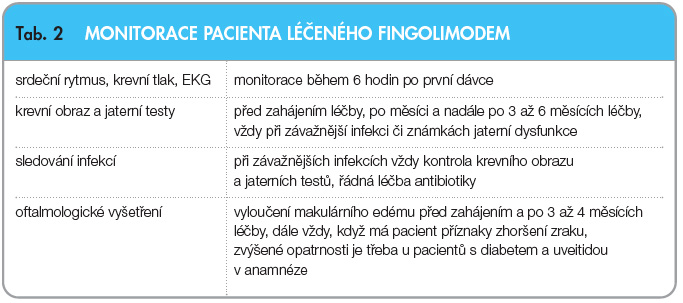 Doporučená sledování pro běžnou kli-nickou praxi zaměřená na minimalizaci rizika vedlejších účinků jsou uvedena v tab. 2.
Doporučená sledování pro běžnou kli-nickou praxi zaměřená na minimalizaci rizika vedlejších účinků jsou uvedena v tab. 2.
Léčbu by měl vést lékař zkušený v léčbě roztroušené sklerózy.
Před zahájením léčby je nutno vyloučit graviditu, bradyarytmii, poruchy atrioventrikulárního převodu, sick sinus syndrom, akutní infekci, závažné jaterní poškození, imunodeficit, maligní onemocnění.
U pacientů, kteří nemají protilátky proti viru varicella-zoster, je doporučeno očkování a odložení začátku terapie o měsíc.
Současnému podávání s antiarytmiky třídy Ia (např. chinidin, prokainamid, disopyramid) nebo třídy III (např. amiodaron, sotalol) je lépe se vyhnout.
Pacienti jsou klinicky sledováni v Centrech pro roztroušenou sklerózu v pravidelných 3měsíčních intervalech s první kontrolou měsíc po zahájení léčby.
Seznam použité literatury
- [1] Chun J, Hartung HP. Mechanism of action of oral fingolimod (FTY720) in multiple sclerosis. Clin Neuropharmacol 2010; 33: 91–101.
- [2] Massberg S, von Andrian UH. Fingolimod and sphingosine-1-phosphate–modifiers of lymphocyte migration. N Engl J Med 2006; 355: 1088–1091.
- [3] Brinkmann V, Lynch KR. FTY720: targeting G-protein-coupled receptors for sphingosine 1-phosphate in transplantation and autoimmunity. Curr Opin Immunol 2002; 14; 560–575.
- [4] Brinkmann V, Cyster JG, Hla T. FTY720: sphingosine 1-phosphate receptor-1 in the control of lymphocyte egress and endothelial barrier function. Am J Transplant 2004; 4: 1019–1025.
- [5] Westermann J, Pabst R. Distribution of lymphocyte subsets and natural killer cells in the human body. Clin Investig 1992; 70: 539–544.
- [6] Mehling M, Brinkmann V, Antel J, et al. FTY720 therapy exerts differential effects on T cell subsets in multiple sclerosis. Neurology 2008; 71: 1261–1267.
- [7] Mehling M, Lindberg R, Kuhle J, et al. Oral fingolimod (FTY720) treatment reduces peripheral IL-17-producing TH17 cells in patients with multiple sclerosis. Mult Scler 2008; 14: S234.
- [8] Lanzavecchia A, Sallusto F. Understanding the generation and function of memory T cell subsets. Curr Opin Immunol 2005; 17: 326–332.
- [9] Sallusto F, Geginat J, Lanzavecchia A. Central memory and effector memory T cell subsets: function, generation, and maintenance. Annu Rev Immunol 2004; 22: 745–763.
- [10] Appay V, van Lier RA, Sallusto F, Roederer M. Phenotype and function of human T lymphocyte subsets: consensus and issues. Cytometry A 2008; 73: 975–983.
- [11] Bar-Or A. The immunology of multiple sclerosis. Semin Neurol 2008; 28: 29–45.
- [12] Mehling M, Lindberg R, Raulf F, et al. Th17 central memory T cells are reduced by FTY720 in patients with multiple sclerosis. Neurology 2010; 75: 403–410.
- [13] Tzartos JS, Friese MA, Craner MJ, et al. Inter-leukin-17 production in central nervous system-infiltrating T cells and glial cells is associated with active disease in multiple sclerosis. Am J Pathol 2008; 172: 146–155.
- [14] Kebir H, Ifergan I, Alvarez JI, et al. Preferential recruitment of interferon-gamma-expressing Th17 cells in multiple sclerosis. Ann Neurol 2009; 66: 390–402.
- [15] Brucklacher-Waldert V, Stuerner K, Kolster M, et al. Phenotypical and functional characterization of T helper 17 cells in multiple sclerosis. Brain 2009; 132: 3329–3341.
- [16] Kataoka H, Sugahara K, Shimano K, et al. FTY720, sphingosine 1-phosphate receptor modulator, ameliorates experimental autoimmune encephalomyelitis by inhibition of T cell infil-tration. Cell Mol Immunol. 2005; 2: 439–448.
- [17] Foster CA, Howard LM, Schweitzer A, et al. Brain penetration of the oral immunomodulatory drug FTY720 and its phosphorylation in the central nervous system during experimental autoimmune encephalomyelitis: consequences for mode of action in multiple sclerosis. J Pharmacol Exp Ther 2007; 323: 469–475.
- [18] Coelho RP, Payne SG, Bittman R, et al. The immunomodulator FTY720 has a direct cytoprotective effect in oligodendrocyte progenitors. J Pharmacol Exp Ther 2007; 323: 626–635.
- [19] Deogracias R, Matsumoto T, Klein C, et al. FTY720 induces BDNF production in neuronal cell cultures. Neurology 2008; 70: A373.
- [20] Brinkmann V, Billich A, Baumruker T, et al. Fingolimod (FTY720): discovery and development of an oral drug to treat multiple sclerosis. Nat Rev Drug Discov 2010; 9: 883–897.
- [21] Pham TH, Okada T, Matloubian M, et al. S1P1 receptor signaling overrides retention mediated by G alpha i-coupled receptors to promote T cell egress. Immunity 2008; 28: 122–133.
- [22] Brinkmann V. FTY720 (fingolimod) in multiple sclerosis: therapeutic effects in the immune and the central nervous system. Br J Pharmacol 2009; 158: 1173–1182.
- [23] Kovarik JM, Schmouder RL, Slade AJ. Overview of FTY720 clinical pharmacokinetics and pharmacology. Ther Drug Monit 2004; 26: 585–587.
- [24] Kovarik JM, Schmouder RL, Barilla D, et al. Multiple-dose FTY720: tolerability, pharmacokinetics, and lymphocyte responses in healthy subjects. J Clin Pharmacol 2004; 44: 532–537.
- [25] Kovarik JM, Hartmann S, Bartlett M, et al. Oral-intravenous crossover study of fingolimod pharmacokinetics, lymphocyte responses and cardiac effects. Biopharm Drug Dispos 2007; 28: 97–104.
- [26] O'Connor P, Comi G, Montalban X, et al. FTY720 D2201 Study Group. Oral fingolimod (FTY720) in multiple sclerosis: two-year results of a phase II extension study. Neurology 2009; 72: 73–79.
- [27] Comi G, O'Connor P, Montalban X, et al. FTY720D2201 Study Group. Phase II study of oral fingolimod (FTY720) in multiple sclerosis: 3-year results. Mult Scler 2010; 16: 197–207.
- [28] Cohen JA, Barkhof F, Comi G, et al. TRANSFORMS Study Group. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402–415.
- [29] Kappos L, Radue EW, O'Connor P, et al. FREEDOMS Study Group. A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387–401.
- [30] Scott LJ. Fingolimod: a review of its use in the management of relapsing-remitting multiple sclerosis. CNS Drugs 2011; 25: 673–698.
- [31] Reynolds MW, Stephen R, Seaman C, Rajagopalan K. Persistence and adherence to disea-se modifying drugs among patients with multiple sclerosis. Curr Med Res Opin 2010; 26: 663–674.
- [32] Kovarik JM, Dole K, Riviere GJ, et al. Ketoconazole increases fingolimod blood levels in a drug interaction via CYP4F2 inhibition. J Clin Pharmacol 2009; 49: 212–218.
- [33] Kovarik JM, Lu M, Riviere GJ, et.al The effect on heart rate of combining single-dose fingolimod with steady-state atenolol or diltiazem in healthy subjects. Eur J Clin Pharmacol 2008; 64: 457–463.