Fixní kombinace ER niacin/laropiprant
Statiny jsou lékem volby u naprosté většiny dyslipidemií. Nicméně i pacienti léčení statiny vykazují velké reziduální riziko, na němž se mohou podílet nedostatečně snížené hodnoty LDL cholesterolu, nízké koncentrace HDL cholesterolu, vysoké hladiny triglyceridů a lipoproteinu (a). Kyselina nikotinová (niacin) upravuje všechny tyto lipoproteinové třídy zhruba o 20 % („pravidlo 20“) a řada intervenčních studií svědčí ve prospěch jejího účinku na snížení rizika kardiovaskulárních příhod i příznivé ovlivnění aterosklerotického procesu.
Niacin byl zaveden do léčby dyslipidemií již v roce 1950, přesto je celosvětově velmi málo používán a v České republice nebyl několik desetiletí vůbec k dispozici. Hlavní příčinou jeho nedostatečného využití je sice benigní, ale nepříjemný nežádoucí účinek – flush. Kvůli němu se často nepodaří dosáhnout vhodných terapeutických dávek niacinu a potřebné adherence k léčbě.
V současnosti se dostává na náš trh hypolipidemický přípravek obsahující kyselinu nikotinovou s řízeným uvolňováním (ER niacin) v kombinaci s laropiprantem (vysoce selektivním antagonistou receptoru pro prostaglandin D2), který snižuje výskyt a intenzitu flushe, aniž by ovlivňoval lipidy modifikující účinky niacinu. V práci je popsán jeho mechanismus účinku, farmakokinetické vlastnosti, hypolipidemické účinky, dosavadní klinické zkušenosti, indikace, kontraindikace i nežádoucí účinky, včetně lékových interakcí.
Fixní kombinace ER niacin/laropiprant bude představovat významné rozšíření našich možností v léčbě dyslipidemií. Probíhající velké intervenční studie AIM-HIGH a HPS2-THRIVE, jejichž výsledky jsou očekávány v horizontu 1–3 let, poskytnou lepší náhled na prospěšnost léčby niacinem, jakož i na bezpečnost a účinnost kombinovaného přípravku ER niacin/laropiprant.
Úvod
Velké metaanalýzy intervenčních studií s monoterapií statiny prokázaly, že snížení hladiny LDL cholesterolu (LDL-C) vede k významnému snížení kardiovaskulární (KV) morbidity i mortality, a to jak u nediabetiků [1], tak u diabetiků [2]. Léčba statiny je proto léčbou první volby prakticky u všech typů dyslipidemií (s výjimkou těžké hypertriglyceridemie) [3–5]. Snížení LDL-C o 1 mmol/l vede k přibližně 21% snížení relativního rizika KV příhod. I přes tento velký úspěch je u pacientů aktivně léčených ve studiích se statiny zaznamenáváno vysoké reziduální riziko.
Statiny snižují především hladinu LDL-C, zatímco HDL cholesterol (HDL-C) a triglyceridy (TG) ovlivňují nepříliš výrazně. Nízké koncentrace HDL-C jsou významným nezávislým rizikovým faktorem ischemické choroby srdeční a dalších KV onemocnění [6] a zůstávají významným prediktorem rizika i u pacientů léčených statiny, kteří dosáhli velmi nízkých koncentrací LDL-C [7], podobně jako zvýšené koncentrace triglyceridů [8, 9].
Zvýšené plazmatické hladiny TG jsou často asociovány s nízkými hladinami HDL-C a se zmnožením počtu malých hustých LDL částic. Tato trias, nazývaná též aterogenní lipoproteinový fenotyp nebo aterogenní dyslipidemie, je typicky provázena inzulinovou rezistencí a dalšími nelipidovými KV rizikovými faktory, jako je arteriální hypertenze, prozánětlivý a protrombogenní stav. I když hodnoty LDL-C bývají u této trias většinou nepříliš zvýšené nebo i normální, jsou tyto změny provázeny vysokým KV rizikem a často se též podílejí na vysokém reziduálním riziku i u pacientů léčených statiny.
Výraznější snížení hodnot LDL-C i ovlivnění dalších lipoproteinových tříd hrajících roli v procesu aterogeneze, jako je snížení hladiny lipoproteinů o intermediární hustotě (IDL), o velmi nízké hustotě (VLDL), lipoproteinu (a) – Lp(a) – a zvýšení hladiny lipoproteinů o vysoké hustotě (HDL), by mohlo snížit výše uvedené vysoké reziduální riziko [3–5].
Kyselina nikotinová (niacin) významným způsobem ovlivňuje všechny výše uvedené lipoproteinové třídy a jako jediné v současnosti používané hypolipidemikum významně snižuje též koncentraci Lp(a). Mírného ovlivnění výše uvedených lipidových abnormalit je možno dosáhnout dávkou niacinu 1 g/den, nicméně niacin podávaný v dávce 2 g/den vede k dvojnásobnému snížení hladin LDL-C a dvojnásobnému zvýšení HDL-C a k několikanásobnému snížení hladin triglyceridů. Dosažení těchto terapeutických dávek je proto velmi důležité.
I když je niacin nejstarším hypolipidemikem používaným k léčbě dyslipidemií (do léčby uveden již v padesátých letech minulého století), jeho širší používání v klinické praxi bylo celosvětově limitováno častým výskytem nežádoucího účinku – flushe; ten je též nejčastější příčinou neschopnosti dosáhnout výše uvedených terapeutických hladin a ve vysokém procentu vede k ukončení této terapie samotnými pacienty. Při podávání formy kyseliny nikotinové s prodlouženým uvolňováním – extended release (ER) niacin – je sice zaznamenáno méně epizod flushe, nicméně i léčba tímto přípravkem musí být zahajována malou dávkou 500 mg/den s postupným zvyšováním k plné terapeutické dávce 2000 mg/den v průběhu týdnů až měsíců, aby se zabránilo vzniku tohoto nepříjemného nežádoucího účinku. Retrospektivní observační studie ukázala, že 85 % pacientů přestalo užívat ER niacin během prvního roku po zavedení léčby a hlavní uváděnou příčinou byl flush [10]. Až 40 % z těch pacientů, kteří setrvali v léčbě ER niacinem, užívalo po půl roce dávku ≤ 500 mg/den, která má minimální účinky na modifikaci lipidového spektra. Po jednom roce léčby užívala dávku vyšší než 1500 mg/den pouze 2 % pacientů. Z výše uvedeného je patrné, že flush je závažným nežádoucím účinkem, jenž brání adherenci k léčbě a dosažení terapeutických dávek.
Flush je zprostředkován primárně prostaglandinem D2 (PGD2) [11]. Pro snížení tohoto sice benigního, ale nepříjemného nežádoucího účinku byl vyvinut přípravek kombinující kyselinu nikotinovou s řízeným uvolňováním (ER niacin) s laropiprantem (LRPT), selektivním antagonistou receptoru pro PGD2 (podtyp 1 – DP1), který významně snižuje výskyt kožního flushe nezávisle na mechanismu ovlivnění hladin lipidů. V České republice nebyl niacin více než třicet let vůbec k dispozici, a to i přes snahu České společnosti pro aterosklerózu (ČSAT) zajistit jeho dovoz. Je proto velmi potěšující, že na náš trh bude po mnoha letech uveden kombinovaný přípravek s řízeným uvolňováním kyseliny nikotinové a laropiprantem v jedné tabletě.
Farmakologická skupina
Fixní kombinace ER niacin/laropiprant patří do farmakologické skupiny: hypolipidemika, kyselina nikotinová a deriváty, ATC kód C10AD52.
Jedna tableta obsahuje acidum nicotinicum s řízeným uvolňováním (ER niacin) 1000 mg a laropiprantum 20 mg. Kyselina nikotinová v tomto přípravku zajišťuje ovlivnění lipidů – snižuje hladiny LDL-C, celkového cholesterolu (TC), VLDL-C, apolipoproteinu B (apo B), hlavního strukturálního proteinu všech aterogenních částic, TG a Lp(a) a zvyšuje hladiny HDL-C a apolipoproteinu A-I (apo A-I), hlavní proteinové složky HDL. Laropiprant potlačuje zrudnutí zprostředkované PGD2, které je spojeno s podávánim kyseliny nikotinové. Laropiprant nemá na hladiny lipidů žádny vliv ani neinterferuje s účinky kyseliny nikotinové na lipidy.
Chemické a fyzikální vlastnosti
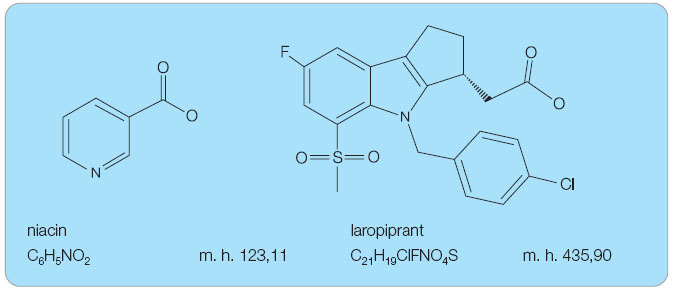
Niacin je chemicky kyselina pyridin-3-karboxylová (kyselina nikotinová). Laropiprant je chemicky kyselina (-)-[(3R)-4-(4-chlorobenzyl)-7-fluoro-5-(methylsulfonyl)-1,2,3,4-tetrahydrocyklopenta[b]indol-3-yl] octová (obr. 1).
Mechanismus účinku, farmakodynamika
Kyselina nikotinová
![Obr. 2 Schematické znázornění mechanismu účinku niacinu; volně podle [13] – Kamanna, Kashyap, 2008.](https://www.remedia.cz/photo-a-28037---.jpg) Hypolipidemický účinek kyseliny nikotinové je vysvětlován jednak inhibicí uvolňování volných mastných kyselin (FFA) z tukové tkáně a snížením jejich transportu do jater [12]. Tento klasický antilipolytický účinek kyseliny nikotinové je zprostředkován jejím agonistickým působením na receptor kyseliny nikotinové (GPR109A). Kyselina nikotinová inhibuje též aktivitu jaterní diacylglycerol acyltransferázy-2 (DGAT2) – klíčového enzymu katalyzujícího syntézu triglyceridů. Snížená tvorba triglyceridů v játrech vede ke zvýšené intrahepatální degradaci apo B [13]. Důsledkem toho je snížená tvorba VLDL a jejich metabolického degradačního produktu LDL, viz obr 2. Niacin ovlivňuje též distribuci LDL subpopulací s posunem od malých hustých LDL k více buoyantním LDL, které jsou méně aterogenní.
Hypolipidemický účinek kyseliny nikotinové je vysvětlován jednak inhibicí uvolňování volných mastných kyselin (FFA) z tukové tkáně a snížením jejich transportu do jater [12]. Tento klasický antilipolytický účinek kyseliny nikotinové je zprostředkován jejím agonistickým působením na receptor kyseliny nikotinové (GPR109A). Kyselina nikotinová inhibuje též aktivitu jaterní diacylglycerol acyltransferázy-2 (DGAT2) – klíčového enzymu katalyzujícího syntézu triglyceridů. Snížená tvorba triglyceridů v játrech vede ke zvýšené intrahepatální degradaci apo B [13]. Důsledkem toho je snížená tvorba VLDL a jejich metabolického degradačního produktu LDL, viz obr 2. Niacin ovlivňuje též distribuci LDL subpopulací s posunem od malých hustých LDL k více buoyantním LDL, které jsou méně aterogenní.
Snížení hladiny triglyceridů je obvykle provázeno zvýšením HDL-C v důsledku snížení intenzity výměny triglyceridů za cholesterol estery HDL částic. Roli při zvýšení hladin HDL-C pravděpodobně hraje i inhibice předpokládaného HDL katabolického receptoru, což vede k inhibici vychytávání HDL-apo A-I a ke změně zastoupení jednotlivých subpopulací HDL s preferenčním zvýšením Lp(A-I) (HDL se zastoupením pouze apo A-I) ve srovnání s Lp(A-I+A-II) (HDL se zastoupením apo A-I i apo A-II), což je považováno z hlediska aterogeneze za příznivý účinek, viz obr. 2 [13]. To má za následek kvalitativní změny HDL částic, které mají lepší schopnost navodit reverzní transport cholesterolu, stimulovat endoteliální produkci oxidu dusnatého, navozovat obnovu endotelu a inhibovat endoteliální buněčný oxidační stres [12, 13].
Zatím není jasné, jakým mechanismem snižuje kyselina nikotinová hladiny Lp(a). Zajímavé je, že léky ovlivňující hladiny lipidů zvýšením jejich odbourávání a stimulací LDL receptorů (jako statiny, ezetimib nebo pryskyřice) nemají na hladiny Lp(a) žádný vliv. Pouze přípravky ovlivňující produkci lipoproteinů, jako je niacin nebo mipomersen (apo B antisense-oligonukleotid), snižují hladiny tohoto vesměs geneticky determinovaného a vysoce aterogenního Lp(a).
Účinek niacinu na plazmatické lipidy záleží na dávce a typu dyslipidemie. Klinicky významné změny hladin lipidů lze obvykle pozorovat při podávání dávek 1 g/den nebo vyšších, ale k dosažení plného účinku jsou obvykle nutné dávky 1,5–2 g/den [13–15]. Obecně je možno předpokládat, že niacin v dávce větší než 1,5 g/den sníží hladiny LDL-C, triglyceridů a Lp(a) asi o 20 % a zvýší hodnoty HDL-C rovněž asi o 20 % („pravidlo 20“). Niacin vykazuje navíc další nelipidové účinky, jako je snížení koncentrace fibrinogenu, inhibitoru plazminogenového aktivátoru-1 [16, 17] a zvýšení tvorby adiponektinu v adipocytech, což může dále ovlivňovat produkci řady prozánětlivých působků [18]. Mezi nelipidové účinky patří i mírné snížení systolického i diastolického krevního tlaku, doložené po léčbě niacinem [19]. Nedávno bylo prokázáno, že kyselina nikotinová stimuluje též odsun volného cholesterolu z tukové tkáně, která je největším skladištěm volného cholesterolu v těle [20]. Všechny výše popsané lipidové i nelipidové účinky mohou přispívat k antiaterogennímu působení kyseliny nikotinové.
Potěšující skutečností je existence řady studií prokazujících, že kyselina nikotinová (ať už v monoterapii, či v kombinaci s dalšími hypolipidemiky – statiny, pryskyřicemi, klofibrátem) snižuje kardiovaskulární morbiditu a mortalitu [21–24] a příznivě ovlivňuje aterosklerotický proces [25–29]. Coronary Drug Project hodnotil účinek niacinu v monoterapii u pacientů s prokázanou ischemickou chorobou srdeční [21]. Po 6 letech léčby se snížil výskyt hlavních koronárních příhod o 27 % ve srovnání s placebem. Sekundární analýza po 15 letech pak prokázala signifikantní snížení mortality o 11 % [22], a to i přes skutečnost, že pacienti již posledních 9 let neužívali studijní léčbu dle původního protokolu, ale obě větve byly léčeny dle uvážení ošetřujících lékařů.
Studie HATS (HDL-Atherosclerosis Treatment Study), byť s malým počtem zařazených pacientů, prokázala signifikantní 89% snížení rizika vzniku KV příhod po terapii kombinací niacinu se simvastatinem oproti placebu [24]. Další malé studie přinášely zcela konzistentně obdobné výsledky, které však vzhledem k počtu zařazených pacientů nebyly statisticky významné.
Metaanalýza 11 randomizovaných studií [30] s celkovým počtem 2682 pacientů ve skupině niacinové a s 3934 pacienty ve skupině kontrolní prokázala, že niacin signifikantně snížil relativní riziko hlavních koronárních příhod o 25 %, cévních mozkových příhod o 26 % a jakýchkoliv KV příhod o 27 %. Více pacientů v niacinové skupině vykazovalo regresi koronární aterosklerózy [30]. Obdobné účinky niacinu byly pozorovány při sledování tloušťky intimy-medie [30].
Laropiprant
Kyselinou nikotinovou indukované zrudnutí kůže (flush) je zprostředkováno předevšim interakcí prostaglandinu D2 (PGD2) se specifickým receptorem (prostaglandin-D2-receptor-1, PGD2-DP1). Kvůli snížení tohoto nepříjemného nežádoucího účinku byl vyvinut selektivní antagonista tohoto receptoru – MK-0524, laropiprant [31]. Nepředpokládá se, že by laropiprant inhiboval tvorbu prostaglandinů, ale inhibuje vazodilataci po tvorbě PDG2 blokádou vazby PGD2 na výše uvedený receptor DP1. Ačkoliv je laropiprant potentním inhibitorem tohoto receptoru, neeliminuje flush u všech pacientů. Vyšší dávky laropiprantu ani aspirin nebo jiná nesteroidní antirevmatika nemohou tento reziduální flush eliminovat.
Laropiprant má rovněž afinitu k tromboxanovému receptoru A2 (TP – tento receptor hraje důležitou roli ve funkci krevních destiček), i když je v porovnání s DP1 na TP podstatně méně účinný. Nicméně, v současné době používané terapeutické dávky laropiprantu neměly klinicky významné účinky na čas krvácení nebo na trombocytární funkce (kolagenem indukovanou agregaci destiček). Současné studie (i když zatím krátkodobé) ukazují, že laropiprant neovlivňuje lipidy modifikující vlastnosti niacinu a má sám o sobě minimální nežádoucí účinky.
 Farmakokinetické vlastnosti
Farmakokinetické vlastnosti
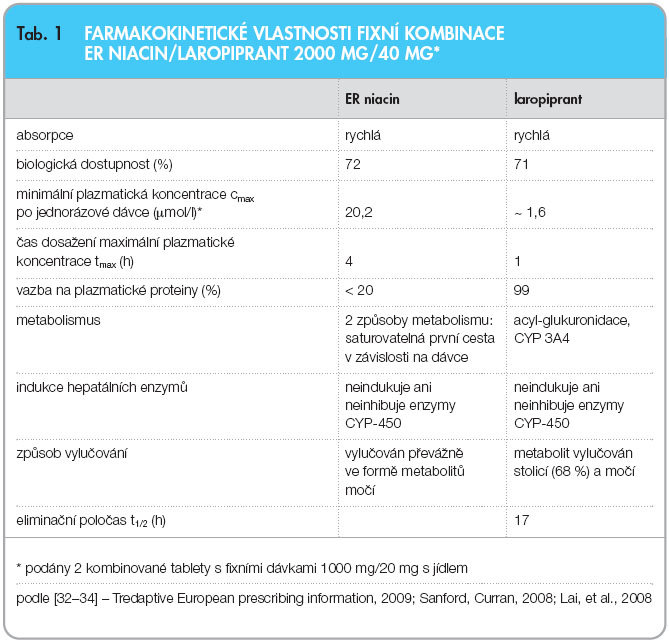
Farmakokinetické vlastnosti niacinu a laropiprantu jsou shrnuty v tab. 1 [32–34].
Niacin
Niacin je po perorálním podání rychle a dobře absorbován [32]. Forma niacinu s prodlouženým uvolňováním (ER) dosahuje maximální plazmatické koncentrace (cmax) pomaleji než forma kyseliny nikotinové s okamžitým uvolňováním (IR) [32, 33]. Po podání ER niacinu s laropiprantem 2000 mg/40 mg (2 kombinované tablety s fixními dávkami 1000 mg/20 mg) společně s jídlem bylo dosaženo maximální koncentrace (cmax) průměrně za 4 hodiny (tmax). Biologická dostupnost byla minimálně 72 %. Vazba niacinu na sérové proteiny je nízká (< 20 %). Niacin je vylučován převážně ve formě svých metabolitů močí. Niacin ani jeho metabolity nejsou inhibitory četných jaterních enzymů cytochromu P-450 (CYP), včetně CYP1A2, CYP2B6, CYP2C9, CYP2C19, CYP2D, CYP2E1 nebo CYP3A4, ani 3-glukuronidace estradiolu zprostředkované UGT1A1 [32].
Laropiprant
Po jednorázovém perorálním podání 40 mg laropiprantu (v podobě 2 tablet ER niacin 1000 mg/laropiprant 20 mg) je průměrná biologická dostupnost laropiprantu 71 % [34]. Farmakokinetický profil laropiprantu je zhruba lineární, na dávce závislý, hodnot cmax je dosaženo asi za 1 hodinu po podání [34]. Absorpce laropiprantu není ovlivněna při současném podání jídla s obsahem tuku. Opakované podávání laropiprantu nevede k jeho akumulaci. Laropiprant se intenzivně váže na plazmatické proteiny a je metabolizován převážně acyl-glukuronidací a vzniklý konjugát je vylučován stolicí (68 %) a močí. Poločas eliminace laropiprantu je 17 hodin.
Farmakokinetická data nejsou k dispozici pro ER niacin/laropiprant u lidí starších 65 let. Věk do 65 let, pohlaví ani rasa nemají zjevný vliv na farmakokinetiku niacinu či laropiprantu. Jelikož niacin a jeho metabolity jsou vylučovány ledvinami, ER niacin/laropiprant by se měl podávat obezřetně u osob s poruchou renálních funkcí [32]. Farmakokinetické vlastnosti laropiprantu jsou významně ovlivněny u osob s poruchou jaterních funkcí [32].
Klinické zkušenosti
Do současnosti bylo publikováno několik randomizovaných, placebem kontrolovaných, dvojitě zaslepených klinických studií fáze III, které zhodnotily účinnost kombinace ER niacin/LRPT podáváné samostatně nebo se statinem na modifikaci lipidového spektra [35–37].
Nejvýznamnější v tomto ohledu je studie Maccubbinova [36], která kromě účinku ER niacinu/LRPT na modifikaci lipidů sledovala rovněž velmi podrobně četnost výskytu, intenzitu a délku trvání flushe pomocí „Flushing Symptom Questionnaire“ (FSQ). Do této studie bylo zařazeno celkem 1613 pacientů, kteří dostávali ER niacin 1 g/LRPT 20 mg (n = 800), ER niacin 1 g (n = 543), nebo placebo (n = 270) po dobu 4 týdnů. Po této době byla zvýšena dávka ER niacinu (v první a ve druhé skupině) a LRPT (v první skupině) na dvojnásobek po dobu 20 týdnů. Vzhledem k tomu, že většina zařazených pacientů byla ve vysokém riziku ICHS, asi dvě třetiny pacientů vstupovaly do studie se stabilní léčbou statiny, pouze jedna třetina byla „statin naivní“.
![Graf 1 Efekt podávání niacinu s prodlouženým uvolňováním (ER niacin), fixní kombinace ER niacin/laropiprant a placeba na lipidové parametry; podle [36] – Maccubbin, et al., 2008.](https://www.remedia.cz/photo-a-28039---.jpg) Pokud jde o účinek modifikující lipidy, ER niacin/LRPT vedl ke snížení hladiny LDL-C o 18,4 % (primární „endpoint“), non-HDL-C o 19,8 %, triglyceridů o 25,8 %, apolipoproteinu B o 18,8 %, celkového cholesterolu o 8,5 % a poměru celkový cholesterol/HDL-C o 23,1 %, zatímco hladina HDL-C se zvýšila o 20,0 % (sekundární cíle) ve srovnání s placebem v týdnu 12–24 (graf 1). Účinek na lipidové parametry byl prakticky shodný s účinkem ER niacinu samotného [36], viz graf 1.
Pokud jde o účinek modifikující lipidy, ER niacin/LRPT vedl ke snížení hladiny LDL-C o 18,4 % (primární „endpoint“), non-HDL-C o 19,8 %, triglyceridů o 25,8 %, apolipoproteinu B o 18,8 %, celkového cholesterolu o 8,5 % a poměru celkový cholesterol/HDL-C o 23,1 %, zatímco hladina HDL-C se zvýšila o 20,0 % (sekundární cíle) ve srovnání s placebem v týdnu 12–24 (graf 1). Účinek na lipidové parametry byl prakticky shodný s účinkem ER niacinu samotného [36], viz graf 1.
![Graf 2 Intenzita flushe během prvního týdne podávání niacinu s prodlouženým uvolňováním (ERN), fixní kombinace ER niacin/laropiprant (ERN/LRPT) a placeba; podle [36] – Maccubbin, et al., 2008.](https://www.remedia.cz/photo-a-28040---.jpg) ER niacin/LRPT vedl k signifikantně nižšímu výskytu všech předem specifikovaných primárních „flushing endpoints“ (tj. výskyt, intenzita, ukončení léčby pro flush) [36]. Během prvního týdne léčby ER niacinem/LRPT vykazovalo flush o 65 % pacientů méně ve srovnání s léčbou ER niacinem samotným (p < 0,001) a tyto nežádoucí epizody byly kratší (1 vs. 60 minut), viz graf 2. Po 6. týdnu léčby fixní kombinací ER niacin/LRPT se výskyt epizod flushe přiblížil četnosti výskytu u pacientů, kteří dostávali placebo, zatímco u jedinců léčených ER niacinem samotným byl zjištěn stejně častý výskyt jako v 6. týdnu (graf 3). Bezpečnostní profil kombinace ER niacin/LRPT byl obdobný jako u ER niacinu [36].
ER niacin/LRPT vedl k signifikantně nižšímu výskytu všech předem specifikovaných primárních „flushing endpoints“ (tj. výskyt, intenzita, ukončení léčby pro flush) [36]. Během prvního týdne léčby ER niacinem/LRPT vykazovalo flush o 65 % pacientů méně ve srovnání s léčbou ER niacinem samotným (p < 0,001) a tyto nežádoucí epizody byly kratší (1 vs. 60 minut), viz graf 2. Po 6. týdnu léčby fixní kombinací ER niacin/LRPT se výskyt epizod flushe přiblížil četnosti výskytu u pacientů, kteří dostávali placebo, zatímco u jedinců léčených ER niacinem samotným byl zjištěn stejně častý výskyt jako v 6. týdnu (graf 3). Bezpečnostní profil kombinace ER niacin/LRPT byl obdobný jako u ER niacinu [36].
![Graf 3 Četnost výskytu a intenzita flushe v průběhu 1.–24. týdne podávání niacinu s prodlouženým uvolňováním (ER niacin), fixní kombinace ER niacin/laropiprant a placeba; podle [36] – Maccubbin, et al., 2008.](https://www.remedia.cz/photo-a-28041---.jpg) Tato studie tedy potvrdila, že kombinovaný přípravek ER niacin/LRPT významně snižuje výskyt flushe, což umožňuje jednodušší titraci dávky niacinu a dosažení jeho účinné terapeutické dávky 2 g/den. V této dávce ER niacin/LRPT významně ovlivňuje všechny hlavní lipoproteinové třídy zhruba o 20 % („pravidlo 20“), což skýtá předpoklad kardioprotektivního účinku, který byl prokázán v předchozích studiích s niacinem.
Tato studie tedy potvrdila, že kombinovaný přípravek ER niacin/LRPT významně snižuje výskyt flushe, což umožňuje jednodušší titraci dávky niacinu a dosažení jeho účinné terapeutické dávky 2 g/den. V této dávce ER niacin/LRPT významně ovlivňuje všechny hlavní lipoproteinové třídy zhruba o 20 % („pravidlo 20“), což skýtá předpoklad kardioprotektivního účinku, který byl prokázán v předchozích studiích s niacinem.
Další velká mezinárodní randomizovaná dvojitě zaslepená studie fáze III trvala 12 týdnů a srovnávala lipidy modifikující účinky ER niacinu/LRPT v kombinaci se simvastatinem (n = 609) oproti ER niacinu/LRPT samotnému (n = 195) a proti simvastatinu samotnému (n = 594) [37]. Tato studie měla 7 paralelních větví (1 větev ER niacin/LRPT samotný, 3 větve s kombinací ER niacin/LRPT s různými dávkami simvastatinu a další 3 větve s různými dávkami simvastatinu samotného). V prvních 4 týdnech byla dávka ER niacinu/LRPT 1 g/20 mg a dávky simvastatinu ve třech různých větvích 10 mg, 20 mg a 40 mg (a to jak samostatně, tak v kombinaci s ER niacin/LRPT) a tyto dávky byly zvýšeny ve 4. týdnu u kombinace ER niacin/LRPT na 2 g/40 mg a na 20 mg, 40 mg a 40 mg u simvastatinu.
Kombinace ER niacin/LRPT + simvastatin (všechny dávky simvastatinu hodnoceny dohromady) významně zlepšila klíčové lipidové parametry ve srovnání se samotnou kombinací ER niacin/LRPT i ve srovnání se samotným simvastatinem. Pokles hladiny LDL-C ve 12. týdnu léčby proti vstupním hodnotám ve výše uvedených skupinách představoval -47,9 %, -17,0 % a -37,0 %. Hladina HDL-C stoupla o 25,7 %, 23,4 % a 6,0 %. Lp(a) byl ovlivněn pouze ve větvích s kombinací ER niacin/LRPT, a nikoliv ve větvích se statinem samotným: ve 12. týdnu byl zjištěn pokles -19,8 %, -25 % a 0 %. Zajímavý byl též pokles hladiny apolipoproteinu (apo B) v jednotlivých větvích této studie. Apo B je ukazatelem počtu aterogenních lipoproteinových částic, neboť každá tato částice obsahuje pouze jednu molekulu apo B-100. Je známo, že statiny snižují hladinu LDL-C procentuálně více než apo B a vysoké procento osob dosahujících cílové hodnoty LDL-C zůstává ponecháno s vysokou koncentrací apo B, což představuje významné reziduální riziko [38]. Nejvíce je to patrné u jedinců s přítomností většího množství malých hustých LDL částic ochuzených o cholesterol, jako např. u nemocných s metabolickým syndromem a diabetem, kteří mají charakteristickou aterogenní dyslipidemii. Zatímco ER niacin samotný snížil ve výše uvedené studii hladiny LDL-C i apo B procentuálně stejně (-17,0 % vs. -17,1 %), simvastatin samotný snížil hladiny LDL-C o 37,0 % a apo B jen o 28,8 % [37]. To by mohlo svědčit pro větší ovlivnění malých hustých LDL částic niacinem ve srovnání se simvastatinem.
Tato studie potvrdila, že ER niacin/LRPT v kombinaci se simvastatinem významně upravuje celý lipidový profil ve srovnání se samotným ER niacinem i samotným simvastatinem a je dobře tolerován [37].
Zařazení do současné palety léčiv
Jak již bylo uvedeno výše, statiny představují léky první volby prakticky u všech forem dyslipidemií s výjimkou těžké hypertriglyceridemie (> 7 mmol/l), a to jak u nediabetiků, tak u diabetických pacientů. Nicméně velké procento pacientů takto léčených vykazuje vysoké reziduální riziko, a to zejména pacienti s aterogenní dyslipidemií, charakterizovanou snížením hladiny HDL-C, zvýšením hladiny triglyceridů a zmnožením malých hustých LDL. K ovlivnění tohoto typu dyslipidemie jsme měli zatím k dispozici do kombinace se statiny pouze fibráty (konkrétně fenofibrát), efektivně snižující hladinu triglyceridů. Nicméně účinek fenofibrátu na HDL-C je podstatně menší než účinek niacinu. Ve studii FIELD u diabetiků 2. typu např. mikronizovaný fenofibrát, který byl podáván v dávce 200 mg/den, zvýšil hladinu HDL-C po 5 letech trvání studie pouze o 2 % ve srovnání s placebem [39]. Ve velkých intervenčních studiích u diabetiků 2. typu vedla léčba fenofibrátem samotným [39] či v kombinaci se statinem [40] k signifikantnímu snížení výskytu kardiovaskulárních příhod pouze v podskupinách pacientů, kteří měli zvýšení hladiny triglyceridů ≥ 2,3 mmol/l a současné snížení HDL-C ≤ 0,9 mmol/l. Navíc, fenofibrát přidaný k léčbě statinem ve studii ACCORD nevedl k dalšímu snížení hladiny LDL-C [40].
Jak zvýšení koncentrace HDL-C, tak výsledky dosavadních intervenčních studií s niacinem jsou tedy příznivější než výsledky studií s fenofibrátem, a to i přes skutečnost, že niacin mírně zvyšuje glykemii. Naproti tomu léčba fenofibrátem přináší pozitivní ovlivnění mikrovaskulárních diabetických komplikací [39–42], zatímco údaje o tom, jak tyto komplikace ovlivňuje niacin, doposud chybějí. Předpokládá se, že rozhodující výsledky přinesou velké intervenční studie s klinickými „endpointy“ posuzující přidání ER niacinu (studie AIM HIGH) a kombinace ER niacin/LRPT (studie HPS2 THRIVE) k léčbě statiny [43].
Niacin (včetně kombinovaného přípravku ER niacin/LRPT) jako jediné dostupné hypolipidemikum ovlivňuje Lp(a), který je velmi závažným kauzálním rizikovým faktorem ischemické choroby srdeční, jak prokázaly poslední velké studie [44, 45]. Plazmatické koncentrace Lp(a) jsou vesměs geneticky determinovány a jsou jen nepatrně ovlivnitelné faktory životního stylu.
Na základě doporučení Evropské aterosklerotické společnosti (EAS) by pacienti s vysokým nebo intermediárním rizikem KV onemocnění měli mít vyšetřeny hladiny Lp(a) a měli by být léčeni niacinem s cílem snížit jeho hladiny pod 50 mg/dl [46]. Tato indikace není zatím bohužel zahrnuta do SPC kombinovaného přípravku ER niacin/LRPT.
Nicméně podle současných Doporučení pro diagnostiku a léčbu dyslipidemií ČSAT [5] se při přítomnosti vysokých hladin Lp(a) absolutní riziko mortality na KV onemocnění zvyšuje a tito pacienti vyžadují zahájení farmakoterapie dříve, než by odpovídalo výši KV rizika dle tabulek SCORE, a je nutno u nich zvážit nižší cílovou hodnotu LDL-C.
Indikace
Kombinovaný přípravek ER niacin/laropiprant je určen k léčbě pacientů se smíšenou dyslipidemií (se zvýšením hladin LDL-C, triglyceridů a s nízkou koncentrací HLD-C) a u pacientů s primární hypercholesterolemií (heterozygotní familiární i nefamiliární), a to v kombinaci s inhibitory reduktázy HMG-CoA (statiny) u těch jedinců, kde statiny samotné nejsou schopny upravit hladiny cholesterolu k žádoucím hodnotám. V monoterapii jej lze použít pouze u pacientů, u nichž je použití statinů nevhodné nebo kteří léčbu statiny netolerují. Během terapie je samozřejmě nutné pokračovat v režimových opatřeních, jako je dieta, snižování hmotnosti a fyzická aktivita.
Kontraindikace
Mezi hlavní kontraindikace léčby kombinovaným přípravkem ER niacin/laropiprant patří samozřejmě hypersenzitivita na léčivé látky nebo na kteroukoliv pomocnou látku tohoto přípravku (např. nesnášenlivost laktózy). Použití kombinovaného přípravku ER niacin/laropiprant u pacientů s poruchou funkce jater nebylo studováno. Avšak vzhledem k tomu, že při léčbě kyselinou nikotinovou byly popsány (podobně jako po terapii dalšími přípravky snižujícími hladiny lipidů) abnormality jaterních testů, je podávání i tohoto preparátu kontraindikováno u jedinců s významnou nebo neobjasněnou poruchou funkce jater. U pacientů, kteří přecházejí z léčby kyselinou nikotinovou s okamžitým uvolňováním na léčbu kombinovaným přípravkem ER niacin/laropiprant, se musí terapie zahajovat dávkou 1000 mg/20 mg, neboť po přechodu z terapie vyššími dávkami na léčbu kombinovaným přípravkem podávaným ve stejných dávkách se vyskytly ojedinělé případy závažné hepatální toxicity. Opatrnosti je zapotřebí též u osob konzumujících větší množství alkoholu nebo majících v anamnéze postižení jater. Testy jaterních funkcí se doporučuje provést před zahájením léčby, každých 6 až 12 týdnů v prvním roce a poté pravidelně (např. dvakrát ročně) v průběhu léčby. Pacienty, u nichž se zvýšení hladin transamináz objeví, je nutno sledovat do vymizení abnormalit. Pokud zvýšení hodnot alaninaminotransferázy (ALT) nebo aspartataminotransferázy (AST) dosahující ≥ 3násobku horní hranice normálu (ULN) přetrvává, doporučuje se snížení dávky nebo ukončení léčby.
Mezi další kontraindikace patří aktivní vředová léze a arteriální krvácení. Vzhledem k tomu, že kyselina nikotinová a její metabolity se vylučují ledvinami, je nutné též obezřetné podávání kombinovaného přípravku ER nacin/laropiprant u pacientů s poruchou funkce ledvin.
Jelikož je kyselina nikotinová indikována k léčbě dyslipidemie především v kombinaci se statiny, je nutno zvažovat i možnost vzniku myopatie/rabdomyolýzy, které byly při této kombinované léčbě vzácně popsány. Mezi rizikové faktory predisponující k rabdomyolýze patří porucha funkce ledvin, věk nad 70 let, hypotyreóza, nadměrné užívání alkoholu, dědičné svalové poruchy či předchozí výskyt myopatie po léčbě statiny či fibráty a lékové interakce vedoucí ke zvýšení plazmatických hladin statinů. Pacient musí být na možnost tohoto nežádoucího účinku upozorněn a poučen, že při výskytu svalových bolestí a/nebo svalové slabosti je zapotřebí vyhledat lékaře a provést vyšetření krve se stanovením hladin sérové kreatinkinázy. Pokud se zjistí, že jsou bez předchozí vyčerpávající zátěže výrazně zvýšeny (> 5násobek horní hranice normy), je nutno léčbu ukončit.
Kreatinkináza by měla být v průběhu léčby monitorována, i když ani toto opatření nemusí zabránit vzniku závažné myopatie. Důležitý pro prevenci tohoto vzácného, ale závažného nežádoucího účinku je tedy především poučený a spolupracující pacient a vnímavý lékař.
Nežádoucí účinky
Jak již bylo popsáno výše, nejčastějším nežádoucím účinkem léčby niacinem je flush. Může se projevovat jako zarudnutí kůže (nejčastěji v oblasti hlavy a horní poloviny těla), pocity horka, pálení, svědění nebo brnění. Z klinického hlediska je tento nežádoucí účinek benigní, ale některými jedinci je vnímán velmi nepříznivě a je nejčastějším důvodem přerušení léčby kyselinou nikotinovou [10]. Jelikož kyselina nikotinová a její metabolity jsou vylučovány močí, je nutné používat i kombinovaný přípravek ER niacin/laropiprant u pacientů s poruchou funkcí ledvin velmi obezřetně. Vzhledem k možnosti vzácného postižení jater při podávání všech forem kyseliny nikotinové je třeba opatrnosti i u osob s anamnézou předchozího jaterního onemocnění.
Podávání kombinovaného přípravku ER niacin/laropiprant může být spojeno i s dalšími nežádoucími účinky, které jsou popisovány při léčbě kyselinou nikotinovou, jako je mírné zvýšení hladin glukózy nalačno a hladin kyseliny močové, jakož i mírné snížení hladin trombocytů a fosforu. Je proto nutné pečlivě sledovat diabetické pacienty a nemocné s poruchou glukózové tolerance, kteří někdy mohou vyžadovat úpravu diety či antidiabetické léčby. Opatrnosti je též třeba u pacientů s anamnézou dny či hypofosfatemie. Pacienty vyžadující chirurgický zákrok a užívající ER niacin 2000 mg/ laropiprant 40 mg je třeba pečlivě hodnotit s ohledem na možnost krvácení.
Opatrnosti je též zapotřebí u pacientů s nestabilní anginou pectoris či s akutním infarktem myokardu, zvláště pokud jsou léčeni nitráty, blokátory kalciových kanálů či adrenergními blokátory.
Lékové interakce
Kyselina nikotinová
Při současném podávání niacinu se simvastatinem bylo pozorováno mírné zvýšení AUC a cmax aktivního metabolitu simvastatinu (kyseliny simvastatinové), nicméně klinický význam a mechanismus této interakce není zatím znám [32]. Interakce s ostatními statiny nebyly dosud studovány.
Vstřebávání niacinu by mohlo být ovlivněno současným podáváním sequestrantů žlučových kyselin, podobně jako je tomu u dalších kyselých léčivých přípravků. Je proto doporučováno podávat kombinovaný přípravek ER niacin/laropiprant alespoň 1 hodinu před podáním sequestrantů žlučových kyselin nebo 4 hodiny po jejich podání.
Kyselina nikotinová může potencovat účinky gangliových blokátorů a vazoaktivních léčiv, jako jsou nitráty, blokátory kalciových kanálů a adrenergní blokátory, což může vést k posturální hypertenzi.
Laropiprant
Po podávání laropiprantu bylo pozorováno mírné zesílení inhibičního účinku klopidogrelu na agregaci destiček indukovanou kolagenem. Tento vliv však pravděpodobně není klinicky významný, neboť při současném podávání laropiprantu s klopidogrelem nedošlo k prodloužení času krvácení [33]. V klinickém hodnocení nemělo současné podávání laropiprantu s kyselinou acetylsalicylovou žádný vliv na kolagenem indukovanou agregaci destiček ani na čas krvácení. Klinické hodnocení u pacientů, kteří užívali současně kyselinu acetylsalicylovou i klopidogrel s kombinovaným přípravkem ER niacin/laropiprant, však nevyloučilo možnost prodloužení času krvácivosti [32]. Pacienti, kteří vyžadují tuto kombinovanou léčbu, by proto měli být obezřetně sledováni.
Naproti tomu farmakokinetický profil warfarinu není laropiprantem ovlivněn. Opakované podání laropiprantu může zvýšit až dvojnásobně hladiny aktivního metabolitu midazolamu, a tím posílit jeho sedativní účinek, což je nutné v klinické praxi zohlednit [32]. Neočekavá se, že by laropiprant způsoboval interakce se substráty izoenzymů CYP 3A4, 2C9, 2C8 a lidskeho P-glykoproteinu [32].
Těhotenství
O použití fixní kombinace ER niacin/ LRPT u těhotných žen nejsou k dispozici žádné údaje. Tato kombinace nebyla ve studiích reprodukční toxicity testována a potenciální riziko pro člověka není známo. Rovněž nebyly provedeny žádné studie u kojících zvířat. Rozhodnutí o tom, zda pokračovat v kojení, nebo je přerušit či zda pokračovat, nebo nepokračovat v léčbě, musí být učiněno s ohledem na přínos kojení pro dítě a přínos podávání přípravku pro ženu.
Dávkování a způsob podání
Dávkování a způsob podání jsou pro omezení nežádoucích účinků (především flushe) a zajištění dlouhodobé spolupráce pacientů nesmírně důležité, a je proto zapotřebí věnovat tomuto postupu mimořádnou pozornost. Řádná a podrobná edukace pacienta v tomto směru je nesmírně důležitá!
Zahajovací dávku představuje jedna tableta (1000 mg ER niacinu/20 mg laropiprantu) denně, po čtyřech týdnech se přechází na podávání udržovací dávky 2000 mg/40 mg užívané jako dvě tablety (1000 mg ER niacinu/20 mg laropiprantu) s řízeným uvolňováním jednou denně. Denní dávky vyšší než 2000 mg/40 mg nebyly hodnoceny, a tudíž se jejich podávání nedoporučuje. Pokud se léčba kombinovaným přípravkem ER niacin/laropiprant vynechá po dobu 7 a více po sobě jdoucích dnů, musí být obnovena dávkou 1000 mg/20 mg podávanou po dobu 1 týdne.
Tablety je nutno užívat v celku, spolu s jídlem, večer nebo před ulehnutím. Před polknutím se nesmí tableta dělit, rozlamovat, drtit ani žvýkat, aby nedošlo k narušení vlastností zajišťujících řízené uvolňování. V době užití přípravku je nutno se vyhýbat pití alkoholu a horkých nápojů nebo konzumaci kořeněných jídel, čímž se sníží možnost vzniku flushe.
Závěr
Kyselina nikotinová (niacin) ovlivňuje příznivě prakticky všechny proaterogenní lipoproteinové abnormality. Její nejčastější nežádoucí účinek – flush – je příčinou obtížného dosahování terapeutických dávek a špatné adherence k léčbě. Kombinovaný přípravek s fixní kombinací ER niacinu a laropiprantu si ponechává účinky kyseliny nikotinové na modifikaci lipidového spektra a významně snižuje frekvenci epizod a intenzitu flushe. Léčivý přípravek obsahující fixní kombinaci ER niacin/laropiprant bude tedy představovat významné rozšíření našich možností při léčbě dyslipidemií. Probíhající velké intervenční studie AIM-HIGH a HPS2-THRIVE, jejichž výsledky jsou očekávány v horizontu 1–3 let, poskytnou lepší náhled na prospěšnost léčby niacinem, jakož i na bezpečnost a účinnost kombinovaného přípravku ER niacin/laropiprant.
Práce byla částečně podpořena grantem NS/10284.
Seznam použité literatury
- [1] Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomized trials of statins. Lancet 2005; 366: 1267–1278.
- [2] Cholesterol Treatment Trialists' (CTT) Collaborators. Efficacy of cholesterol-lowering treatment in 18,686 people with diabetes in 14 randomized trials of statins: a meta-analysis. Lancet 2008; 371: 117–125.
- [3] Grundy SM, Cleeman JI, Merz CNB, et al. Implication of Recent Clinical Trials for the National Cholesterol Education Program Adult Treatment Panel III Guidelines. Circulation 2004; 110: 227–239.
- [4] Graham J, Atar D, Borch-Johnsen K, et al. European guidelines on cardiovascular disease prevention in clinical practice: executive summary: Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (Constituted by representatives of nine societies and by invited experts). Eur Heart J 2007; 28: 2375–2414.
- [5] Vaverková H, Soška V, Rosolová H, Češka R, et al. Czech Atherosclerosis Society Guidelines for the Diagnosis and Treatment of Dyslipidemias in Adults (Doporučení pro diagnostiku a léčbu dyslipidemií v dospělosti, vypracované výborem České společnosti pro aterosklerózu). Cor Vasa 2007; (Suppl. 11/49): 47–60.
- [6] Di Angelantonio E, Sarwar N, Perry P, et al. Major lipids, apolipoproteins, and risk of vascular disease. JAMA 2009; 302: 1993–2000.
- [7] Barter PJ, Gotto AM, LaRosa JC, et al. Treating to New Targets Investigators. HDL cholesterol, very low levels of LDL cholesterol, and cardiovascular events. N Engl J Med 2007; 357: 1301–1310.
- [8] Sarwar N, Danesh J, Eiriksdottir G, et al. Triglycerides and the risk of coronary heart disease: 10,158 incident cases among 262,525 participants in 29 Western prospective studies. Circulation 2007; 115: 450–458.
- [9] Miller M, Cannon CP, Murphy SA, et al. Impact of triglyceride levels beyond low-density lipoprotein cholesterol after acute coronary syndrome in the PROVE IT-TIMI 22 trial. J Am Coll Cardiol 2008; 51: 724–730.
- [10] Kamal-Bahl SJ, Burke T, Watson D, Wentworth C. Discontinuation of lipid modifying drugs among commercially insured United States patients in recent clinical practice. Am J Cardiol 2007; 99: 530–534.
- [11] Benyo Z, Gille A, Kero J. GPR109A (PUMA-G/HM74A) mediates nicotinic acid-induced flushing. J Clin Invest 2005; 115: 3634–3640.
- [12] Karpe F, Chamas L. Hyperlipidemia and cardiovascular disease: nonantilipolytic effects of nicotinic acid in adipose tissue. Curr Opin Lipidol 2010; 21: 282–283.
- [13] Kamanna VS, Kashyap ML. Mechanism of action of niacin. Am J Cardiol 2008; 101(8A): 20B–26B.
- [14] Vogt A, Kassner U, Hostalek U, et al. Evaluations of safety and tolerability of prolonged-release nicotinic acid in a usual care setting: the NAUTILUS Study. Curr Med Res Opin 2006; 22: 417–425.
- [15] Capuzzi DM, Guyton JR, Morgan JM, et al. Efficacy and safety of an extended-release niacin (Niaspan): a long-term study. Am J Cardiol 1998; 82: 74U–81U.
- [16] Kamanna VS, Kashyap ML. Nicotinic acid (niacin) receptor agonists: will they be useful therapeutic agents? Am J Cardiol 2007; 100 (11A): S53–S61.
- [17] Ganji SH, Qin S, Zhang L, et al. Niacin inhibits vascular oxidative stress, redox-sensitive genes, and monocyte adhesion to human aortic endothelial cells. Atherosclerosis 2009; 202: 68–75.
- [18] Digby JE, McNeill E, Dyar OJ, et al. Anti-inflammatory effects of nicotinic acid in adipocytes demonstrated by suppression of fractalkine, RANTES, and MCP-1 and up regulation of adiponectin. Atherosclerosis 2010; 209: 89–95.
- [19] Bays HE, Maccubbin D, Meehan AG, et al. Blood pressure-lowering effects of extended-release niacin alone and extended-release niacin/laropiprant combination: a post hoc analysis of a 24-week, placebo-controlled trial in dyslipidemic patients. Clin Ther 2009; 31: 115–122.
- [20] Wu ZH, Zhao SP. Niacin promotes cholesterol efflux through stimulation of the PPARgama-LXRalpha-ABCA1 pathway in 3T3-L1 adipocytes. Pharmacology 2009; 84: 282–287.
- [21] Coronary Drug Project Research Group. Clofibrate and niacin in coronary heart disease. JAMA 1975; 231: 360–381.
- [22] Canner PL, Berge KG, Wenger NK, et al. Fifteen year mortality in Coronary Drug Project patients: long-term benefit with niacin. J Am Coll Cardiol 1986; 8: 1245–1255.
- [23] Carlson LA, Rosenhamer G. Reduction of mortality in the Stockholm Ischaemic Heart Disease Secondary Prevention Study by combined treatment with clofibrate and nicotinic acid. Acta Med Scand 1988; 223: 405–418.
- [24] Brown BG, Zhao XQ, Chait A, et al. Simvastatin and niacin, antioxidant vitamins, or the combination for the prevention of coronary disease. N Engl J Med 2001; 345: 1583–1592.
- [25] Blankenhorn DH, Nessim SA, Johnson RL, et al. Beneficial effects of combined colestipol-niacin therapy on coronary atherosclerosis and coronary venous bypass grafts. JAMA 1987; 257: 3233–3240.
- [26] Brown BG, Brockenbrough A, Zhao XQ, et al. Very intensive lipid therapy with lovastatin, niacin and colestipol for prevention of death and myocardial infarction: A 10-year familial atherosclerosis treatment study (FATS) follow up. Circulation 1998; 98: I-635.
- [27] Taylor AJ, Sullenberger LE, Lee HJ, et al. Arterial Biology for the Investigation of the Treatment Effects of Reducing Cholesterol (ARBITER) 2: a double-blind, placebo-controlled study of extended-release niacin on atherosclerosis progression in secondary prevention patients treated with statins. Circulation 2004; 110: 3512–3517.
- [28] Taylor AJ, Lee HJ, Sullenberger LE, et al. The effect of 24 month of combination statin and extended-release niacin on carotid intima-media thickness: ARBITER 3. Curr Med Res Opin 2006; 11: 2243–2250.
- [29] Taylor AJ,Villines TC, Stanek EJ, et al. Extended-release niacin or ezetimibe and carotid intima-media thickness. N Engl J Med 2009; 361: 2113–2122.
- [30] Bruckert E, Labreuche J, Amarenco P. Meta-analysis of the effect of nicotinic acid alone or in combination on cardiovascular events and atherosclerosis. Atherosclerosis 2010; 210: 353–361.
- [31] Sturino CF, O'Neil G, Lachance N, et al. Discovery of a potent and selective PGD2 receptor 1 antagonist [(3R)-4-(4-chlorobenzyl)-7-fluoro-5-(methylsulfonyl)-1,2,3,4-tetrahydrocyclopentaindol-3-yl]-acetic acid (MK-0524). J Med Chem 2007; 50: 794–806.
- [32] Merck Sharp & Dohme Ltd. Tredaptive European prescribing information [online]. Available from URL: http: //www.emea.europa.eu/humandocs/ PDFs/EPAR/tredaptive/H-889-PI-en.pdf [Accessed 2009 Aug 3].
- [33] Sanford M, Curran MP. Niacin extended-release/simvastatin. Drugs 2008; 68: 2372–2387.
- [34] Lai E, Wenning LA, Crumley TM, et al. Pharmacokinetics, pharmacodynamics and safety of a prostaglandin D2 receptor antagonist. Clin Pharmacol Ther 2008; 83: 840–847.
- [35] McCormack PL, Keating GM. Prolonged-release nicotinic acid: a review of its use in the treatment of dyslipidaemia. Drugs 2005; 65: 2719–2740.
- [36] Maccubbin D, Bays HE, Olsson AG, et al. Lipid-modifying efficacy and tolerability of extended-release niacin/laropiprant in patients with primary hypercholesterolemia or mixed dyslipidemia. Int J Clin Pract 2008; 62: 1959–1970.
- [37] Gleim G, Ballantyne CM, Liu N, et al. Efficacy and safety profile of co-administered ER niacin/laropiprant and simvastatin in dyslipidemia. Br J Cardiol 2009; 16: 90–97.
- [38] Sniderman AD. Differential response of cholesterol and particle measures of atherogenic lipoproteins to LDL lowering therapy: implications to clinical practice. J Clin Lipidol 2008; 2: 36–42.
- [39] The FIELD study investigators. Effects of long-term fenofibrate therapy on cardiovascular events in 9795 people with type 2 diabetes (the FIELD study): randomized controlled trial. Lancet 2005; 366: 1849–1861.
- [40] The ACCORD study group. Effects of combination lipid therapy in type 2 diabetes mellitus. N Engl J Med March 14, 2010; DOI: 10.1056/ NEJMoa1001282.
- [41] Rajamani K, Colman PG, Li LP, et al. on behalf of the FIELD study investigators. Effect of fenofibrate on amputation events in people with type 2 diabetes mellitus (FIELD study): a prespecified analysis of a randomised controlled trial. Lancet 2009; 373: 1780–1788.
- [42] The ACCORD Study Group and ACCORD Eye Study Group. Effects of Medical Therapies on Retinopathy Progression in Type 2 Diabetes. N Engl J Med June 29, 2010, DOI:10.1056/ NEJMoa1001288.
- [43] National Institutes of Health. Treatment of HDL to Reduce the Incidence of Vascular Events HPS2 THRIVE. http: //www.clinicaltrials. gov/ct2/show/ NCT00461630.
- [44] Kamstrup PR, Tybjaerg-Hansen A, Steffensen R, Nordestgard BG. Genetically Elevated Lipoprotein(a) and Increased Risk of Myocardial Infarction. JAMA 2009; 301: 2331–2339.
- [45] Danesh J, Collins R, Peto R. Lipoprotein(a) and coronary heart disease: meta-analysis of prospective studies. Circulation 2000; 102: 1082–1085.
- [46] The European Atherosclerosis Society. Cardiovascular risk reduction in atherogenic dyslipidemia: Beyond LDL-C and statins: EAS Press release on EAS Consensus Panel Lp(a). June 23, 2010, http://www.eas-society.org/consensus_position_paper_initiative.asp