Indakaterol maleát
Léčivou látku indakaterol maleát řadíme do skupiny β2-adrenergních agonistů s dlouhým účinkem. Indakaterol je téměř úplným agonistou b2-adrenoreceptorů, tj. má výrazně převyšující agonistickou aktivitu vůči b2-receptorům v porovnání s působením na β1- a β3-adrenoreceptory. V průběhu měření prováděných během 24 hodin indakaterol signifikantně zvyšuje prebronchodilatační i pobronchodilatační hodnoty usilovně vydechnutého objemu vzduchu za první sekundu výdechu (FEV1). Účinek nastupuje již za 5 minut po podání a nesnižuje se s délkou podávání. Klinickými studiemi byla prokázána větší účinnost indakaterolu ve srovnání s jinými látkami používanými v léčbě chronické obstrukční plicní nemoci (CHOPN), jako je formoterol, salmeterol a tiotropium. Nežádoucí účinky jsou málo četné a nezávažné. Přípravek s obsahem indakaterolu je určen k udržovací bronchodilatační léčbě obstrukce dýchacích cest u dospělých nemocných s CHOPN. Indakaterol je předepisován u nemocných s diagnózou CHOPN od středně těžkého stadia (stadium II), kteří dodržují zákaz kouření. Z veřejného zdravotního pojištění není kombinace indakaterol + tiotropium nemocným s CHOPN hrazena.
Farmakologická skupina
Indakaterol maleát patří do skupiny β2-adrenergních agonistů s dlouhým účinkem.
ATC kód je R03AC18.
Chemické a fyzikální vlastnosti
![Obr. 1 Chemický strukturní vzorec indakaterol maleátu; podle [39] – Moen, 2010.](https://www.remedia.cz/photo-a-28465---.jpg) Chemický vzorec indakaterol maleátu je (5-[(R)-2-(5,6-diethylindan-2-ylamino)1-hydroxy-ethyl]-8-hydroxy-1H-chinolin-2-on). Je to heterocyklický, lipofilní, aromatický uhlovodík se sumárním vzorcem C28H32N2O7 o molekulové hmotnosti 508,56 g/mol. Makroskopicky látka vypadá jako bílý, lehce našedlý nebo nažloutlý prášek, který je velmi obtížně rozpustný ve vodě, nerozpustný v roztoku 0,9% NaCl a v pufrovacím roztoku o pH 1–10. Stejně jako u ostatních β2-agonistů spočívají farmakokinetické vlastnosti indakaterolu v tom, že se jedná o chirální molekulu s R-konfigurací (obr. 1).
Chemický vzorec indakaterol maleátu je (5-[(R)-2-(5,6-diethylindan-2-ylamino)1-hydroxy-ethyl]-8-hydroxy-1H-chinolin-2-on). Je to heterocyklický, lipofilní, aromatický uhlovodík se sumárním vzorcem C28H32N2O7 o molekulové hmotnosti 508,56 g/mol. Makroskopicky látka vypadá jako bílý, lehce našedlý nebo nažloutlý prášek, který je velmi obtížně rozpustný ve vodě, nerozpustný v roztoku 0,9% NaCl a v pufrovacím roztoku o pH 1–10. Stejně jako u ostatních β2-agonistů spočívají farmakokinetické vlastnosti indakaterolu v tom, že se jedná o chirální molekulu s R-konfigurací (obr. 1).
Mechanismus účinku, farmakodynamika
Indakaterol je ultradlouhodobě působící agonista β2-adrenoreceptorů [1]. Tyto receptory stimulují nitrobuněčnou adenylcyklázu, což je enzym, který aktivuje přeměnu adenosintrifosfátu (ATP) na cyklický adenosin-3',5'-monofosfát (cAMP). Zvýšení koncentrace cAMP působí relaxaci hladké svaloviny.
Indakaterol má i další terapeutický účinek spočívající v tom, že stabilizuje žírné buňky [2]. In vitro inhibuje indakaterol v závislosti na koncentraci IgE zprostředkované uvolňování histaminu z lidských mastocytů [2]. Indakaterol též inhibuje IgE mediované uvolnění cysteinylových leukotrienů a prostaglandinu D2 z lidských žírných buněk [2].
Indakaterol je dlouhodobě působící β2-agonista účinný v nanomolárních koncentracích s rychlým nástupem účinku. Je téměř plným agonistou lidských β2-adrenoreceptorů. Jeho maximální účinek (Emax) dosahuje 73 ± 1 % maximálního účinku úplného agonisty β2-receptorů isoprenalinu. Pro srovnání, salmeterol má jen částečnou účinnost (Emax 38 6 1 %) [3, 4]. Podobně jako formoterol je indakaterol velmi slabým agonistou β1-adrenoreceptorů (Emax 16 %) a 20krát slabším agonistou β3-adrenoreceptorů [3].
![Obr. 2 Rozdílné působení salmeterolu a indakaterolu na buněčné membráně; podle [40] – Cazzola, et al., 2010.](https://www.remedia.cz/photo-a-28466---.jpg) Indakaterol má vysokou a dlouhotrvající β2-agonistickou aktivitu s rychlým nástupem účinku, což bylo prokázáno v pokuse prováděném in vitro na izolovaném lidském bronchu (např. vyvoláním relaxace a bronchodilatace) [3].
Indakaterol má vysokou a dlouhotrvající β2-agonistickou aktivitu s rychlým nástupem účinku, což bylo prokázáno v pokuse prováděném in vitro na izolovaném lidském bronchu (např. vyvoláním relaxace a bronchodilatace) [3].
Rychlejší nástup účinku a delší působení indakaterolu ve srovnání s jinými agonisty β2-receptorů mohou být způsobeny interakcí s lipidovou membránou [5]. Formoterol a indakaterol mají 2krát vyšší afinitu k lipidové membráně, která tvoří okolí β2-receptorů, než salmeterol a salbutamol. Díky ethylové skupině indakaterol rychle proniká do lipidové membrány a rozruší mikrookolí β2-receptorů, což umožňuje rychlý nástup jeho účinku. Indakaterol dlouhodobě setrvává v těsném kontaktu s b-receptory na raftové mikrodoméně buněčné membrány. Proto má indakaterol téměř úplný β2-agonistický a dlouhodobý účinek [5]. Navíc indakaterol neovlivňuje stabilitu membrán, naopak salmeterol mebrány destabilizuje, což zřejmě ovlivní funkce b-receptorů, a tak se snižuje účinnost salmeterolu [5]. Rozdíly v působení indakaterolu a salmeterolu ukazuje obr. 2.
Indakaterol, formoterol a salmeterol nevyvolávají tachyfylaxi, což prokázaly studie provedené nejprve na morčatech [3], posléze i při dlouhodobém podávání nemocným při klinických studiích [6–8].
U nemocných s CHOPN vykazuje indakaterol signifikantní bronchodilatační účinek trvající přibližně 24 hodin po podání [9, 10].
Ačkoli agonisté b-adrenoreceptorů mají významné nežádoucí kardiovaskulární účinky vyvolané přítomností β1- a β2-adrenoreceptorů v srdci [11], ukazuje se, že indakaterol na tyto receptory působí méně [12, 13]. Byly provedeny tři studie zabývající se vlivem indakaterolu na myokard. První studie trvala 7 dní (635 nemocných), druhá 28 dní (163 nemocných) a ve třetí byl indakaterol podán jednorázově (u 16 nemocných). V těchto studiích nebyly zaznamenány žádné významné abnormality EKG a rovněž incidence změn QT intervalu byla nízká jak u nemocných, kteří dostávali indakaterol opakovaně v dávkách od 50 do 800 µg 1krát denně, tak u pacientů, jimž byl podán indakaterol v jednorázové dávce 400–3000 µg [12]. Rovněž ve studii provedené na souboru 404 zdravých dobrovolníků, kteří dostávali indakaterol v dávce 150–600 µg denně po dobu 14 dní, nebyly zaznamenány žádné významné změny QT intervalu. Nebyly prokázány ani změny při korekci intervalu QT na QTc [13].
Farmakokinetické vlastnosti
Po inhalačním podání indakaterolu dosahuje absolutní biologická dostupnost 43 % [14–16]. Maximální sérové koncentrace (cmax) bylo dosaženo průměrně za 15 minut po inhalaci indakaterolu v dávce 150–600 µg [14–16], a to 252,9 pg/ml po inhalaci 150 µg a 537,2 pg/ml po podání dávky 300 µg [16]. Tomu odpovídající plocha pod křivkou sérové koncentrace a času (AUCs) v intervalu 0–24 hodin (AUC24) byla 1202 pg.h/ml, resp. 2639 pg.h/ml [16]. Systémová expozice u indakaterolu se s dávkou 150–600 µg zvyšuje proporcionálně, což bylo prokázáno ve 14. den [16]. Rovnovážného stavu koncentrace indakaterolu v séru bylo dosaženo po 12–14 dnech podávání 1krát denně s poměrem akumulace 2,9–3,5 ve čtrnáctý den v porovnání s prvním dnem, vyjádřeno plochou pod křivkou AUC24 [14, 15]. V rovnovážném stavu (den 14) bylo dosaženo cmax 438,6 pg/ml po podávání dávky 150 µg 1krát denně, u indakaterolu podávaného v dávce 300 µg to bylo 858,6 pg/ml s odpovídající plochou pod křivkou AUC24 3882 pg.h/ml, resp. 8137 pg.h/ml [16].
Distribuční objem indakaterolu po intravenózním podání byl 2557 l [14, 15]. Vazba indakaterolu na sérové proteiny změřená in vitro byla 94–96 % [14, 15].
Indakaterol a jeho metabolity se vylučují nejvíce biliární cestou. Ledvinami se vylučuje menší část. Indakaterol je metabolizován na hydroxylované deriváty převážně cytochromem P-450, přesněji enzymem CYP3A4 [9, 10]. Indakaterol a hydroxylované deriváty jsou dále metabolizovány na fenolické-O-glukuronidy indakaterolu a další metabolity (diastereomer hydroxylovaného derivátu, N-glukuronid indakaterolu a C- a N-dealkylované produkty) [14, 15]. Po perorálním podání se indakaterol vylučuje převážně v nezměněné formě stolicí (54 % dávky), 23 % vylučované dávky činí hydroxylované metabolity [14, 15]. Exkrece močí představuje méně než 2 % dávky [14, 15]. Průměr eliminačního poločasu indakaterolu je v rozsahu od 45,5 do 126 hodin [10, 14]. Na základě akumulace při opakovaném podávání byl efektivní poločas vypočítán na 40–49 hodin [16].
Farmakokinetika indakaterolu není významně ovlivňována věkem, pohlavím, tělesnou hmotností nebo rasou [14, 15]. Nebyly zjištěny změny ve farmakokinetice u osob s lehkým nebo středně těžkým jaterním poškozením, farmakokinetika nebyla ale vyšetřována u nemocných s těžkým poškozením jater. Neočekává se, že by zhoršení funkce ledvin ovlivnilo farmakokinetiku, protože vylučování ledvinami hraje jen malou úlohu v eliminaci indakaterolu [14, 15].
 Studie zabývající se farmakokinetickými interakcemi ukázaly, že expozice indakaterolu se současným podáváním inhibitorů CYP3A4, jako je ketokonazol a erythromycin v kombinaci s inhibitorem P-glykoproteinu verapamilem, zvyšuje koncentrace indakaterolu, ale tyto interakce nejsou klinicky významné [14, 15]. Farmakokinetické vlastnosti jsou shrnuty v tab. 1.
Studie zabývající se farmakokinetickými interakcemi ukázaly, že expozice indakaterolu se současným podáváním inhibitorů CYP3A4, jako je ketokonazol a erythromycin v kombinaci s inhibitorem P-glykoproteinu verapamilem, zvyšuje koncentrace indakaterolu, ale tyto interakce nejsou klinicky významné [14, 15]. Farmakokinetické vlastnosti jsou shrnuty v tab. 1.
Klinické zkušenosti
Účinnost a bezpečnost indakaterolu u nemocných s CHOPN byla ověřena v řadě klinických randomizovaných a placebem kontrovaných studií provedených ve fázi II a III.
Studie fáze II
Ve dvojitě slepé studii kontrolované placebem, která trvala 28 dní, byla zkoušena účinnost a bezpečnost dvou různých dávek indakaterolu (400 a 800 µg) podávaných 1krát denně ráno práškovým inhalátorem (DPI) u 163 nemocných s CHOPN (FEV1 30–70 %) náležitých hodnot. Nemocní byli randomizováni v poměru 2 : 2 : 1 tak, aby dostávali buď indakaterol, nebo placebo.
Obě dávky indakaterolu vedly k signifikantnímu zvýšení FEV1 ve 30. minutě po podání v den 1, 14 a 28, stejně jako ke zvýšení FEV1 před podáním dávky v den 14 a 28 v porovnání s placebem. Zvýšení při podání indakaterolu ve 30. minutě prvního dne léčby bylo 220 6 36 ml při podání 400 µg a 210 6 36 ml při podání dávky 800 µg. V den 14 nastalo za 30 minut po podání zlepšení oproti placebu o 320 ml, resp. o 270 ml, a v den 28 o 260 6 61 ml při dávce 400 µg, podání dávky 800 µg pak vedlo ke zlepšení o 200 6 61 ml (p < 0,01 pro všechny dávky ve srovnání s placebem). Žádné statisticky významné rozdíly v účinnosti mezi dávkou indakaterolu 400 a 800 µg nebyly prokázány. Rozdíly v prebronchodilatačních hodnotách FEV1 mezi dávkou 400 a 800 µg indakaterolu a placebem byly 220 6 49 ml, resp. 210 6 49 ml ve 28. den (p < 0,0001), stejně významné rozdíly byly zjištěny ve 14. den studie. Podobné změny jako u hodnot FEV1 byly zaznamenány v hodnotě usilovné vitální kapacity (FVC), což svědčí o možném ovlivnění hyperinflace.
Žádné signifikantní rozdíly v incidenci nežádoucích účinků nebyly zjištěny. Z nežádoucích účinků vyskytujících se při léčbě β2-agonisty byl u jednoho nemocného z každé skupiny léčené indakaterolem pozorován třes. Pět (7,5 %) nemocných léčených dávkou 800 µg indakaterolu si stěžovalo na bolesti hlavy. Nejčastějším nežádoucím účinkem ve skupině léčené indakaterolem byl kašel. Vyskytl se u 14,7 % nemocných léčených dávkou 400 µg a u 28,4 % nemocných léčených dávkou 800 µg. Kašel byl většinou mírný, objevoval se obvykle na začátku studie a s průběhem se zmírnil, takže na konci se jeho výskyt nelišil od výskytu u nemocných léčených placebem. Nebyly zjištěny žádné klinicky významné rozdíly v srdeční frekvenci nebo krevním tlaku mezi skupinou léčenou indakaterolem a placebem. Rovněž také nebyl zjištěn rozdíl v QTc intervalu. Statisticky významné rozdíly byly zjištěny mezi placebem a indakaterolem v hodnotách krevního tlaku, glykemie a sérové koncentrace kalia. Pří dávce indakaterolu 800 µg klesl systolický tlak měřený 1 hodinu po podání dávky ve 14. den studie z průměrné hodnoty před podáním 129,2 ± 17,6 mm Hg (SD) na 126,0 ±15,7 mm Hg (p < 0,05 vs. placebo); u pacientů, kteří dostávali indakaterol v dávce 400 µg, se diastolický tlak snížil z hodnoty 79,2 ± 11,4 mm Hg před podáním na 77,7 6 11,0 mm Hg za jednu hod. po podání v den 14 (p < 0,05 vs. placebo). Při léčbě indakaterolem se průměrná koncentrace kalia v séru snížila ze 4,46 6 0,33 mmol/l naměřených před podáním na hodnotu 4,41 ± 0,36 mmol/l (p < 0,05 vs. placebo) měřenou hodinu po podání dávky v den první. Hodnoty glykemie se zvýšily z 5,02 ± 1,14 mmol/l před podáním na 5,14± 0,67 mmol/l hodinu po podání (p < 0,05 vs. placebo) ve čtrnáctý den studie. Tyto malé změny krevního tlaku, glykemie a sérové koncentrace kalia však nebyly klinicky významné. Indakaterol v dávce 400 a 800 µg vykazuje významné bronchodilatační účinky již za 30 min. po podání a tyto účinky trvají 24 hodin. Nebylo prokázáno snížení účinnosti ani po 28 dnech podávání [17].
Cílem další dvojitě slepé placebem kontrolované studie bylo zjistit účinnost a snášenlivost indakaterolu podávaného v dávce 50, 100, 200 nebo 400 µg vícedávkovým práškovým inhalátorem (MDD-PI) nebo v dávce 400 µg podávané jednodávkovým práškovým inhalátorem (SDDPI). Každá dávka byla podávána po 7 dní. V pokračovací fázi této studie dostávali nemocní otevřenou formou tiotropium. Do studie bylo zařazeno 635 nemocných s CHOPN (věk 40–75 let; FEV1 40 % náležité hodnoty).
Z nežádoucích účinků se nejčastěji vyskytovala bolest hlavy a kašel se stejnou incidencí u všech dávek (3,6–6,7 %). Kašel se objevoval ve srovnání s placebem častěji u skupiny léčené indakaterolem (2,9–12,5 %), v placebové větvi byl zjištěn u 0,9 % nemocných. Incidence tohoto jevu s délkou podávání klesala. Průměrné hodnoty koncentrace kalia v séru a glykemie se u nemocných léčených různě vysokými dávkami indakaterolu nelišily. Nebyly zjištěny ani klinicky závažné změny v tepové frekvenci, systolickém a diastolickém tlaku, ani v QTc intervalu.
Sériová měření FEV1 začínající za 5 minut po podání a končící za 24 hodin po podání prokázala, že všechny dávky indakaterolu ve srovnání s placebem signifikantně zvýšily hodnotu FEV1 vyjádřenou plochou pod křivkou (AUC) v den 1 a 7 (p < 0,001). V první den byla dávka 400 µg statisticky významně účinnější než dávka 100 a 50 µg při všech měřeních (p < 0,05) i než dávka 200 µg při měření za 5 minut až za 12 hodin s výjimkou měření za 15 minut a za 1 hodinu.
Prebronchodilatační hodnoty FEV1 byly v 7. den studie signifikantně vyšší při podávání indakaterolu ve všech studovaných dávkách (p < 0,001). Tyto nálezy prokazují, že indakaterol má ve všech testovaných dávkách rychlý nástup účinku (již za 5 minut) a že tento účinek trvá 24 hodin. Maximálního účinku je dosaženo za 3 hodiny po podání. Podobné výsledky byly získány pro hodnoty FVC.
V otevřené fázi studie, při porovnávání účinku indakaterolu a tiotropia, byly hodnoty FEV1 u indakaterolu měřené mezi 0.–4. hodinou signifikantně lepší v den první i sedmý a pro hodnoty měřené mezi 22.–24. hodinou v den sedmý [9].
Další dvojitě slepá zkřížená studie porovnávala podávání indakaterolu a formoterolu. Po dobu 24 hodin byla sledována účinnost indakaterolu podávaného 1krát denně v dávce 150, 300 a 600 µg ve srovnání s placebem nebo s formoterolem podávaným 2krát denně. Studie se zúčastnilo 51 nemocných se středně těžkou nebo těžkou CHOPN (věk 40–75 let, hodnota prebronchodilatačního FEV1 < 65 %). Každá z pěti vizit byla oddělena šesti dny bez léčby. Byly sledovány hodnoty prebronchodilatačního FEV1, plocha pod křivkou pro FEV1 za 30 min.–4 hod. (AUC 30min-4h). Všechny změřené hodnoty prebronchodilatačního FEV1 byly u všech dávek indakaterolu i formoterolu ve srovnání s placebem signifikantně lepší (p < 0,001). Rovněž bylo prokázáno, že 600 a 300 µg je účinnějších než dávka 150 µg i než formoterol v čase 24 hodin. Změny FVC byly podobné jako u hodnot FEV1. Nejčastějším nežádoucím účinkem byl lehký a přechodný kašel (3,9–6,4 %). Ukázalo se, že indakaterol může být podáván 1krát denně a že dávky 600 a 300 µg byly účinnější než dávka 150 µg [10].
V další studii byla porovnávána účinnost indakaterolu v dávce 300 µg oproti placebu a formoterolu. Tato studie byla uspořádána ve třech fázích. První dvě fáze byly randomizované, dvojitě slepé. Nemocní dostávali buď indakaterol, nebo placebo. Během třetí fáze, která nebyla zaslepená, dostávali nemocní formoterol v dávce 12 µg 2krát denně. Měření byla prováděna do 8 hodin a pak za 23 a 24 hodin. Obě léčivé látky při všech měřeních ovlivňovaly FEV1 a inspirační kapacitu (IC) více než placebo. Maximální bronchodilatační efekt vyjádřený změnou FEV1 byl u indakaterolu a formoterolu srovnatelný. Maximální účinek indakaterolu naIC byl ale větší. Indakaterol měl větší účinek než formoterol na FEV1 v 8. a 24. hodině a účinek na IC byl nejvyšší mezi 4.–24. hodinou [18].
Studie fáze IIb se zúčastnilo 801 nemocných se středně těžkou nebo těžkou CHOPN. Tato studie měla dvě stadia. V prvním stadiu na začátku dostávali nemocní nejméně 2 týdny indakaterol v různých dávkách (75, 150, 300 nebo 600 µg), placebo nebo formoterol. Látky byly podávány dvojitě zaslepeně prostřednictvím SDDPI. V dalším rameni bylo podáváno otevřenou formou 18 µg tiotropia. Výsledky získané po 2 týdnech léčby pak vyhodnocovala skupina nezávislých expertů. Podle hodnoty prebronchodilatačního FEV1 a FEV1 AUC1-4h byla stanovena nejnižší a druhá nejnižší dávka indakaterolu, která byla účinnější než formoterol a tiotropium v obou parametrech. V těchto kritériích byl nejúčinnější indakaterol v dávce 150 µg a vyšší. Proto byly vybrány pro další studium dávky 150 µg a 300 µg. Při podávání těchto dávek se zvýšily hodnoty prebronchodilatačního FEV1 průměrně o 180 ml, respektive o 210 ml [19].
Studie fáze III
V těchto studiích probíhajících až 52 týdnů byly zkoušeny různé dávky indakaterolu. Většiny studií se zúčastnili nemocní s CHOPN ve stadiu středně těžkém nebo těžkém. Nejčastěji byly sledovány následující parametry:
- hodnota prebronchodilatačního FEV1 za 24 hodin po podání látky v různé dny během studie (obvykle první den, uprostřed a na konci studie);
- hodnota FEV1 od 5 minut do 24 hodin po podání se sledováním začátku bronchodilatačního působení;
- hodnota FEV1 vyjádřená plochou pod křivkou (AUC), v některých studiích byl tento parametr sledován v časných stadiích (za 30 min.–4 hod. nebo za 1–4 hod.) a za 22–24 hod.;
- ovlivnění počtu exacerbací;
- kvalita života.
Účinnost indakaterolu jako udržovací léčby byla zhodnocena ve 4 publikovaných (zařazeno více než 400 nemocných) studiích, které byly randomizované, paralelně probíhající, dvojitě slepé [20–23], a v jedné velké randomizované dvojitě slepé studii fáze III, v níž byl zkoušen i salmeterol [24].
Do těchto pěti studií byli zařazeni nemocní ve věku 40 a více let se spotřebou cigaret ≥ 10 krabičkoroků [24] nebo ≥ 20 krabičkoroků [10, 20, 22, 23]. K vylučovacím kritériím patřilo astma, vyžadování dlouhodobé léčby kyslíkem a nutnost hospitalizace pro exacerbaci CHOPN nebo respirační infekci v období 6 týdnů před zahájením studie [15, 19, 21, 22, 24]. Průměrný věk nemocných byl 62–64 let s převahou mužů (51–82 %). Ve velmi těžkém nebo těžkém stadiu nemoci se nacházelo 38–48 % pacientů. Pobronchodilatační FEV1 na začátku studií dosahoval 50,8–56,3 % náležité hodnoty, poměr FEV1/FVC byl 50,0–53,5 % [20, 21–24].
Studie INHANCE (INdacaterol vs tiotropium to Help Achieve New COPD treatment Excellence) měla 3 fáze. Cílem první jednoduché fáze bylo zjistit optimální dávkování indakaterolu [21]. Ve druhé fázi byli nemocní randomizováni zaslepeně do větve užívající indakaterol v dávce 150 µg (416 nemocných) nebo 300 µg (416 nemocných) nebo placebo prostřednictvím jednodávkového inhalátoru (SDD-PI – Single Dose Dry Powder Inhaler), nebo do větve s otevřenou formou podávání tiotropia v dávce 18 µg 1krát denně komerčně vyráběným inhalátorem. Tato část studie trvala 26 týdnů [21], v rameni léčeném indakaterolem nebo placebem pokračovala studie dalších 26 týdnů. Cílem bylo ověřit bezpečnost podávaného indakaterolu.
Studie INVOLVE (INdacaterol: Value in COPD pulmOnary disease: Longer term Validation of Efficacy and safety) trvala 52 týdnů. Cílem bylo zjistit účinnost a bezpečnost indakaterolu [22]. V této studii nemocní dostávali buď indakaterol v dávce 300 µg (437 pacientů), 600 µg (425 nemocných) 1krát denně jednodávkovým inhalátorem (SDDPI), formoterol 12 µg 2krát denně, nebo placebo.
Ve 12týdenní studii INLIGHT-1 (INdacaterol efficacy evaLuation using 150 µg doses witH COPD patiens 1) dostávali nemocní s CHOPN (211) 150 µg indakaterolu, nebo placebo (205) 1krát denně pomocí SDPPI. Nemocní ve studii INLIGHT-2 dostávali indakaterol 150 µg (330), salmeterol 50 µg 2krát denně (333), nebo placebo (335) po dobu 26 týdnů [20].
Ve studii INSIST (INdacaterol investigating SuperiorIty vs SalmeTerol) byli nemocní randomizováni do větve léčené 150 µg indakaterolu 1krát denně ráno (559) nebo do větve léčené salmeterolem v dávce 50 µg 2krát denně (562). Studie trvala 12 týdnů [24].
Ovlivnění plicních funkcí
Po 12 týdnech podávání indakaterolu vykazovali nemocní s CHOPN ve středním nebo těžkém stadiu statisticky významně lepší plicní funkce než ti, kteří dostávali placebo [20, 21, 23]. Pacienti léčení indakaterolem v dávce 150 nebo 300 µg měli statisticky významně lepší prebrochodilatační hodnoty FEV1 (p < 0,001) než pacienti léčení placebem. Rozdíly v hodnotě prebronchodilatačního FEV1 byly mezi 130 až 180 ml, což bylo více než stanovené klinicky významné zlepšení, za které je považováno zvýšení FEV1 o více než 120 ml [20–23, 26].
Indakaterol v dávce 150 nebo 300 µg podávaný 1krát denně zvýšil prebronchodilatační hodnotu FEV1 měřenou ve 12. týdnu studie o 180 ml pro obě podávané dávky a o 140 ml při léčbě tiotropiem podávaným 1krát denně v dávce 18 µg. Ve srovnání s placebem bylo toto zvýšení signifikantní (p < 0,001) [21].
![Graf 1 Výsledky studie INSIST. Indakaterol prokázal superioritu vůči salmeterolu s ohledem na parametr FEV1AUC5min–11h 45min; b.i.d. – inhalace 2krát denně; o.d. – podání 1krát denně; AUC – plocha pod křivkou, FEV1 – usilovně vydechnutý objem vzduchu za první sekundu výdechu; podle [38] – Korn, et al., 2011.](https://www.remedia.cz/photo-a-28468---.jpg) Indakaterol byl mnohem účinnější v ovlivnění prebronchodilatačního FEV1 ve 12. týdnu při porovnání s formoterolem nebo salmeterolem [23, 24]. Studie INLIGHT-2 prokázala, že podávání indakaterolu 1krát denně v dávce 300 µg vedlo ve 12. týdnu léčby k signifikantnímu navýšení prebronchodilatační hodnoty FEV1 v porovnání s léčbou formoterolem 2krát denně v dávce 12 µg (p < 0,001) [22]. V další studii indakaterol v dávce 150 µg 1krát denně signifikantně zlepšil hodnotu prebronchodilatačního FEV1 ve 12. týdnu studie oproti salmeterolu v dávce 50 µg (p < 0,001) [23]. Rovněž studie INSIST prokázala lepší účinnost indakaterolu ve srovnání se salmeterolem [24. 38]. Výsledky uvádí graf 1.
Indakaterol byl mnohem účinnější v ovlivnění prebronchodilatačního FEV1 ve 12. týdnu při porovnání s formoterolem nebo salmeterolem [23, 24]. Studie INLIGHT-2 prokázala, že podávání indakaterolu 1krát denně v dávce 300 µg vedlo ve 12. týdnu léčby k signifikantnímu navýšení prebronchodilatační hodnoty FEV1 v porovnání s léčbou formoterolem 2krát denně v dávce 12 µg (p < 0,001) [22]. V další studii indakaterol v dávce 150 µg 1krát denně signifikantně zlepšil hodnotu prebronchodilatačního FEV1 ve 12. týdnu studie oproti salmeterolu v dávce 50 µg (p < 0,001) [23]. Rovněž studie INSIST prokázala lepší účinnost indakaterolu ve srovnání se salmeterolem [24. 38]. Výsledky uvádí graf 1.
Účinek na počet exacerbací a příznaky
Počet exacerbací CHOPN byl signifikantně snížen při podávání indakaterolu v dávce 150 µg v porovnání s placebem ve studii INHANCE [21] a při dávce 300 µg ve studii INVOLVE [22]. Ve studiích INVOLVE [21], INLIGHT-1 [20] a INLIGHT-2 [23] byl sledován parametr „den se špatnou kontrolou“. Tento termín je definován jako den s výskytem nejméně dvou příznaků z pěti možných (kašel, pískoty na hrudníku, produkce sputa, zabarvení sputa a dušnost). Procento dní se špatnou kontrolou bylo signifikantně nižší ve srovnání s placebem ve studii INVOLVE [22] a ve studii INLIGHT-1 [20]. Nemocní léčení indakaterolem v porovnání s těmi, kteří dostávali placebo, měli signifikantně vyšší procento dní, kdy nepotřebovali úlevovou medikaci [20–23]. Ve studii INSIST [24] byl počet dní bez použití úlevové medikace signifikantně vyšší (p < 0,05) ve srovnání se salmeterolem. Souborná analýza výsledků studií INHANCE, INVOLVE [25] a INLIGHT-1 [27] získaných po třech měsících sledování a výsledků získaných po šesti měsících probíhajících studií INHANCE, INVOLVE a INLIGHT-2 [27] prokázala, že při léčbě indakaterolem v obou dávkách i při léčbě formoterolem uváděli nemocní signifikantně více dní (p < 0,001) bez použití úlevové medikace oproti léčbě tiotropiem otevřenou formou. V analýze provedené po šesti měsícich se ukázalo, že podávání indakaterolu v dávce 300 µg vedlo u nemocných k signifikantnímu nárůstu počtu dní bez úlevové medikace (p < 0,01) ve srovnání s nemocnými léčenými salmeterolem (rozdíl pro dávku 150 µg byl nesignifikantní) [28]. Indakaterol v porovnání s placebem signifikantně (p < 0,01) zmírňuje další příznaky CHOPN, jako je dušnost (měřená indexem dušnosti TDI) [21–23], zvyšuje procento dnů bez nočního buzení [21–23] a procento dnů, v nichž je nemocný schopen vykonávat běžné činnosti [21–23].
Účinek na kvalitu života
Kvalita života vztažená ke zdraví byla zjišťována dotazníkem SGRQ (St. Georges’ Respiratory Questionnaire) ve třech studiích (INHANCE, INVOLVE a INLIGHT-2) [21–23]. Studie prokázaly významné zlepšení kvality života oproti placebu. Souborná analýza výsledků studií získaných po třech měsících (INHANCE, INVOLVE) [25] a INLIGHT-1 [27] a po šesti měsících (INHANCE, INVOLVE a INLIGHT-2 [28]) prokázala, že ve všech léčebných větvích došlo ke klinicky významnému zlepšení skóre SGRQ (kromě větve s otevřeným podáváním tiotropia po 3 měsících). Ve třetím měsíci došlo při obou dávkováních indakaterolu k signifikantnímu zlepšení celkového skóre SGRQ (p < 0,05) oproti placebu i oproti tiotropiu. I po šesti měsících byl účinnější indakaterol než tiotropium (p < 0,01).
Další studie fáze III INTEGRAL [29], INTIME [30], INSURE [31] a INDORSE [8] se zaměřily na sledování účinnosti indakaterolu v porovnání s jinými bronchodilatačně působícími látkami, na sledování jeho bezpečnosti a na otázku, zda je lepší podávat indakaterol ráno, nebo večer.
Ve studii INTEGRAL (INdacaterol: Twenty four hours Efficacy duration usinG salmeteRol as Active controL) [30] byly porovnávány hodnoty FEV1 měřené v průběhu 24 hodin v den první a čtrnáctý při podání dávky 300 µg indakaterolu s placebem a se salmeterolem 50 µg podávaným 2krát denně. Studie byla randomizovaná, dvojitě slepá. Hodnoty prebronchodilatačního FEV1 ve 24. hodině po podání ve 14. den studie byly u indakaterolu o 200 ml vyšší než při podávání placeba (p < 0,001) a o 90 ml vyšší než při léčbě salmeterolem (p = 0,0011). Indakaterol měl výraznější bronchodilatační účinky než placebo (p < 0,001) ve všech měřeních během 24 hodin prováděných v den 1 a 14. Indakaterol byl rovněž účinnější ve většině měření než salmeterol včetně měření za 5 minut po podání (p < 0,05).Léčba byla dobře snášena.
Studie INTIME (INdacaterol & TIotropium: Measuring Efficacy) [31] porovnávala účinek indakaterolu (150 a 300 µg) s tiotropiem v dávce 18 µg a s placebem podávaným po dobu 14 dnů. Jednalo se o studii randomizovanou, zkříženou, dvojitě slepou, které se zúčastnilo 169 nemocných. Hodnoty prebronchodilatačního FEV1 měřené za 24 hodin po podání indakaterolu po 14denním podávání byly u obou dávek signifikantně vyšší než u placeba (170 ml, resp. 150 ml; p < 0,001). Rozdíl při porovnání indakaterolu v obou dávkách a tiotropia byl nesignifikantní. Studie ukázaly, že indakaterol není v léčbě nemocných s CHOPN méně účinný než tiotropium.
Studie INSURE (INdacaterol: Starting qUickly and Remaining Effective in COPD) [32] porovnávala začátek působení indakaterolu v dávce 150 a 300 µg se salbutamolem 200 µg, salmeterolem/flutikasonem 50/500 µg a placebem u nemocných se středně těžkým nebo těžkým stadiem CHOPN. První měření FEV1 bylo prováděno za 5, 15 a 30 minut a po 1 a 2 hodinách po podání látky. Za 5 minut po podání byl rozdíl v hodnotě FEV1 proti placebu při dávce indakaterolu 150 a 300 µg signifikantně vyšší (p < 0,001). Rozdíly FEV1 zjištěné při porovnání indakaterolu se salbutamolem po 5 minutách (10 a 20 ml při dávce 150 µg, resp. 300 µg) byly nesignifikantní. Rozdíl mezi hodnotami FEV1 měřenými 5 minut po podání indakaterolu a kombinace salmeterol/flutikason byl signifikantně větší pro indakaterol podávaný jak v dávce 150 µg, tak 300 µg (50 ml, p = 0,003; 70 ml, p < 0,001). Jedna dávka indakaterolu 150 i 300 µg má stejně rychlý nástup účinku jako salbutamol, ale ještě rychlejší než kombinace salmeterol/flutikason.
Studie INDORSE (Indacaterol Double-blind One yeaR Safety Evaluation) byla zaměřena na bezpečnost léčby indakaterolem podávaným v dávce 150 a 300 µg nebo placebem po dobu 52 týdnů. Indakaterol neovlivňoval EKG (QTc interval) ani sérové koncentrace kalia nebo glukózy. Indakaterol zvyšoval prebronchodilatační FEV1 v 52. týdnu oproti placebu o 170 ml. Nebyl prokázán pokles účinnosti. Léčba indakaterolem vedla k signifikantnímu snížení počtu exacerbací oproti placebu (0,62; p < 0,05), ke snížení použití salbutamolu jako úlevové léčby. Kvalita života se zlepšila, došlo k poklesu skóre SGRQ o méně než 4 jednotky [8].
V krátkodobé studii INPUT (Indacaterol: APraising Uniterrupted efficacy for Twenty four hours) trvající 14 dní, do které bylo zařazeno 96 nemocných, bylo zkoumáno, zda podávání indakaterolu v jedné denní dávce 300 µg ráno či večer má rozdílný bronchodilatační účinek. Vedle placeba byl podáván salmeterol v dávce 2krát denně 50 µg. Bronchodilatační účinek indakaterolu vyjádřený hodnotou pre-bronchodilatačního FEV1 nezávisel na tom, zda byl přípravek podán ráno, nebo večer [32].
Indikace
Přípravek s obsahem indakaterolu je určen k udržovací bronchodilatační léčbě obstrukce dýchacích cest u dospělých nemocných s CHOPN. Indakaterol je předepisován pacientům s diagnózou CHOPN od středně těžkého stadia (stadium II), kteří dodržují zákaz kouření. Z veřejného zdravotního pojištění není hrazena kombinace indakaterolu s tiotropiem.
Kontraindikace
Mezi kontraindikace řadíme pouze hypersenzitivitu na indakaterol, laktózu nebo na jinou pomocnou látku obsaženou v přípravku.
Nežádoucí účinky
Výsledky standardně prováděných genetických testů in vitro a in vivo prokázaly bezpečnost podávání indakaterolu bez výskytu karcinogenních účinků [33]. Rovněž nebyly prokázány teratogenní účinky.
 Nejčastějším nežádoucím účinkem pozorovaným ve studiích byl kašel, a to kašel mírný, který se s dobou podávání zmírňoval. Kašel byl pravděpodobně závislý na dávce, většinou se vyskytoval hned po inhalaci a rychle vymizel. Nedocházelo k bronchospasmu. Mechanismus vzniku tohoto nežádoucího jevu je nejasný. Předpokládá se, že indakaterol má specifický stimulační účinek na receptory pro kašel, které se nacházejí v horních a centrálních dýchacích cestách. Je pravděpodobné, že během času dochází k tachyfylaxi. Nebyly zaznamenány žádné klinicky významné změny QTc intervalu, tepové frekvence, krevního tlaku a koncentrace kalia a glukózy v séru [34].
Nejčastějším nežádoucím účinkem pozorovaným ve studiích byl kašel, a to kašel mírný, který se s dobou podávání zmírňoval. Kašel byl pravděpodobně závislý na dávce, většinou se vyskytoval hned po inhalaci a rychle vymizel. Nedocházelo k bronchospasmu. Mechanismus vzniku tohoto nežádoucího jevu je nejasný. Předpokládá se, že indakaterol má specifický stimulační účinek na receptory pro kašel, které se nacházejí v horních a centrálních dýchacích cestách. Je pravděpodobné, že během času dochází k tachyfylaxi. Nebyly zaznamenány žádné klinicky významné změny QTc intervalu, tepové frekvence, krevního tlaku a koncentrace kalia a glukózy v séru [34].
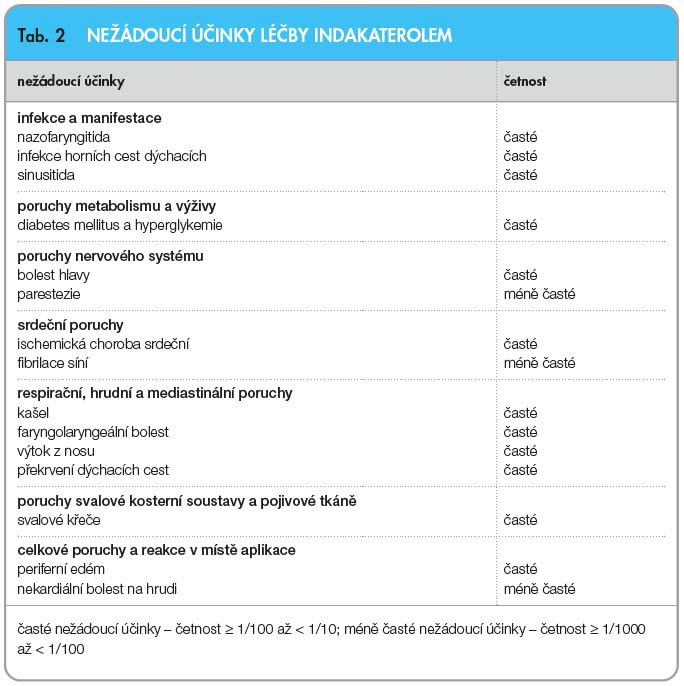
Podle Souhrnu údajů o přípravku [35] se při podávání doporučených dávek nejčastěji vyskytly tyto nežádoucí účinky: nazofaryngitida (9,1 %), kašel (6,8 %), infekce horních cest dýchacích (6,2 %) a bolest hlavy (4,8 %). Dále byla zaznamenána klinicky nevýznamná systémová β2-adrenergní stimulace. Průměrná změna srdečního rytmu byla méně než jeden tep za minutu. Souhrn nežádoucích účinků uvádí tab. 2.
Lékové interakce
Souběžné podávání sympatomimetik může potencovat nežádoucí účinky. Současná hypokalemická léčba methylaxantinovými deriváty, steroidy nebo diuretiky nešetřícími kalium může zvyšovat hypokalemický účinek indakaterolu. Indakaterol nesmí být podáván společně s β2-adrenergními antagonisty (včetně očních kapek), pokud pro jejich podávání nejsou závažné důvody. V případně nutnosti indikace b-adrenergních blokátorů upřednostňujeme kardioselektivní b-adrenergní blokátory. Inhibice hlavních enzymů odbourávajících indakaterol (tj. CYP3A4 a P-glykoproteinu P-gp) zvyšuje systémovou expozici indakaterolu až na dvojnásobek. Neprokázalo se ale, že by indakaterol vyvolával interakce s doprovodnou léčbou.
Těhotenství a kojení
Indakaterol neprokázal teratogenní účinky v pokusech na zvířatech [33], nicméně údaje o jeho podávání těhotným ženám nejsou k dispozici. Přípravek smí být podáván v těhotenství pouze tehdy, pokud očekávaný prospěch léčby převáží její rizika.
Podle údajů získaných u krys se odhaduje, že do mateřského mléka se dostane při podání dávky 300 µg asi 0,18 % indakaterolu a jeho metabolitů [36]. Nicméně nelze vyloučit riziko pro kojené dítě, proto je nutné zvážit přínos kojení pro dítě a přínos podávání přípravku matce.
Dávkování
Doporučená dávka je inhalace obsahu jedné 150mikrogramové tobolky 1krát denně s použitím inhalátoru DPI. Maximální dávka je 300 µg 1krát denně.
Pro inhalační podávání byl vyvinut speciální inhalační systém s malým vnitřním odporem – Breezhaler. Doporučený nádechový průtok, který zaručuje depozici v plicích, je ≥ 60 l/min. Je prokázáno, že většina nemocných s CHOPN ve všech stupních závažnosti je schopna tohoto průtoku dosáhnout [37].
Stabilita
Léčivý přípravek má být uchováván při teplotě do 30 °C. Tobolky musí být uchovávány v blistru, aby byly chráněny před vlhkostí. Vyjímají se teprve bezprostředně před použitím.
Literatura
Seznam použité literatury
- [1] Cazzola M, Segreti A, Matera MG. Novel bronchodilators in asthma. Curr Opin Pulm Med 2010; 16: 6–12.
- [2] Scola AM, Loxham M, Charlton SJ, et al. The long-acting beta-adrenoreceptor agonist, indacaterol, inhibits IgE-dependent response of human lung mast cells. Br J Pharmacol 2009; 158: 267–276.
- [3] Battram C, Charlton SJ, Cuenoud B, et al. In vitro and in vivo pharmacological characterization of 5-[(R)-2-(5,6-diethyl-indan-2-ylamino)-1-hydroxy-ethyl]-8-hydroxy-1H-quinolin-2-one (indacaterol), a novel inhaled beta(2) adrenoceptor agonist with a 24-h duration of action. J Pharmacol Exp Ther 2006; 317: 762–770.
- [4] Naline E, Trifilieff A, Fairhust RA. Effect of indacaterol, a novel long-acting beta2-agonist, on isolated human bronchi. Eur Respir J 2007; 29: 575–581.
- [5] Lombardi D, Cuenoud B, Kramer SD. Lipid membrane interactions of indacaterol and salmeterol: do they influence their pharmacological properties? Eur J Pharm Sci 2009; 38: 533–547.
- [6] Chuchalin AG, Tsoi AN, Richter K, et al. Safety and tolerability of indacaterol in asthma: a randomized, placebo-controlled 28-day study. Respir Med 2007; 101: 2065–2075.
- [7] Yang WH, Martinot JB, Pohunek P, et al. Tolerability of indacaterol, a novel once-daily b2-agonist, in patients with asthma: a randomized, placebo-controlled, 28 day safety study. Ann Allergy Asthma Immunol 2007; 99: 555–561.
- [8] Chapman KR, Rennard SI, Dogra A, et al. Long-term Safety and Efficacy of Indacaterol, a Novel Long-acting b2-Agonist, in Subjects with COPD: a Randomized, Placebo-controlled Study. Chest; Prepublished online February 24, 2011; DOI 10.1378/chest.10–1830. http://chestjournal. chestpubs.org/content/early/2011/02/23/chest.10–1830.
- [9] Rennard S, Bantje T, Centanni S, et al. A dose-ranging study of indacaterol in obstructive airways disease, with a tiotropium comparison. Respir Med 2008; 102: 1033–1044.
- [10] Bauwens O, Ninane V, Van de Maele B, et al. 24-hour bronchodilator efficacy of single doses of indacaterol in subjects with COPD: comparison with placebo and formoterol. Curr Med Res Opin 2009; 25: 463–470.
- [11] Cazzola M, Matera MG, Donner CF. Inhaled b2-adrenoreceptor agonists: cardiovascular safety in patients with obstructive lung disease. Drugs 2005; 65: 1595–1610.
- [12] Beier J, Bantje T, Owen R, et al. Cardiac safety of indacaterol, a novel once-daily bronchodilator, in COPD [abstract No P3611] Eur Respir J 2008; 32: Suppl. 52: 631s.
- [13] Khindri S, Sabo R, Harris S, et al. Cardiac safety of indacaterol – no clinical effect on QT in healthy subjects [abstract No P2031] 19th Annual Congress of the European Respiratory Society 2009; Vienna.
- [14] Onbrez Breezhaler (indacaterol) 150 and 300 microgram inhalation powder, hard capsules: EU summary of product characteristics. West Sussex UK: Novartis Europharm Limited, 2009.
- [15] European Medicines Agency. Assessment report for Onbrez Breezhaler [online]. Available from URL:http: //www.ema.europa.eu/humandocs/PDFs/EPAR/onbrez-breezhaler/H-1114-en6.pdf [Accessed 2010; Jan 22].
- [16] Perry S, Woessner R, Kaiser G, et al. Pharmacokinetics of indacaterol after single and multiple inhaled doses [abstract no.F57] Am J Respir Crit Care Med 2010; 181: A4420.
- [17] Beier J, Chanez P, Martinot JB, et al. Safety, tolerability and efficacy of indacaterol, a novel once daily b(2)-agonist, in patients with COPD: a 28-day randomised, placebo controlled clinical trial. Pulm Pharmacol Ther 2007; 20: 740–749.
- [18] Beier J, Beeh KM, Brookman L, et al. Bronchodilator effect of indacaterol and formoterol in patients with COPD. Pulm Pharmacol Ther 2009; 22: 492–496.
- [19] Barnes PJ, Pocock SJ, Magnussen H, et al. Integrating indacaterol dose selection in clinical study in COPD using an adaptive seamless design. Pulm Pharmacol Ther 2010; 23: 167–171.
- [20] Feldman G, Siler T, Prasad N, et al. Efficacy and safety of indacaterol 150 mg once-daily in COPD: a double-blind randomised,12 week study. BMC Pulm Med 2010; 10: 10–19.
- [21] Donohue JF, Fogarty C, Lötwall J, et al. Once-daily bronchodilators for chronic obstructive pulmonary disease: indacaterol versus tiotropium. Am J Respir Crit Care Med 2010; 182: 155–162.
- [22] Dahl R, Chung KF, Buhl R, et al. Efficacy and a new once-daily long acting b2 agonist indacaterol versus twice-daily formoterol in COPD. Thorax 2009; 65: 473–479.
- [23] Kormann O, Dahl R, Centanni S, et al. Once-daily indacaterol versus twice-daily salmeterol for COPD: a placebo controlled comparison. Eur Respir J 2011; 37: 273–279.
- [24] Korn S, Kerwin E, Atis S, et al. Indacaterol once-daily provides superior efficacy to salmeterol: a 12-week trial [abstract plus poster] 20th Annual Congress of the European Respiratory Society 2010; Sep 18–22 Barcelona.
- [25] Novartis clinical trial results database. A 2 week treatment, multi-center, randomized, parallel group, double blind, double dummy study to assess the superiority of indacaterol (150 mg o.d,) via a SDDPI in patients with moderate to severe COPD, using salmeterol (50 mg b.i.d.) as an active comparator delivered via a DISKUS inhaler [online]. Available from URL: http://www.novctrd.com [Accessed 2010; Oct 13].
- [26] Cazzola M, MacNee W, Martinez FJ, et al. Outcomes for COPD pharmacological trials: from lung function to biomarkers. Eur Resp J 2008; 31: 416–469.
- [27] Siler TM, Wiliams J, Yegen U, et al. The effect of once-daily indacaterol on health-related quality of life, rescue medication use, and exacerbation rates in patients with moderate-to-severe COPD: a pooled analysis of three months of treatment. Am J Respir Crit Care Med 2010; 181: A4430. Plus poster presented at the 106th International Conference of the American Thoracic Society 2010; May 14–19 New Orleans.
- [28] Kleerup E, Williams J, Yegen U, et al. The effect of indacaterol once-daily on health related quality of life, symptoms and rescue medication use in moderate-to-severe chronic obstructive pulmonary disease: pooled analysis of six month data [abstract No F66]. Am J Respir Crit Care Med 2010; 181: A4429. Plus poster presented at the 106th International Conference of the American Thoracic Society 2010; 14–19 New Orleans.
- [29] Laforce C, Aumann J, de Teresa Parreno L, et al. Sustained 24-hour efficacy on once daily indacaterol (300 mg) in patients with chronic obstructive pulmonary disease: A randomized, crossover study. Pulm Pharmacol Ther 2011; 24: 162–168.
- [30] Vogelmeier C, Ramos-Barbon D, Jack D, et al. Indacaterol provides 24-hour bronchodilation in COPD: a placebo-controlled blinded comparison with tiotropium. Respir Res 2010; 11: 135–142.
- [31] Balint B, Watz H, Amos C, et al. Onset of action of indacaterol in patients with COPD: comparison with salbutamol and salmeterol-fluticasone. Int J Chron Obstruct Pulmon Dis 2010; 5: 311–318.
- [32] Magnussen H, Verkindre C, Jack D, et al. Indacaterol once-daily is equally effective dosed either in the evening or morning in COPD patients: a placebo-controlled comparison with placebo. ERS Annual Congress 2009; Poster 3461.
- [33] EMEA (2009b) European Medicine Agency: Evaluation of Medicine in Human Use. Assessment Report EMA/65991/2009. Availabe at http://www. ema.europa.eu/docs/en-GB/document-library/ EPAR – Public assessment-report/human/001114/ WC500053753.pdf
- [34] Tashkin DP. Indacaterol maleate for the treatment of chronic obstructive pulmonary disease. Expert Opin Pharmacother 2010; 11: 2077–2085.
- [35] Souhrn údajů o přípravku Obreez Breezhaler, Novartis 2011.
- [36] Brienza NS, Amor-Carro O, Ramos-Barbon D. An update on the use of indacaterol in patients with COPD. Ther Adv Respir Dis 2011; 5: 29–40.
- [37] Pavkov R, Mueller S, Fiebich K, et al. Characteristics of capsule based dry powder inhaler for the delivery of indacaterol. Curr Med Res Opin 2010; 26: 2527–2533.
- [38] Korn S, Kerwin E, Atis S, et al. Indacaterol once-daily provides superior efficacy to salmeterol twice-daily in COPD: a 12-week study. Respir Med 2011 May; 105: 719–726. Epub 2011 Mar 1.
- [39] Moen MD. Indacaterol: in chronic obstructive pulmonary disease. Drugs 2010; 70: 2269–2280.
- [40] Cazzola M, Proietto A, Matera MG. Indacaterol for chronic obstructive pulmonary disease (COPD). Drugs Today 2010; 46: 139–150.