Inosin pranobex, klinickou praxí ověřený účinný imunomodulátor; možné mechanismy působení
Souhrn:
Krejsek J. Inosin pranobex, klinickou praxí ověřený účinný imunomodulátor; možné mechanismy působení. Remedia 2018; 28: 396–400.
Podrobné poznání fyziologie i patofyziologie obranného i poškozujícího zánětu umožňuje stále častěji léčebné imunomodulační zásahy. Možnosti, jak tlumit poškozující zánět, jsou poměrně rozsáhlé a zahrnují celé spektrum léčiv, včetně biologik. Naproti tomu možnosti, jak léčebně potencovat imunitní systém, jsou velmi omezené. Většinou se jedná o látky přírodního původu, které jsou součástí potravních doplňků. V úzkém slova smyslu jediným lékem s prokázanými imunomodulačními a imunopotenciačními účinky je inosin pranobex. Tento lék je indikován u celého spektra nemocných s klinickými projevy imunitní nedostatečnosti. Působí přímo protivirově. Moduluje imunitní systém na mnoha úrovních. Zasahuje do zásadních imunobiologických ukazatelů na úrovni buňky, např. do energetického metabolismu, buněčné signalizace a proliferace. Moduluje složky vrozené imunity, NK buňky a dendritické buňky. Tlumí tvorbu prozánětlivých cytokinů tumor nekrotizujícího faktoru α a interleukinu 6. Homeostaticky a regulačně optimalizuje funkční polarizaci subsetů T lymfocytů Th1, Th2, Th17 a Treg.
Summary:
Krejsek J. Inosine pranobex, effective immunomodulatory drug approved by the long‑term clinical application; possible mechanisms of action. Remedia 2018; 28: 396–400.
Detailed understanding of the physiology and pathophysiology of the inflammatory response enables to conduct the therapeutical modulation of the immune system. There is a broad range of drugs to suppress inflammation. However, the availability of drugs to potentiate immune system is very limited. Mostly, these are substances of natural origin marketed as food supplements. In narrow sense, there is only one drug with approved immunomodulatory potential, inosine pranobex. This drug is indicated to treat the whole spectrum of patients with clinical presentation of immunodeficiency. Inosine pranobex is also acting as an antiviral agent. Immune system is modulated by inosine pranobex on several levels. It intervenes with crucial immuobiological endpoints on the cellular level, e.g., with the cell energetic metabolism, cellular signalization and cell proliferation. Inosine pranobex is targeting innate immunity, NK cells and dendritic cells. The production of pro‑inflammatory cytokines, such as TNFα and IL‑6, is suppressed by the action of inosine pranobex. Inosine pranobex is optimizing the functional polarization of various immunoregulatory subsets of T cells such as Th1, Th2, Th17 and Treg to restore homeostatic regulation of the immune system.
Key words: inosine pranobex, immunomodulation, cell activation and proliferation, innate immunity modulation, homeostatic regulatory potential.
Úvod
Modulace imunitního systému je v klinické praxi stále častějším léčebným zásahem. Pomineme li aktivní imunizaci, máme k dispozici řešení pro nemocné s protilátkovými deficity spočívající v celoživotní aplikací imunoglobulinových přípravků. Pro nejtěžší defekty T lymfocytární imunity, pro nemocné s těžkou kombinovanou imunodeficiencí a s některými defekty ve vrozené imunitě je jediným řešením transplantace kostní dřeně. Pro nemocné s méně závažnými projevy imunitní nedostatečnosti, jichž je v porovnání s primárními imunodeficiencemi řádově více, jsou možnosti imunomodulace, či spíše imunopotenciace omezené. Nemocné se sníženou obranyschopností vůči bakteriálním patogenům můžeme léčebně ovlivnit bakteriálními lyzáty. Skupinou imunomodulátorů s nejlépe prokázaným efektem jsou betaglukany, které jsou však produkovány pouze ve formě potravních doplňků. Klasický imunomodulační přípravek levamisol již není používán z důvodu výskytu závažných nežádoucích účinků [1]. Lze uzavřít, že jediným léčivem s prokázaným klinickým účinkem a s vynikajícím bezpečnostním profilem, potvrzeným desítkami let používání, který v sobě kombinuje imunomodulační a antivirové účinky, je inosin pranobex. Cílem tohoto sdělení je shrnutí a interpretace mechanismu účinků inosin pranobexu v kontextu nejnovějších poznatků o fungování imunitního systému a klinicky ověřených aplikací.
Základní charakteristiky
Inosin pranobex je syntetická látka tvořená para acetamidobenzoovou solí N N dimetylamino 2 propanolu a inosinu v molárním poměru 3 : 1, jež byla syntetizována koncem padesátých let minulého století. Pro klinické použití byla schválena v sedmdesátých letech 20. století. Inosin je purin přirozeně se nacházející v potravě. Jedná se o méně typický nukleosid, nicméně vyskytuje se celkem běžně v transferové ribonukleové kyselině (tRNA), kde se inosin na tzv. wobble pozici antikodonu může párovat s cytosinem, adeninem i uracilem. Pro lidské tělo je inosin přirozeným prekurzorem esenciálních látek, jakými jsou adenosintrifosfát (ATP) a guanosintrifosfát, které jsou v těle zdrojem energie. Do regulací buněčného metabolismu zasahují cyklické purinové nukleotidy a koenzymy obsahující purinové nukleotidy, které rovněž vznikají z inosinu. Kyselina p acetamidobenzoová je chemicky podobná kyselině p aminobenzoové, která se přirozeně vyskytuje v lidských buňkách a tkáních. Tyto skutečnosti vysvětlují, proč je inosin pranobex mimořádně dobře tolerován. Látka je detailně popsána ‒ jsou k dispozici údaje o její farmakokinetice, farmakodynamice a biologické dostupnosti. Inosin pranobex je indikován u nemocných s deficiencí či s dysfunkcí buňkami zprostředkované imunity a u nemocných s primárním nebo sekundárním defektem imunity spojeným s virovými infekcemi herpetickými viry typu 1 a 2, cytomegalovirem, dále virem varicella zoster a virem Epsteina‒Barrové. Je indikován u nemocných s condylomata accuminata buď samostatně, nebo v kombinaci s jinými léčebnými přístupy, a dále u nemocných s mukokutánními, vulvovaginálními nebo endocervikálními projevy infekce lidskými papilomaviry. Inosin pranobex prokázal účinnost v léčbě nemocných s hepatitidami virového původu, příušnicemi, zarděnkami, u pacientů s aftózní stomatitidou virového původu a u nemocných se spalničkami a subakutní sklerotizující panencefalitidou [2].
Přímé protivirové působení inosin pranobexu
Toto léčivo je unikátní ve schopnosti ovlivnit klinický průběh virových infekcí způsobených imunobiologicky zásadně odlišnými virovými agens. Mechanismus protivirového působení inosin pranobexu není detailně popsán, přestože mu byla věnována v minulosti značná pozornost. Je to pravděpodobně způsobeno faktem, že v té době ještě nebyly dostatečně rozvinuté molekulárně biologické metody nutné k vysvětlení mechanismů protivirového půs
obení různých léčiv. Je doložen přímý zásah inosin pranobexu do virové replikace. Děje se tak zjednodušeně řečeno ovlivněním editace virové RNA, v níž inosin nahradí adenin mechanismem označovaným jako „wobble“ (zakolísání). Výsledkem je narušení transkripce virových nukleových kyselin a proteosyntézy virových bílkovin na úrovni tRNA. Tím je utlumena virová replikace, která nevede ke vzniku rezistence hostitele vůči viru [3]. Převládá názor, že protivirový účinek inosin pranobexu je navíc zprostředkován potenciací specifické buňkami zprostředkované imunity a účinkem tohoto léku na protilátkovou imunitu.
Mechanismy imunomodulačního působení inosin pranobexu
Nukleotidy a nukleosidy, kam lze chemicky zařadit i inosin, jsou v buňkách nezbytnou součástí řady biochemických procesů, které podmiňují životní funkce buněk, tkání a celého organismu. Jsou zapojeny do procesů replikace deoxyribonukleové kyseliny, tvorby jednovláknové RNA (mRNA), tRNA a proteosyntézy. Jsou nositel
i energie a uplatňují se i v regulacích metabolických drah, např. ve formě cyklického adenosinmonofosfátu, jehož koncentrace určuje aktivitu proteinové kinázy A. Ta prostřednictvím aktivace transkripčních faktorů zasahuje do přepisů několika tisíc genů, z nichž mnohé se podílejí na regulacích obranného i poškozujícího zánětu. Dostupnost nukleotidů tedy pozitivně moduluje funkce
imunitního systému. Má však obecně anabolické účinky. Prokazatelně stimuluje reparační procesy v centrální nervové soustavě. Potencuje tvorbu neuritů a přežívání astrocytů, zvyšuje výkon svalstva, včetně myokardu. Má pozitivně inotropní účinky a jeví se jako kardioprotektivum. Ne náhodou je inosin běžně využíván i jako tzv. nutraceutikum pro zvýšení tělesné výkonnosti, zvláště u sportovců.
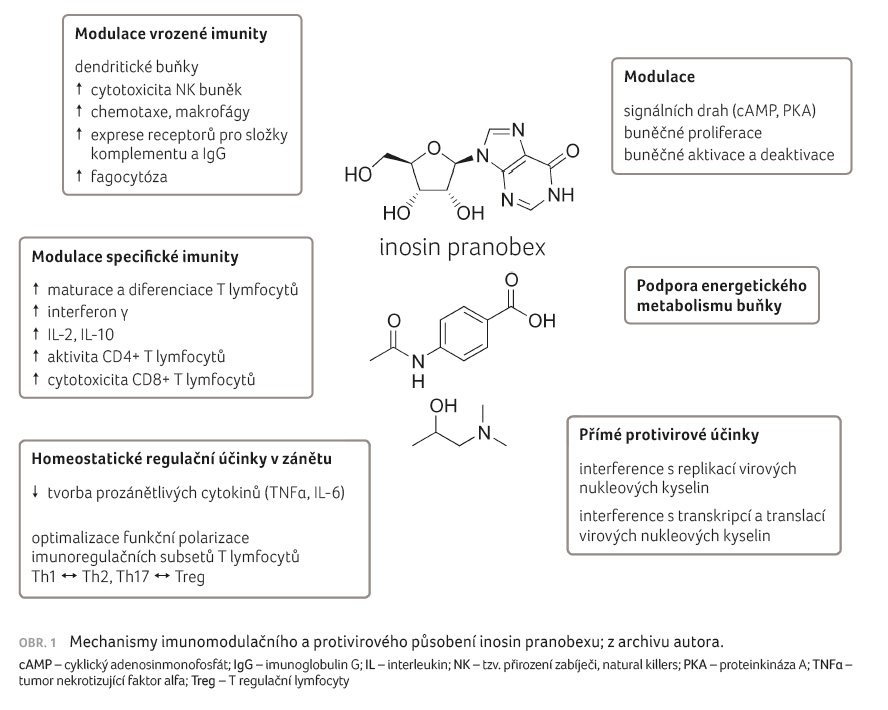
Tento obecný účinek však nemůže vysvětlit relativně specifický vliv inosin pranobexu na imunitní systém. Zde musíme vyjít z nových poznatků, které identifikují nukleotidy a nukleosidy (ATP aj.) uvolněné mimo buňku např. v procesu její imunogenní smrti jako vzory vnitřního poškození DAMP (damage associated molecular patterns). Jsou rozpoznávány prostřednictvím receptorů PRR (pattern recognition receptors), zde konkrétně receptory pro AGE (bílkoviny vznikající neenzymovou glykosylací, advanced glycation endproducts), vyjádřenými především na buňkách vrozené imunity, které slouží jako buňky prezentující antigenní podněty T lymfocytům. Jedná se především o různé typy dendritických buněk, které můžeme blíže charakterizovat např. stanovením jejich membránové výbavy. Stimulují je k internalizaci vzorů DAMP, k nitrobuněčnému zpracování a k prezentaci ve formě komplexů antigenní peptidy‒molekuly HLA (hlavního histokompatibilního systému). Nukleotidy uvolněné do mezibuněčného prostoru jsou hydrolyzovány ektonukleotidázami, např. antigeny CD39 a CD73. Ty jsou vyjádřeny zvláště na subsetu T regulačních (Treg) T lymfocytů. Výsledkem je jejich zesílená aktivace. Vazba nukleotidů na purinergní receptory z rodiny P2R vyjádřené na buňkách prezentujících antigen zesiluje jejich aktivaci a usměrněný pohyb. Tak je umocňována účinnost imunitní odpovědi. V protikladu vede vazba nukleosidů na receptory rodiny P1R, vyjádřené především na aktivovaných efektorových T lymfocytech, k jejich tlumení. Tímto způsobem lze vysvětlit jeden z možných imunomodulačních efektů nukleotidů. Nukleotidy zasahují také do regulací autofagie. Bez větších detailů konstatujeme, že tímto mechanismem dochází k udržení dostatečné úrovně energetických zdrojů v buňce, která je vystavena stresu. Vede také k již zmíněnému uvolnění, či spíše k aktivnímu transportu nukleotidů vně buňky, kde slouží jako vzory DAMP a stimulují obranný zánět.
Vznik vzorů DAMP v našem těle signalizuje imunitnímu systému narušení molekulové, buněčné či tkáňové homeostázy. Je podmínkou rozvoje zánětlivé reakce, která má primárně zamezit dalšímu poškození našich struktur s následnou reparací a zhojením. Za fyziologických podmínek je tedy na ně zapotřebí pohlížet jako na signály, tzv. alarminy, které vzbudí fyziologickou imunitní odpověď. V závislosti na jejich molekulární podstatě jsou jednotlivé složky a mechanismy imunitní soustavy stimulovány odlišně. Působení inosin pranobexu nebylo v tomto ohledu detailně studováno. Můžeme se ale opřít o výsledky klinických pozorování, z nichž můžeme implikovat stran možných mechanismů či účinků inosin pranobexu [4].
Imunomodulační působení inosin pranobexu můžeme doložit z experimentů na zdravých dobrovolnících a ze studií in vitro. Petrova a kol. (2010) [5] studovali dynamiku tvorby interferonu γ (IFNγ), interleukinu 2 (IL 2), interleukinu 10 (IL 10) a tumor nekrotizujícího faktoru α (TNFα) po podání 3× 1 g inosin pranobexu denně po pět následujících dnů v týdnu po dobu tří týdnů. Koncentrace cytokinů byla měřena před zahájením intervence, dále v den 7, 10, 14, 21, 28, 35 a 42. Hodnota TNFα se prakticky neměnila po celou dobu sledování. Koncentrace IFNγ se významně zvýšila 7. a 10. den sledování. Podobně tomu bylo u IL 2, u kterého došlo k dalšímu zvýšení 42. den sledování. Hodnota IL 10 byla významně zvýšena mezi 7.‒28. dnem pozorování. Z výsledků lze odvodit, že inosin pranobex nestimuluje tvorbu obecně pluripotentního prozánětlivého cytokinu TNFα. Zvýšení tvorby IFNγ a IL 2 ukazuje zřetelně na aktivaci T lymfocytární imunity, zvláště subsetu Th1. Subset Th1 je podstatnou součástí obranného zánětu namířeného proti virovým infekcím a kontroluje také protinádorovou obrannou reakci. Za velmi cennou lze považovat stimulaci tvorby IL 10 vlivem inosin pranobexu. Z této skutečnosti můžeme odvodit, že tento lék zasahuje do homeostatických regulací zánětu. Nejvýznamnějším zdrojem homeostatického regulačního cytokinu IL 10 je subset Treg lymfocytů. Tvorbou IL 10 je udržována optimální aktivita subsetu Th17 T lymfocytů, které jsou součástí obranného zánětu namířeného vůči patogenním bakteriím a houbám. T lymfocyty subsetu Th17, které unikly kontrole, však jsou klíčovou součástí poškozujícího zánětu u pacientů trpících imunopatologickými onemocněními, např. roztroušenou sklerózou, revmatoidní artritidou, Crohnovou chorobou nebo psoriázou. Lze tedy oprávněně tvrdit, že inosin pranobex vedle imunopotenciačních efektů zasahuje i do homeostatických regulací kontrolujících zánětlivou reakci [6].
V kultivační studii provedené in vitro, v níž byl testován účinek inosin pranobexu na expresi podjednotky α receptoru pro IL 2 (CD25) na lidských lymfocytech izolovaných z periferní krve, prokázali Lasek a kol. (2015) v pětidenním intervalu zvýšení exprese CD25 v závislosti na koncentraci inosin pranobexu [7]. Receptor pro IL 2 je klíčový v regulaci specifické buněčné imunity zprostředkované T lymfocyty. Zesílení jeho exprese zřetelně dokládá imunopotenciační vliv.
Ve studii in vitro prokázali Majewska a kol. (2015), že inosin pranobex samotný tlumí replikaci adenovirů v lidské buněčné linii A549 [8]. Tento účinek inosin pranobexu byl dále potencován kombinací s interferonem α. Jejich nálezy jsou ve shodě s klinickou studií Berana a kol. (2016) [9]. Ten sledoval vliv inosin pranobexu v léčbě nemocných s prokázanou akutní virovou respirační infekcí v randomizované, placebem kontrolované, dvojitě zaslepené studii. Nejčastější příčinou akutních virových infekcí dýchacího traktu jsou viry chřipky A a B, virus parainfluenzy, respirační syncytiální virus, koronaviry, enteroviry, reoviry a adenoviry. Inosin pranobex byl podáván 231 pacientům v dávce 1 000 mg 3× denně po dobu sedmi dnů. Placebová skupina zahrnovala 232 nemocných. Nebyly zjištěny významné rozdíly ve vymizení symptomů mezi skupinami. Ve skupině s inosin pranobexem však došlo k rychlejšímu zlepšení stavu. Pacienti mladší než 50 let měli signifikantní prospěch z podání inosin pranobexu podobně jako pacienti bez dalších onemocnění, kteří nebyli obézní. Lék byl dobře tolerován.
V klinické studii Ahmeda a kol. (2017) byl in vivo prokázán známý in vitro potenciál inosin pranobexu ke zvýšení koncentrace Treg a NK T lymfocytů (včetně invariantních NK T lymfocytů) při 14denním kontinuálním podávání v dávce 1 g 4× denně [10]. Zvýšení podílů NK buněk (tzv. přirozených zabíječů, natural killers) z celkových lymfocytů bylo u poloviny dobrovolníků užívajících inosin pranobex zaznamenáno do 1,5 hodiny od podání léku a ke statisticky významnému zvýšení došlo od pátého dne a toto zvýšení bylo trvalé po celou dobu sledování. Studie potvrzuje a rozšiřuje poznání imunomodulačního působení inosin pranobexu. Bezpečný profil léku podtrhuje i skutečnost, že nebylo zjištěno ani ovlivnění celkových počtů B a T lymfocytů, ani koncentrace sérových imunoglobulinů třídy G (včetně podtříd IgG1–4), A a M.
V minulosti byl jako velmi žádoucí vyhodnocován imunopotenciační účinek inosin pranobexu. V klinických studiích inosin pranobex normalizoval (na pacientovy výchozí hodnoty) nedostatečnou nebo porušenou buněčnou imunitu vyvoláním odpovědi specifické buňkami zprostředkované imunity, která iniciuje proliferaci, diferenciaci a maturaci T lymfocytů a potenciaci jimi indukovaných reakcí v buňkách stimulovaných mitogenem nebo antigenem. Nyní je zřetelné, že zřejmě podstatnější jsou imunomodulační, homeostatické účinky tohoto léku. Je to v naprostém souladu se současným chápáním fungování imunitní soustavy jako součásti zánětu. Rozhraní mezi obranným a poškozujícím zánětem je totiž velmi neostré. Obě formy zánětlivé reakce se vzájemně prolínají a jejich rovnováha může být velmi snadno narušena za vzniku převažující imunopatologické reakce. Homeostatické regulace zánětlivé odpovědi jsou mimořádně komplexní a komplikované. Je o nich obtížné vyslovit komplexní soudy. Zahrnují složky vrozené imunity tak, jak již bylo řečeno. V případě specifické imunity máme nejvíce dokladů o regulačním působení funkčně polarizovaných subsetů T lymfocytů, především Th1, Th2, Th17 a Treg. Podobné funkční polarizace lze identifikovat i v jiných složkách imunity. Imunoregulační subsety jsou ve vzájemných vztazích a jejich aktivity odrážejí momentální potřeby organismu. Homeostatické regulace imunity jsou ovlivněny i nukleosidy, např. inosinem, který je degradačním produktem purinů, adenosinu a ATP. Haskó a kol. (2000) použili myší peritoneální makrofágy a splenocyty ke studiu vlivu inosinu na tvorbu TNFα, IL 1β, IL 10, IL 12, IFNγ a chemokinu MIP1α po kultivaci in vitro [11]. Prokázali, že s výjimkou IL 10 byla tvorba všech jmenovaných prozánětlivých cytokinů vlivem inosinu tlumena. Tvorba IL 10, homeostatického protizánětlivého cytokinu, nebyla inosinem tlumena. K podobným závěrům došli za použití myších splenocytů Shinohara a Tsukimoto (2018) [12]. Prokázali, že v přítomnosti inosinu dochází k významně nižší tvorbě IL 2 a IL 6. Není však ovlivněna exprese α podjednotky receptoru pro IL 2 (CD25). Tyto změny nebyly podmíněny buněčnou smrtí a signální dráha ERK1/2 nebyla inosinem ovlivněna.
Závěr
Inosin pranobex je lék, který svou desetiletí trvající existencí v klinické praxi zřetelně prokázal svoji užitečnost. Lze právem konstatovat, že v současnosti představuje prakticky jediný imunomodulační přípravek, který je možné aplikovat v široké klinické praxi. Prospěch z jeho účinků může mít celé spektrum nemocných s klinickými projevy imunodeficience, které se manifestují jako patologie různých orgánů. Z tohoto důvodu ho využívají nejen kliničtí imunologové a alergologové, ale je indikován i gynekology, plicními lékaři, dermatology a uplatňuje se též v infekčním lékařství [13]. Z dostupných vědeckých dat lze odvodit, že spíše než imunopotenciační je jeho účinek imunomodulační, homeostatický. Zasahuje do regulací obranného zánětu. Klinický efekt léčby inosin pranobexem je dokumentován bohatě v řadě často dobrých a kvalitních klinických studií. Klinická zkušenost jasně dokládá, že lék je bezpečný a může být aplikován v běžné klinické praxi, včetně první linie. I toto představuje odlišnost od nových imunopřípravků, jejichž podání musí být indikováno, provedeno a výsledek vyhodnocen pouze ve vysoce specializovaných centrech.
Seznam použité literatury
- [1] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Garamon: Hradec Králové, 2016; 496 s. Více informací na: http://www.imunologie‑cloveka‑krejsek.cz
- [2] Souhrn údajů o přípravku Isoprinosine tablety. Registrační číslo: 42/198/81‑C. Datum poslední revize textu: 17. 5. 2010. Dostupné na: http://www.sukl.cz/modules/medication/detail.php?code=0162748&
- [3] Alseth I, Dalhus B, Bjørås M. Inosine in DNA and RNA. Curr Opin Genetics Develop 2014; 26: 116–123.
- [4] Kepp O, Loos F, Liu P, Kroemer G. Extracellular nucleosides and nucleotides as immunomodulators. Immunol Rev 2017; 280: 83–92.
- [5] Petrova M, Jelev D, Ivanova A, Krastev Z. Isoprinosine affects serum cytokine levels in healthy adults. J Interferon Cytokine Res 2010; 30: 223–228.
- [6] Georgala S, Katoulis AC, Befon A, et al. Inosiplex for treatment of alopecia areata: a randomized placebo‑controlled study. Acta Derm Venerol 2006; 86: 422–424.
- [7] Lasek W, Janyst M, Wolny R, et al. Immunomodulatory effects of inosine pranobex on cytokine production by human lymphocytes. Acta Pharm 2015; 65: 171–180.
- [8] Majewska A, Lasek W, Janyst M, Młynarczyk G. Inhibition of adenovirus multiplication by inosine pranobex and interferon α in vitro. Central Eur J Immunol 2015; 40: 395–399.
- [9] Beran J, Šalapová E, Špajdel M. Inosine pranobex is safe and effective for the treatment of subjects with confirmed acute respiratory viral infections: analysis and subgroup analysis from a Phase 4, randomised, placebo‑controlled, double‑blind study. BMC Infectious Diseases 2016; 16; doi:10.1186/s12879‑016‑1965‑5.
- [10] Ahmed SR, Newman AS, O’Daly J, et al. Inosine acedoben dimepranol promotes and early and sustained increase in the natural killer cell component of circulating lymphocytes: A clinical trial supporting anti‑viral indications. Int Immunopharmacol 2017; 42: 108–114.
- [11] Haskó G, Kuhel DG, Németh ZH, et al. Inosine inhibits inflammatory cytokine production by a posttranscriptional mechanism and protects against endotoxin‑induced shock. J Immunol 2000; 164: 1013–1019.
- [12] Shinohara Y, Tsukimoto M. Guanine and inosine nucleotides/nucleosides suppress murine T cell activation. Biochem Biophys Res Commun 2018; 498: 764–768.
- [13] Gołębiowska‑Wawrzyniak M, Markiewicz K, Kozar A, et al. The study on therapeutic efficacy of inosine pranobex in children. Polish J Food Nutr Sci 2004; 13/54(SI 2): 33–36.