Lebrikizumab
Souhrn
Rob F. Lebrikizumab. Remedia 2024; 34: 5–10.
V posledních letech se výrazně rozšířily možnosti léčby těžkých forem atopické dermatitidy, ke klasické biologické léčbě přibyly i inhibitory Janus kináz. Tato skupina léčiv však není vhodná pro všechny pacienty a v oblasti monoklonálních protilátek jsme dosud měli k dispozici pouze dupilumab. Situace se mění s příchodem lebrikizumabu – nové monoklonální protilátky, která inhibuje s vysokou afinitou signalizaci interleukinu 13. Lebrikizumab prokázal v průběhu klinického hodnocení velmi dobrou účinnost, srovnatelnou s ostatními cílenými léčivy pro terapii atopické dermatitidy, a velmi dobrý bezpečnostní profil bez nutnosti pravidelné laboratorní monitorace. Výrazně tak rozšiřuje možnosti léčby našich pacientů.
Klíčová slova: atopická dermatitida – lebrikizumab – IL‑13 – účinnost – bezpečnostní profil.
Summary
Rob F. Lebrikizumab. Remedia 2024; 34: 5–10.
In recent years, treatment options for severe forms of atopic dermatitis have significantly expanded. In addition to classic biological treatment, JAK inhibitors also became available. However, this group of drugs is not suitable for all patients, and only one monoclonal antibody – dupilumab – could have been used until recently. This situation is changing with the arrival of lebrikizumab, which is a new monoclonal antibody that inhibits interleukin 13 signaling with high affinity. Lebrikizumab has demonstrated very good efficacy during clinical trials, comparable to other targeted drugs for the therapy of atopic dermatitis, and a very good safety profile, without the need of regular laboratory monitoring. Thus, it significantly expands the treatment options for our patients.
Key words: atopic dermatitis – lebrikizumab – IL‑13 – efficacy – safety profile.
Úvod
Atopická dermatitida je v populaci velmi častým onemocněním vyskytujícím se převážně u dětí, ale také u dospělých. Po dlouhou dobu nebyla k dispozici žádná cílená terapie pro pacienty se závažnými formami onemocnění. S příchodem první monoklonální protilátky dupilumabu se významně zlepšila kvalita života mnohých pacientů. Velmi recentně se také terapeutické možnosti rozšířily o inhibitory Janus kináz (JAK), které vynikají velmi rychlou a účinnou úlevou od svědění; dle současných doporučení však tato léčba není pro některé pacienty vhodná. Nové možnosti terapie v oblasti monoklonálních protilátek nám tak dávají možnost lepší personalizace terapie pro naše pacienty [1].
Lebrikizumab je novým moderním biologickým léčivem, které inhibuje signalizaci klíčového interleukinu (IL) 13, a tím efektivně blokuje patologickou imunitní reakci při atopické dermatitidě. V rozsáhlém klinickém hodnocení prokázal lebrikizumab dobrou účinnost i velmi dobrý bezpečnostní profil nejen u dospělých, ale také u adolescentů starších 12 let. Výhody pro pacienty léčené lebrikizumabem představuje měsíční interval aplikace při udržovací terapii a léčba bez nutnosti provádět laboratorní vyšetření před zahájením a v průběhu léčby [2].
Farmakologická skupina
Lebrikizumab je humanizovaná monoklonální protilátka IgG4, která inhibuje s vysokou afinitou signalizaci IL‑13. Dle ATC klasifikace je lebrikizumab řazen mezi dermatologická léčiva určená k terapii atopické dermatitidy (D11AH10).
Indikace
Lebrikizumab je indikován k léčbě středně těžké až těžké atopické dermatitidy u dospělých a dospívajících ve věku od 12 let s tělesnou hmotností nejméně 40 kg, kteří jsou kandidáty na systémovou terapii [3].
Dávkování a vedení léčby
Doporučené dávkovací schéma je 500 mg lebrikizumabu (dvě injekce po 250 mg) aplikovaných v 0. a 2. týdnu s následnou dávkou 250 mg podávanou subkutánně jednou za dva týdny až do 16. týdne. Po dosažení klinické odpovědi je doporučena udržovací dávka lebrikizumabu 250 mg aplikovaná jednou za čtyři týdny [3].
U pacientů, u nichž nebyla po 16 týdnech léčby zaznamenána žádná klinická odpověď, je třeba zvážit ukončení léčby. U některých pacientů s počáteční částečnou odpovědí může při pokračující léčbě jednou za dva týdny až do 24. týdne dojít následně ke zlepšení [3].
Léčba starších pacientů nevyžaduje úpravu dávkování. Obdobně není třeba změna dávkování u pacientů s poruchou funkce ledvin či jater.
Způsob podání
Lebrikizumab se podává ve formě subkutánní injekce obvykle do stehna, břicha nebo do horní části paže. Vzhledem k tomu, že při prvních dvou dávkách pacient aplikuje vždy dvě injekce, měla by být každá aplikována do jiného místa. Obdobně je vhodné při dalších aplikacích střídat místo vpichu a vyhýbat se aplikacím v místě citlivé nebo poškozené kůže. Po provedení nácviku správné techniky podání léčiva si mohou pacienti aplikovat injekce sami, pokud lékař rozhodne, že je to vhodné [3].
Vyšetření před zahájením léčby
Před zahájením terapie lebrikizumabem není nutné provádět laboratorní vyšetření.
Monitoring v průběhu léčby
V průběhu léčby není vyžadována laboratorní monitorace. Většina současných doporučení se shoduje na vyšetřování krevního obrazu a základních biochemických parametrů (jaterní funkce, renální parametry, glykemie, lipidogram) alespoň jednou ročně, hlavně pro včasný záchyt komorbidit.
Mechanismus účinku
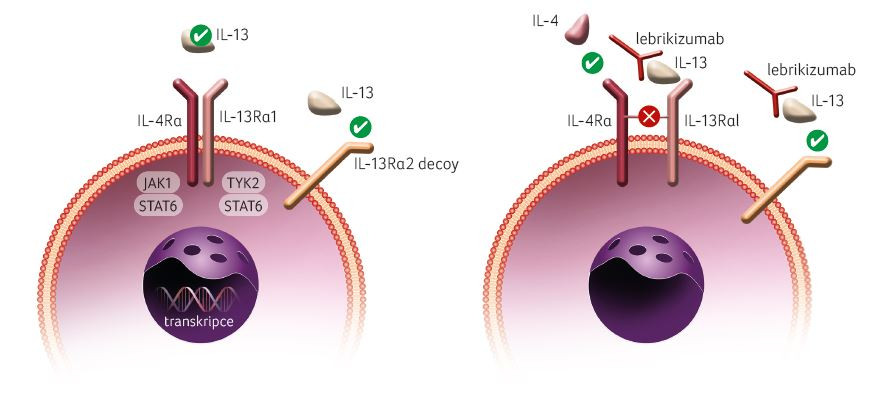 Lebrikizumab je monoklonální protilátka IgG4, která se váže s vysokou afinitou na IL‑13 a selektivně inhibuje signalizaci IL‑13 prostřednictvím heterodimeru receptoru alfa IL‑4 (IL‑4Rα)/receptoru alfa 1 IL‑13 (IL‑13Rα1). Inhibicí této signální dráhy dochází k potlačení účinků IL‑13. Současně lebrikizumab nebrání vazbě IL‑13 na receptor IL‑13 alfa 2 (IL‑13Rα2 nebo decoy receptor), což umožňuje internalizaci IL‐13 do buňky. Díky tomu dochází k přirozené clearance IL‑13 a snížení jeho hladin v tkáních (obr. 1). Současně lebrikizumab díky vysoké afinitě a pomalé rychlosti disociace na epitopu IL‑13 prokázal in vitro nižší pokles inhibiční koncentrace oproti ostatním anti‑IL‑13 monoklonálním protilátkám. Z dostupného výzkumu se zdá, že rozdíly mezi jednotlivými monoklonálními protilátkami blokujícími IL‑13 jsou způsobeny spíše blokováním receptoru a všech jeho přidružených funkcí než jen blokováním cytokinu a inhibicí pouze signalizace IL‑13 [4,5].
Lebrikizumab je monoklonální protilátka IgG4, která se váže s vysokou afinitou na IL‑13 a selektivně inhibuje signalizaci IL‑13 prostřednictvím heterodimeru receptoru alfa IL‑4 (IL‑4Rα)/receptoru alfa 1 IL‑13 (IL‑13Rα1). Inhibicí této signální dráhy dochází k potlačení účinků IL‑13. Současně lebrikizumab nebrání vazbě IL‑13 na receptor IL‑13 alfa 2 (IL‑13Rα2 nebo decoy receptor), což umožňuje internalizaci IL‐13 do buňky. Díky tomu dochází k přirozené clearance IL‑13 a snížení jeho hladin v tkáních (obr. 1). Současně lebrikizumab díky vysoké afinitě a pomalé rychlosti disociace na epitopu IL‑13 prokázal in vitro nižší pokles inhibiční koncentrace oproti ostatním anti‑IL‑13 monoklonálním protilátkám. Z dostupného výzkumu se zdá, že rozdíly mezi jednotlivými monoklonálními protilátkami blokujícími IL‑13 jsou způsobeny spíše blokováním receptoru a všech jeho přidružených funkcí než jen blokováním cytokinu a inhibicí pouze signalizace IL‑13 [4,5].
Farmakokinetické vlastnosti
Pohlaví, věk ani rasa nemají významný vliv na farmakokinetiku lebrikizumabu. Expozice lebrikizumabu je nižší u pacientů s vyšší tělesnou hmotností, ale bez významného ovlinění klinické účinnosti léčiva.
Subkutánní aplikace lebrikizumabu má na základě analýzy populační farmakokinetiky absolutní biologickou dostupnost kolem 86 %. Maximálních sérových koncentrací je dosahováno za týden po podání dávky. Po nasycovacích dávkách 500 mg v 0. týdnu a 2. týdnu bylo dosaženo ustálených sérových koncentrací ve 4. týdnu při první dávce 250 mg jednou za 2 týdny. Rozdílný výběr místa vpichu neměl významný vliv na absorpci lebrikizumabu [3].
V organismu se očekává, že se lebrikizumab rozloží na malé peptidy a jednotlivé aminokyseliny prostřednictvím katabolických drah stejným způsobem jako endogenní imunoglobuliny G (IgG). Průměrný poločas eliminace je kolem 24 dnů.
Klinické zkušenosti
Účinnost a bezpečnost lebrikizumabu byly studovány u více než 1 300 osob v rámci fáze I–III klinického hodnocení. Současně stále probíhají další studie např. u pediatrické populace mladší 12 let. Mezi pivotní studie fáze III klinického hodnocení lebrikizumabu patří ADvocate 1 a 2 (monoterapie) a ADhere (kombinovaná léčba s topickými kortikoidy). Všechny tyto tři studie byly multicentrické, randomizované, dvojitě zaslepené a placebem kontrolované. Do těchto studií byli zařazováni dospělí a dospívající pacienti (ve věku od 12 do 17 let a s tělesnou hmotností ≥ 40 kg) se středně těžkou až těžkou atopickou dermatitidou definovanou hodnotou EASI (Eczema Area and Severity Index) ≥ 16, se skóre celkového hodnocení zkoušejícím (Investigators Global Assessment, IGA) ≥ 3 a s postižením povrchu těla (Body Surface Area, BSA) ≥ 10 %. Pacienti zahrnutí do těchto tří studií měli v minulosti nedostatečnou odpověď na lokální terapii nebo bylo zjištěno, že lokální léčba pro ně nebyla vhodná. Téměř polovina všech pacientů v těchto studiích již v minulosti systémovou terapii atopické dermatitidy měla [6,7].
Studie ADvocate 1 a 2 – lebrikizumab v monoterapii
![GRAF 1 Účinnost lebrikizumabu v monoterapii (studie ADvocate 1 a ADvocate 2); podle [6] – Silverberg, et al., 2023. EASI 75 – 75% zlepšení Eczema Area and Severity Index GRAF 1 Účinnost lebrikizumabu v monoterapii (studie ADvocate 1 a ADvocate 2); podle [6] – Silverberg, et al., 2023. EASI 75 – 75% zlepšení Eczema Area and Severity Index](https://www.remedia.cz/photo-pg-1266---.jpg) ADvocate 1 a 2 byly identické studie s 16týdenním indukčním obdobím následovaným 36 týdny udržovací léčby až do celkem 52 týdnů. Do klinického hodnocení bylo zařazeno 869 pacientů ve věku od 12 let. Po dobu studie nebylo povoleno využívat lokální kortikoidy, pouze v rámci záchranné terapie. Po 16 týdnech léčby (ukončení indukčního období) dosáhlo primárního cíle IGA 0 nebo 1 ve studii ADvocate 1 celkem 43 % pacientů léčených lebrikizumabem každé 2 týdny oproti 13 % pacientů léčených placebem. Velmi obdobný výsledek byl zaznamenán ve studii ADvocate 2, kde dosáhlo IGA 0 nebo 1 celkem 33 % pacientů léčených lebrikizumabem a pouze 11 % osob v rameni s placebem. Odpovědi EASI 75 (zlepšení skóre EASI alespoň o 75 %) dosáhlo 59 % (ADvocate 1), respektive 52 % (ADvocate 2) pacientů v ramenech s lebrikizumabem a pouze 16 %, respektive 18 % v placebových skupinách. Optimálního terapeutického cíle EASI 90 (90% zlepšení skóre EASI) dosáhlo v monoterapii 38 %, respektive 31 % pacientů s lebrikizumabem a pouze 9 %, respektive 10 % pacientů při podávání placeba (graf 1).
ADvocate 1 a 2 byly identické studie s 16týdenním indukčním obdobím následovaným 36 týdny udržovací léčby až do celkem 52 týdnů. Do klinického hodnocení bylo zařazeno 869 pacientů ve věku od 12 let. Po dobu studie nebylo povoleno využívat lokální kortikoidy, pouze v rámci záchranné terapie. Po 16 týdnech léčby (ukončení indukčního období) dosáhlo primárního cíle IGA 0 nebo 1 ve studii ADvocate 1 celkem 43 % pacientů léčených lebrikizumabem každé 2 týdny oproti 13 % pacientů léčených placebem. Velmi obdobný výsledek byl zaznamenán ve studii ADvocate 2, kde dosáhlo IGA 0 nebo 1 celkem 33 % pacientů léčených lebrikizumabem a pouze 11 % osob v rameni s placebem. Odpovědi EASI 75 (zlepšení skóre EASI alespoň o 75 %) dosáhlo 59 % (ADvocate 1), respektive 52 % (ADvocate 2) pacientů v ramenech s lebrikizumabem a pouze 16 %, respektive 18 % v placebových skupinách. Optimálního terapeutického cíle EASI 90 (90% zlepšení skóre EASI) dosáhlo v monoterapii 38 %, respektive 31 % pacientů s lebrikizumabem a pouze 9 %, respektive 10 % pacientů při podávání placeba (graf 1).
Důležitým kritériem pro hodnocení léčby atopické dermatitidy je i ústup svědění, které bývá nejvýraznějším subjektivním symptomem pacientů. Zmírnění pruritu alespoň o 4 body dosáhlo po 16 týdnech 46 %, respektive 40 % pacientů užívajících lebrikizumab a pouze 13 %, respektive 12 % osob v placebových skupinách [6].
![GRAF 2A, B Dlouhodobé udržení odpovědi EASI 75 (A) a EASI 90 (B) po 52 týdnech léčby; podle [8] – Blauvelt, et al., 2023. EASI 75/90 – 75%/90% zlepšení Eczema Area and Severity Index GRAF 2A, B Dlouhodobé udržení odpovědi EASI 75 (A) a EASI 90 (B) po 52 týdnech léčby; podle [8] – Blauvelt, et al., 2023. EASI 75/90 – 75%/90% zlepšení Eczema Area and Severity Index](https://www.remedia.cz/photo-pg-1267---.jpg) Pacienti, kteří měli dobrou odpověď na terapii lebrikizumabem (dosažení primárních cílů bez záchranné medikace) v těchto studiích, mohli dále pokračovat v extenzi studie po provedení rerandomizace na lebrikizumab každé 2 týdny, lebrikizumab každé 4 týdny nebo placebo. Po celkem 52 týdnech léčby udrželo odpověď EASI 75 celkem 78 % pacientů léčených lebrikizumabem každé 2 týdny, 82 % pacientů s lebrikizumabem podávaným každé 4 týdny a 66 % pacientů, kteří dostávali placebo. Ambicióznější odpovědi EASI 90 dosáhlo 64 % osob s aplikací lebrikizumabu každé 2 týdny a 66 % osob s aplikací každé 4 týdny (graf 2A, B) [8].
Pacienti, kteří měli dobrou odpověď na terapii lebrikizumabem (dosažení primárních cílů bez záchranné medikace) v těchto studiích, mohli dále pokračovat v extenzi studie po provedení rerandomizace na lebrikizumab každé 2 týdny, lebrikizumab každé 4 týdny nebo placebo. Po celkem 52 týdnech léčby udrželo odpověď EASI 75 celkem 78 % pacientů léčených lebrikizumabem každé 2 týdny, 82 % pacientů s lebrikizumabem podávaným každé 4 týdny a 66 % pacientů, kteří dostávali placebo. Ambicióznější odpovědi EASI 90 dosáhlo 64 % osob s aplikací lebrikizumabu každé 2 týdny a 66 % osob s aplikací každé 4 týdny (graf 2A, B) [8].
Studie ADhere – lebrikizumab v kombinaci s topickými kortikoidy
![GRAF 3A, B Zmírnění svědění (hodnoceno jako změna hodnoty NRS ≥ 4) a zlepšení kvality života (hodnoceno pomocí DLQI) při terapii lebrikizumabem v kombinaci s lokálními kortikoidy oproti placebu s lokálními kortikoidy; podle [7] – Simpson, et al., 2023. NRS – Numeric Rating Scale; DLQI – Dermatology Life Quality Index; TCS – topické kortikoidy GRAF 3A, B Zmírnění svědění (hodnoceno jako změna hodnoty NRS ≥ 4) a zlepšení kvality života (hodnoceno pomocí DLQI) při terapii lebrikizumabem v kombinaci s lokálními kortikoidy oproti placebu s lokálními kortikoidy; podle [7] – Simpson, et al., 2023. NRS – Numeric Rating Scale; DLQI – Dermatology Life Quality Index; TCS – topické kortikoidy](https://www.remedia.cz/photo-pg-1268---.jpg) Do studie ADhere bylo zařazeno 211 pacientů starších 12 let, kteří mohli již od počátku klinického hodnocení využívat pravidelně mírně a středně účinné lokální kortikoidy po celou dobu 16 týdnů trvání studie. Primárními cíli této studie bylo taktéž dosažení odpovědi EASI 75 a IGA skóre 0 či 1. V případě možnosti pravidelného využití lokálních kortikoidů lze očekávat lepší výsledky oproti monoterapii hlavně v placebových ramenech, což se v této studii potvrdilo. Po 16 týdnech dosáhlo odpovědi EASI 75 celkem 70 % pacientů léčených lebrikizumabem oproti 42 % pacientů s placebem. Optimálního účinku EASI 90 dosáhlo 41 % osob, které dostávaly lebrikizumab, a jen 22 % osob na placebu. Prakticky identický výsledek byl i u hodnocení IGA 0 nebo 1 ve skupině lebrikizumabu (41 %) i placeba (22 %). Zmírnění pruritu alespoň o 4 body dosáhlo po 16 týdnech 51 % pacientů užívajících lebrikizumab a 32 % osob v placebové skupině. Lebrikizumab v kombinaci s lokálními kortkoidy měl taktéž výrazně pozitivní vliv na kvalitu života pacientů hodnocenou pomocí skóre DLQI (Dermatology Life Quality Index) oproti skupině využívající pouze lokální kortikoidy a placebo (graf 3A, B). Pacienti užívající lebrikizumab taktéž měli vyšší kvalitu spánku a měli signifikantně méně dnů, ve kterých museli aplikovat lokální kortikoidy [7].
Do studie ADhere bylo zařazeno 211 pacientů starších 12 let, kteří mohli již od počátku klinického hodnocení využívat pravidelně mírně a středně účinné lokální kortikoidy po celou dobu 16 týdnů trvání studie. Primárními cíli této studie bylo taktéž dosažení odpovědi EASI 75 a IGA skóre 0 či 1. V případě možnosti pravidelného využití lokálních kortikoidů lze očekávat lepší výsledky oproti monoterapii hlavně v placebových ramenech, což se v této studii potvrdilo. Po 16 týdnech dosáhlo odpovědi EASI 75 celkem 70 % pacientů léčených lebrikizumabem oproti 42 % pacientů s placebem. Optimálního účinku EASI 90 dosáhlo 41 % osob, které dostávaly lebrikizumab, a jen 22 % osob na placebu. Prakticky identický výsledek byl i u hodnocení IGA 0 nebo 1 ve skupině lebrikizumabu (41 %) i placeba (22 %). Zmírnění pruritu alespoň o 4 body dosáhlo po 16 týdnech 51 % pacientů užívajících lebrikizumab a 32 % osob v placebové skupině. Lebrikizumab v kombinaci s lokálními kortkoidy měl taktéž výrazně pozitivní vliv na kvalitu života pacientů hodnocenou pomocí skóre DLQI (Dermatology Life Quality Index) oproti skupině využívající pouze lokální kortikoidy a placebo (graf 3A, B). Pacienti užívající lebrikizumab taktéž měli vyšší kvalitu spánku a měli signifikantně méně dnů, ve kterých museli aplikovat lokální kortikoidy [7].
Studie ADore – lebrikizumab v kombinaci s lokální terapií u adolescentů
![GRAF 4A, B Dosažení terapeutické účinnosti EASI 75 a EASI 90 u adolescentních pacientů léčených lebrikizumabem po dobu 52 týdnů; podle [9] – Paller, et al., 2023. EASI 75/90 – 75%/90% zlepšení skóre Eczema Area and Severity Index GRAF 4A, B Dosažení terapeutické účinnosti EASI 75 a EASI 90 u adolescentních pacientů léčených lebrikizumabem po dobu 52 týdnů; podle [9] – Paller, et al., 2023. EASI 75/90 – 75%/90% zlepšení skóre Eczema Area and Severity Index](https://www.remedia.cz/photo-pg-1269---.jpg) V rámci studie ADore byla hodnocena účinnost a bezpečnost terapie lebrikizumabem u adolescentů (12–18 let) po dobu 52 týdnů. V průběhu tohoto klinického hodnocení mohli adolescentní pacienti využívat lokální terapii včetně lokálních kortikoidů a topických imunomodulátorů. Do studie bylo zařazeno 206 pacientů, z nichž 172 (83 %) studii dokončilo. Pouze 5 (2 %) pacientů ukončilo předčasně studii z důvodů nežádoucích účinků a 4 (2 %) pacienti pro nedostatečnou účinnost léčby. Po 16 týdnech terapie dosáhlo 73 % pacientů EASI 75 a 44 % pacientů EASI 90. Po 52 týdnech terapie udrželo 82 % pacientů účinnost EASI 75 a 61 % pacientů EASI 90 (graf 4A, B). Adolescentní pacienti taktéž vykazovali rychlé a signifikantní zlepšení kvality života a snížení výskytu úzkostí a depresivních stavů [9].
V rámci studie ADore byla hodnocena účinnost a bezpečnost terapie lebrikizumabem u adolescentů (12–18 let) po dobu 52 týdnů. V průběhu tohoto klinického hodnocení mohli adolescentní pacienti využívat lokální terapii včetně lokálních kortikoidů a topických imunomodulátorů. Do studie bylo zařazeno 206 pacientů, z nichž 172 (83 %) studii dokončilo. Pouze 5 (2 %) pacientů ukončilo předčasně studii z důvodů nežádoucích účinků a 4 (2 %) pacienti pro nedostatečnou účinnost léčby. Po 16 týdnech terapie dosáhlo 73 % pacientů EASI 75 a 44 % pacientů EASI 90. Po 52 týdnech terapie udrželo 82 % pacientů účinnost EASI 75 a 61 % pacientů EASI 90 (graf 4A, B). Adolescentní pacienti taktéž vykazovali rychlé a signifikantní zlepšení kvality života a snížení výskytu úzkostí a depresivních stavů [9].
Bezpečnostní profil
Robustnější data týkající se bezpečnosti lebrikizumabu máme z integrované analýzy osmi studií fáze II a III klinického hodnocení. Data vycházejí z analýzy celkem 1 720 pacientů exponovaných lebrikizumabu (1 637 osoboroků expozice). Při srovnání všech placebem kontrolovaných období byla frekvence nežádoucích účinků souvisejících s léčbou mezi jednotlivými studijními skupinami podobná, alespoň jedna nežádoucí událost se objevila u 49 % pacientů léčených lebrikizumabem a u 53 % pacientů s placebem, většina těchto příhod byla nezávažná a mírná nebo středně závažná. Nejčastějšími nežádoucími příhodami byly atopická dermatitida v ramenech s placebem (18 %) a konjunktivitida ve skupinách s lebrikizumabem (6 %). Mezi další nejčastější nežádoucí události při terapii lebrikizumabem patřil výskyt nazofaryngitid (4 %) a bolesti hlavy (4 %). Závažné nežádoucí události se vyskytly jen u 1 % pacientů s lebrikizumabem a u 2 % pacientů s placebem. Výskyt jakéhokoliv typu konjunktivitidy byl pozorován u 2 % pacientů v rameni s placebem a u 9 % všech pacientů s lebrikizumabem, všechny však byly hodnoceny jako mírné nebo střední závažnosti [10].
Infekce včetně herpetických nebyly při terapii lebrikizumabem časté a jejich výskyt byl obdobný jako při podávání placeba. Taktéž v průběhu těchto studií nebyl zaznamenán zvýšený výskyt parazitárních infekcí. Reakce v místě vpichu byly hlášeny u 3 % pacientů ve skupině s lebrikizumabem a u 2 % osob v rameni s placebem. Přerušit léčbu pro nežádoucí účinky muselo ve všech studiích s lebrikizumabem pouze 4 % pacientů s aktivní léčbou a 1 % osob na placebu. V průběhu všech klinických studií zemřeli tři (0,2 %) pacienti exponovaní lebrikizumabu, žádné z těchto úmrtí však nebylo hodnoceno jako související s léčbou. V dosud provedených klinických studiích s lebrikizumabem nebyla hlášena hypersenzitivita nebo anafylaktická reakce na lebrikizumab. Zvýšená sérová koncentrace eozinofilů se v průběhu léčby vyskytla u 20 % pacientů léčených lebrikizumabem oproti 12 % z ramene s placebem, většina těchto zvýšení byla mírná, bez klinických obtíží u pacientů. Vzhledem k expozici adolescentů v průběhu klinických studií byl hodnocen i růst pacientů, který se nelišil mezi placebem a lebrikizumabem. Adolescentní pacienti, kteří užívali lebrikizumab až po 52 týdnů, neměli změněný průměrný percentil růstu ve srovnání s vrstevníky stejného věku a pohlaví. Léčba lebrikizumabem tak neměla klinicky významný dopad na růst [3,10].
Kontraindikace
Lebrikizumab je kontraindikován pouze u pacientů s hypersenzitivitou na léčivou látku nebo na kteroukoli pomocnou látku [3].
Lékové interakce
V rámci klinického hodnocení nebyly provedeny studie lékových interakcí. Lebrikizumab je monoklonální protilátkou, a proto se žádné farmakokinetické interakce neočekávají [3].
Vakcinace
Bezpečnost a účinnost souběžného podávání lebrikizumabu s živými atenuovanými vakcínami nebyly dosud zkoumány. Proto by se lebrikizumab neměl s těmito vakcínami souběžně podávat.
V rámci klinického hodnocení byla zkoumána imunitní odpověď na neživé vakcíny u pacientů užívajících lebrikizumab. Po 12 týdnech podávání lebrikizumabu byli někteří pacienti očkováni kombinovanou vakcínou proti záškrtu, tetanu a dávivému kašli, části pacientů byla podána meningokoková vakcína. Hodnocení imunitní odpovědi po čtyřech týdnech neprokázalo negativní ovlivnění souběžnou léčbou lebrikizumabem. Nebyly taktéž zaznamenány žádné nežádoucí interakce. Obdobně jako u ostatních biologických léčiv tak lze očkovat pacienty užívající lebrikizumab inaktivovanými nebo neživými vakcínami [3].
Těhotenství a kojení
Těhotenství
Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky léčby. Nicméně údaje o podávání lebrikizumabu těhotným ženám nejsou k dispozici. Proto se podávání přípravku v těhotenství z preventivních důvodů nedoporučuje [3].
Kojení
Není známo, zda se lebrikizumab vylučuje do lidského mateřského mléka. Je známo, že je v lidském mateřském mléce přítomen mateřský IgG, proto riziko pro novorozence (kojence) nelze vyloučit. U kojících žen je proto nutno vždy postupovat individuálně na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku [3].
Fertilita
Studie na zvířatech neprokázaly žádnou poruchu fertility [3].
Závěr
Lebrikizumab byl schválen Evropskou lékovou agenturou v listopadu 2023 a je indikován k léčbě středně těžké až těžké atopické dermatitidy u dospělých a dospívajících pacientů od 12 let s tělesnou hmotností nejméně 40 kg, kteří jsou kandidáty na systémovou terapii. Lebrikizumab přináší novou možnost účinné terapie těžkých forem atopické dermatitidy pomocí vysoce účinné blokace IL‑13. Díky svému velmi dobrému bezpečnostnímu profilu s poměrně nízkým výskytem konjunktivitid v klinických studiích a bez nutnosti laboratorní monitorace je lebrikizumab vhodným lékem i pro adolescentní pacienty. V České republice nebyla zatím u přípravku stanovena úhrada.
Doc. MUDr. Filip Rob, Ph.D.
Dermatovenerologická klinika 2. LF UK a FN Bulovka
Budínova 67/2, 180 81 Praha 8
e-mail: filip.rob@bulovka.cz
Literatura
[1] David E, Ungar B, Renert‐Yuval Y, et al. The evolving landscape of biologic therapies for atopic dermatitis: Present and future perspective. Clin Exp Allergy 2023; 53: 156–172.
[2] Bernardo D, Bieber T, Torres T. Lebrikizumab for the Treatment of Moderate‑to‑Severe Atopic Dermatitis. Am J Clin Dermatol 2023; 24: 753–764.
[3] Sourhn údajů o přípravku Ebglyss. Dostupné na: https://www.sukl.cz (navštíveno 25. 1. 2024)
[4] Okragly A, Ryuzoji A, Daniels M, et al. Comparison of the affinity and in vitro activity of lebrikizumab, tralokinumab, and cendakimab primary human cell assays‑IL‑13 induced periostin. Inflammatory Skin Disease Summit (ISDS), Nov. 2021. Virtual/New York (USA).
[5] Okragly AJ, Ryuzoji A, Wulur I, et al. Binding, Neutralization and Internalization of the Interleukin‑13 Antibody, Lebrikizumab. Dermatol Ther (Heidelb) 2023; 13: 1535–1547.
[6] Silverberg JI, Guttman‑Yassky E, Thaçi D, et al. Two phase 3 trials of lebrikizumab for moderate‑to‑severe atopic dermatitis. N Engl J Med 2023; 388: 1080–1091.
[7] Simpson EL, Gooderham M, Wollenberg A, et al. Efficacy and safety of lebrikizumab in combination with topical corticosteroids in adolescents and adults with moderate‑to‑severe atopic dermatitis: a randomized clinical trial (ADhere). JAMA Dermatol 2023; 159: 182–191.
[8] Blauvelt A, Thyssen JP, Guttman‑Yassky E, et al. Efficacy and safety of lebrikizumab in moderate‑to‑severe atopic dermatitis: 52‑week results of two randomized double‑blinded placebo‑controlled phase III trials. Br J Dermatol 2023; 188: 740–748.
[9] Paller AS, Flohr C, Eichenfield LF, et al. Safety and Efficacy of Lebrikizumab in Adolescent Patients with Moderate‑to‑Severe Atopic Dermatitis: A 52‑Week, Open‑Label, Phase 3 Study. Dermatol Ther (Heidelb) 2023; 13: 1517–1534.
[10] Gold LS, Thaci D, Thyssen JP, et al. Safety of Lebrikizumab in Adults and Adolescents with Moderate‑to‑Severe Atopic Dermatitis: An Integrated Analysis of Eight Clinical Trials. Am J Clin Dermatol 2023; 24: 595–607.