Midostaurin v léčbě akutní myeloidní leukemie s FLT3‑ITD, charakteristika a první klinické zkušenosti
Souhrn:
Válka J, Soukup P, Novotová E, Čemusová B, Vydra J. Midostaurin v léčbě akutní myeloidní leukemie s FLT3‑ITD, charakteristika a první klinické zkušenosti. Remedia 2020; 30: 277–283.
Multikinázový inhibitor midostaurin je novou léčivou látkou užívanou spolu se standardní chemoterapií v terapii pacientů s akutní myeloidní leukemií (AML) s mutací kinázy FLT3. Jedná se o přípravek první generace ze skupiny inhibitorů FLT3 a v současnosti je jedinou léčivou látkou z této skupiny, která má schválenu indikaci a úhradu v indukční a konsolidační léčbě pacientů s AML. Midostaurin je podáván ve formě perorálních tobolek dvakrát denně 8.–21. den cyklu chemoterapie. Prostřednictvím enzymu CYP3A4 je biotransformován na metabolity, které mají rovněž farmakologickou aktivitu. Zvýšené opatrnosti je nutno dbát při současné medikaci silnými inhibitory CYP3A4, které mohou vést ke zvýšení toxicity vlivem prodloužení expozice účinné látce. Midostaurin je pacienty obecně dobře tolerován, zvláště při podávání s jídlem, které redukuje dosažené vrcholové maximální koncentrace a snižuje četnost epizod nevolnosti a zvracení. Nejčastějším nežádoucím účinkem v klinických studiích byla febrilní neutropenie, specifickými nežádoucími účinky jsou prodloužení intervalu QTc a rozvoj intersticiálního plicního postižení. Ve studii RATIFY dosáhl medián celkového přežití při terapii midostaurinem se standardní chemoterapií 74,7 měsíce oproti 25,6 měsíce při léčbě standardní chemoterapií v kombinaci s placebem. Při terapii midostaurinem byla pozorována vyšší četnost dosažení kompletní remise onemocnění a delší interval přežití bez nemoci daný redukcí četnosti relapsů AML. Článek rovněž shrnuje klinické zkušenosti s midostaurinem a management nežádoucích účinků v praxi pracoviště autorů – ÚHKT.
Summary:
Valka J, Soukup P, Novotova E, Cemusova B, Vydra J. Midostaurin in the treatment of acute myeloid leukemia with FLT3‑ITD, characteristics and first clinical experience. Remedia 2020; 30: 277–283.
The multi‑kinase inhibitor midostaurin is a new therapeutic agent used together with standard chemotherapy in the treatment of patients with acute myeloid leukemia (AML) and a FLT3‑kinase mutation. It is a first generation product from the FLT3‑inhibitor family and is currently the only therapeutic agent of this group approved and reimbursed for the treatment of patients in induction and consolidation of AML. Midostaurin is administered orally as capsules twice daily on days 8‑21 of the chemotherapy cycle and is metabolised by CYP3A4 to metabolites that also have pharmacological activity. Caution should be exercised if it is co‑administered with potent CYP3A4 inhibitors that may lead to increased toxicity due to prolonged exposure to the active substance. Midostaurin is generally well tolerated by patients, particularly when administered with food that lowers the peak of maximal concentrations and reduces the frequency of nausea and vomiting. The most common adverse event in clinical trials was febrile neutropenia and specific adverse events included QTc prolongation and development of interstitial lung involvement. In the RATIFY study, median overall survival for midostaurin in combination with standard chemotherapy was 74.7 months compared with 25.6 months for standard chemotherapy in combination with placebo. In the midostaurin arm, a higher rate of complete AML remissions and a longer disease‑free interval due to a reduction in the frequency of relapses were observed. The article also summarizes the clinical experience with midostaurin and the management of adverse reactions at the UHKT.
Key words: midostaurin, acute myeloid leukemia, AML – FLT3‑ITD
Úvod
Midostaurin (Rydapt) je cytostatikum ze skupiny multikinázových inhibitorů. Přípravek je novým léčivem užívaným spolu se standardní chemoterapií v léčbě pacientů s akutní myeloidní leukemií (AML) s přítomnou mutací kinázy FLT3 (fms related thyrosine kinase 3). Jedná se o přípravek první generace ze skupiny inhibitorů FLT3 a v současnosti je jedinou léčivou látkou z této skupiny, která má schválenu indikaci a úhradu k léčbě pacientů s AML. Ostatní inhibitory FLT3 se dosud nacházejí v různých fázích klinického testování a jsou dostupné k léčbě nemocných pouze v rámci klinických studií či specifických léčebných programů.
Indikace a úhrada
Midostaurin je indikován v léčbě dospělých pacientů s nově diagnostikovanou AML s mutací genu FLT3, a to ve třech fázích léčby:
- V indukční terapii AML v kombinaci se standardní chemoterapií daunorubicinem a cytarabinem, zde je cílem terapie dosažení kompletní odpovědi.
- V konsolidační terapii v kombinaci s chemoterapií vysokodávkovaným cytarabinem s cílem zajistit přetrvávání kompletní odpovědi a zabránit relapsu onemocnění.
- U pacientů s kompletní odpovědí je indikován jako následná udržovací monoterapie s cílem udržet kompletní odpověď (kompletní remisi onemocnění) a zabránit relapsu onemocnění či jej maximálně oddálit.
Midostaurin je ze zdravotního pojištění hrazen pro léčbu AML v 1–2 cyklech indukční terapie 3 + 7 (daunorubicin + cytarabin) a ve 3–4 cyklech konsolidační terapie vysokodávkovaným cytarabinem (HiDAC, high dose cytarabin) či střednědávkovaným cytarabinem (intermediate dose cytarabin, IDAC). U pacientů starších 60 let je nutno v dokumentaci doložit písemné zdůvodnění vhodnosti intenzivní terapie. Udržovací monoterapie není v současné době v České republice ze zdravotního pojištění hrazena.
Dále je midostaurin indikován jako monoterapie k léčbě pacientů s agresivní systémovou mastocytózou (ASM), systémovou mastocytózou spojenou s dalším hematologickým onemocněním (SM AHN) nebo s mastocytární leukemií (MCL). S užitím midostaurinu v těchto indikacích nemají autoři tohoto článku dosud žádné klinické zkušenosti.
Dávkování
V léčbě AML je midostaurin užíván perorálně v dávce 50 mg (tedy 2 tobolky po 25 mg) dvakrát denně ve dvanáctihodinových intervalech. Z farmakokinetických důvodů by měl být midostaurin užíván s jídlem (viz níže). Přípravek je podáván 8.–21. den cyklu chemoterapie (indukční i konsolidační). V následné udržovací monoterapii u pacientů s kompletní remisí AML je poté užíván do relapsu onemocnění každý den po dobu až 12 cyklů, přičemž každý cyklus trvá 28 dní. V případě, že je pacient indikován k alogenní transplantaci kostní dřeně (stem cell transplantation, SCT), je léčba midostaurinem ukončena 48 hodin před zahájením přípravného režimu transplantace.
V terapii ASM, SM AHN a MCL je doporučovaná dávka midostaurinu 100 mg dvakrát denně, přípravek je užíván perorálně. Léčba by měla být podávána po dobu trvání klinického přínosu nebo do projevů neakceptovatelné toxicity.
U starších pacientů (> 65 let) a u nemocných s mírnou až středně těžkou poruchou funkce ledvin či s mírnou až středně těžkou poruchou funkce jater není potřeba úprava dávky. U dětí a dospívajících (do 18 let) nebyla bezpečnost a účinnost midostaurinu detailněji studována a jeho podání není u této populace indikováno a nedoporučuje se [1].
Mechanismus účinku
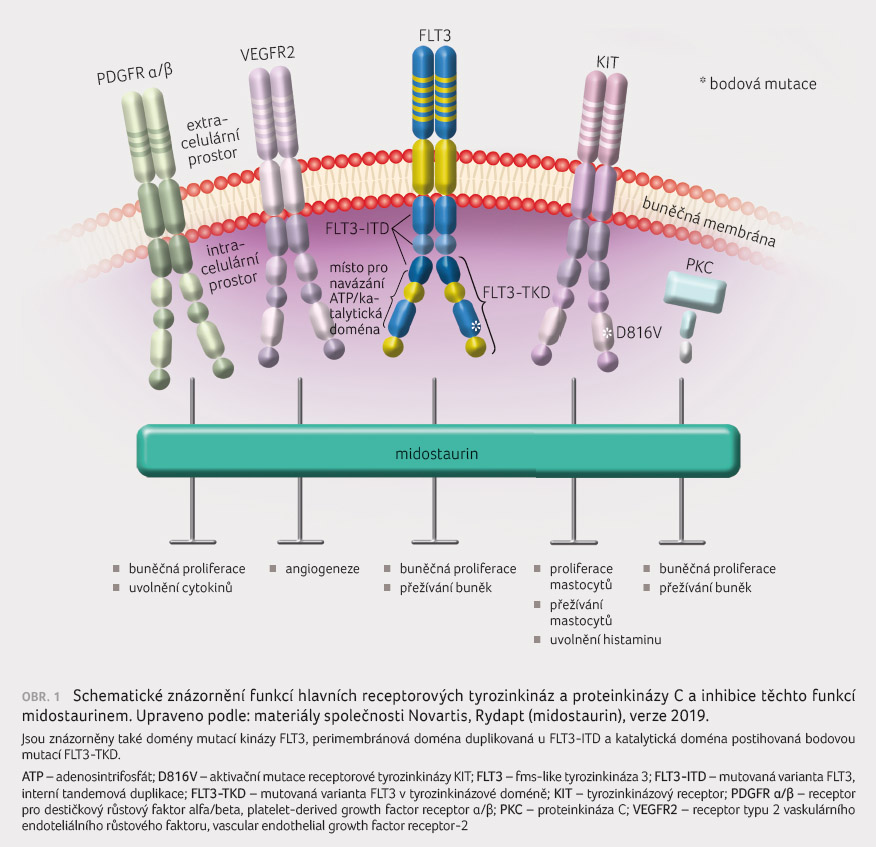
Midostaurin je multikinázový inhibitor, který vazbou v oblasti katalytické domény receptorových tyrozinových kináz (FLT3, KIT, PDGFR α/β, VEGFR2) a serin/threoninových kináz (proteinkináza C) inhibuje mitogenní signalizaci růstových faktorů a tím zastavuje buněčný růst [1].
Midostaurin inhibuje receptorovou kinázu FLT3, včetně jejích mutovaných variant FLT3 ITD (interní tandemová duplikace) a FLT3 TKD (tyrozinkinázová doména). Kináza FLT3 za fyziologického stavu po své aktivaci dále aktivuje signální dráhy podílející se na buněčné proliferaci [2]. V případě mutace dochází ke vzniku spontánně dimerizujících proteinů FLT3, tím je obcházena ligandem zprostředkovaná aktivace, což vede k nekontrolované proliferaci a ke snížené diferenciaci buněk podněcujících vývoj AML [3]. Inhibicí této signalizace dochází k zastavení buněčného cyklu leukemických buněk a je navozena jejich apoptóza [2].
Mutaci kinázy FLT3 zjišťujeme asi u 30 % dospělých pacientů s AML vzniklou de novo. Ve třech čtvrtinách případů se jedná o mutaci typu ITD, která vede k duplikaci části proteinu (v rozsahu 3−100 aminokyselin) přiléhající k buněčné membráně. Mutace FLT3 ITD je spojena s časným relapsem onemocnění a s celkovou vysokou četností relapsů a významně zhoršuje prognózu pacientů s AML. Zbývající čtvrtina pacientů má mutaci v tyrozinkinázové doméně kinázy FLT3, klinický význam této mutace je nejistý [4,5].
Midostaurin působí jako multikinázový inhibitor, navíc původně vyvinutý jako inhibitor proteinkinázy C k léčbě pacientů se solidními nádory [6], proto má relativně nízkou specifitu k inhibici kinázy FLT3. V klinických studiích je zkoušena řada nových kinázových inhibitorů FLT3 vyšších generací s významně vyšší specifitou právě ke kináze FLT3, tyto
látky ovšem v současné době dosud nemají schválenu indikaci a úhradu a mimo klinické studie nejsou běžně dostupné.
Mechanismus účinku midostaurinu a typy inhibovaných kináz schematicky znázorňuje obrázek 1.
Farmakokinetické vlastnosti
Midostaurin je po perorálním podání rychle vstřebán s dosažením maximální koncentrace (cmax) v průběhu 1−1,5 hodiny po podání dávky [7]. Absorpce midostaurinu se výrazně zvyšuje při podávání s jídlem. Při podávání spolu s běžným jídlem se absorpce (plocha pod křivkou plazmatické koncentrace, AUC) midostaurinu zvyšuje o 22 %, při podávání s jídlem s vysokým obsahem tuku pak až o 59 %. Současně také dochází ke snížení cmax při užívání přípravku s jídlem ve srovnání s užíváním nalačno, a to o 20 % při užívání s běžným jídlem a o 27 % při užívání s jídlem s vysokým obsahem tuku [8]. V plazmě je midostaurin, stejně jako jeho metabolity, vázán na α1-kyselý glykoprotein (AGP), dále také na albumin a lipoprotein [9].
Midostaurin je metabolizován v játrech prostřednictvím enzymu CYP3A4; inhibitory a induktory tohoto enzymu proto mohou zvyšovat či snižovat biologickou dostupnost midostaurinu. Hlavními metabolity midostaurinu jsou CGP62221 a CGP52421. Metabolit CGP62221 je produktem O demetylace základní molekuly, zatímco CGP52421 vzniká její hydroxylací [8]. Oba tyto metabolity vykazují in vitro farmakologickou aktivitu a představují asi 28 %, resp. 38 % celkové lékové
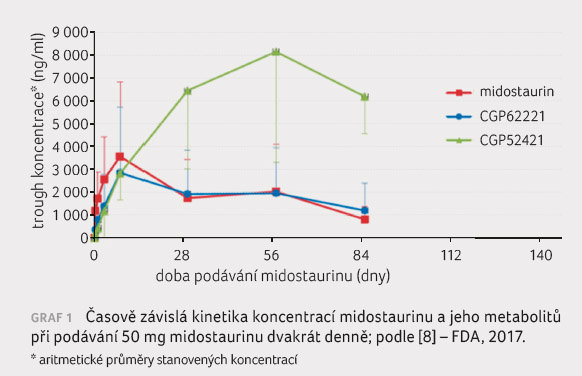
expozice v plazmě 96 hodin po podání dávky midostaurinu [1]. Relativní účinnost všech tří látek (midostaurin: CGP62221: CGP52421) při inhibici FLT3 v buňce je přibližně 1 : 1,4 : 0,1 [10]. Po opakovaném podání perorálních dávek vykazuje midostaurin časově závislou kinetiku s významným zvyšováním plazmatických koncentrací během prvních 3–5 dní s následným poklesem koncentrací na ustálenou hodnotu po 28 dnech (40–80% snížení koncentrace proti maximu v prvních dnech podání). Příčinou těchto klesajících koncentrací midostaurinu je pravděpodobně autoindukce cytochromu CYP3A4 midostaurinem a jeho dvěma aktivními metabolity [10]. Podobný trend vykazuje taktéž farmakokinetika metabolitu CGP62221. Vlivem odlišné farmakokinetiky metabolitu CGP52421 dochází po jednom měsíci kontinuální léčby u AML při podávání standardní dávky léčiva až k devítinásobnému zvýšení koncentrace tohoto metabolitu ve srovnání se zvýšením koncentrace midostaurinu (graf 1).
Mediány poločasů eliminace (t1/2) midostaurinu a jeho aktivních metabolitů CGP62221 a CGP52421 z plazmy jsou přibližně 20,9, 32,3 a 471 hodin. Midostaurin je vylučován převážně stolicí (78 % dávky), a to zejména ve formě metabolitů (73 % dávky), močí jsou vylučována pouze 4 % celkové dávky midostaurinu [1].
Kontraindikace
Kontraindikací podání midostaurinu je hypersenzitivita na účinnou látku nebo na kteroukoliv z látek pomocných. Kontraindikováno je také současné podávání midostaurinu se silnými induktory cytochromu CYP3A4, jako jsou rifampicin, karbamazepin, fenytoin a jiné.
Nežádoucí účinky
Bezpečnostní profil midostaurinu byl studován v registrační studii RATIFY celkem u 717 pacientů. Medián expozice přípravku činil 42 (2–576) dní. Nejčastějším nežádoucím účinkem byla febrilní neutropenie, která se vyskytla u 83,4 % pacientů v rameni s midostaurinem a u 80,5 % v rameni s placebem. Frekvence febrilní neutropenie se tedy s přidáním midostaurinu významně nezvyšuje oproti samotné standardní chemoterapii. Dalšími velmi častými nežádoucími účinky byly nevolnost (83,4 %) a zvracení (60,7 %). Frekventním nežádoucím účinkem byla také exfoliativní dermatitida, která se objevila u 61,6 % pacientů. Nejčastějším závažným nežádoucím účinkem stupně 3 nebo 4 byla febrilní neutropenie s frekvencí 83,5 % a dále potom lymfopenie (20 %) a exfoliativní dermatitida (13,6 %). Četnost ukončení léčby pro nežádoucí účinky v rameni studie s midostaurinem byla 3,1 % proti 1,3 % v rameni studie s placebem. Nejčastějším nežádoucím účinkem, který vedl k ukončení terapie midostaurinem, byla exfoliativní dermatitida (1,2 %) [8].
Tabulkový přehled všech nežádoucích
účinků s četností převyšující 10 % během indukční
fáze ve studii RATIFY uvádí tabulka 1.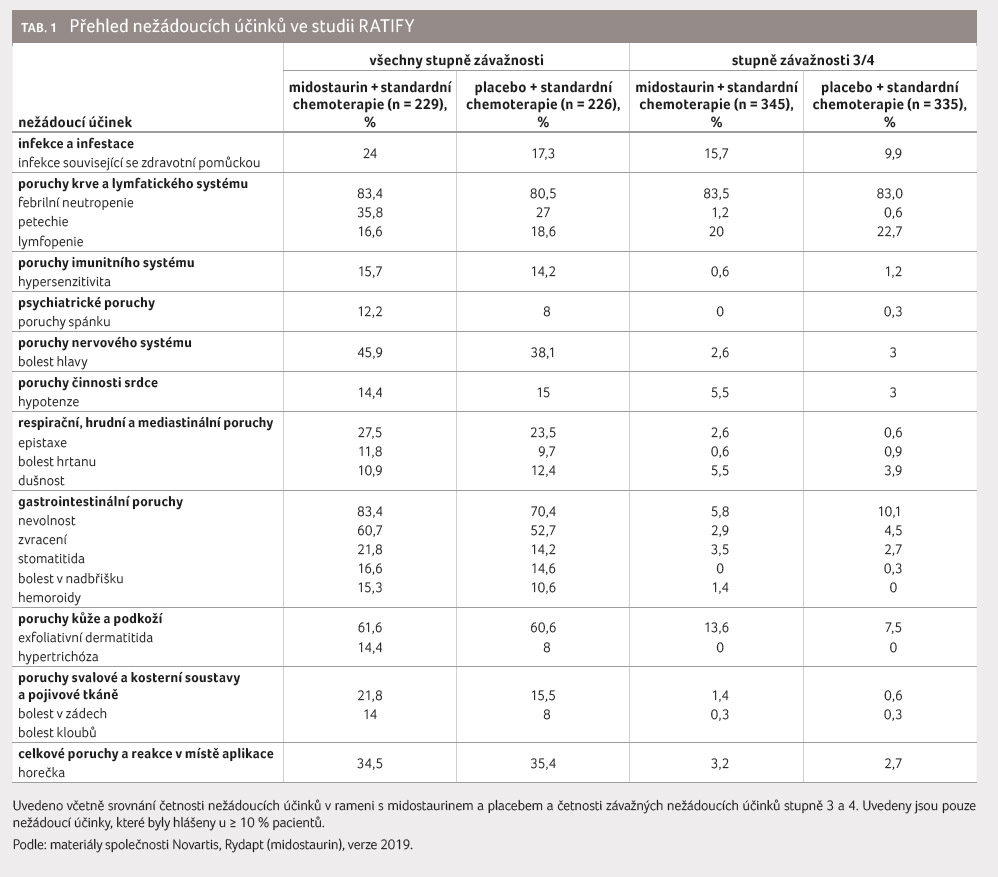
Specifickými nežádoucími účinky spojenými s terapií midostaurinem jsou prodloužení intervalu QTc a plicní toxicita. Prodloužení intervalu QTc na více než 480 ms bylo pozorováno u 10,1 % pacientů ve studii, prodloužení delší než 500 ms pak bylo zaznamenáno u 6,2 % pacientů [5]. Riziko prodloužení intervalu QT stoupá při současném podávání léků prodlužujících interval QT. Plicní toxicita charakteru pneumonitidy nebo intersticiálního plicního postižení byla pozorována u 11,4 % pacientů ve studii (ve 3,1 % případů přímo spojena s terapií midostaurinem) [5]. Jako důležité preventivní opatření se jeví neodkladné provedení HRCT (výpočetní tomografie s vysokým prostorovým rozlišením) plic u pacientů s respiračními symptomy a přerušení podávání midostaurinu u nemocných s rozvojem intersticiálního plicního procesu. Management nejčastějších a specifických nežádoucích účinků midostaurinu blíže popisuje oddíl Klinické zkušenosti v závěru tohoto článku.
Lékové interakce
Současné podávání midostaurinu se silnými induktory CYP3A4 (karbamazepin, rifampicin, fenytoin aj.) vede ke snížení koncentrací midostaurinu a jeho aktivních metabolitů a způsobuje až desetinásobné snížení expozice účinným látkám [12]. Dle Souhrnu údajů o přípravku (SPC) je proto současné podávání midostaurinu spolu se silnými induktory CYP3A4 kontraindikováno z důvodu snížení efektivity terapie.
Konkomitantní medikace silnými inhibitory CYP3A4 vede ke zvýšené expozici midostaurinu a jeho metabolitům. Inhibice CYP3A4 ketokonazolem vede k 1,8násobnému zvýšení cmax midostaurinu a k opožděné tvorbě a vylučování jeho metabolitů, což zvyšuje až desetinásobně celkovou expozici midostaurinu a může vést ke zvýšené toxicitě léčby tímto přípravkem [12]. Mezi silné inhibitory CYP3A4 se řadí zejména azoly, které jsou důležitou součástí profylaxe a terapie mykotických infekcí u hematologických pacientů. Z azolů jsou silnými inhibitory zejména ketokonazol a itrakonazol, středně silnými pak flukonazol, vorikonazol a posakonazol. Mezi inhibitory CYP3A4 patří rovněž některá antibiotika, zejména makrolidy (klaritromycin) a chinolony (ciprofloxacin), rovněž často používaná v terapii či profylaxi u hematologických pacientů [13].
Jak bylo zmíněno výše, současné podávání midostaurinu s látkami prodlužujícími interval QT potencuje riziko jeho nežádoucího prodloužení a vznik arytmií charakteru torsade de pointes (TdP). Mezi látky s významným rizikem rozvoje TdP při současném užívání s midostaurinem patří setrony (zejména ondansetron, méně granisetron), amiodaron, citalopram a některé antimikrobiální látky (makrolidová antibiotika, chinolony a azolová antimykotika).
Těhotenství a kojení
Dosud nebyly provedeny studie bezpečnosti a toxicity midostaurinu u těhotných pacientek, avšak studie na potkanech a králících prokázaly toxicitu midostaurinu pro plod. Podávání midostaurinu těhotným ženám a ženám v reprodukčním věku, které nepoužívají antikoncepci, se proto nedoporučuje. Současně by také mělo být během léčby a nejméně po dobu čtyř měsíců po podání poslední dávky midostaurinu přerušeno kojení. Studie na zvířatech prokázaly vylučování midostaurinu a jeho metabolitů do mateřského mléka [1].
Klinické zkušenosti
Registrační studií midostaurinu byla
RATIFY. Tato mezinárodní multicentrická, placebem kontrolovaná
studie fáze III hodnotila účinnost midostaurinu u 717
pacientů s nově diagnostikovanou AML s mutací FLT3
ve věku 18–65 let. Studie srovnávala efekt midostaurinu
v kombinaci se standardní chemoterapií oproti standardní
chemoterapii v kombinaci s placebem a následně
udržovací monoterapii midostaurinem proti placebu po dobu
jednoho roku [5]. Medián celkového přežití (overall survival,
OS) při terapii midostaurinem se standardní chemoterapií dosáhl
74,7 měsíce (95% interval spolehlivosti [CI] 31,5−nedosaženo),
při podávání standardního chemoterapeutického režimu
v kombinaci s placebem činil medián OS 25,6 měsíce
(95% CI 18,6−42,9). Data popisující OS nebyla cenzorována
ve vztahu k provedení SCT (graf 2) [5]. Četnost dosažení kompletních remisí činila
v rameni s midostaurinem 65 % proti 58 % v rameni
s placebem. Medián přežití bez nemoci (disease free
survival, DFS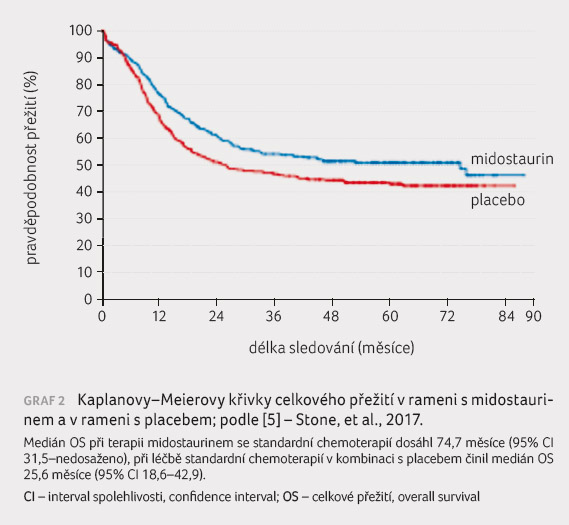 ) dosáhl u pacientů léčených chemoterapií
a midostaurinem 26,7 měsíce (95% CI 19,4−nedosaženo),
zatímco u pacientů léčených chemoterapií a placebem
činil pouze 15,5 měsíce (95% CI 11,3−23,5). Současně byl také
pozorován významný vliv na redukci výskytu relapsu
onemocnění, kumulativní incidence relapsu ve 12. měsíci
od diagnózy činila u midostaurinu 26 % oproti 41 %
u ramene s placebem [5]. Celkové přežití pacientů
ve vztahu k provedení SCT ukázalo 22% snížení rizika
mortality pacientů v rameni s midostaurinem proti
pacientům v rameni s placebem, u nichž byla
provedena SCT, a 20% snížení rizika mortality pacientů
v rameni s midostaurinem proti pacientům v rameni
s placebem, u nichž SCT provedena nebyla [1].
) dosáhl u pacientů léčených chemoterapií
a midostaurinem 26,7 měsíce (95% CI 19,4−nedosaženo),
zatímco u pacientů léčených chemoterapií a placebem
činil pouze 15,5 měsíce (95% CI 11,3−23,5). Současně byl také
pozorován významný vliv na redukci výskytu relapsu
onemocnění, kumulativní incidence relapsu ve 12. měsíci
od diagnózy činila u midostaurinu 26 % oproti 41 %
u ramene s placebem [5]. Celkové přežití pacientů
ve vztahu k provedení SCT ukázalo 22% snížení rizika
mortality pacientů v rameni s midostaurinem proti
pacientům v rameni s placebem, u nichž byla
provedena SCT, a 20% snížení rizika mortality pacientů
v rameni s midostaurinem proti pacientům v rameni
s placebem, u nichž SCT provedena nebyla [1].
Na našem pracovišti (Ústav hematologie a krevní transfuze – ÚHKT) jsme od září roku 2019 podali midostaurin celkem u sedmi pacientů s nově diagnostikovanou AML s mutací genu FLT3 ITD. Celkem bylo dokončeno 12 cyklů terapie midostaurinem (1,71 cyklu na pacienta). Pět pacientů dosáhlo kompletní remise onemocnění po jednom cyklu léčby midostaurinem, a to do dne 35 od zahájení terapie, současně nebylo pozorováno zásadní prodloužení cytopenie a s tím spojené zvýšení frekvence či závažnosti infekčních komplikací. U jedné ze zbývajících pacientek došlo po indukční terapii s midostaurinem k ustálené redukci počtu blastů v kostní dřeni a k rozvoji MDS EB 2 (myelodysplastického syndromu s nadbytkem blastů stupně 2) s dalším velmi dobrým a dlouhodobým efektem azacitidinu. U poslední nemocné indukční léčba selhala a bylo nutno podat záchrannou chemoterapii. Při dodržování zásadních doporučení pro terapii midostaurinem (podrobněji v dalším textu) se u žádného pacienta nevyskytly projevy závažné toxicity terapie. Přerušení podávání přípravku bylo nutné pouze ve dvou případech, u jedné pacientky došlo v průběhu indukční terapie k rozvoji zvracení a netolerance příjmu per os a u jednoho pacienta bylo nutno cyklus midostaurinu v indukční terapii přerušit pro rozvoj tako tsubo kardiomyopatie v souvislosti se základní diagnózou. Celkově byla u všech nemocných kombinovaná terapie (chemoterapie + midostaurin) dobře tolerována a nevedla k výraznému zvýšení zátěže pro pacienty. Vzhledem k nízkému počtu pacientů, kterým byl midostaurin na našem pracovišti podán, a krátkému období jejich sledování není zatím možno se blíže vyjádřit o účinnosti terapie v praktických podmínkách.
S ohledem na výše uvedené lékové interakce a možné nežádoucí účinky léčby midostaurinem dodržujeme v praxi ÚHKT následující postupy.
Profylaxe posakonazolem v indukční terapii AML – je možná i přes mírně zvýšené riziko prodloužení intervalu QTc, přistupujeme proto k častějšímu monitoringu EKG, při prodloužení intervalu QTc přecházíme na profylaxi mikafunginem v profylaktické dávce.
Profylaxe ciprofloxacinem – je nevhodná z důvodu vysokého rizika prodloužení intervalu QTc a nevýhodného poměru přínosu a rizik. U neinfekčních pacientů přecházíme alespoň 24 hodin před podáním první dávky midostaurinu na profylaxi intravenózním piperacilin tazobaktamem nebo perorálním cefuroximem, u infekčních pacientů volíme parenterální antibiotickou terapii dle zvyklostí pracoviště.
Profylaxe nauzey a zvracení – standardní profylaxi granisetronem v dávce 3 mg i.v. à 12 hodin ukončujeme nejpozději 48 hodin od podání první dávky midostaurinu, u senzitivních pacientů přecházíme na profylaxi metoklopramidem. V případě potřeby léčby nevolnosti a zvracení lze užít olanzapin 5 mg, eventuálně setrony v redukovaných dávkách – granisetron 1 mg i.v./palonosetron 0,25 mg i.v.
Nutné podání s jídlem – při podávání midostaurinu spolu s jídlem dochází ke zvýšení jeho účinnosti (zvýšení AUC o 22 %) a ke snížení cmax (o 20 %), to je současně prevencí nauzey a zvracení po midostaurinu.
Monitoring EKG – v prvním týdnu podání při indukční chemoterapii monitorujeme EKG (interval QTc) 2× týdně, v případě současného podávání posakonazolu nebo antiemetik 3× týdně, ve druhém týdnu indukce a v konsolidačních cyklech monitorujeme interval QTc pouze 1× týdně (při současné rizikové medikaci alespoň 2× týdně). Současně dbáme na udržení iontové homeostázy. Při prodloužení intervalu QTc na hodnotu vyšší než 480 ms přerušujeme podávání midostaurinu, kontrolujeme konkomitantní medikaci a mineralogram, po zkrácení intervalu QTc pod hodnotu 480 ms vracíme midostaurin v plné dávce se současnou častější kontrolou EKG.
V případě plicní symptomatologie pacientů, zejména dušnosti a hyposaturace, provádíme neodkladně HRCT plic. Při přítomnosti intersticiálního procesu v CT obraze je nutno podávání midostaurinu ihned přerušit.
Kazuistiky
Prvním kazuistickým případem je žena, ročník 1991, u níž byla 2. listopadu 2019 stanovena diagnóza AML s mutací genu NPM1 (nukleofosmin 1) dle WHO (Světové zdravotnické organizace), AML s vyzráváním (M2) dle FAB, FLT3 ITD pozitivní, cytogeneticky 46,XX, vstupně hyperleukocytární s počtem leukocytů 111,6 tisíce/µl. Pacientka bez komorbidit. Po dvou leukocytaferézách byla 3. listopadu 2019 zahájena indukce 3 + 7, od 8. do 21. dne indukce byl podáván midostaurin v dávce 50 mg per os dvakrát denně. Během prvních tří dnů bylo podávání midostaurinu komplikováno výraznou nauzeou, pro kterou bylo nutno celkem tři dávky přípravku vynechat. V dalších dnech již byla nemocná bez nauzey a zvracení, per os medikaci tolerovala bez obtíží. Z důvodu významného tumor lysis syndromu při vstupní hyperleukocytóze byl úvod terapie (před zahájením léčby midostaurinem) komplikován rozvojem respirační insuficience a diseminovanou intravaskulární koagulací. Od 10. dne cyklu se rozvinula mukozitida dutiny ústní přispívající k obtížné toleranci per os medikace. Kontrolní vyšetření aspirátu v den 21 prokázalo morfologicky aplazii kostní dřeně bez zmnožení blastů, v den 35 pacientka dosáhla první hematologické kompletní remise s pozitivitou reziduální nemoci (leukemia associated immunophenotype, LAIP 0,03 %, NPM1 v kostní dřeni 1 482 kopií). Dne 17. prosince 2019 byla pacientce plánovaně podána konsolidace HIDAC, od 8. do 21. dne s midostaurinem ve standardní dávce. Konsolidační cyklus byl komplikován febrilní neutropenií. Pacientka byla 28. února 2020 alogenně transplantována periferními progenitorovými buňkami (PBPC) od haploidentického bratra po myeloablativním přípravném režimu kombinací fludarabin a busulfan s profylaxí reakce štěpu proti hostiteli (graft versus host disease, GvHD) potransplantačním cyklofosfamidem, cyklosporinem a mykofenolátem. Doba přihojení štěpu nebyla prodloužena, do dimise se neprojevily známky GVHD.
Druhým případem je muž, ročník 1965, s diagnózou akutní myelomonocytární leukemie, AML M4 dle FAB, FLT3 ITD pozitivní, NPM1 bez mutace, cytogeneticky 46,XY diagnóza stanovena 19. září 2019. Pacient bez komorbidit. Při příjmu udával tlak na hrudi, EKG křivka byla brugadoidního typu s ST elevacemi ve V1–V3, ECHO srdce bez poruchy kinetiky, současně zjištěna mírná elevace hodnot vysoce senzitivního troponinu (hsTnI). Provedená koronarografie neprokázala nález patologie na věnčitých tepnách. Indukční terapie byla zahájena 19. září, z důvodu kardiálních obtíží v režimu 7 + 3 (nejprve s podáním cytarabinu), od 8. dne cyklu zahájena léčba midostaurinem v neredukované dávce 50 mg 2× denně. Dne 4. října 2019 byla u nemocného diagnostikována tako tsubo kardiomyopatie. Opakovaně byla provedena koronarografie věnčitých tepen bez průkazu uzávěru či významného zúžení, přetrvával brugadoidní typ EKG, Brugadův syndrom byl vyloučen farmakologickým testem. Při diagnóze kardiomyopatie byl midostaurin v den 16 cyklu chemoterapie ukončen. Aspirace kostní dřeně prokázala v den 28 morfologicky 3,8 % myeloblastů s negativním LAIP, v den 36 bylo dosaženo první kompletní remise AML. První konsolidace HIDAC byla zahájena 30. října, midostaurin podán ve dnech 8−21 bez komplikací. U pacienta přetrvával abnormální typ EKG, kardiální obtíže se již neprojevily. Pro nedostupnost dárce bylo nutno přistoupit k podání druhé konsolidace HIDAC – léčba byla aplikována od 19. prosince taktéž s midostaurinem ve dnech 8−21. Obě konsolidace proběhly nekomplikovaně. Alogenní transplantace PBPC od nepříbuzného 10/10 shodného dárce byla provedena 13. února 2020 v myeloablativním přípravném režimu fludarabin a busulfan s profylaxí GvHD potransplantačním cyklofosfamidem, cyklosporinem a mykofenolátem. Nemocný je bez známek GvHD s normálními hodnotami krevního obrazu.
Závěr
Midostaurin je přípravek první generace ze skupiny inhibitorů FLT3 a v současnosti představuje v rámci této skupiny jedinou léčivou látku, která má schválenou indikaci a úhradu v indukční a konsolidační léčbě AML s mutací kinázy FLT3. Terapie midostaurinem v kombinaci se standardní chemoterapií je dle našich klinických zkušeností dobře tolerována a není spojena se zásadními nežádoucími účinky. Nezaznamenali jsme žádné dramatické prodloužení období cytopenie ani zvýšení četnosti komplikací s ní spojených. Dle provedených klinických studií má přidání midostaurinu ke standardní chemoterapii pozitivní efekt na prodloužení OS pacientů s AML s mutací FLT3 a na snížení frekvence relapsů základního onemocnění.
Seznam použité literatury
- [1] Souhrn údajů o přípravku Rydapt, revize 2018. Dostupné na: www.sukl.cz
- [2] Fathi AT, Chabner BA. FLT3 inhibition as therapy in AML: a record of trials and tribulations. Oncologist 2011; 16 : 1162−1174.
- [3] Kelly LM, Liu Q, Kutok JL, et al. FLT3 internal tandem duplication mutations associated with human acute myeloid leukemias induce myeloproliferative disease in a murine bone marrow transplant model. Blood 2002; 99: 310−318.
- [4] Kottaridis PD, Gale RE, Frew ME, et al. The presence of a FLT3 internal tandem duplication in patients with acute myeloid leukemia (AML) adds important prognostic information to cytogenetic risk group and response to the first cycle of chemotherapy: analysis of 854 patients from the United Kingdom Medical Research Council AML 10 and 12 trials. Blood 2001; 98: 1752–1759.
- [5] Stone RM, Mandrekar S, Sanford BL, et al. Midostaurin plus chemotherapy for acute myeloid leukemia with a FLT3 mutation. N Engl J Med 2017; 377: 454−464.
- [6] Propper DJ, McDonald AC, Man A, et al. Phase I and pharmacokinetic study of PKC412, an inhibitor of protein kinase C. J Clin Oncol 2001; 19: 1485–1492.
- [7] Gallogly MM, Lazarus HM, Cooper BW. Midostaurin: a novel therapeutic agent for patients with FLT3‑mutated acute myeloid leukemia and systemic mastocytosis. Ther Adv Hematol 2017; 8: 245–261.
- [8] RYDAPT (midostaurin) capsules pharmacology review. Silver Spring, MD: US Food and Drug Administration; 2017. Dostupné na: https://www.accessdata.fda.gov/drugsatfda_docs/nda/2017/207997Orig1Orig2s000ClinPharmR.pdf
- [9] Fabbro D, Ruetz S, Bodis S, et al. PKC412: a protein kinase inhibitor with a broad therapeutic potential. Anti‑Cancer Drug Des 2000; 15: 17–28.
- [10] Dutreix, C, Huntsman Labed, A, Roesel J, et al. Midostaurin: review of pharmacokinetics (PK) and PK/pharmacodynamic (PD) relationship in AML/MDS patients. J Clin Oncol 2009; 27(15S): e14540−e14540.
- [11] RYDAPT® (midostaurin) 25 mg soft capsules Core Data Sheet, version 1.1. Novartis Pharmaceuticals Corp; 2017.
- [12] Dutreix C, Munarini F, Lorenzo S, et al. Investigation into CYP3A4‑mediated drug‑drug interactions on midostaurin in healthy volunteers. Cancer Chemother Pharmacol 2013; 72: 1223−1234.
- [13] Schlafer D. Management of Midostaurin‑CYP3A4 Drug‑Drug Interactions in Patients with Acute Myeloid Leukemia. Oncology (Williston Park) 2019; 33: pii: 629381.