Mirabegron
Více než 400 milionů obyvatel planety trpí symptomy hyperaktivního močového měchýře (OAB – overactive bladder). V léčbě hyperaktivního močového měchýře jsou farmakologickou léčbou volby antimuskarinové látky, v České republice v první linii neretardované lékové formy, ve druhé linii dlouhodobě působící léčivé přípravky a jejich kombinace s léky první linie. Limitující pro terapii jsou především jejich nežádoucí účinky, které vedou k relativně nízké compliance pacientů. U části pacientů však není dosaženo dostatečného efektu i přes jejich dobrou spolupráci. Se zcela odlišným mechanismem účinku se nově setkáváme u mirabegronu, který je selektivním agonistou β3-adrenoreceptorů. Mirabegron byl vyvinut pro léčbu hyperaktivního močového měchýře.
Celosvětově bylo do randomizovaných studií s mirabegronem zařazeno více než 10 000 pacientů. Mirabegron v dávce 50 mg vedl k významnému zmírnění symptomů hyperaktivního močového měchýře (snížení počtu epizod inkontinence a počtu mikcí) ve srovnání s placebem, ale i ve srovnání s retardovanou formou močového spasmolytika (tolterodinem). Zmírnění symptomů vede ke zlepšení kvality života. Nežádoucí účinky jsou srovnatelné s podáním placeba. Mirabegron tak představuje novou terapeutickou možnost v léčbě hyperaktivního močového měchýře s dobrou účinností a snášenlivostí.
Farmakologická skupina
Mirabegron patří mezi urologika, močová spasmolytika, ATC kód: G04BD12.
Je první molekulou, která ovlivňuje detruzor (hladkou svalovinu močového měchýře) cestou 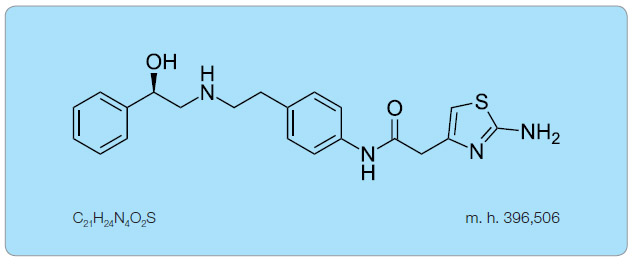 agonismu β3-adrenergních receptorů. Chemický strukturní a sumární vzorec mirabegronu uvádí obr. 1.
agonismu β3-adrenergních receptorů. Chemický strukturní a sumární vzorec mirabegronu uvádí obr. 1.
Mechanismus účinku, farmakodynamika
Mirabegron je selektivní agonista β3--adrenoreceptorů. Aktivací β3-adrenoreceptorů v detruzoru dochází prostřednictvím enzymu adenylátcyklázy ke zvýšení koncentrace cyklického adenosin monofosfátu (cAMP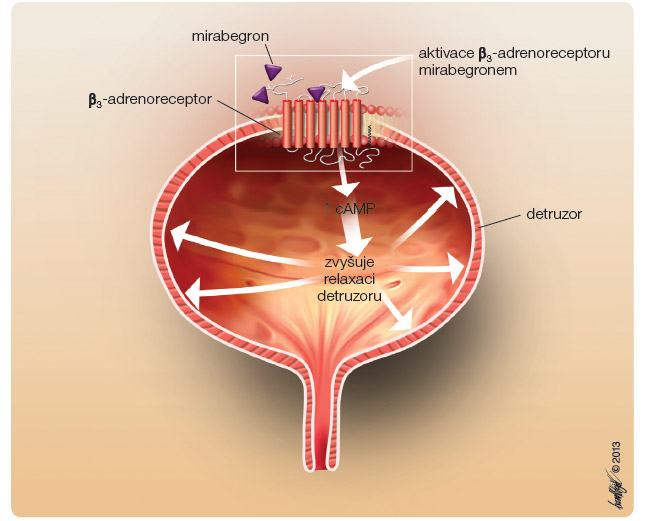 ) a k následnému uvolnění detruzoru. Výsledkem je zlepšení plnicí funkce močového měchýře (obr. 2). Mirabegron má nízkou aktivitu vůči dalším dvěma adrenoreceptorům β1 a β2, stejně tak i vůči ostatním receptorům (např. α1A, M2 a transportéry NA/DA). V lidském močovém měchýři jsou vysoce (až z 97 %) exprimovány právě β3-adrenoreceptory (obr. 3) [1]. Na zvířecím modelu byl prokázán relaxační účinek a snížení frekvence močení. Po podání mirabegronu se zvýšil mikční objem a snížila se frekvence kontrakcí bez mikce, neměl však vliv na mikční tlak a objem reziduální moče.
) a k následnému uvolnění detruzoru. Výsledkem je zlepšení plnicí funkce močového měchýře (obr. 2). Mirabegron má nízkou aktivitu vůči dalším dvěma adrenoreceptorům β1 a β2, stejně tak i vůči ostatním receptorům (např. α1A, M2 a transportéry NA/DA). V lidském močovém měchýři jsou vysoce (až z 97 %) exprimovány právě β3-adrenoreceptory (obr. 3) [1]. Na zvířecím modelu byl prokázán relaxační účinek a snížení frekvence močení. Po podání mirabegronu se zvýšil mikční objem a snížila se frekvence kontrakcí bez mikce, neměl však vliv na mikční tlak a objem reziduální moče. ![Obr. 3 Struktura lidského β3-adrenoreceptoru; volně podle [17] – Yasuhiko, et al., 2010.](https://www.remedia.cz/photo-a-29415---.jpg) V průběhu plnicí fáze převládá stimulace sympatických nervů. Noradrenalin se uvolňuje z nervových zakončení, tím dochází k aktivaci β-adrenoreceptorů ve svalovině močového měchýře a k jejímu následnému uvolnění. Během mikční fáze je močový měchýř ovládán převážně parasympatickou nervovou soustavou. Acetylcholin uvolněný z pánevních nervových zakončení stimuluje cholinergní receptory M2 a M3, tím navozuje kontrakci močového měchýře. Aktivace dráhy M2 navíc inhibuje vzestup hladiny cAMP, vyvolaný prostřednictvím β3-adrenoreceptorů. Aktivace β3-adrenoreceptorů proto nezasahuje do
V průběhu plnicí fáze převládá stimulace sympatických nervů. Noradrenalin se uvolňuje z nervových zakončení, tím dochází k aktivaci β-adrenoreceptorů ve svalovině močového měchýře a k jejímu následnému uvolnění. Během mikční fáze je močový měchýř ovládán převážně parasympatickou nervovou soustavou. Acetylcholin uvolněný z pánevních nervových zakončení stimuluje cholinergní receptory M2 a M3, tím navozuje kontrakci močového měchýře. Aktivace dráhy M2 navíc inhibuje vzestup hladiny cAMP, vyvolaný prostřednictvím β3-adrenoreceptorů. Aktivace β3-adrenoreceptorů proto nezasahuje do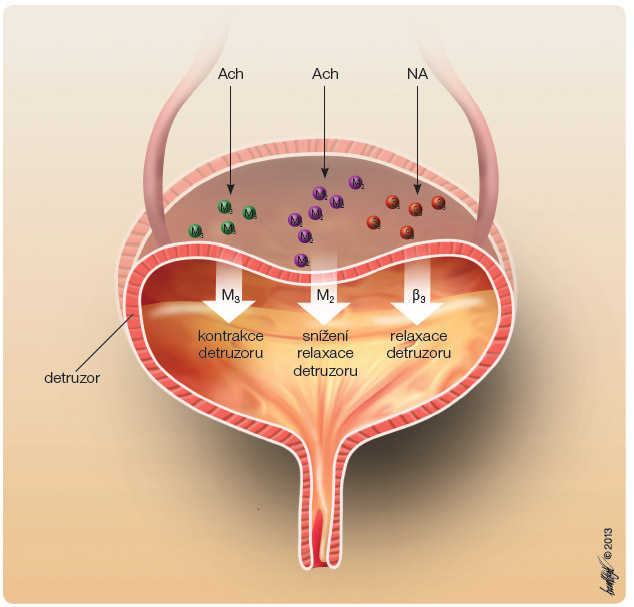 mikčního procesu (obr. 4).
mikčního procesu (obr. 4).
Farmakokinetické vlastnosti
Základní farmakokinetické parametry mirabegronu jsou shrnuty v tab. 1.
Absorpce
Po podání per os dosahuje mirabegron maximální plazmatické koncentrace (cmax) za 3–4 hodiny. Absolutní biologická dostupnost je 35 % při dávce 50 mg. Průměrná hodnota cmax a AUC se zvyšuje více než dávka, proporcionálně v celém rozpětí dávkování. V celkové populaci mužů a žen vedlo dvojnásobné zvýšení dávky z 50 mg na 100 mg mirabegronu ke zvýšení ho dnoty cmax přibližně 2,9násobně a AUCtau 2,6násobně, zatímco čtyřnásobné zvýšení dávky z 50 mg na 200 mg mirabegronu zvýšilo hodnoty cmax přibližně 8,4krát a AUCtau 6,5krát. Ustálených koncentrací je dosaženo do 7 dnů při dávkování mirabegronu jednou denně.
dnoty cmax přibližně 2,9násobně a AUCtau 2,6násobně, zatímco čtyřnásobné zvýšení dávky z 50 mg na 200 mg mirabegronu zvýšilo hodnoty cmax přibližně 8,4krát a AUCtau 6,5krát. Ustálených koncentrací je dosaženo do 7 dnů při dávkování mirabegronu jednou denně.
Při pravidelném denním podávání je plazmatická koncentrace léčiva v ustáleném stavu přibližně dvojnásobná oproti podání jediné dávky.
Současné podání tablety o dávce 50 mg spolu s jídlem s vysokým obsahem tuku snížilo cmax mirabegronu o 45 % a AUC o 17 %. Potrava s nízkým obsahem tuku snížila cmax mirabegronu o 75 % a AUC o 51 %. Mirabegron je možné užívat v doporučené dávce spolu s jídlem nebo nezávisle na jídle.
Distribuce
Mirabegron je rozsáhle distribuován v organismu. Distribuční objem v ustáleném stavu (Vss) je přibližně 1670 l. Přibližně v 71 % se váže na proteiny lidské plazmy. Vykazuje středně vysokou afinitu k albuminu a α1-kyselému glykoproteinu. Mirabegron proniká do červených krvinek a koncentrace 14C-mirabegronu in vitro byla v erytrocytech dvojnásobná oproti plazmě.
Metabolismus
Biotransfomace mirabegronu probíhá více cestami – dealkylací, oxidací, glukuronidací a amidovou hydrolýzou. Mirabegron je hlavní cirkulující složkou po podání jediné dávky 14C-mirabegronu. V plazmě jsou detekovatelné dva hlavní metabolity – glukuronidy fáze 2, které představují 16 % a 11 % celkové expozice. Oba jsou farmakologicky neaktivní. Mirabegron neinhibuje metabolismus současně podávaných léčiv, která jsou metabolizována enzymy cytochromu P450. Omezenou úlohu v eliminaci mají CYP2D6 a CYP3A4 při oxidačním metabolismu. Kromě CYP3A4 a CYP2D6 jsou do metabolismu zapojeny butyrylcholinesteráza,
uridin difosfo-glukuronosyltransferáza (UGT) a pravděpodobně i alkoholdehydro-
genáza (ADH).
Exkrece
Celková tělesná clearance (CLtot) z plazmy je přibližně 57 l/h. Terminální eliminační poločas (t1/2) je přibližně 50 hodin. Renální clearance (CLR) představuje přibližně 13 l/h, to odpovídá téměř 25 % hodnoty CLtot. Renální eliminace mirabegronu probíhá primárně prostřednictvím aktivní tubulární sekrece spolu s glomerulární filtrací. Vylučování nezměněného mirabegronu močí závisí na dávce a pohybuje se přibližně od 6,0 % po denní dávce 25 mg až do 12,2 % po denní dávce 100 mg. Po podání 160 mg 14C-mirabegronu zdravým dobrovolníkům bylo přibližně 55 % radionuklidu získáno zpět v moči a 34 % ve stolici. Nezměněný mirabegron odpovídal za 45 % radioaktivity moči, což ukazuje na přítomnost metabolitů. Nezměněný mirabegron odpovídal za většinu radioaktivity ve stolici.
Závislost na věku a pohlaví
Hodnoty cmax a AUC mirabegronu a jeho metabolitů po opakovaném podání perorální dávky u starších dobrovolníků (≥ 65 let) byly podobné jako u mladších (18–45 let). Hodnoty cmax a AUC jsou přibližně o 40 % až 50 % vyšší u žen než u mužů. Rozdíly mezi pohlavími v hodnotách cmax a AUC jsou připisovány rozdílům v tělesné hmotnosti a v biologické dostupnosti.
Klinické zkušenosti
Na studie fáze II (BLOSSOM [2]a DRAGON [3]) navázaly studie fáze III. Účinnost a bezpečnost byla ověřena ve 41 klinických studiích s více než 10 tisíci pacienty se symptomy dolních močových cest, kteří se účastnili studií fáze I, II a III; 622 z nich užívalo mirabegron déle než jeden rok.Studie fáze III 178-CL-046, 178-CL--047 a 178-CL-074 byly 12týdenní, studie 178-CL-049 byla roční. Všechny probíhaly v Evropě, Severní Americe a Austrálii.
Studie 046 je komparátorem kontrolovaná studie [4], v níž mirabegron v dávce 50 mg výrazně snížil frekvenci močení (ve srovnání s placebem, p < 0,05) a tolterodin ve standardní dávce (4 mg) nebyl v tomto cílovém ukazateli signifikantně účinnější než placebo. Mirabegron 50 mg dále významně (p < 0,05) zvýšil objem vymočené moči během jednoho vymočení a signifikantně (p < 0,05) snížil počet epizod inkontinence.
Studie 047 [5, 6] rovněž dokládá signifikantní snížení počtu epizod inkontinence za 24 hodin (-1,47 mirabegron vs. -1,13 placebo; p < 0,05) a výrazné snížení frekvence močení během 24 hodin (-1,66 mirabegron vs. -1,05 placebo; p < 0,05). Mirabegron v dávce 50 mg dále statisticky významně zvýšil objem vymočené moči (18,2 ml mirabegron vs. 7,0 ml placebo; p < 0,05).
Studie 074 [7] sledovala podání mirabegronu v dávce 25 nebo 50 mg vs. placebo. Mirabegron v dávce 25 mg i 50 mg signifikantně snížil počet epizod inkontinence za 24 hodin (-1,36 mirabegron 25 mg, -1,38 mirabegron 50 mg vs. -0,96 placebo; p < 0,05) a výrazně snížil frekvenci močení za 24 hodin (-1,65 mirabegron 25 mg, -1,60 mirabegron 50 mg vs. -1,18 placebo; p < 0,05), což byly předem definované primární cílové ukazatele této studie. Mirabegron v dávce 50 mg pak dále statisticky významně zvýšil objem vymočené moči (20,7 ml mirabegron 50 mg, 12,8 ml mirabegron 25 mg vs. 8,3 ml placebo; p < 0,05 pro 50 mg). Navíc mirabegron 50 mg zlepšil kvalitu života pacientů s OAB měřenou pomocí vizuální analogové škály TS-VAS (+1,88 mirabegron vs. +1,05 placebo; p < 0,001) nebo pomocí specifického dotazníku OAB-q (obtěžování symptomy OAB – výraznější snížení ve prospěch mirabegronu -18,8 vs. -16,0 placebo; p = 0,028).
Studie 049 [8], mezinárodní, multicentrická, dvojitě zaslepená, randomizovaná studie s paralelními skupinami, kontrolovaná aktivním komparátorem, dlouhodobě sledovala bezpečnost léčby mirabegronem. Celkový bezpečnostní profil mirabegronu byl velmi dobrý a srovnatelný s placebem a s výsledky zaznamenanými v ostatních kratších studiích fáze III. Mirabegron navíc znamenal 3–4krát nižší výskyt sucha v ústech (nejtypičtější a nejčastější nežádoucí účinek antimuskarinik) ve srovnání s tolterodinem. Mirabegron 50 mg si zachovával účinnost na všechny symptomy OAB po celou dobu sledování srovnatelnou s výsledky časově kratších studií fáze III. Metaanalýza tří studií fáze III s 4611 pacienty [9] dokládá lepší, odlišný bezpečnostní profil léčby a nižší výskyt:
- sucha v ústech ve srovnání s tolterodinem (1,7 % vs. 10,1 %) a s ostatními antimuskariniky (29,6 %);
- pruritu ve srovnání s tolterodinem (0,2 % vs. 1,4 %) a s ostatními antimuskariniky (15,4 %);
- retence moči ve srovnání s tolterodinem (0,1 % vs. 0,6 %) a s ostatními antimuskariniky (1,1 %).
Nep![Graf 1 Relativní riziko sucha v ústech při užívání antimuskarinika a nebo placeba versus léčba mirabegronem 50 mg; podle [10] – Maman, et al., 2013. Čím dále v pravé části grafu se uvedená hodnota nachází, tím více je z hlediska daného nežádoucího účinku lepší mirabegron 50 mg ve srovnání s danou terapií. IR – immediate release, okamžité uvolňování; ER – extended release, prodloužené uvolňování](https://www.remedia.cz/photo-a-29418---.jpg) římé srovnání na základě Network meta-analysis s dostupnými antimuskariniky (Mixed Treatment Comparison; MTC) bylo
římé srovnání na základě Network meta-analysis s dostupnými antimuskariniky (Mixed Treatment Comparison; MTC) bylo ![Graf 2 Relativní riziko zácpy při užívání antimuskarinika a nebo placeba versus léčba mirabegronem 50 mg; podle [10] – Maman, et al., 2013. Čím dále v pravé části grafu se uvedená hodnota nachází, tím více je z hlediska daného nežádoucího účinku lepší mirabegron 50 mg ve srovnání s danou terapií. IR – immediate release, okamžité uvolňování; ER – extended release, prodloužené uvolňování](https://www.remedia.cz/photo-a-29419---.jpg) provedeno s celkem 40 studiemi (26 033 pacientů). Grafy 1 a 2 srovnávají výskyt sucha v ústech a obstipace u pacientů léčených antimuskariniky, mirabegronem či placebem [10].
provedeno s celkem 40 studiemi (26 033 pacientů). Grafy 1 a 2 srovnávají výskyt sucha v ústech a obstipace u pacientů léčených antimuskariniky, mirabegronem či placebem [10].
Zařazení do současné palety léčiv
Farmakologickou léčbou volby nemocných s příznaky OAB je podání močových spasmolytik. V první linii léčby jsou neretardované lékové formy (s okamžitým uvolňováním léčiva) oxybutynin, propiverin, trospium, tolterodin. Možné je i v první linii podání tricyklických antidepresiv; lze využít jejich kombinovaného účinku (centrální a periferní anticholinergní efekt, blokáda aktivity transportního systému na presynaptické membráně vychytávající zpětně noradrenalin a serotonin) a také centrálního sedativního účinku – imipramin. Možné je podání inhibitorů fosfodiesterázy 5. typu (PDI5) – tadalafil, sildenafil.
Pokud se nedostaví požadovaný efekt léčby nebo pacient léčbu netoleruje pro výskyt nežádoucích účinků, volí urolog nebo urogynekolog léčivé přípravky s prodlouženým uvolňováním účinných látek zařazených do druhé linie léčby – tolterodin, solifenacin, darifenacin, fesoterodin, oxybutynin v transdermální náplasti. V léčbě bývají k dotitrování účinku kombinovány léčivé přípravky 1. a 2. linie.
Po selhání 2. linie léčby část pacientů rezignuje a své obtíže [11, 12] řeší pouze preskripcí a používáním hygienických pomůcek. Po selhání veškerých možností farmakoterapie přichází na řadu chirurgická léčba, např. aplikace botulotoxinu do sliznice močového měchýře a různé augmentace močového měchýře (náhrada střevem nebo žaludkem).
Na podkladě podrobné analýzy III. fáze studie 046 u selektované skupiny pacientů s př![Graf 3 Průměrná změna v epizodách inkontinence a počtu mikcí za jeden den ve srovnání s počátkem terapie u pacientů dříve léčených antimuskariniky; podle [13] – Khullar, et al., 2012. NS – není statisticky významný rozdíl v porovnání s placebem; *statisticky významné zlepšení v porovnání s placebem; jako aktivní kontrola byl použit tolterodin SR 4 mg](https://www.remedia.cz/photo-a-29420---.jpg) edcházející léčbou antimuskariniky, kteří přerušili terapii buď pro nedostatečnou snášenlivost nebo nedostačující účinek, zaznamenala přibližně polovina pacientů přínos z léčby mirabegronem (graf 3). Předchozí terapie zahrnovala tolterodin, solifenacin, oxybutynin, trospium, darifenacin, propiverin, fesoterodin [13].
edcházející léčbou antimuskariniky, kteří přerušili terapii buď pro nedostatečnou snášenlivost nebo nedostačující účinek, zaznamenala přibližně polovina pacientů přínos z léčby mirabegronem (graf 3). Předchozí terapie zahrnovala tolterodin, solifenacin, oxybutynin, trospium, darifenacin, propiverin, fesoterodin [13].
Zdá se tedy, že máme k dispozici přípravek, který za dobré snášenlivosti může být využit při selhání 2. linie léčby hyperaktivního močového měchýře, eventuálně v kombinaci s předcházející terapií. Zkoušeny jsou i další přípravky ve skupině, např. solabegron [14].
Indikace
Mirabegron je indikován k symptomatické léčbě urgence, zvýšené frekvence močení a/nebo urgentní inkontinence, jež se mohou vyskytnout u dospělých pacientů se syndromem hyperaktivního močového měchýře (OAB).
Dávkování
Doporučená dávka pro dospělé pacienty je 50 mg mirabegronu jednou denně, s jídlem nebo nezávisle na jídle.
Insuficience ledvin a jater
Jediná dávka mirabegronu 100 mg podaná u dobrovolníků s mírnou insuficiencí ledvin zvýšila cmax o 6 %, se střední insuficiencí ledvin o 23 % a se závažnou insuficiencí o 92 %. Mirabegron nebyl studován u pacientů v terminálním stadiu onemocnění ledvin (GFR < 15 ml/min/1,73 m2 či u pacientů na hemodialýze) nebo se závažným poškozením jater (Childovo-Pug-hovo skóre C), a proto se jeho používání u těchto skupin pacientů nedoporučuje.
Hypertenze
Mirabegron nebyl hodnocen u pacientů s těžkou neléčenou hypertenzí (systolic-
ký TK ≥ 180 mm Hg a/nebo diastolický TK ≥ 110 mm Hg). Jeho používání se u této populace pacientů nedoporučuje. U pacientů s hypertenzí 2. stupně (systolický TK ≥ 160 mm Hg a/nebo diastolický TK ≥ 100 mm Hg) je k dispozici omezené množství údajů.
Pacienti s vrozeným nebo získaným prodloužením intervalu QT
Při používání mirabegronu v terapeutických dávkách nebylo v klinických studiích prokázáno klinicky relevantní prodloužení intervalu QT. Vzhledem k tomu, že pacienti se známou anamnézou prodloužení intervalu QT nebo pacienti, kteří užívají léky, o kterých je známo, že prodlužují interval QT, nebyli do těchto studií zařazeni, není účinek mirabegronu u těchto pacientů znám. Při podávání mirabegronu těmto pacientům je třeba dbát zvýšené opatrnosti.
Těhotenství
O používání mirabegronu u těhotných žen je k dispozici omezené množství údajů. Studie na zvířatech prokázaly reprodukční toxicitu. Mirabegron se nedoporučuje podávat těhotným ženám a ženám, které mohou otěhotnět a nepoužívají antikoncepci.Kojení
Mirabegron se vylučuje do mléka hlodavců, a proto se předpokládá, že bude přítomný v lidském mateřském mléce. Nebyly provedeny žádné studie, které by posoudily vliv mirabegronu na tvorbu mléka u lidí, jeho přítomnost v lidském mateřském mléce nebo jeho účinky na kojené dítě. Ve farmakokinetických pokusech na potkanech dochází přibližně k 1,7násobnému zvýšení koncentrace mirabegronu nebo jeho metabolitů v mateřském mléce. Během kojení by mirabegron neměl být podáván.
Fertilita
Nebyly zjištěny žádné s léčbou související účinky mirabegronu na fertilitu zvířat. Vliv mirabegronu na lidskou fertilitu nebyl stanoven.
Ovlivnění pozornosti
Mirabegron nemá žádný nebo má zanedbatelný vliv na schopnost řídit nebo obsluhovat stroje.
Kontraindikace
Kontraindikací léčby mirabegronem je hypersenzitivita na léčivou látku nebo na kteroukoli pomocnou látku. Mirabegron nemá kontraindikace obdobné skupině antimuskarinik.
Nežádoucí účinky
Bezpečnost mirabegronu byla hodnocena u 8433 pacientů s OAB. Z nich 5648 dostalo nejméně jednu dávku mirabegronu ve fázích II a III klinického zkoušení, 622 pacientů dostávalo mirabegron nejméně jeden rok (365 dní). Ve třech 12týdenních dvojitě zaslepených studiích fáze III kontrolovaných placebem dokončilo léčbu mirabegronem 88 % pacientů. Pro nežádoucí účinky přerušila léčbu 4 % pacientů. Většina nežádoucích účinků byla mírné až střední závažnosti.
Nejčastějšími nežádoucími účinky hlášenými u pacientů léčených mirabegronem 50 mg jsou tachykardie a infekce močových cest. Tachykardie se vyskytla u 1,2 % pacientů, k přerušení léčby vedla tachykardie u 0,1 % pacientů. Frekvence infekcí močových cest byla 2,9 %, u žádného z pacientů nebyla důvodem k přerušení léčby. Nežádoucí účinky pozorované v průběhu jednoroční studie s aktivním komparátorem (tolterodinem) byly typem a závažností obdobné s kontrolovanými studiemi fáze III.
Lékové interakce
Mirabegron je transportován a metabolizován více cestami. Mirabegron je substrátem cytochromu P450 (CYP) 3A4, CYP2D6, butyrylcholinesterázy, uridin difosfo-glukuronosyltransferázy (UGT), efluxního transportéru P-glykoproteinu
(P-gp) a influxních organických kationových transportérů (OCT) OCT1, OCT2 a OCT3. Studie mirabegronu využívající lidské jaterní mikrozomy a rekombinantní lidské CYP enzymy ukázaly, že mirabegron je mírný a časově závislý inhibitor CYP2D6 a slabý inhibitor CYP3A [15]. Mirabegron při vysokých koncentracích inhiboval transport léku zprostředkovaný P-gp.
Účinek mirabegronu na transportéry
Mirabegron je slabý inhibitor P-gp. U zdravých dobrovolníků mirabegron zvýšil u substrátu P-gp digoxinu cmax o 29 % a AUC o 27 %. Pacientům, kteří začínají užívat kombinaci mirabegronu a digoxinu, by měla být zpočátku předepsána nejnižší dávka digoxinu. K získání požadovaného klinického účinku je třeba monitorovat sérové koncentrace digoxinu a použít je pro titraci dávky digoxinu. Při kombinaci mirabegronu se substráty citlivými k P-gp, jako je např. dabigatran, by měl být zvažován potenciál pro inhibici substrátu P-gp mirabegronem.
Jiné interakce
Nebyly zjištěny žádné klinicky významné interakce při současném podávání mirabegronu s terapeutickými dávkami solifenacinu, tamsulosinu, warfarinu, metforminu nebo v kombinaci s perorálně podávanými kontraceptivy obsahujícími ethinylestradiol a levonorgestrel. Žádná úprava dávkování se nedoporučuje.
Seznam použité literatury
- [1] Bhangu AA, Beard JAS, Grimer RJ. Should soft tissue sarcomas be treated at a specialist centre? Sarcoma 2004; 8: 1–6.
- [2] Bauer HCG, Trovik CS, Alvegard TA, et al. Monitoring referral and treatment in soft tissue sarcoma: a study based on 1 851 patients from the Scandinavian Sarcoma Group Register. Acta Orthop Scand 2001; 72: 150–159.
- [3] Rydholm A. Improving the management of soft tissue sarcoma (Editorial). BMJ 1998; 317: 93–94.
- [4] NCCN Guidelines, Soft Tissue Sarcoma, version I.20113, NCCN.org. Brennan MF, Antonescu CR, Maki RG. Management of Soft Tissue Sarcoma.Springer Science + Business Media, New York 2013.
- [5] ESMO/European Sarcomas Network Working Group. Soft tissue and visceral sarcomas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2012; 23 (suppl 7):vii92–vii99.
- [6] van der Graaf WTA, Judson I, Verweij J, et al. Results of a randomized phase III trial (EORTC 62012) of single agent doxorubicin versus doxorubicin plus ifosfamide as first line chemotherapy for patients with advanced or metastatic soft tissue sarcoma: A survival study by the EORTC Soft Tissue and Bone Sarcoma Group. ESMO Congress 2012. Abstract LBA7.
- [7] van der Graaf WTA, Blay JY, Chabla SP, et al. Pazopanib for metastatic soft tissue sarcoma (PALETTE): a randomised, double blind, placebo-controlled phase 3 trial. Lancet 2012; 379: 1879–1886.
- [8] Maki RG, Wathen JK, Patel SR, et al. Randomized phase II study of gemcitabine and docetaxel compared with gemcitabine alone in patients with metastatic soft tissue sarcomas: results of sarcoma alliance for research through collaboration study 002. J Clin Oncol 2007; 25: 2755–2763.
- [9] García-Del-Muro X, López-Pousa A, Maurel J, et al. Randomized phase II study comparing gemcitabine plus dacarbazine versus dacarbazine alone in patients with previously treated soft tissue sarcoma: a Spanisch Group for Research on Sarcomas study. J Clin Oncol 2011; 29: 2528–2533.
- [10] Maman K, Aballea S, Nazir J, et al. Comparative efficacy and safety of treatments for the management of overactive bladder: A systematic literature review and mixed treatment comparison. Value in Health 16: A180, Abstr. PUK1 (2013).
- [11] Linnér L, Schioler H, Samuelsson E, et al. Low persistence of anticholinergic drug use in Sweden. Eur J Clin Pharmacol 2011; 67: 535–536.
- [12] Wagg A, Compion G, Fahey A, Siddiqui E. Persistence with prescribed antimuscarinic therapy for overactive bladder: a UK experience. BJU Int 2012; 110: 1767–1774. doi: 10.1111/j.1464-410X.2012.11023.x. Epub 2012 Mar 12.
- [13] Khullar V, et al. Efficacy of mirabegron in patients with and without prior antimuscarinic therapy for overactive bladder (OAB): Post-hoc analysis of a prospective, randomised European-Australian phase III trial. European Urology Supplements 2012; 11: e684.
- [14] Ohlstein EH, von Keitz A, Michel MC. A multicenter, doubleblind, randomized, placebo-controlled trial of the β3-adrenoceptor agonist solabegron for overactive bladder. Eur Urol 2012; 62: 834–840.
- [15] Tyagi P, Tyagi V. Mirabegron, a β3-adrenoceptor agonist for the potential treatment of urinary frequency, urinary incontinence or urgency associated with overactive bladder. Drugs 2010; 13: 713–722.
- [16] Betmiga: Summary of product characteristics (SPC) – available at http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_-_Product_Information/human/002388/WC500137309.pdf
- [17] Yasuhiko I, Naoki A, Yukio H. Beta3-Adrenoceptor Agonists: Possible Role in the Treatment of Overactive Bladder. Korean J Urol 2010; 51: 811–818.