Niraparib
Souhrn:
Zvaríková M, Kristková L. Niraparib. Remedia 2020; 30: 375–382.
Inhibitory poly‑adenosindifosfát‑ribózo‑polymerázy (PARP) v posledních letech změnily management terapie ovariálního karcinomu. V rámci klinických studií byla účinnost inhibitorů PARP zkoušena v indikaci jako udržovací terapie po chemoterapii, ale také jako monoterapie. Jejich účinek byl potvrzen jak u platina‑senzitivních, tak u platina‑rezistentních tumorů. S objevením inhibitorů PARP dnes pacientkám můžeme zásadně prodloužit interval po léčbě chemoterapií do další progrese onemocnění s nutností zahájení další linie paliativní chemoterapie.
Summary:
Zvarikova M, Kristkova L. Niraparib. Remedia 2020; 30: 375–382.
Poly-adenosinediphosphate-ribose-polymerase (PARP) inhibitors have changed the management of ovarian cancer treatment in last couple of years. In clinical studies, the efficacy of PARP inhibitors was evaluated in maintenance therapy after chemotherapy but also as monotherapy. Their effect was confirmed in both platina-sensitive and platina-resistant tumors. With PARP inhibitors, we can significantly prolong the interval after chemotherapy until the next disease progression with the need to initiate another line of palliative chemotherapy.
Key words: ovarian cancer, BRCA genes, HRD, PARP inhibitors , niraparib
Úvod
Ovariální karcinom má celosvětově nejvyšší mortalitu mezi gynekologickými nádory. Pětileté přežívání se pohybuje kolem 46 %, což souvisí se skutečností, že více než 60 % pacientek je diagnostikováno v pokročilém stadiu onemocnění [1,2]. Základní metodou léčby je cytoredukční operace, po níž následuje chemoterapie založená na platinovém derivátu, která se podává adjuvantně nebo s neoadjuvantním záměrem. Poté následuje tzv. odložená cytoredukční operace (interval debulking surgery, IDS). I přes vysoký podíl senzitivity při primární terapii více než 75 % pacientek v pokročilém stadiu nemoci relabuje [3]. Nemocné s relapsem onemocnění jsou následně léčeny dalšími liniemi chemoterapie, které prodlužují jejich celkové přežití, ale choroba se v případě relapsu stává inkurabilní. Rozhodování o léčbě v dalších liniích je již méně definované. Faktory, které ovlivňují rozhodovací proces další léčby pacientek, jsou: doba, za kterou došlo k relapsu onemocnění, počet předchozích linií léčby, histologický subtyp, molekulární profil, reziduální nežádoucí účinky a celkový performance status pacientky [4].
Standardem pro nemocné, u nichž dojde k relapsu po více než šesti měsících léčby, je v současné době chemoterapie na bázi platinového derivátu [2,5]. Aktuálně lze pacientkám v určitých přesně specifikovaných případech nabídnout možnost udržovací léčby v rámci první nebo dalších linií buď bevacizumabem, nebo u platina senzitivních nemocných s mutací BRCA inhibitorem poly adenosindifosfát ribózo polymerázy (PARP). Bez ohledu na citlivost onemocnění na platinu podíl pacientek, jež dosáhnou odpovědi, přežití bez progrese onemocnění (progression free survival, PFS) a celkového přežití (overall survival, OS), s každou linií klesá. Medián OS u nemocných, u nichž nastal relaps po třetí linii léčby, je kratší než rok [6–8].
S ohledem na vysoký podíl relapsů a špatnou prognózu pacientek s pokročilým epiteliálním karcinomem ovaria (epithelial ovarian cancer, EOC) je snaha vyvíjet nové možnosti léčby a přístupy k rekurentnímu EOC. Postupně se zlepšující porozumění biologii EOC vede k vývoji nových cílených molekulárních a biologických agens, jako jsou antiangiogenní látky, inhibitory PARP, inhibitory signálních drah a imunoterapie.
Farmakologická skupina
Inhibitory PARP jsou považovány za jednu z nejzajímavějších nových možností léčby ovariálního karcinomu. Nejvyšší účinnost inhibitorů PARP byla zaznamenána v terapii pacientek s karcinomem vaječníků vykazujících mutaci BRCA, a to zárodečnou nebo somatickou. V současné době je však známo, že aktivita inhibitorů PARP je přítomna také u karcinomů wild type BRCA, zejména u high grade serózních karcinomů (HGSC), které vykazují homologní rekombinantní nedostatečnost (homologous recombination deficiency, HRD) prostřednictvím mutací nebo jiných molekulových odchylek v kritických genech pro opravu DNA. V rámci klinických studií byla účinnost inhibitorů PARP zkoušena v indikaci jako udržovací terapie po chemoterapii, ale také jako monoterapie. Jejich účinek byl potvrzen jak u platina senzitivních, tak u platina rezistentních tumorů. S objevením inhibitorů PARP dnes pacientkám můžeme zásadně prodloužit interval po léčbě chemoterapií do další progrese onemocnění s nutností zahájení další linie paliativní chemoterapie. K inhibitorům PARP je řazen též niraparib (Zejula 100 mg, tvrdé tobolky), který patří do skupiny jiných cytostatik, s ATC kódem L01XX54. Přípravek není v současné době hrazen pojišťovnou na území ČR.
Mechanismus účinku
PARP1 představuje kritický enzym buněčné proliferace a opravy poškození DNA, především jednovláknových zlomů (single strand break, SSB) v procesu excize bází (base excision repair, BER). Protein DNA PARP1 se naváže přímo na místo poškození DNA, zde vytváří rozvětvené řetězce poly adenosindifosfát ribózo polymerázy, na něž se vážou další reparační enzymy. Při inhibici PARP se mění neopravené jednoduché zlomy během replikace na zlomy dvojité, které jsou za normálních okolností opravovány bezchybným mechanismem homologní rekombinace, na níž se podílejí právě geny BRCA1 a BRCA2. Absence funkční homologní rekombinace nebo BER nemá vliv na životaschopnost buněk, ale deficit obou procesů dohromady vede k syntetické smrti buňky. V případě mutace genů BRCA závisí oprava DNA buněk nádoru především na PARP. Pokud je však i PARP inhibována, dochází k chromozomální instabilitě, zástavě buněčného cyklu a apoptóze. Zvýšená cytotoxicita indukovaná niraparibem byla pozorována v nádorových buněčných liniích s deficiencemi nebo bez deficiencí tumor supresorových genů karcinomu prsu (BRCA 1 a 2) [9,10].
Niraparib redukuje růst nádorů u tumorů s mutacemi genů BRCA 1 a 2, s wild type BRCA s HRD, ale i u tumorů, které mají wild type BRCA bez detekovatelné HRD.
Indikace
Přípravek Zejula je indikován jako monoterapie k udržovací léčbě dospělých pacientek s rekurentním platina senzitivním high grade serózním epiteliálním karcinomem vaječníků, vejcovodů nebo s primárním karcinomem pobřišnice, které reagují (úplně nebo částečně) na chemoterapii na bázi platiny.
Dávkování
Dávkování je 300 mg niraparibu (tři 100mg tvrdé tobolky), které jsou podávány jednou denně ve stejnou dobu. Pacientkám má být doporučeno, aby dávku užívaly každý den přibližně ve stejný čas. Protože mezi hlavní nežádoucí účinky užívání niraparibu patří nauzea, jedním z možných způsobů, jak ji zvládnout, může být podávání přípravku před spaním. V léčbě se doporučuje pokračovat do progrese onemocnění.
Farmakokinetika
Po jednorázovém podání 300 mg niraparibu nalačno bylo měřitelné koncentrace niraparibu v plazmě dosaženo během 30 minut a průměrné maximální plazmatické koncentrace (cmax) niraparibu bylo dosaženo asi za tři hodiny (804 ng/ml). Po několika perorálních podáních niraparibu v dávkách od 30 do 400 mg jednou denně byla akumulace niraparibu přibližně dvoj až trojnásobná. Systémová expozice (cmax a plocha pod křivkou plazmatické koncentrace, AUC) niraparibu se s titrací dávky z 30 na 400 mg zvyšovala úměrně k velikosti dávky. Absolutní biologická dostupnost niraparibu je přibližně 73 %, což ukazuje na minimální účinek prvního průchodu játry. Jídlo s vysokým obsahem tuků podané souběžně s přípravkem aplikovaným v dávce 300 mg farmakokinetické vlastnosti niraparibu významně neovlivnilo. Niraparib byl středně vázán na proteiny v lidské plazmě (83,0 %), zejména na sérový albumin. Při farmakokinetické analýze niraparibu v populaci byla hodnota distribučního objemu (Vd/F) u onkologických pacientek 1 074 l, což ukazuje na rozsáhlou tkáňovou distribuci niraparibu. Látka je metabolizována primárně karboxylesterázami na hlavní neaktivní metabolit M1. Ve studii hmotnostní rovnováhy byly hlavními cirkulujícími metabolity M1 a M10 (následně zformované glukuronidy M1). Po perorálním jednorázovém podání 300 mg niraparibu činila průměrná hodnota terminálního poločasu (t½) niraparibu 48–51 hodin (přibližně dva dny). Při farmakokinetické analýze v populaci byla systémová clearance (CL/F) niraparibu u onkologických pacientek 16,2 l/h. Niraparib je eliminován primárně hepatobiliární a renální cestou. Při jednorázovém perorálním podání 300mg dávky [14C] niraparibu bylo za 21 dnů z moči a stolice získáno zpět v průměru 86,2 % dávky (rozmezí 71–91 %). Z podané radioaktivně značené dávky se močí vyloučilo 47,5 % (rozmezí 33,4–60,2 %) a stolicí 38,8 % (rozmezí 28,3–47,0 %) dávky. V moči shromážděné za šest dnů bylo zjištěno 40,0 % dávky primárně ve formě metabolitů a 31,6 % dávky bylo zjištěno ve stolici primárně ve formě nezměněného niraparibu.
Úprava dávky u starších pacientek (≥ 65 let) není nutná. Pro pacientky starší 75 let jsou k dispozici pouze omezené klinické údaje. U pacientek s lehkou až středně těžkou poruchou funkce ledvin není nutná žádná úprava dávkování. Nejsou k dispozici žádné údaje o pacientkách s těžkou poruchou funkce ledvin nebo v konečném stadiu onemocnění ledvin podstupujících hemodialýzu. U nemocných s lehkou až středně těžkou poruchou funkce jater není nutná žádná úprava dávkování. Nejsou k dispozici žádné údaje o pacientkách s těžkou poruchou funkce jater.
Kontraindikace
Niraparib je kontraindikován v případě hypersenzitivity na léčivou látku nebo na kteroukoliv pomocnou látku přípravku. Ženy v reprodukčním věku by v průběhu léčby neměly otěhotnět a ani by neměly být na začátku léčby těhotné. U všech žen v reprodukčním věku má být před zahájením léčby proveden těhotenský test. Ženy v reprodukčním věku musejí používat účinnou antikoncepci během léčby a jeden měsíc po podání poslední dávky přípravku Zejula. Údaje o podávání niraparibu těhotným ženám jsou omezené nebo nejsou k dispozici. Studie reprodukční a vývojové toxicity na zvířatech nebyly provedeny. Vzhledem k mechanismu účinku by však niraparib mohl při podání těhotné ženě poškodit embryo nebo plod včetně embryoletálních a teratogenních účinků. Není známo, zda se niraparib či jeho metabolity vylučují do mateřského mléka. Během podávání přípravku Zejula a jeden měsíc po podání poslední dávky je kojení kontraindikováno.
Nežádoucí účinky – shrnutí
bezpečnostního profilu
V pivotní studii ENGOT OV16 byly nežádoucí účinky vyskytující se u ≥ 10 % pacientek léčených přípravkem Zejula v monoterapii následující: nauzea, trombocytopenie, únava/astenie, anémie, zácpa, zvracení, bolesti břicha, neutropenie, insomnie, bolest hlavy, snížená chuť k jídlu, nazofaryngitida, průjem, dyspnoe, hypertenze, dyspepsie, bolest zad, závrať, kašel, infekce močových cest, artralgie, palpitace a dysgeuzie. Mezi nejčastější závažné nežádoucí účinky s výskytem vyšším než 1 % (dle četnosti nežádoucích účinků objevujících se během léčby) patřily trombocytopenie a anémie.
Lékové interakce
Kombinace niraparibu s vakcínami nebo imunosupresivními látkami nebyla předmětem studie. K dispozici jsou jen omezené údaje o niraparibu v kombinaci s cytotoxickými léčivými přípravky. Při používání niraparibu v kombinaci s vakcínami, imunosupresivy nebo s jinými cytotoxickými léčivými přípravky je proto nutné postupovat s opatrností. V podmínkách in vivo je niraparib substrátem karboxylesteráz a UDP glukosyltransferáz. V podmínkách in vivo je oxidativní metabolismus niraparibu minimální. Při současném podávání přípravku Zejula s léčivými přípravky inhibujícími (např. itrakonazol, ritonavir či klaritromycin) nebo indukujícími (např. rifampin, karbamazepin či fenytoin) enzymy cytochromu P450 (CYP) není nutná žádná úprava dávkování. Niraparib je substrátem P glykoproteinu (P gp) a proteinu rezistence karcinomu prsu (breast cancer resistance protein, BCRP). Vzhledem k jeho vysoké propustnosti a biologické dostupnosti je však riziko klinicky relevantní interakce s léčivými přípravky, které tyto transportéry inhibují, nepravděpodobné. Proto není nutná žádná úprava dávkování přípravku Zejula při současném podávání s léčivými přípravky inhibujícími P gp (např. amiodaron, verapamil) nebo BCRP (např. osimertinib, velpatasvir či eltrombopag).
Niraparib není substrátem exportní pumpy solí žlučových kyselin (bile salt export pump, BSEP). Hlavní primární metabolit M1 není substrátem P gp, BCRP ani BSEP. Niraparib není substrátem efluxních transportérů MATE1/2, ale M1 je substrátem obou. Co se týče transportérů pro jaterní vychytávání, nejsou niraparib ani M1 substrátem polypeptidů transportujících organické anionty 1B1 (OATP1B1), 1B3 (OATP1B3) ani transportéru organických kationtů 1 (OCT1). Při současném podávání s léčivými přípravky inhibujícími transportéry OATP1B1 či 1B3 (např. gemfibrozil, ritonavir) nebo OCT1 (např. dolutegravir) není nutná žádná úprava dávkování přípravku Zejula. Niraparib ani M1 nejsou substrátem OAT1, OAT3 ani OCT2. Při současném podávání s léčivými přípravky inhibujícími transportéry OAT1 (např. probenecid) či OAT3 (např. probenecid, diklofenak) nebo OCT2 (např. cimetidin, chinidin) není nutná žádná úprava dávkování přípravku Zejula. Niraparib ani M1 nejsou inhibitory žádných enzymů CYP metabolizujících léčivé látky, jmenovitě CYP1A1/2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 ani CYP3A4/5. Ačkoliv v játrech se inhibice CYP3A4 neočekává, možnost inhibice CYP3A4 na úrovni střev nebyla u relevantních koncentrací niraparibu stanovena. Proto se při podávání niraparibu v kombinaci s léčivými látkami metabolizovanými CYP3A4, především pokud se jedná o látky s úzkým terapeutickým rozmezím (cyklosporin, takrolimus, alfentanil, ergotamin, pimozid, quetiapin a halofantrin), doporučuje zachovávat opatrnost.
V podmínkách in vitro nejsou niraparib ani M1 induktory CYP3A4. V podmínkách in vitro niraparib při vysokých koncentracích slabě indukuje CYP1A2 a klinický význam tohoto účinku nelze zcela vyloučit. M1 není induktorem CYP1A2. Proto se při podávání niraparibu v kombinaci s léčivými látkami metabolizovanými CYP1A2, především pokud se jedná o léčivé látky s úzkým terapeutickým rozmezím (např. klozapin, teofylin či ropinirol), doporučuje zachovávat opatrnost.
Niraparib není inhibitorem BSEP. V podmínkách in vitro niraparib velice slabě inhibuje P gp a BCRP, přičemž poloviční maximální inhibiční koncentrace (IC50) představuje 161 µM, resp. 5,8 µM. Proto nelze vyloučit klinicky relevantní lékovou interakci související s inhibicí těchto efluxních transportérů, ačkoliv je taková interakce nepravděpodobná. Pokud je niraparib podáván v kombinaci se substráty BCRP (irinotekan, rosuvastatin, simvastatin, atorvastatin a metotrexát), je doporučeno zachovávat opatrnost. Niraparib je inhibitorem MATE1/2 s IC50 0,18 µM, resp. ≤ 0,14 µM. Nelze vyloučit zvýšenou koncentraci současně podávaných léčivých přípravků v plazmě, které jsou substráty těchto transportérů (např. metformin). Hlavní primární metabolit M1 se nejeví být inhibitorem P gp, BCRP, BSEP ani MATE1/2. Niraparib ani M1 nejsou inhibitory polypeptidů transportujících OATP1B1 ani OATP1B3. V podmínkách in vitro niraparib slabě inhibuje OCT1 s IC50 34,4 µM. Při podávání niraparibu v kombinaci s léčivými látkami transportovanými OCT1, jako je např. metformin, je nutné zachovávat opatrnost. Co se týče inhibice transportérů pro renální vychytávání (OAT1, OAT3 a OCT2), niraparib ani M1 neinhibují OAT1, OAT3 ani OCT2. Všechny klinické studie byly provedeny pouze u dospělých [11].
Klinické studie
Klinická účinnost a bezpečnost niraparibu coby udržovací terapie byla hodnocena v několika klinických studiích.
ENGOT OV16/studie NOVA
Niraparib byl úspěšně testován
ve studii NOVA, což je randomizovaná, dvojitě zaslepená
studie fáze III srovnávající udržovací terapii niraparibem
oproti placebu u pacientek s platina senzitivním
rekurentním ovariálním karcinomem. V této studii byly
randomizovány ženy s recidivujícím HGSC citlivým na platinu
do ramene s niraparibem (300 mg)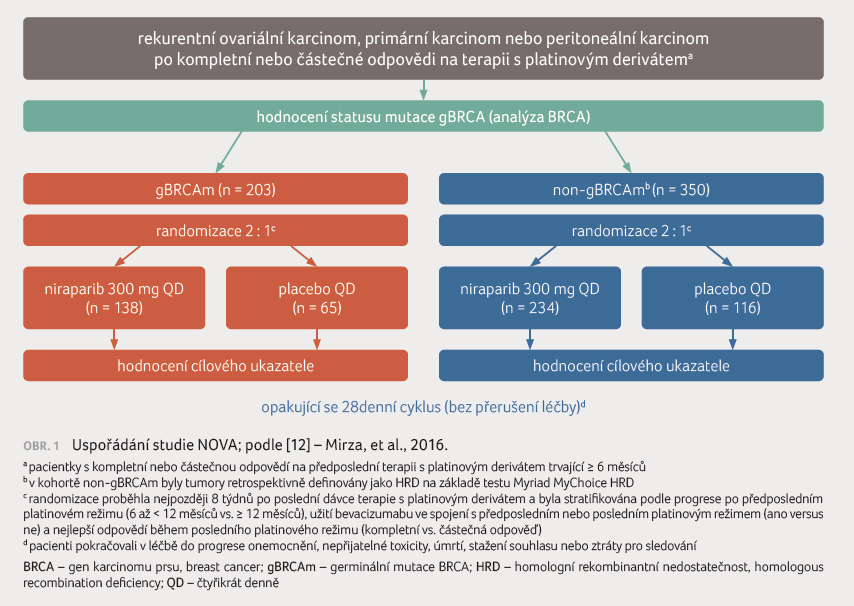 versus do ramene
s placebem v poměru 2 : 1 (obr. 1). Před vstupem do studie byly pacientky vyšetřeny
na přítomnost somatické či germinální mutace BRCA (gBRCAm)
a HRD. Do studie mohly být zařazeny pacientky
s histologicky prokázaným ovariálním, peritoneálním nebo
tubárním karcinomem a s histologicky potvrzeným serózním
papilárním karcinomem. Do studie bylo zařazeno celkem 553
pacientek (546 pacientek bylo nakonec léčených). V rameni
s niraparibem bylo dosaženo prodloužení PFS ve všech
třech předem definovaných populacích: PFS 21,0 měsíce oproti
5,5 měsíce ve prospěch niraparibu pro karcinomy s gBRCAm
(95% interval spolehlivosti [CI] 0,17–0,41; poměr rizik [HR] 0,27;
p < 0,0001),
PFS 12,9 měsíce oproti 3,8 měsíce ve prospěch niraparibu
pro nádory non gBRCAm s HRD (95% CI 0,24–0,59; HR 0,38;
p < 0,0001)
a PFS 9,3 měsíce oproti 3,9 měsíce ve prospěch
niraparibu pro skupinu bez gBRCAm (95% CI 0,34–0,61; HR 0,45;
p < 0,001), graf 1A–C. NOVA byla
první úspěšnou prospektivní studií fáze III s inhibitory
PARP, která dokládá jejich přínos u rekurentního
platina senzitivního karcinomu ovaria. Niraparib byl
v listopadu 2017 zaregistrován Evropskou lékovou agenturou
(EMA) jako monoterapie k udržovací léčbě dospělých
pacientek s rekurentním platina senzitivním high grade
serózním epiteliálním
versus do ramene
s placebem v poměru 2 : 1 (obr. 1). Před vstupem do studie byly pacientky vyšetřeny
na přítomnost somatické či germinální mutace BRCA (gBRCAm)
a HRD. Do studie mohly být zařazeny pacientky
s histologicky prokázaným ovariálním, peritoneálním nebo
tubárním karcinomem a s histologicky potvrzeným serózním
papilárním karcinomem. Do studie bylo zařazeno celkem 553
pacientek (546 pacientek bylo nakonec léčených). V rameni
s niraparibem bylo dosaženo prodloužení PFS ve všech
třech předem definovaných populacích: PFS 21,0 měsíce oproti
5,5 měsíce ve prospěch niraparibu pro karcinomy s gBRCAm
(95% interval spolehlivosti [CI] 0,17–0,41; poměr rizik [HR] 0,27;
p < 0,0001),
PFS 12,9 měsíce oproti 3,8 měsíce ve prospěch niraparibu
pro nádory non gBRCAm s HRD (95% CI 0,24–0,59; HR 0,38;
p < 0,0001)
a PFS 9,3 měsíce oproti 3,9 měsíce ve prospěch
niraparibu pro skupinu bez gBRCAm (95% CI 0,34–0,61; HR 0,45;
p < 0,001), graf 1A–C. NOVA byla
první úspěšnou prospektivní studií fáze III s inhibitory
PARP, která dokládá jejich přínos u rekurentního
platina senzitivního karcinomu ovaria. Niraparib byl
v listopadu 2017 zaregistrován Evropskou lékovou agenturou
(EMA) jako monoterapie k udržovací léčbě dospělých
pacientek s rekurentním platina senzitivním high grade
serózním epiteliálním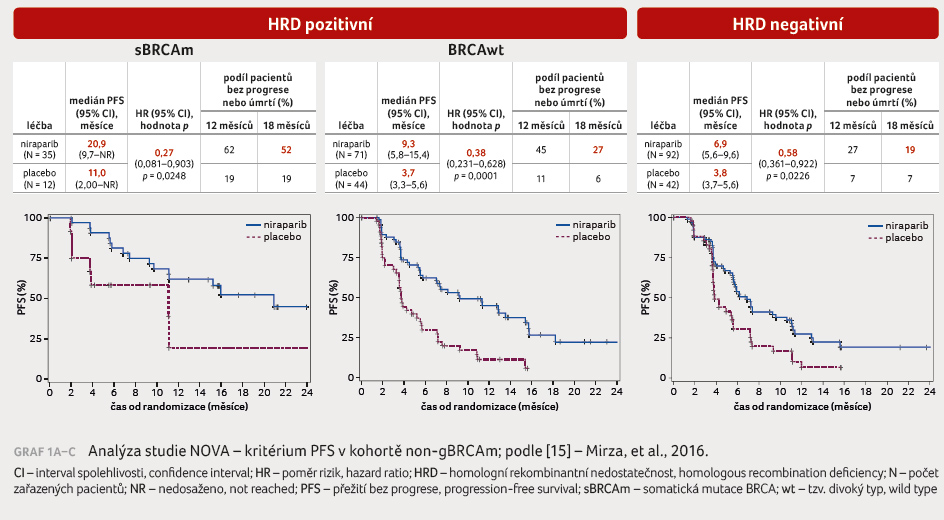 karcinomem vaječníků, vejcovodů nebo
s primárním karcinomem pobřišnice, které úplně nebo
částečně reagují na chemoterapii na bázi platiny.
karcinomem vaječníků, vejcovodů nebo
s primárním karcinomem pobřišnice, které úplně nebo
částečně reagují na chemoterapii na bázi platiny.
Nežádoucí účinky byly řešitelné snížením dávky či odložením léčby. Běžný byl výskyt hematologické toxicity (trombocytopenie v 61,3 %, anémie v 50,1 % a neutropenie v 30,2 %), maximální rozvoj hematologické toxicity byl zaznamenán v prvních třech cyklech léčby. Ačkoliv toxicita stupně 3 nebo 4 byla běžná, byla zvládnutelná a zásadně nezvyšovala morbiditu ani mortalitu.
Výše zmíněná studie prokázala signifikantní prodloužení PFS u všech pacientek léčených niraparibem bez ohledu na přítomnost či absenci mutací BRCA či HRD [12–17].
ENGOT OV26/GOG 3012/studie PRIMA
Jedná se o dvojitě zaslepenou
studii fáze III, do níž byly zařazeny pacientky s nově
diagnostikovaným pokročilým ovariálním karcinomem v poměru
2 : 1 k léčbě niraparibem či placebem jednou denně
po absolvování chemoterapie s platinovým derivátem
a s potvrzenou léčebnou odpovědí (parciální či
kompletní remise), obrázek 2.
Léčba byla podávána po dobu 36 měsíců či do progrese
onemocnění. Hlavním cílovým ukazatelem bylo stanovení PFS,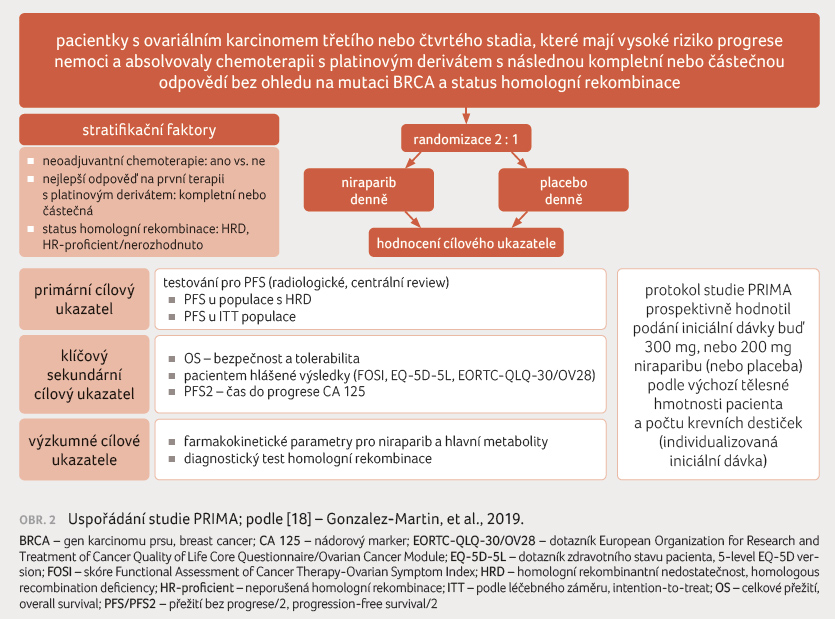 předběžná interim analýza OS přinesla následující závěry.
U pacientek s HRD byl medián PFS signifikantně delší
než ve skupině s placebem (21,9 měsíce vs. 10,4 měsíce;
HR 0,43; 95% CI 0,31–0,59). V celkové populaci pacientek
činil PFS 13,8 měsíce vs. 8,2 měsíce (HR 0,62; 95% CI
0,50–0,76), graf 2A–C.
V interim analýze provedené po 24 měsících byla
prokázána míra OS 84 % ve skupině s niraparibem a 77 %
ve skupině s placebem (HR 0,70; 95% CI 0,44–1,11)
u celkové populace pacientek. U pacientek s pozitivní
HRD představovalo dvouleté přežití 91 % při léčbě niraparibem
a 85 % při
předběžná interim analýza OS přinesla následující závěry.
U pacientek s HRD byl medián PFS signifikantně delší
než ve skupině s placebem (21,9 měsíce vs. 10,4 měsíce;
HR 0,43; 95% CI 0,31–0,59). V celkové populaci pacientek
činil PFS 13,8 měsíce vs. 8,2 měsíce (HR 0,62; 95% CI
0,50–0,76), graf 2A–C.
V interim analýze provedené po 24 měsících byla
prokázána míra OS 84 % ve skupině s niraparibem a 77 %
ve skupině s placebem (HR 0,70; 95% CI 0,44–1,11)
u celkové populace pacientek. U pacientek s pozitivní
HRD představovalo dvouleté přežití 91 % při léčbě niraparibem
a 85 % při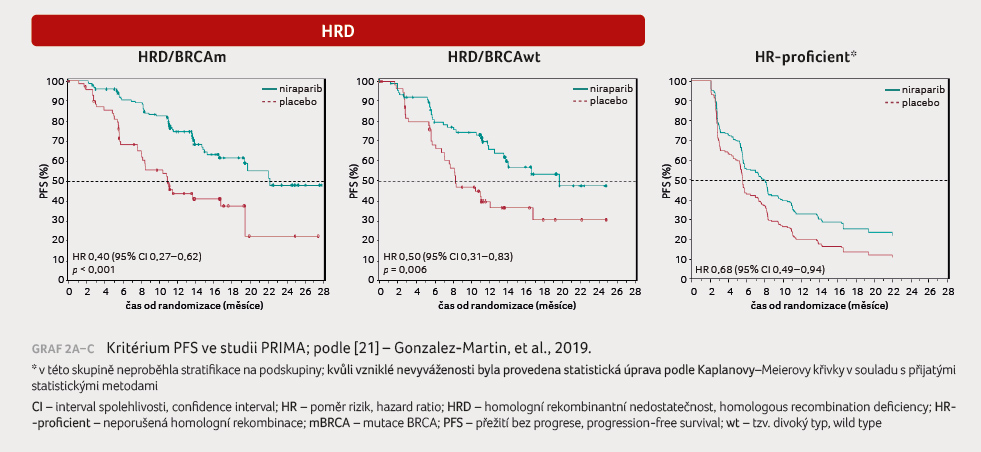 podávání placeba (HR 0,61; 95% CI
0,27–1,39), graf 3A–C.
Nejčastějšími nežádoucími účinky stupně 3 a vyššího
byly anémie (31,0 % pacientek), trombocytopenie (28,7 %)
a neutropenie (12,8 %). Nebylo zaznamenáno žádné úmrtí
v souvislosti s léčbou niraparibem.
podávání placeba (HR 0,61; 95% CI
0,27–1,39), graf 3A–C.
Nejčastějšími nežádoucími účinky stupně 3 a vyššího
byly anémie (31,0 % pacientek), trombocytopenie (28,7 %)
a neutropenie (12,8 %). Nebylo zaznamenáno žádné úmrtí
v souvislosti s léčbou niraparibem.
Studií PRIMA bylo potvrzeno signifikantní prodloužení PFS u pacientek s nově diagnostikovaným pokročilým ovariálním karcinomem, které obdržely niraparib po léčbě chemoterapií první linie, s prokázanou terapeutickou odpovědí u všech nemocných bez ohledu na status HRD [18–21].
Studie QUADRA
Pacientky s recidivujícím
karcinomem vaječníku jsou léčeny několika liniemi chemoterapie.
V pozdních liniích léčby dosahuje chemoterapie u pacientek
odpovědi (response rate, RR) 5–10 %. Použití inhibitorů PARP
u této podskupiny je omezeno pouze na pacientky s mutacemi
v genech BRCA1 a BRCA2, ale pouze 20 % nemocných
s karcinomem ovaria má mutaci BRCA, to znamená, že pro
pacientky bez mutace nelze tuto terapii použít. Na základě
výsledků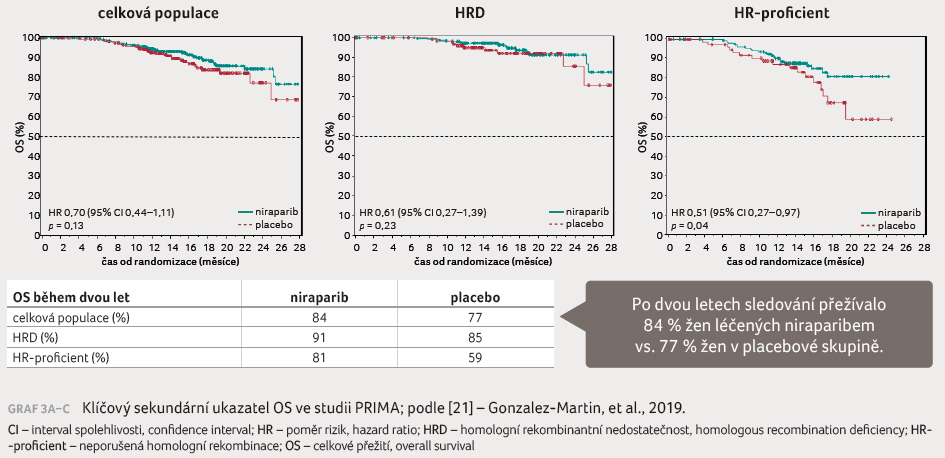 studie fáze I (použití niraparibu v indikaci
udržovací terapie) byla studie QUADRA navržena tak, aby umožnila
hodnocení protinádorové aktivity a bezpečnosti niraparibu
ve vyšších liniích u recidivujícho karcinomu ovaria
bez ohledu na citlivost na platinu a molekulární
biomarkery.
studie fáze I (použití niraparibu v indikaci
udržovací terapie) byla studie QUADRA navržena tak, aby umožnila
hodnocení protinádorové aktivity a bezpečnosti niraparibu
ve vyšších liniích u recidivujícho karcinomu ovaria
bez ohledu na citlivost na platinu a molekulární
biomarkery.
Studie QUADRA je multicentrická jednoramenná studie fáze II, do níž byly zařazovány pacientky s recidivujícím HGSC, s tumorem tuby nebo s primárním peritoneálním karcinomem, které podstoupily tři nebo více předchozích linií chemoterapie (gemcitabin, doxorubicin, topotekan, karboplatina, oxaliplatina, cisplatina, bevacizumab, inhibitor PARP v monoterapii nebo kombinace dle standardu léčby). Podmínkou vstupu do studie bylo měřitelné onemocnění, performance status 0–1 a odpovídající orgánové funkce. Všechny pacientky musely podstoupit somatické testování HRD pomocí testu Myriad MyChoice HRD a genetické testování. V původním protokolu neměla studie limitaci stran počtu absolvovaných linií, do studie byly zařazovány i pacientky s platina rezistentním a refrakterním karcinomem bez ohledu na mutaci BRCA či status HRD. Po počátečním zařazení 292 pacientek došlo ke změně uspořádání studie kvůli omezení náboru. Mohly být zařazeny pouze nemocné, které absolvovaly tři nebo čtyři linie léčby a u nichž došlo k relapsu po první linii léčby v odstupu minimálně šesti měsíců. Další změna uspořádání ve studii nastala 24. května 2016, kdy se uzavřel příjem pacientek s HRD negativními nádory. Pacientky v rámci studie užívaly niraparib v dávce 300 mg denně kontinuálně do progrese onemocnění nebo do neakceptovatelné toxicity. Primárním cílem studie bylo dosažení celkové odpovědi na léčbu (overall response rate, ORR) u nemocných s defekty v rámci HRD (včetně pacientek s mutací BRCA a bez ní), které byly senzitivní na poslední platinovou chemoterapii a absolvovaly tři nebo čtyři předchozí linie terapie. V období od 1. dubna 2015 do 1. listopadu 2017 bylo randomizována 729 pacientek (z toho 463 zahájilo terapii niraparibem). V době první analýzy 11. dubna 2018 bylo v aktivní léčbě ještě 21 pacientek. Medián počtu předchozích linií činil 4 (mezikvartilní rozpětí [IQR] 3–5) a medián OS dosahoval 12,2 měsíce (IQR 3 ∙ 7–22 ∙ 1). Celkem 151 (33 %) ze 463 pacientek bylo rezistentních a 161 (35 % z 463) pacientek bylo refrakterních na platinovou chemoterapii. Nejčastějšími nežádoucími účinky stupně 3 nebo vyššího byly anémie v 24 % případů (113 ze 463) a trombocytopenie v 21 % (95 ze 463). Nejčastější závažné nežádoucí příhody v souvislosti s terapií představovaly obstrukce tenkého střeva (7 %), trombocytopenie (7 %) a zvracení (6 %). Bylo zaznamenáno jedno úmrtí v důsledku krvácení do gastrointestinálního traktu v souvislosti s terapií.
V rámci této studie byl doložen klinický prospěch aplikace niraparibu u předléčených pacientek s karcinomem ovaria, a to zejména s HRD pozitivním onemocněním citlivým na platinu, které zahrnuje nejen nemocné s mutacemi BRCA, ale i nemocné s wild type BRCA [22–25].
Závěr
Historicky je klinická aktivita inhibitorů PARP spojována s přítomností mutací BRCA ve většině studií. Klinické studie s niraparibem prokázaly efektivitu v léčbě i u pacientek s wild type BRCA tumory. Tato data by měla podporovat rozšíření indikace léčby inhibitory PARP na pacientky s karcinomem ovaria s HRD nad rámec mutací BRCA. Předběžně se ukazuje v interim analýzách rovněž zlepšení celkového přežití, nicméně nejsou ještě k dispozici kompletní data.
Seznam použité literatury
- [1] SEER Cancer Statistics Review (CSR) 1975–2013. Bethesda, MD: National Cancer Institute, 2016. Dostupné na: https://seer.cancer.gov/archive/csr/1975_2013/
- [2] GLOBOCAN 2012 v1.0, estimated cancer incidence, mortality and prevalence worldwide: IARC CancerBase no. 11. Lyon, France: International Agency for Research on Cancer, 2013. Dostupné na: http://publications.iarc.fr/Databases/Iarc‑Cancerbases/Globocan‑2012‑Estimated‑Cancer‑Incidence‑Mortality‑And‑Prevalence‑Worldwide‑In‑2012‑V1‑0‑2012
- [3] McMeekin DS, Tillmanns T, Chaudry T, et al. Timing isn’t everything: an analysis of when to start salvage chemotherapy in ovarian cancer. Gynecol Oncol 2004; 95: 157–164.
- [4] Alvarez RD, Matulonis UA, Herzog TJ, et al. Moving beyond the platinum sensitive/resistant paradigm for patients with recurrent ovarian cancer. Gynecol Oncol 2016; 141: 405–409.
- [5] Matulonis UA, Harter P, Gourley C, et al. Olaparib maintenance therapy in patients with platinum‑sensitive, relapsed serous ovarian cancer and a BRCA mutation: overall survival adjusted for postprogression poly(adenosine diphosphate ribose) polymerase inhibitor therapy. Cancer 2016; 122: 1844–1852.
- [6] Hoskins PJ, Le N. Identifying patients unlikely to benefit from further chemotherapy: a descriptive study of outcome at each relapse in ovarian cancer. Gynecol Oncol 2005; 97: 862–869.
- [7] Bruchim I, Jarchowsky‑Dolberg O, Fishman A. Advanced second line chemotherapy in the treatment of patients with recurrent epithelial ovarian cancer. Eur J Obstet Gynecol Reprod Biol 2013; 166: 94–98.
- [8] Hanker LC, Loibl S, Burchardi N, et al. The impact of second to sixth line therapy on survival of relapsed ovarian cancer after primary taxane/platinum‑based therapy. Ann Oncol 2012; 23: 2605–2612.
- [9] dʼAdda di Fagagna F, Hande MP, Tong WM, et al. Functions of poly(ADP‑ribose) polymerase in controlling telomere length and chromosomal stability. Nat Genet 1999; 23: 76–80.
- [10] Tong WM, Cortes U, Wang ZQ. Poly(ADP‑ribose) polymerase: a guardian angel protecting the genome and suppressing tumorigenesis. Biochim Biophys Acta 2001; 1552: 27–37.
- [11] SPC Zejula. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/zejula‑epar‑product‑information_cs.pdf
- [12] Mirza MR, Monk BJ, Herrstedt J, et al. Niraparib maintenance therapy in platinum‑sensitive, recurrent ovarian cancer. N Engl J Med 2016; 375(Suppl): 2154–2164.
- [13] Juden LM, Freese E, Bessette, et al. Long‑term safety of niraparib in patients with recurrent ovarian cancer: results from the ENGOT‑OV16/NOVA trial. Presented at Oncology Nursing Society Congress; April 11–14, 2019; Anaheim, USA.
- [14] Matulonis UA, Herrstedt J, Tinker AV, et al. Long‑term benefit of niraparib treatment of recurrent ovarian cancer. J Clin Oncol 2017; 35(15 Suppl): 5534–5534.
- [15] Mirza MR, Monk BJ, Oza AM, et al. ENGOT‑OV16/NOVA trial: niraparib maintenance therapy in patients with recurrent ovarian cancer. Presented at the European Society of Medical Oncology Annual Conference; Oct 8, 2016; Copenhagen, Dánsko.
- [16] Lord R, Mirza MR, Bessette P, et al. Safety and dose modification for patients with low body weight receiving niraparib in the ENGOT‑OV16/NOVA phase 3 trial. Presented as the Society for Gynecologic Oncology 2018; March 24–27, 2018; New Orleans, USA.
- [17] Wang J, Zhang ZY, Mirza MR, et al. The exposure‑response relationship of niraparib in patients with gBRCAmut and non‑gBRCAmut: results from the ENGOT‑OV16/NOVA trial. Presented at European Society for Medical Oncology 2017; September 8–12, 2017; Madrid, Španělsko.
- [18] Gonzalez‑Martin A, dePont C, Graybill W, et al. Niraparib Treatment in Patients with Newly Diagnosed Advanced Ovarian Cancer After Response to Chemotherapy. N Engl J Med 2019; 381: 2391–2402.
- [19] A Study of Niraparib Maintenance Treatment in Patients With Advanced Ovarian Cancer Following Response on FrontLine Platinum‑Based Chemotherapy. Dostupné na: https://clinicaltrialsgov/ct2/show/NCT02655016 [Accessed 25 September 2019].
- [20] Berek JS, Matulonis UA, Peen U, et al. Safety and dose modification for patients receiving niraparib. Ann Oncol 2018; 29: 1784–1792.
- [21] Gonzales‑Martin A, Pothuri B, Vergote I, et al. Niraparib Therapy in Patients With Newly Diagnosed Advanced Ovarian Cancer (PRIMA/ENGOT‑OV26/GOG‑3012). Presented at the European Society for Medical Oncology (ESMO). September 28, 2019. Barcelona, Španělsko. Poster LBA1.
- [22] Moore KN, Alvarez Secord A, Geller MA, et al. Niraparib monotherapy for late‑line treatment of ovarian cancer (QUADRA): a multicenter, open‑label, single‑arm phase 2 trial. Lancet Oncol 2019; 20: 636–648.
- [23] Moore KN, Alvarez Secord A, Geller M, et al. QUADRA: A phase 2, open‑label, single‑arm study to evaluate niraparib in patients with relapsed ovarian cancer in 4th line or later line of therapy; results from the BRCAmut subset. Presented at the European Society of Medical Oncology Meeting. October 19–23, 2018; Munich, Německo. Poster 944P.
- [24] Rimel BJ, Secord AA, Geller MJ, et al. Safety and Efficacy Results of Retreatment With PARP Inhibitor Monotherapy in Late‑Line Recurrent Ovarian Cancer: Results From a Subset of the QUADRA Trial. Gynecol Oncol 2020; 156: e4–e5.
- [25] Matulonis UA, Monk BJ, Alvarez Secord A, et al. Baseline platelet count and body weight as predictors of early dose modification in the QUADRA trial of niraparib monotherapy for the treatment of heavily pretreated (≥4th line), advanced, recurrent high‑grade serous ovarian cancer. Gynecol Oncol 2019; 154: 3.