Palbociklib
Souhrn:
Palbociklib (Ibrance) je vysoce selektivní inhibitor cyklin dependentní kinázy (cyclin‑dependent kinase, Cdk) 4/6. V klinických studiích (PALOMA‑1 a PALOMA‑2) palbociklib v kombinaci s letrozolem v první linii hormonální léčby a u žen pre‑ a peri‑ nebo postmenopauzálních v kombinaci s fulvestrantem (PALOMA‑3), u nichž došlo k předchozí progresi po hormonální terapii, signifikantně prodloužil dobu přežití bez progrese onemocnění a zlepšil léčebnou odpověď. Nejčastějším nežádoucím účinkem včetně stupně ≥ 3 byla neutropenie, která však nekorelovala s febrilní neutropenií (< 2 %) a byla dobře zvladatelná odkladem dávky nebo jejím snížením. Palbociklib v kombinaci s hormonální léčbou může zlepšit prognózu u pacientek trpících ER pozitivním a HER2 negativním karcinomem prsu.
Key words: Cdk4/6 inhibitor – palbociclib – metastatic breast cancer – hormonal therapy.
Summary:
Palbociclib (Ibrance) is a highly selective inhibitor of cyclin‑dependent kinases 4 and 6 (Cdk4/6). In clinical trials (PALOMA‑1 and PALOMA‑2), palbociclib in combination with letrozole in the first line hormonal therapy in pre‑, peri‑, and postmenopausal women, or in combination with fulvestrant in postmenopausal women (PALOMA‑3) with prior disease progression after hormonal therapy, significantly prolonged progression‑free survival and improved clinical response. Neutropenia was the most commonly reported adverse event, including grade ≥ 3, that did not correlate with febrile neutropenia (< 2%) and generally manageable with a dose delay or reduction. Palbociclib in combination with hormonal therapy can improve the prognosis of patients with ER‑positive, HER2‑negative breast cancer.
Farmakologická skupina a terapeutické indikace
Palbociklib (Ibrance) se řadí mezi Jiná cytostatika, inhibitory proteinkináz, s označením ATC kódem L01XE33. Přípravek je podle indikačního omezení Státního ústavu pro kontrolu léčiv (SÚKL) na základě výsledků klinických studií MONALEESA 1‒3 indikován k léčbě lokálně pokročilého nebo metastazujícího karcinomu prsu s pozitivním estrogenovým receptorem (estrogen receptor, ER) a negativním receptorem lidského epidermálního růstového faktoru typu 2 (human epidermal growth factor receptor 2, HER2): v kombinaci s inhibitory aromatázy v první linii léčby a v kombinaci s fulvestrantem u žen, které byly předtím léčeny hormonální terapií. U pre nebo perimenopauzálních žen je třeba endokrinní léčbu kombinovat s agonistou hormonu uvolňujícího luteinizační hormon (luteinizing hormone releasing hormone, LHRH) [1].
Dávkování
Účinnost palbociklibu byla poprvé
zkoušena v klinické studii 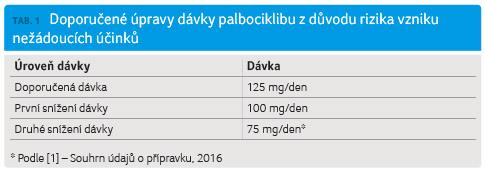 fáze I u 41 pacientů
s pokročilým solidním nádorem. Maximální tolerovaná
dávka, která byla doporučena do klinické studie fáze II,
byla 125 mg/den palbociklibu ve dnech 1‒21 ve 28denním
cyklu [2]. V souladu s léčbou pacientek v klinických
studiích lze v terapii palbociklibem pokračovat tak dlouho,
dokud z ní má nemocná klinický přínos nebo dokud nedojde
k nepřijatelné toxicitě. V případě výskytu
nežádoucích účinků, hlavně hematologické toxicity, je
doporučeno snížit dávku (tab. 1). U pacientů s lehkou až středně těžkou
poruchou funkce ledvin (clearance kreatininu ≥ 30 ml/min)
není nutná úprava dávky přípravku, stejně tak u nemocných
s lehkou poruchou funkce jater a u pacientů ve věku
nad 65 let.
fáze I u 41 pacientů
s pokročilým solidním nádorem. Maximální tolerovaná
dávka, která byla doporučena do klinické studie fáze II,
byla 125 mg/den palbociklibu ve dnech 1‒21 ve 28denním
cyklu [2]. V souladu s léčbou pacientek v klinických
studiích lze v terapii palbociklibem pokračovat tak dlouho,
dokud z ní má nemocná klinický přínos nebo dokud nedojde
k nepřijatelné toxicitě. V případě výskytu
nežádoucích účinků, hlavně hematologické toxicity, je
doporučeno snížit dávku (tab. 1). U pacientů s lehkou až středně těžkou
poruchou funkce ledvin (clearance kreatininu ≥ 30 ml/min)
není nutná úprava dávky přípravku, stejně tak u nemocných
s lehkou poruchou funkce jater a u pacientů ve věku
nad 65 let.
Zařazení do současné palety léčiv
Přípravek je v kombinaci s hormonální léčbou (letrozol nebo fulvestrant) součástí algoritmu léčby ER pozitivního HER2 negativního lokálně pokročilého karcinomu prsu. V České republice má zatím pouze registraci, ne však úhradu.
Mechanismus účinku
Palbociklib je vysoce selektivní,
reverzibilní inhibitor Cdk4/6. Cyklin dependentní kinázy patří
mezi hlavní regulátory buněčného cyklu [3]. Jedná se
o serin treonin kinázy zodpovědné za fosforylaci
a s ní spojenou aktivaci cyklinů. Klíčovým je
cyklin D, který je aktivován fosforylovanou formou Cdk4/6 [4].
Výsledkem aktivace cyklinu D je fosforylace Rb
(retinoblastomového) proteinu, jenž inaktivuje transkripční faktor
E2F (transkripční ![OBR. 1 Mechanismus účinku palbociklibu; podle [13] – Vidula, et al., 2016. Fáze buněčného cyklu – první přípravná (G1), syntetická (S), druhá přípravná (G2), mitotická (m). Cdk – cyklin dependentní kináza; e2F – transkripční faktor; p – fosforylace, phosphorylation; R – bod zlomu, restriction point; rb – retinoblastomový](https://www.remedia.cz/photo-a-31216---.jpg) faktor regulující geny nezbytné pro
pokračování buněčného cyklu, obr. 1). Tento proces
umožní buňce přejít přes G1 kontrolní bod z G
do S fáze buněčného cyklu. Pokud buňka výše zmíněné
pochody nedokončí a buněčný cyklus nepřejde do S fáze,
dochází k aktivaci apoptózy. Alterace výše popsaného
mechanismu vede ke ztrátě regulace buněčného cyklu
a ke vzniku hormonální rezistence. V nádorových buňkách
karcinomu prsu je častá zvýšená exprese a aktivita Cdk4/6,
bývá přítomna i řada mutací genů vedoucích ke zvýšené
produkci cyklinu D, Cdk4/6 a k poklesu exprese
inhibitoru Cdk4/6 p16 [5,6].
faktor regulující geny nezbytné pro
pokračování buněčného cyklu, obr. 1). Tento proces
umožní buňce přejít přes G1 kontrolní bod z G
do S fáze buněčného cyklu. Pokud buňka výše zmíněné
pochody nedokončí a buněčný cyklus nepřejde do S fáze,
dochází k aktivaci apoptózy. Alterace výše popsaného
mechanismu vede ke ztrátě regulace buněčného cyklu
a ke vzniku hormonální rezistence. V nádorových buňkách
karcinomu prsu je častá zvýšená exprese a aktivita Cdk4/6,
bývá přítomna i řada mutací genů vedoucích ke zvýšené
produkci cyklinu D, Cdk4/6 a k poklesu exprese
inhibitoru Cdk4/6 p16 [5,6].
Farmakokinetické vlastnosti
Absorpce
Ve studii fáze I byl palbociklib v dávkování 125 mg v 1.‒21. dni 28denního cyklu pomalu absorbován. Medián doby do dosažení maximální koncentrace palbociklibu byl v těchto sledováních 8 hodin. Průměrná absolutní biologická dostupnost palbociklibu po perorální dávce 125 mg je 46 %. Výskyt neutropenie stupně ≤ 3 s nadirem na konci 21denního užívání přípravku byl u 12 % pacientek jediným faktorem limitujícím dávku. K restituci leukocytů docházelo ke konci období bez užívání léků, tedy do osmi dnů. Příjem jídla významně snižoval interindividuální a intraindividuální variabilitu expozice palbociklibu. Na základě těchto výsledků je doporučeno užívat přípravek spolu s jídlem [7,8].
Distribuce a eliminace
Vazba palbociklibu na proteiny v lidské plazmě in vitro byla ~85 % bez závislosti na plazmatické koncentraci léčiva [7].
U pacientů s pokročilým nádorovým onemocněním prsu byl průměrný poločas eliminace z plazmy 28,8 hodiny. U šesti zdravých subjektů mužského pohlaví, jimž byla podána jedna perorální dávka [14C] palbociklibu, byl medián 92 % celkově podané radioaktivní dávky odbourán za 15 dnů; stolice (74 % dávky) představovala hlavní cestu exkrece, 17 % dávky se vyloučilo v moči. Exkrece nezměněného palbociklibu ve stolici byla 2 % a v moči 7 % podané dávky [5,7].
Klinické zkušenosti
Palbociklib byl americkým Úřadem pro kontrolu potravin a léčiv (Food and Drug Administration, FDA) schválen pro první linii léčby metastatického ER pozitivního HER2 negativního karcinomu prsu v kombinaci s letrozolem na základě výsledků klinické studie fáze II vedené pod názvem PALOMA 1/TRIO 18. Do sledování byly zařazeny pacientky s metastatickým ER pozitivním HER2 negativním karcinomem prsu bez předchozí léčby pro metastatické onemocnění. Nemocné byly rozděleny do dvou kohort ‒ do první kohorty byly zařazeny pacientky pouze na základě potvrzení pozitivity ER a negativity HER2, do druhé kohorty musely mít pacientky potvrzenou amplifikaci genu CCDN1 (více než tři kopie) a ztrátu proteinu p16 (ztráta heterozygozity), což splňovalo přibližně 36 % nemocných s luminálním B karcinomem prsu. Pacientky mohly být léčeny inhibitorem aromatázy v adjuvanci a byly stratifikovány do tří skupin podle toho, zda u nich došlo k progresi onemocnění za více než rok po ukončení léčby, do roka po ukončení léčby nebo zda se u nich vyskytl metastatický karcinom prsu de novo. Primárním cílovým ukazatelem studie bylo přežití bez progrese onemocnění (progression free survival, PFS). K sekundárním cílovým ukazatelům patřily četnost léčebných odpovědí (response rate, RR) a celkové přežití (overall survival, OS). Vzhledem k tomu, že po první interim analýze se výsledky v kohortě 1 a 2 nelišily, byly pacientky dále zařazovány pouze na základě pozitivity ER a negativity HER2. Medián PFS pro obě kohorty nemocných léčených kombinací letrozol a palbociklib byl 20,2 měsíce a 10,2 měsíce pro skupinu léčenou letrozolem (HR [poměr rizik] 0,488; 95% CI [interval spolehlivosti] 0,319‒0,748; p = 0,0004). Podíl léčebných odpovědí u pacientek s měřitelnou lézí byl 55 % v rameni s kombinovanou terapií a 39 % v rameni s monoterapií (p = 0,47). Trvání léčebné odpovědi u pacientek, které dosáhly kompletní remise (complete remission, CR), bylo 20,3 měsíce, 11,1 měsíce pak u nemocných, jež dosáhly částečné odpovědi (partial remission, PR). Přínos kombinační léčby byl pozorován napříč všemi předem definovanými podskupinami pacientek nezávisle na věku, předléčenosti a lokalitě metastáz. Největší přínos terapie byl pozorován u nemocných nepředléčených adjuvantní léčbou (HR 0,341; 95% CI 0,194‒0,599; p = 0,00004) [9].
Předem byla plánována i analýza účinnosti palbociklibu u podskupin pacientek pouze s kostními metastázami a viscerálními metastázami. Větší redukce rizika progrese onemocnění byla pozorována u nemocných s kostními metastázami (HR 0,294; 95% CI 0,092‒0,945; p = 0,0148) ve srovnání s pacientkami s viscerálními metastázami (HR 0,547; 95% CI 0,317‒0,944; p = 0,0137). Na letošní konferenci ASCO (American Society of Clinical Oncology), která se konala v červnu v Chicagu, byly prezentovány výsledky hodnotící OS u pacientek léčených v rámci klinické studie PALOMA 1. Nebylo prokázáno signifikantní prodloužení OS v rameni s palbociklibem oproti letrozolu samotnému (37,5 měsíce vs. 34,5 měsíce). Příčinou bude nejspíš malý počet nemocných (jednalo se o studii fáze II) a stále ještě poměrně krátký follow up. Z tohoto důvodu jsou rozhodující výsledky vycházející ze sledování PALOMA 2.
Klinická studie fáze III vedená pod názvem PALOMA 2 měla potvrdit příznivé výsledky klinické studie fáze II ‒ PALOMA 1/TRIO 18. Výsledky sledování byly prezentovány na kongresu ASCO v roce 2016. Do studie bylo za stejných podmínek jako v hodnocení PALOMA 1/TRIO 18 zařazeno celkem 666 pacientek, které byly randomizovány v poměru 2 : 1 ve prospěch kombinační léčby letrozolem a palbociklibem versus letrozolem samotným. Sledování se zúčastnilo 180 center v 17 zemích. Výsledky hodnocení PALOMA 2 jsou konzistentní s výsledky klinické studie PALOMA 1/TRIO 18. Medián PFS u nemocných léčených kombinací byl 24,8 měsíce versus 14,5 měsíce u pacientek léčených letrozolem (HR 0,58; 95% CI 0,46‒0,72; p < 0,000001). Klinický přínos byl 85 % versus 70 % (OR [poměr šancí] 2,39; p < 0,001) [7].
Účinnost palbociklibu v kombinaci s hormonální léčbou fulvestrantem u pacientek s ER pozitivním HER2 negativním karcinomem prsu v dalších liniích léčby zkoumá klinická studie fáze III vedená pod názvem PALOMA 3. Celkem 521 pacientek bylo randomizováno v poměru 2 : 1 ve prospěch kombinace fulvestrantu s palbociklibem. Do studie mohly být zařazeny i pacientky pre a perimenopauzální v případě, že současně dostávaly analog LHRH goserelin. PALOMA 3 je tak první studií, kde byl fulvestrant zkoušen u skupiny pre a perimenopauzálních nemocných. Zařazovacím kritériem byla rezistence na předchozí hormonální léčbu ‒ inhibitor aromatázy u postmenopauzálních pacientek a tamoxifen u peri a premenopauzálních pacientek. Asi třetina nemocných byla předléčena jednou linií chemoterapie pro metastatické onemocnění. Primárním cílovým ukazatelem studie bylo PFS podle hodnocení zkoušejícího. Medián PFS byl 9,5 měsíce u pacientek léčených kombinací versus 4,6 měsíce u pacientek s fulvestrantem (HR 0,46; 95% CI 0,36‒0,59; p < 0,0001) nezávisle na menopauzálním stavu zařazených. Klinický přínos u nemocných léčených kombinací byl 64 % vs. 36 % u nemocných léčených fulvestrantem (p < 0,0001). Výsledky OS zatím nelze vyhodnotit. Studie potvrdila konzistentnost výsledků léčby palbociklibem [8].
Klinické studie zkoumající účinnost palbociklibu, které byly vedené pod názvem PALOMA, neprobíhaly na českých pracovištích. Lék byl však dostupný v léčebném programu v onkologických centrech v letech 2016 a 2017 u pacientek předléčených čtyřmi a více liniemi terapie pro metastatické onemocnění. V Masarykově onkologickém ústavu jsme léčili kombinací palbociklibu s hormonální léčbou (podle výběru ošetřujícího lékaře) osm pacientek. Můžeme potvrdit, že tolerance léku byla velice dobrá i u této těžce předléčené skupiny nemocných a toxicita byla dobře zvladatelná. I v případě neutropenií stupně 3/4 jsme se u pacientek nesetkali s febrilní neutropenií. K vyřešení toxicity zpravidla stačilo dávku zredukovat podle doporučení.
Kontraindikace a nežádoucí účinky
Při podání palbociklibu je třeba dbát na možnou přecitlivělost na složky přípravku a na současné užívání s přípravky obsahujícími třezalku tečkovanou.
Nejčastějšími nežádoucími účinky v rameni s palbociklibem ve studii PALOMA 1/TRIO 18 byly neutropenie, leukopenie, slabost, nevolnost, artralgie a alopecie. Neutropenie jakéhokoliv stupně závažnosti byla zaznamenána u 79,5 % pacientů v rameni s palbociklibem ve srovnání s 6,3 % v rameni s placebem. Neutropenie stupně 3/4 byla popsána u 66,4 % pacientů ve srovnání s 1,4 % v kontrolní skupině. Febrilní neutropenie stupně 3/4 byla popsána u devíti nemocných léčených v rameni s palbociklibem. Nejčastějším nehematologickým nežádoucím účinkem byla únava (37,4 % v rameni s palbociklibem a 27,5 % v rameni s placebem), dále pak byly pozorovány nevolnost (35,1 % vs. 25,1 %) a bolesti kloubů (33,3 % vs. 33,8 %). Dalšími nežádoucími účinky, které byly častější v rameni s palbociklibem, byly průjem (26,1 % vs. 19,4 %), kašel (25 % vs. 19,4 %) a stomatitida (15,3 % vs. 5,9 %). Nežádoucí účinky jsou dobře zvládnutelné podpůrnou léčbou a eventuální redukcí dávky. V průběhu terapie bylo zaznamenáno 10 úmrtí v rameni s palbociklibem a čtyři úmrtí v rameni s placebem. V případě jednoho úmrtí v rameni s palbociklibem byla zvažována souvislost se studijní medikací [12]. Nežádoucí účinky popsané v dalších sledováních (PALOMA 2 a PALOMA 3) měly podobnou frekvenci výskytu [11].
Lékové interakce
Palbociklib je primárně metabolizován CYP3A a sulfotransferázovým enzymem SULT2A1. Je třeba se proto podle doporučení SÚKL vyvarovat souběžného používání silných inhibitorů CYP3A, mezi něž patří mimo jiné klaritromycin, indinavir, itrakonazol, ketokonazol, lopinavir/ritonavir, nefazodon, nelfinavir, posakonazol, sachinavir, telaprevir, telitromycin, vorikonazol a grapefruit nebo grapefruitová šťáva. Současně je třeba se vyvarovat souběžného používání silných induktorů CYP3A, mezi něž patří mimo jiné karbamazepin, enzalutamid, fenytoin, rifampicin a třezalka tečkovaná. Při souběžném podávání s palbociklibem může být nutné snížit dávku substrátů senzitivních CYP3A s úzkým terapeutickým indexem (např. cyklosporin, dihydroergotamin, everolimus, fentanyl, chinidin, sirolimus a takrolimus), protože palbociklib může zvyšovat riziko vzniku jejich nežádoucích účinků.
Těhotné nebo kojící pacientky nebyly v klinických studiích léčeny palbociklibem.
Závěr
Inhibitory Cdk4/6 se v současné době jeví jako nejúčinnější cílená léčba v kombinaci s terapií hormonální. K výhodám patří jejich dobrá tolerance, jež umožňuje zachování dobré kvality života během hormonální léčby. Palbociklib má aktuálně nejvíce publikovaných dat z klinických studií fáze III, jež jsou konzistentní napříč klinickými hodnoceními. Přidání palbociklibu k hormonální léčbě prodloužilo PFS přibližně dvojnásobně. Kombinace hormonální terapie s inhibitory Cdk4/6 se zřejmě stane novým standardem léčby u pacientek s metastatickým ER pozitivním HER2 negativním karcinomem prsu. Ačkoliv byl palbociklib registrován Evropskou lékovou agenturou (European Medicines Agency, EMA) již v listopadu 2016, u nás nemá zatím úhradu.
Seznam použité literatury
- [1] Ibrance (palbociclib). Souhrn údajů o přípravku. European Medicines Agency, listopad 2016. Dostupné na: http://www.ema.europa.eu/docs/cs_CZ/document_library/EPAR_‑_Product_Information/human/003853/WC500217196.pdf
- [2] Flaherty KT, Lorusso PM, Demichele A, et al. Phase I, dose‑escalation trial of the oral cyclin‑dependent kinase 4/6 inhibitor PD 0332991, administered using a 21‑day schedule in patients with advanced cancer. Clin Cancer Res 2012; 18: 568–576.
- [3] Fry DW, Harvey PJ, Keller PR, et al. Specific inhibition of cyclin‑dependent kinase 4/6 by PD 0332991 and associated antitumor activity in human tumor xenografts. Mol Cancer Ther 2004; 3: 1427–1438.
- [4] Choi YJ, Anders L. Signaling through cyclin D‑dependent kinases. Oncogene 2014; 33: 1890–1903.
- [5] Thangavel C, Dean JL, Ertel A, et al. Therapeutically activating RB: reestablishing cell cycle control in endocrinetherapy‑resistant breast cancer. Endocr Relat Cancer 2011; 18: 333–345.
- [6] Murphy CG, Dickler MN. The role of CDK4/6 inhibition in breast cancer. Oncologist 2015; 20: 483–490.
- [7] Schmidt M. Palbociclib – from bench to bedside and beyond. Breast Care (Basel) 2016; 11: 177–181.
- [8] Ruiz‑Garcia A, Plotka A, O’Gorman M, et al. Effect of food on the bioavailability of palbociclib. Cancer Chemother Pharmacol 2017; 79: 527–533.
- [9] Finn RS, Crown JP, Lang I, et al. The cyclin‑dependent kinase 4/6 inhibitor palbociclib in combination with letrozole versus letrozole alone as first‑line treatment of oestrogen receptor‑positive, HER2‑negative, advanced breast cancer (PALOMA‑1/TRIO‑18): a randomised phase 2 study. Lancet Oncol 2015; 16: 25–35.
- [10] Finn RS, Martin M, Rugo HS, et al. Palbociclib and letrozole in advanced breast cancer. N Engl J Med 2016; 375: 1925–1936.
- [11] Cristofanilli M, Turner NC, Bondarenko I, et al. Fulvestrant plus palbociclib versus fulvestrant plus placebo for treatment of hormone‑receptor‑positive, HER2‑negative metastatic breast cancer that progressed on previous endocrine therapy (PALOMA‑3): final analysis of the multicentre, double‑blind, phase 3 randomised controlled trial. See comment in PubMed Commons below Lancet Oncol 2016; 17: 425–439.
- [12] Finn RS, Crown JP, Ettl J, et al. Efficacy and safety of palbociclib in combination with letrozole as first‑line treatment of ER‑positive, HER2‑negative, advanced breast cancer: expanded analyses of subgroups from the randomized pivotal trial PALOMA‑1/TRIO‑18. Breast Cancer Res 2016; 18: 67.
- [13] Vidula N, Rugo SH. Cyclin‑dependent kinase 4/6 inhibitors for the treatment of breast cancer: a review of preclinical and clinical data. Clin Breast Cancer 2016; 16: 8–