Ponesimod
Souhrn
Kubala Havrdová E. Ponesimod. Remedia 2022; 32: 521–527.
Roztroušená skleróza (RS) patří mezi onemocnění, v jejichž patogenezi se uplatňují autoimunitní a imunopatologické mechanismy vedoucí ke ztrátě myelinu a axonů – k neurodegeneraci. Jde o nejčastější příčinu invalidity mladých nemocných z neurologické příčiny s prevalencí až 220/100 000 osob v závislosti na zeměpisné šířce či rase sledované populace. Léčba RS zaznamenala v posledních dvou dekádách akcelerovaný vývoj a je založena na podávání tzv. chorobu modifikujících léků (disease‑modifying drugs, DMDs), jejichž hlavním cílem je ovlivnění a zmírnění poškozujícího zánětu v centrálním nervovém systému, a tím oddálení progrese neurologického postižení. K modulaci tohoto poškozujícího zánětu u pacientů s RS jsou používány DMDs založené na různých mechanismech účinku. I když se mnoho let zdálo, že zásadním léčebným přístupem je ovlivnění T lymfocytů, posledních patnáct let ukázalo význam B lymfocytů v patogenezi onemocnění a efekt jejich ovlivnění cestou deplece. V letošním roce byl k paletě DMDs přidán další modulátor receptorů pro sfingosin‑1‑fosfát (S1P). Jeho selektivita pro S1P1 je výhodou pro spektrum nežádoucích účinků, titrace dávky na začátku podávání zlepšuje toleranci a odstraňuje nutnost kardiální monitorace, jeho biologický poločas umožňuje pružně reagovat při nutnosti lék vysadit jak před otěhotněním, tak z důvodu změny léčby. Hlavní předností tohoto nového přípravku v ČR je však jeho zařazení mezi léky první volby pro remitující RS.
Klíčová slova: roztroušená skleróza – ponesimod – sfingosin‑1‑fosfát.
Summary
Kubala Havrdova E. Ponesimod. Remedia 2022; 32: 521–527.
Multiple sclerosis (MS) belongs to the group of diseases in whose pathogenesis autoimmune and immunopathological mechanisms play crucial role, leading to the loss of myelin and axons, i.e. neurodegeneration. It is the most frequent cause of disability of young adults with prevalence up to 220/100,000 inhabitants depending on latitude or race. The treatment of MS has seen accelerated development in last two decades. It consists of administration of disease modifying drugs (DMDs). The main effect of these drugs is based on influencing and suppressing the damaging inflammation in the CNS, ensuring delayed progression of neurological disability. To modulate this damaging inflammation, DMDs with different mechanisms of action are used. For many years, the basic therapeutic approach aimed at suppressing T lymphocytes. Last fifteen years showed the importance of B cells in pathogenesis as well as in treatment via their depletion. This year, a new item enlarged our treatment armamentarium – another sphingosine‑1‑phosphate (S1P) receptor modulator. Its selectivity for S1P1 is an advantage associated with less side effects; dose titration in the first days of administration improves tolerance and decreases need for cardiac monitoring. Its biologic half‑life makes it possible to react flexibly if there is a need to stop treatment with ponesimod either because of pregnancy planning or because of treatment switch. However, the most important advantage in the Czech Republic is definitely its inclusion among the first line drugs.
Key words: multiple sclerosis – ponesimod – sphingosine‑1‑phosphate.
Úvod
Roztroušená skleróza (RS) je onemocnění, v jehož patogenezi se uplatňují autoimunitní a imunopatologické mechanismy namířené proti myelinu a axonům a vedoucí k jejich ztrátě – k neurodegeneraci. Léčba RS zaznamenala v posledních dvou dekádách akcelerovaný vývoj a je založena na podávání tzv. chorobu modifikujících léků (disease‑modifying drugs, DMDs). Jejich hlavním cílem je ovlivnění a zmírnění poškozujícího zánětu v centrálním nervovém systému (CNS) s následným oddálením progrese neurologického postižení [1,2]. K modulaci poškozujícího zánětu u pacientů s RS jsou používány DMDs s různým mechanismem účinku. Za zásadní léčebný přístup bylo dlouhou dobu považováno ovlivnění T lymfocytů, posledních patnáct let ukázalo význam B lymfocytů v patogenezi onemocnění a efekt jejich ovlivnění cestou deplece [3].
Léčivým přípravkem, který přichází na trh v letošním roce, je perorální ponesimod, modulátor sfingosin‑1‑fosfátového (S1P) receptoru. Sfingosin‑1‑fosfát je fosfolipid s mnoha fyziologickými rolemi a extracelulárně se váže na S1P1–S1P5 receptory. Tím dochází ke snížení jejich exprese, internalizaci lymfocytů v lymfatických tkáních a k redukci vyplavení autoreaktivních T lymfocytů do cirkulace a průniku do CNS [4].
Na rozdíl od stávajících modulátorů S1P receptorů se ponesimod selektivně a s vysokou afinitou (10krát vyšší než S1P) váže na S1P1 receptory exprimované na lymfocytech [5]. In vitro měřená účinnost S1P a ponesimodu na lidských receptorech S1P1, S1P2, S1P3, S1P4 a S1P5, hodnocená měřením aktivace G proteinu na ovariálních buňkách čínského křečka, prokázala, že ve vztahu k S1P je afinita ponesimodu k receptoru S1P1 4,4krát vyšší, a naopak afinita k receptoru S1P3 150krát nižší. Z toho lze vyvodit, že ponesimod je 650krát selektivnější pro S1P1 než pro S1P3 oproti přirozenému ligandu [6].
Farmakologická skupina
Ponesimod patří mezi selektivní imunosupresiva, ATC kód: L04AA50.
Ponesimod blokuje schopnost lymfocytů opustit lymfatické uzliny, čímž snižuje počty lymfocytů v periferní krvi. Mechanismus, jímž ponesimod vykazuje terapeutické účinky u RS, zahrnuje omezení migrace lymfocytů do CNS.
Nebyla prokázána cytotoxicita a kromě zadržení autoreaktivních imunitních buněk v lymfatických tkáních není vývoj imunitní odpovědi zasažen. Diferenciace T lymfocytů či humorální imunitní odpověď v případě virových infekcí není ponesimodem ovlivněna [7].
Chemické a fyzikální vlastnosti
Molekula, původně označovaná jako ACT‑128800, je analogem přirozeného sfingosinu. Sumární vzorec má podobu C23H25ClN2O4S, molekulová hmotnost se udává 460,97 g/mol. Strukturu ponesimodu znázorňuje obrázek 1. Oproti jiným modulátorům S1P receptorů není vazba na receptory podmíněna fosforylací molekuly [8].
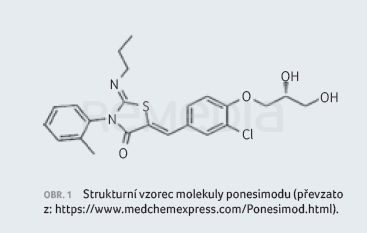
Ponesimod je bílý až světle nažloutlý prášek téměř nerozpustný nebo nerozpustný ve vodě.
Mechanismus účinku, farmakodynamika
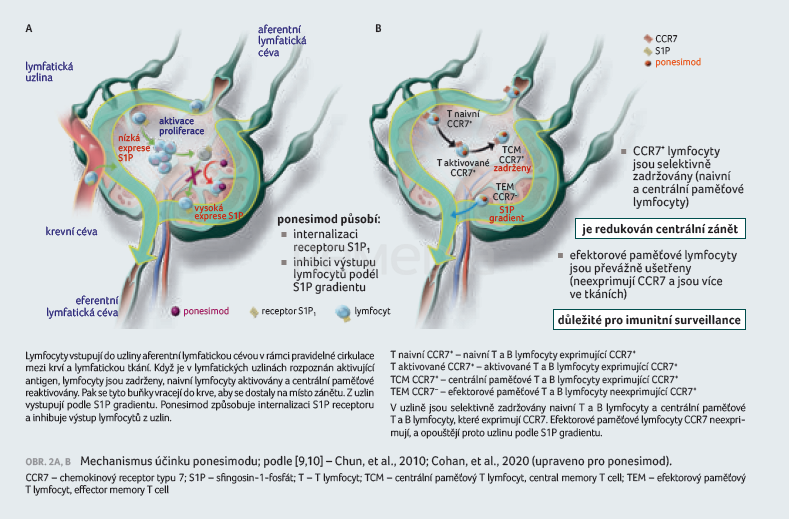
Ponesimod je modulátor receptoru pro S1P, který se s vysokou afinitou váže na receptor S1P nacházející se na lymfocytech a blokuje schopnost lymfocytů opouštět lymfatické uzliny, čímž snižuje počty lymfocytů v periferní krvi [7]. Mechanismus, jímž ponesimod vykazuje terapeutické účinky u RS, může zahrnovat omezení migrace lymfocytů do CNS (obr. 2A, B) [9,10]. Léčba ponesimodem působí na dávce závislý pokles počtu periferních lymfocytů na 30–40 % výchozích hodnot. Po sedmi denních 20mg dávkách byl zaznamenán nejvyšší pokles absolutní střední hodnoty počtu lymfocytů na 26 % výchozích hodnot (650 buněk/µl) pozorovaný šest hodin po podání dávky [7]. Časový průběh redukce podskupin lymfocytů byl srovnatelný pro většinu podskupin. T lymfocyty (včetně pomocných, cytotoxických a regulačních) byly silně ovlivněny, přičemž aktivované T lymfocyty byly zasaženy více než paměťové T buňky. Počet B lymfocytů byl rovněž ovlivněn, ale nepatrně méně než T lymfocyty. Některé typy buněk imunitního systému jako NK buňky (CD3–16+) a CD8+CD25+ regulační T lymfocyty ponesimodem ovlivněny nebyly [5].
Dávkování, léková forma, způsob podání
Ponesimod se podává jednou denně perorálně v dávce 20 mg. V prvních dvou týdnech se léčba musí zahájit 14denním titrovacím balením k eliminaci nežádoucích účinků [11]. Léčba začíná podáním 2mg tablety a zvyšování dávky postupuje podle předem daného titračního schématu v balení. Patnáctý den je podána již plná dávka. Pokud během léčby dojde k vynechání čtyř a více dávek, musí být opět zahájena léčba titračním balením dle titračního schématu. Lék lze podávat během jídla i mimo ně.
Data k léčbě pacientů mladších 18 let a starších 65 let nejsou k dispozici [7].
Farmakokinetika
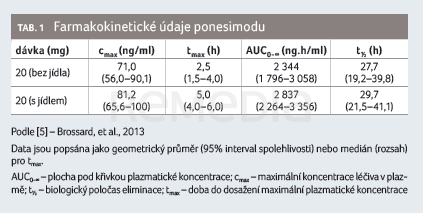
Farmakokinetika ponesimodu je u zdravých subjektů a subjektů s RS podobná a je charakterizována dvoukompartmentovým modelem se zpožděnou absorpcí a lineární eliminací [7,12]. Farmakokinetické parametry ponesimodu jsou uvedeny v tabulce 1 [5]. Podání více dávek ponesimodu indikovalo na dávce závislé zvýšení plazmatických koncentrací a bylo charakterizováno dosažením ustáleného stavu za pět dní po podání [4]. Na základě klinických farmakologických studií není potřebná úprava dávky u pacientů s mírnou až závažnou poruchou funkce ledvin. Výsledky populační farmakokinetické analýzy ukázaly, že věk (rozmezí 17–65 let) nemá významný vliv na farmakokinetiku léčiva. Ponesimod nebyl zkoumán u starší populace (> 65 let). Doba do dosažení maximálních plazmatických koncentrací ponesimodu je 2–4 hodiny po podání dávky. Absolutní biologická dostupnost perorální 10mg dávky je 83,8 %. Potrava nemá na farmakokinetiku ponesimodu klinicky relevantní dopad, proto lze lék užívat s jídlem nebo mimo jídlo. Ponesimod se silně váže na plazmatické proteiny (> 99 %) a je převážně (78,5 %) distribuován v plazmatické frakci celé krve. Studie na zvířatech ukazují, že ponesimod snadno prostupuje hematoencefalickou bariérou. U lidí se před vyloučením rozsáhle metabolizuje, ačkoliv v plazmě byl hlavní cirkulující složkou nezměněný ponesimod. V lidské plazmě byly rovněž identifikovány dva neaktivní cirkulující metabolity – M12 a M13. Oba metabolity jsou při koncentracích dosahovaných terapeutickými dávkami ponesimodu na receptorech S1P neaktivní. Vyšetření in vitro naznačují, že při terapeutické dávce 20 mg jednou denně ponesimod ani jeho metabolit M13 nevykazují žádný klinicky relevantní potenciál lékových interakcí pro enzymy cytochromu P450 (CYP) nebo uridindifosfát‑glukuronyltransferázy (UGT) ani pro transportéry. Po jednorázovém intravenózním podání je celková clearance ponesimodu 3,8 l/h. Eliminační poločas po perorálním podání je přibližně 33 hodin. Po jednorázovém perorálním podání 14C (radiouhlíkem značeného) ponesimodu se 57–80 % dávky vyloučilo stolicí (16 % jako nezměněný ponesimod) a 10–18 % močí (žádný nezměněný ponesimod) [7].
Klinické zkušenosti
Studie fáze II
Optimální dávka ponesimodu byla zkoumána ve studii fáze II, do níž bylo zařazeno 464 pacientů a bylo jim podáváno 10 mg, 20 mg, 40 mg ponesimodu nebo placebo po dobu 24 týdnů [13]. Zařazování do studie probíhalo v letech 2009–2010. Primárním cílovým ukazatelem byl kumulativní počet nových gadolinium enhancujícíh lézí na T1 vážených obrazech, které byly hodnoceny každé čtyři týdny mezi 12.–24. týdnem. Sekundárními cílovými ukazateli byly roční počet relapsů (annualized relapse rate, ARR) a doba do potvrzeného relapsu. Vstupní kritéria se příliš nelišila od vstupních kritérií jiných klinických studií s DMDs. Věk zařazených osob byl v rozmezí 18–55 let, pacienti museli naplnit definici relabující‑remitující formy RS dle McDonaldových kritérií, s hodnotou na škále disability (Expanded Disability Status Scale, EDSS) 0–5,5, museli prodělat nejméně jeden relaps v posledním roce nebo dva relapsy v posledních dvou letech před zařazením do studie a na magnetické rezonanci (MRI) musela být přítomna nejméně jedna aktivní léze vychytávající gadolinium. Průměrný věk pacientů byl přibližně 36 let a doba trvání onemocnění v rozmezí 6,7–8 let, průměrná hodnota EDSS byla 2,2.
Studii dokončilo 393 pacientů. Primární cílový ukazatel – průměrný kumulativní počet nových gadolinium vychytávajících T1 lézí – byl u placebové skupiny 6,2, u skupiny léčené 10 mg ponesimodu 3,5, což znamenalo 43% pokles, u skupiny léčené 20 mg ponesimodu 1,1 (83% pokles oproti placebu) a u skupiny léčené 40 mg ponesimodu 1,4 (77% pokles oproti placebu). Došlo rovněž ke snížení ARR a k prodloužení doby do výskytu prvního relapsu oproti placebu u všech hodnocených dávek.
Pokles počtu lymfocytů byl závislý na dávce a k průměrnému poklesu došlo u 10mg dávky po osmi dnech léčby (o 43–45 %), při navýšení dávky na 20 mg byl zaznamenán další pokles a po 15 dnech činil průměrný pokles počtu lymfocytů 62 %. Při titraci dávky na 40 mg byl zjištěn pouze další mírný pokles – o 67 % po čtyřech týdnech léčby. Průměrný pokles počtu lymfocytů byl oproti výchozím hodnotám během 24 týdnů sledování 50 % pro dávku 10 mg, 65 % pro dávku 20 mg a 69 % pro dávku 40 mg ponesimodu. Počty lymfocytů se vracely k původní hodnotě v průběhu týdne po přerušení podávání ponesimodu.
Většina nežádoucích účinků v této studii byla mírného nebo středně závažného charakteru a výskyt byl srovnatelný ve všech sledovaných skupinách léčených ponesimodem (73,9–77,2 %) i placebem (74,4 %). Mezi nežádoucí účinky s vyšší incidencí u skupin léčených ponesimodem patřily úzkost, závrať, dušnost, zvýšení hodnot jaterních enzymů (alaninaminotransferáza, ALT), chřipka, nespavost a periferní edém [13].
Pacienti, kteří dokončili studii fáze II, měli možnost pokračovat v extenzi klinického hodnocení [14]. Extenze byla rozdělena do tří etap: pacienti, kteří dostávali aktivní látku, pokračovali dále v jejím užívání; pacienti, kteří dostávali placebo, byli randomizováni k podávání tří různých sil ponesimodu. Po první etapě trvající 96 týdnů byli všichni pacienti, kteří dostávali ponesimod v dávce 40 mg, převedeni na nižší terapeutickou dávku 10 mg nebo 20 mg. Během následné druhé etapy extenze byli i pacienti léčení 10mg dávkou ponesimodu převedeni na dávku 20 mg. Rozhodnutí bylo provedeno na základě nezávislé komise hodnotící studijní data s ohledem na malý terapeutický účinek 10mg dávky ponesimodu.
Délka trvání druhé a třetí etapy extenze studie fáze II byla 432 týdnů, celkem tato extenze trvala až 528 týdnů. Během uvedené studie byla jako nejoptimálnější pro průkaz dostatečné účinnosti potvrzena 20mg dávka ponesimodu a po dobu klinického hodnocení nebyl zjištěn žádný nový bezpečnostní signál [14].
Studie fáze III
Výsledky studie fáze II byly potvrzeny multicentrickou randomizovanou studií fáze III OPTIMUM (Oral Ponesimod Versus Teriflunomide In Relapsing Multiple Sclerosis) [15]. Účinek ponesimodu v denní dávce 20 mg byl porovnáván s teriflunomidem podávaným v denní dávce 14 mg. Studie trvala 108 týdnů a bylo do ní zařazeno 1 133 pacientů. Pro mitigaci nežádoucích účinků, známých u jiných modulátorů S1P receptorů, byla v průběhu prvních 14 dní provedena u pacientů titrace na cílovou terapeutickou denní dávku [11].
Primárním cílovým ukazatelem v této studii byl ARR, sekundárními cílovými ukazateli změna příznaků a míra únavy hodnocené pomocí dotazníku Fatigue Symptoms and Impact Questionnaire – Relapsing Multiple Sclerosis (FSIQ–RMS) [16], dále kumulativní počet aktivních lézí na MRI (combined active unique lesions, CUAL) a doba do 12týdenní a 24týdenní progrese postižení (confirmed disability accumulation, CDA).
Součástí studie bylo rovněž hodnocení bezpečnosti a snášenlivosti, parametry atrofie mozkového parenchymu, koncept NEDA‑3 a NEDA‑4 (stav bez známek onemocnění, no evidence of disease activity) byly hodnoceny explorativně.
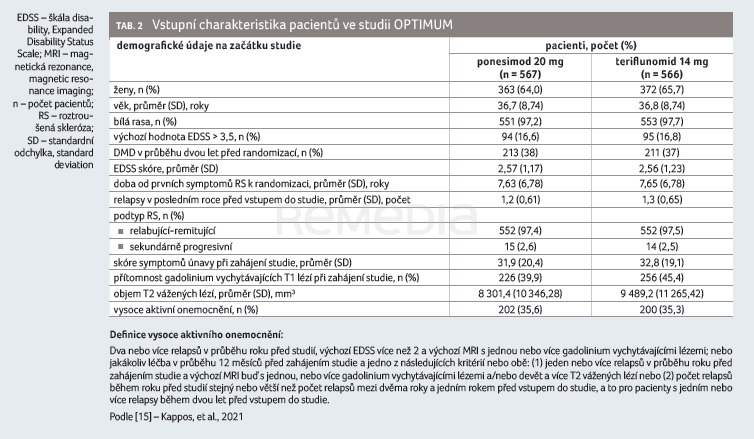
Zařazovací kritéria do této registrační studie byla stejná jako u studie fáze II, vstupní charakteristiky byly rovněž podobné a vyvážené vzhledem k oběma sledovaným skupinám, pouze vstupní hodnota EDSS byla ve studii fáze III vyšší oproti studii fáze II: 2,56 pro teriflunomid a 2,57 pro ponesimod (tab. 2) [15].
Studii dokončilo 83,1 % pacientů léčených ponesimodem a 83,6 % pacientů léčených teriflunomidem. Roční počet relapsů během studie byl významně nižší u pacientů léčených ponesimodem: 0,202 (95% interval spolehlivosti [CI] 0,173–0,235) ve srovnání se skupinou léčenou teriflunomidem (0,290; 95% CI 0,254–0,331; poměr četnosti výskytu [RR] 0,695; p < 0,001).
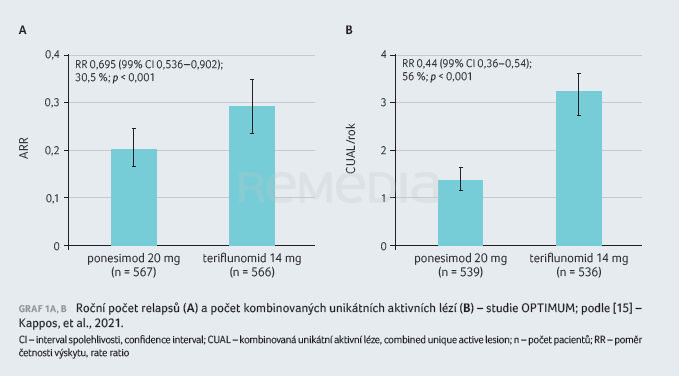
Sekundární cílový ukazatel v podobě změny příznaků souvisejících s únavou prokázal statistickou superioritu ve stabilizaci příznaků spojených s únavou vůči dávce 14 mg teriflunomidu od počátku studie do 108. týdne, hodnoceno pomocí skóre z dotazníku FSIQ‑RMS. Na základě vyšetření MRI bylo potvrzeno, že ponesimod snížil průměrný kumulativní počet aktivních lézí od počátku studie do 108. týdne ve srovnání s teriflunomidem o 56 % (1,405 vs. 3,164; RR 0,444; 95% CI 0,364–0,542; p < 0,001), tabulka 3, graf 1A, B [15].
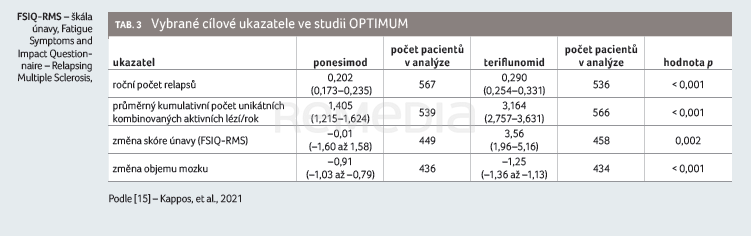
Výsledky v případě dalšího sekundárního cílového ukazatele – doby do potvrzené 12týdenní a 24týdenní progrese postižení – nebyly mezi oběma rameny statisticky významné. Příčinami tohoto výsledku mohou být vysoký podíl pacientů s nízkým vstupním EDSS a celkově velmi nízká progrese EDSS u obou studijních ramen. Prokázání účinnosti v uvedeném ukazateli by pravděpodobně vyžadovalo delší trvání studie a větší počet sledovaných pacientů, zvlášť pokud jsou srovnávány dvě účinné látky. Teriflunomid, jak známo, vykazoval v tomto ukazateli silný benefit oproti placebu ve svých registračních klinických studiích, a to na rozdíl od prvoliniových injekčních léků. Následné cílové ukazatele měly proto explorativní charakter. Ztráta objemu mozkového parenchymu byla ve 108. týdnu u skupiny léčené ponesimodem o 0,34 % nižší ve srovnání se skupinou léčenou teriflunomidem (p < 0,001). Stavu NEDA‑3 ve 108. týdnu bylo dosaženo u 25,0 % léčených ponesimodem a u 16,4 % léčených teriflunomidem (p < 0,001). Nejčastějším důvodem nedosažení NEDA‑3 byly nové nebo zvětšující se T2 léze.
Zařazení do současných léčebných strategií
Ponesimod představuje první modulátor S1P receptoru, který je v České republice možno podávat v první linii léčby, a to i v případě, že nejsou přítomny ukazatele nepříznivé prognózy. Jedná se o lék s vyšší účinností oproti dosavadním přípravkům, jimiž je v ČR léčba běžně zahajována. Dostupná data z klinické praxe, tedy z řady registrů, ukazují zcela jasně, jak se prognóza pacienta s RS mění včasným zavedením účinné léčby [17]. Je to v souladu s patogenetickými poznatky o nutnosti omezit zánět v době, kdy jsou ještě v CNS dostatečné rezervy. Ponechávání vysoce účinné léčby až na dobu, kdy je patrná neúčinnost léčby základní, je hazardováním s osudem pacienta, protože nelze navrátit, co už je v CNS ztraceno. Již první modulátor S1P receptoru byl odlišně schválen Evropskou lékovou agenturou (EMA) a některými jinými státy (Švýcarsko, Spojené státy americké, Austrálie), kde bylo umožněno jeho použití v první linii. Obavy z masivního výskytu nežádoucích účinků se nepotvrdily. Máme‑li tedy možnost změnit prognózu našich pacientů, je ponesimod velmi dobrým nástrojem. Ve skutečnosti podání léku, který ovlivňuje prognózu pacienta, má rovněž lepší farmakoekonomickou návratnost, protože nemocného udrží delší dobu v pracovním procesu a s lepší kvalitou života. Český registr pacientů s RS ReMuS ukazuje, že více než polovina pacientů léčených biologickou léčbou pracuje na plný úvazek. Tato čísla lze v budoucnu ještě zlepšit, neboť i tak je v ČR stále ještě příliš mnoho pacientů, kteří jsou velmi dlouho léčeni nejstaršími léky první volby a dochází u nich k tzv. tiché progresi (silent progression) [18], protože jejich zánět, kompartmentalizovaný za hematoencefalickou bariérou, nelze takovými léky dostatečně ovlivnit.
Pokud se ponesimodem nepodaří aktivitu nemoci utlumit, lze přejít na jakýkoliv eskalační lék – u deplečních terapií je však nutno vyčkat dosažení normálního počtu lymfocytů (tedy alespoň 0,8 × 109/l).
Indikace
Dle Souhrnu údajů o přípravku (SPC) je ponesimod indikován k léčbě dospělých pacientů s relabujícími formami RS s aktivním onemocněním definovaným klinickými nebo zobrazovacími metodami [7]. V rámci úhradových kritérií se ponesimod řadí mezi prvoliniové léky, kdy je možné jej nasadit pacientům s potvrzenou diagnózou RS dle McDonaldových kritérií s invaliditou nepřesahující skóre EDSS 5, u nichž je přítomna vysoká aktivita nemoci (jeden dokumentovaný a léčený relaps v předchozím roce nebo dva dokumentované a léčené relapsy v předchozích dvou letech).
Kontraindikace
Kontraindikacemi podání ponesimodu jsou hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku a imunodeficitní stavy. Ponesimod nemohou užívat pacienti, kteří během posledních šesti měsíců prodělali infarkt myokardu, nestabilní anginu pectoris, cévní mozkovou příhodu, tranzitorní ischemickou ataku, dekompenzované srdeční selhání vyžadující hospitalizaci nebo srdeční selhání třídy III nebo IV podle klasifikace New York Heart Association (NYHA), a pacienti, kteří mají atrioventrikulární blokádu druhého stupně Möbitzova typu II, atrioventrikulární blokádu třetího stupně nebo sick sinus syndrom, pokud nemocný nemá funkční kardiostimulátor. Dalšími kontraindikacemi jsou závažné aktivní infekce, aktivní chronické infekce, aktivní malignity a středně závažná nebo závažná porucha funkce jater (Childova–Pughova třída B, resp. C). Ponesimod by neměl být užíván během těhotenství a u žen ve fertilním věku, které nepoužívají účinnou antikoncepci [7].
Nežádoucí účinky
Nejčastěji hlášenými nežádoucími účinky jsou nazofaryngitida (19,7 %), zvýšení hodnot ALT (17,9 %) a infekce horních cest dýchacích (11 %) [7].
Bradyarytmie
V klinických studiích se bradykardie (srdeční frekvence < 50/min během prvního dne léčby) vyskytla u 5,8 % pacientů léčených ponesimodem v porovnání s 1,6 % pacientů léčených teriflunomidem v dávce 14 mg. Pacienti, kteří měli bradykardii, byli obecně asymptomatičtí. Bradykardie u všech pacientů vymizela bez intervence a nevyžadovala ukončení léčby ponesimodem [11].
Infekce
Celková míra infekcí byla mezi pacienty léčenými ponesimodem a pacienty léčenými teriflunomidem v dávce 14 mg srovnatelná (54,2 % vs. 52,1 %, v uvedeném pořadí). U pacientů léčených ponesimodem byly častější nazofaryngitida a virové infekce. Zahájení léčby ponesimodem má být odloženo u pacientů se závažnou aktivní infekcí, dokud není vyřešena.
Během klinických studií byly při léčbě ponesimodem hlášeny případy herpetické infekce. Pacienty, kteří neprodělali infekci virem varicella zoster (VZV) a mají neúplné očkování, je potřeba před zahájením léčby ponesimodem na VZV protilátky testovat a u osob negativních na protilátky se doporučuje kompletní očkování vakcínou proti VZV [7].
Oportunní infekce
Kryptokokové infekce a progresivní multifokální leukoencefalopatie byly hlášeny u jiných modulátorů S1P receptoru a je potřeba vést tato rizika v patrnosti. Při podezření na výskyt jakékoliv oportunní infekce je nutno léčbu ponesimodem přerušit, dokud se podezření nevyloučí. V případě potvrzení je nutno zahájit příslušnou léčbu daného onemocnění [7].
Snížení počtu lymfocytů
Pokles počtu periferních lymfocytů je závislý na dávce a během prvních několika týdnů se dostává počet lymfocytů v periferní krvi na 30–40 % výchozích hodnot v důsledku reverzibilní sekvestrace lymfocytů v lymfoidních tkáních. Ponesimod může proto zvyšovat riziko rozvoje infekcí.
V registrační studii mělo 3,2 % pacientů léčených ponesimodem v porovnání s žádným z pacientů léčených teriflunomidem v dávce 14 mg počty lymfocytů nižší než 0,2 × 109/l, přičemž hodnoty se obvykle během léčby ponesimodem vrátily na více než 0,2 × 109/l. Pokud absolutní počty lymfocytů klesnou pod 0,2 × 109/l, má být léčba ponesimodem přerušena do doby, dokud tyto počty nedosáhnou více než 0,8 × 109/l, kdy je možné zvážit opětovné zahájení léčby tímto přípravkem. Po přerušení léčby dochází k návratu hodnot lymfocytů k normálu do jednoho týdne [7].
Makulární edém
Ponesimod zvyšuje riziko rozvoje makulárního edému. V rámci klinických studií se makulární edém vyskytl u 0,7 % pacientů, i když u většiny nemocných byl spojen s jinými rizikovými faktory a komorbiditami. Výskyt se většinou vázal na prvních šest měsíců léčby. U všech pacientů se doporučuje vyšetření očního pozadí včetně makuly před zahájením léčby ponesimodem a znovu kdykoliv, pokud nemocný během léčby ponesimodem ohlásí nějakou změnu vidění [7].
Zvýšení hodnot jaterních enzymů
Během registrační studie došlo ke zvýšení aktivity ALT na trojnásobek a pětinásobek horní hranice normálu (ULN) u 17,3 %, resp. u 4,6 % pacientů léčených ponesimodem. K osminásobnému zvýšení hodnoty ALT nad ULN došlo u 0,7 % pacientů léčených ponesimodem. Většina vzestupů byla zaznamenána během šesti nebo 12 měsíců po zahájení léčby. V klinických hodnoceních byla léčba ponesimodem přerušena, pokud zvýšení přesáhlo trojnásobek ULN a pacienti vykazovali příznaky související s dysfunkcí jater. Hodnoty ALT se po přerušení léčby ponesimodem vrátily k normálu [7].
Respirační účinky
U pacientů léčených ponesimodem bylo pozorováno na dávce závislé snížení jednovteřinové vitální kapacity (FEV1) a snížení difuzní kapacity plic pro oxid uhelnatý (DLCO), k čemuž docházelo většinou v prvním měsíci po zahájení léčby. Respirační příznaky související s léčbou ponesimodem lze zvrátit podáváním krátkodobě působících beta2 agonistů, většinou ale není žádný klinický korelát [7].
Kožní novotvary
Ve studijním programu se při léčbě ponesimodem vyskytl jeden případ maligního melanomu a dva případy bazocelulárního karcinomu. Riziko kožních novotvarů je známo při léčbě jiným modulátorem S1P receptoru, proto se doporučuje obezřetnost při léčbě a při souběžném vystavování slunečnímu záření bez ochranných prostředků [7].
Vakcinace
Pro aplikaci vakcín při léčbě ponesimodem jsou k dispozici pouze omezené informace. Vakcíny mohou být během léčby ponesimodem méně účinné. Podání živých atenuovaných vakcín se nedoporučuje. V případě nutnosti je potřeba přerušit léčbu ponesimodem jeden týden před aplikací vakcíny a léčbu opět zahájit čtyři týdny po podání vakcíny [7].
Společností Janssen byl v extenzi studie fáze II studován ponesimod u pacientů po podání různých typů vakcín proti onemocnění covid‑19. Většina pacientů byla schopna vyvinout postvakcinační humorální odpověď [19].
Lékové interakce
Ponesimod nebyl studován v kombinaci s jinými imunomodulačními, imunosupresivními ani cytostatickými přípravky. Ponesimod nebyl studován u pacientů, kteří užívají přípravky na prodloužení QT intervalu, snížení srdeční frekvence či jiná antiarytmika.
Současné podávání ponesimodu s perorální hormonální antikoncepcí nevykázalo žádné klinicky relevantní farmakokinetické interakce s ponesimodem [20].
Před vyloučením dochází k metabolizaci ponesimodu. V plazmě se nachází jak nezměněný ponesimod, tak i jeho neaktivní metabolity. K metabolizaci ponesimodu dochází prostřednictvím několika různých enzymatických systémů, včetně několika enzymů CYP (CYP2J2, CYP3A4, CYP3A5, CYP4F3A a CYP4F12), UGT (zejména UGT1A1 a UGT2B7) a oxidačních enzymů mimo skupinu CYP450, aniž by některý ze způsobů dominoval. Ve studiích in vitro nebyly prokázány klinicky relevantní lékové interakce s jinými léčivými přípravky metabolizovanými enzymatickou cestou CYP, UGT nebo jinými metabolizujícími enzymy. Léčivé přípravky, které inhibují enzymy ze skupiny CYP nebo UGT, neovlivnily farmakokinetiku ponesimodu.
Těhotenství a kojení
Před zahájením léčby ponesimodem u žen ve fertilním věku musí být k dispozici negativní výsledek těhotenského testu. Vzhledem k tomu, že byla u zvířat prokázána reprodukční toxicita, je podávání ponesimodu v průběhu těhotenství kontraindikováno. Jelikož trvá přibližně jeden týden, než se ponesimod vyloučí z těla, mají ženy ve fertilním věku používat účinnou antikoncepci k zabránění otěhotnění během léčby ponesimodem a jeden týden po jejím ukončení. Po přerušení léčby ponesimodem je potřeba brát zřetel na možnou reaktivaci onemocnění [7].
Při zjištění těhotenství je nutno léčbu ponesimodem okamžitě ukončit a tuto situaci obratem nahlásit ošetřujícímu neurologovi.
Závěr
Ponesimod je v tuto chvíli jedním ze tří léků, které ze skupiny vysoce efektivní léčby můžeme v České republice použít hned po stanovení jisté diagnózy roztroušené sklerózy, čímž narůstá pravděpodobnost lepší prognózy pro nově diagnostikované pacienty. Efekt léku, jeho snášenlivost i profil nežádoucích účinků odpovídají skupině sfingosin‑1‑fosfátových modulátorů, management této léčby je však jednodušší, než tomu bylo dosud. Preskripce léku je omezena na centra vysoce specializované péče pro RS a NMOSD, což odpovídá nutnosti pečlivé a edukované farmakovigilance během léčby.
Literatura
[1] Havrdová E, et al. Roztroušená skleróza. Praha: Mladá fronta, 2013, 485 s.
[2] Absinta M, Lassmann H, Trapp BD. Mechanisms underlying progression in multiple sclerosis. Curr Opin Neurol 2020; 33: 277–285.
[3] Krejsek J, Andrýs C, Krčmová I. Imunologie člověka. Hradec Králové: Garamon, 2016, 496 s.
[4] Brossard P, Scherz M, Halabi A, et al. Multiple‑dose tolerability, pharmacokinetics, and pharmacodynamics of ponesimod, an S1P1 receptor modulator: favorable impact of dose up‑titration. J Clin Pharmacol 2014; 54: 179–188.
[5] Brossard P, Derendorf H, Xu J, et al. Pharmacokinetics and pharmacodynamics of ponesimod, a selective S1P1 receptor modulator, in the first‑in‑human study. Br J Clin Pharmacol 2013; 76: 888–896.
[6] Piali L, Froidevaux S, Hess P, et al. The selective sphingosine 1‑phosphate receptor 1 agonist ponesimod protects against lymphocyte‑mediated tissue inflammation. J Pharmacol Exp Ther 2011; 337: 547–556.
[7] Souhrn údajů o přípravku Ponvory. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/ponvory‑epar‑product‑information_cs.pdf
[8] Bolli MH, Abele S, Binkert C, et al. 2‑imino‑thiazolidin‑4‑one derivatives as potent, orally active S1P1 receptor agonists. J Med Chem 2010; 53: 4198–4211.
[9] Chun J, Hartung HP. Mechanism of action of oral fingolimod (FTY720) in multiple sclerosis. Clin Neuropharmacol 2010; 33: 91–101.
[10] Cohan S, Lucassen E, Smoot K, et al. Sphingosine‑1‑Phosphate: Its Pharmacological Regulation and the Treatment of Multiple Sclerosis: A Review Article. Biomedicines 2020; 8: 227.
[11] Lott D, Lehr T, Dingemanse J, Krause A. Modeling Tolerance Development for the Effect on Heart Rate of the Selective S1P1 Receptor Modulator Ponesimod. Clin Pharmacol Ther 2018; 103: 1083–1092.
[12] Krause A, Brossard P, D’Ambrosio D, Dingemanse J. Population pharmacokinetics and pharmacodynamics of ponesimod, a selective S1P1 receptor modulator. J Pharmacokinet Pharmacodyn 2014; 41: 261–278.
[13] Olsson T, Boster A, Fernández Ó, Freedman MS, et al. Oral ponesimod in relapsing‑remitting multiple sclerosis: a randomised phase II trial. J Neurol Neurosurg Psychiatry 2014; 85: 1198–1208.
[14] Freedman MS, Pozzilli C, Kubala Havrdova E, et al.; Ponesimod Phase II Study Group. Long‑term Treatment With Ponesimod in Relapsing‑Remitting Multiple Sclerosis: Results From Randomized Phase 2b Core and Extension Studies. Neurology 2022; 99: e762–e774.
[15] Kappos L, Fox RJ, Burcklen M, et al. Ponesimod Compared With Teriflunomide in Patients With Relapsing Multiple Sclerosis in the Active‑Comparator Phase 3 OPTIMUM Study: A Randomized Clinical Trial. JAMA Neurol 2021; 78: 558–567.
[16] Hudgens S, Schüler R, Stokes J, et al. Development and Validation of the FSIQ‑RMS: A New Patient‑Reported Questionnaire to Assess Symptoms and Impacts of Fatigue in Relapsing Multiple Sclerosis. Value Health 2019; 22: 453–466.
[17] He A, Merkel B, Brown JWL, et al.; MSBase study group. Timing of high‑efficacy therapy for multiple sclerosis: a retrospective observational cohort study. Lancet Neurol 2020; 19: 307–316.
[18] Cree BAC, Hollenbach JA, Bove R, et al.; University of California, San Francisco MS‑EPIC Team. Silent progression in disease activity‑free relapsing multiple sclerosis. Ann Neurol 2019; 85: 653–666.
[19] Wong J, Hertoghs N, Lemle A, et al. COVID‑19 vaccine antibody response in RMS patients treated with ponesimod: results from the long‑term extension study AC‑058B202. Poster presented at: Consortium of Multiple Sclerosis Centers (CMSC) Annual Meeting; June 1–4, 2022; National Harbor, Maryland.
[20] Reyes M, Brossard P, Chassard D, et al. Effects of ponesimod, a selective S1P1 receptor modulator, on the pharmacokinetics of a hormonal combination contraceptive. Eur J Clin Pharmacol 2014; 70: 287–293.