Reslizumab
Souhrn:
Novosad J, Krčmová I. Reslizumab. Remedia 2019; 29: 169–174.
Reslizumab je monoklonální protilátka (IgG4κ) namířená proti interleukinu 5, která je indikována jako přídatná léčba u dospělých pacientů s těžkým eozinofilním astmatem (definovaným zejména počtem eozinofilů v periferní krvi ≥ 400/μl) nedostatečně kontrolovaným i přes užívání vysokých dávek inhalačních kortikosteroidů a dalšího léčiva určeného pro kontrolu astmatu (zejména dlouhodobě působících ß2 agonistů). Interleukin 5 je klíčový cytokin zodpovědný za diferenciaci, zrání, migraci a aktivaci lidských eozinofilů a omezením jeho působení vlivem reslizumabu je zkráceno přežívání a snížena aktivita eozinofilů. Bylo prokázáno, že při léčbě dochází k rychlému poklesu jejich počtu jak v periferní krvi, tak v indukovaném sputu a následně i k ovlivnění průběhu onemocnění zejména ve smyslu zvýšení kvality života, redukce výskytu těžkých exacerbací a tím i k redukci spotřeby systémově užívaných kortikosteroidů (a nepřímo také ke zmírnění výskytu nežádoucích účinků spojených s jejich užíváním). Tato terapie je navíc považována za velmi bezpečnou a dobře tolerovanou.7
Summary:
Novosad J, Krcmova I. Reslizumab. Remedia 2019; 29: 169–174.
Reslizumab is a human monoclonal antibody (IgG4κ) against interleukin 5 indicated as an add‑on therapy in adult patients with severe eosinophilic asthma (defined particularly by eosinophil count of ≥ 400/μl), not sufficiently controlled by high doses of inhalation corticosteroids and another drug dedicated for asthma control (particularly long‑acting ß2 agonists). Interleukin 5 is a key cytokine responsible for differentiation, maturation, migration and activation of human eosinophils and limiting its effect with reslizumab shortens the survival and lowers the activation of eosinophils. It was proven that therapy with reslizumab leads to rapid decrease in their count in peripheral blood as well as in induced sputum. As a result, the disease course is influenced, particularly in terms of the quality of life, reduction of severe exacerbation rate together with the reduction of systemic corticosteroids use (and indirectly the reduction of adverse effects as a side effect of their use). This therapy is regarded as very safe and well tolerated.
Key words: biological therapy, eosinophilic asthma, eosinophils, interleukin 5
Farmakologická skupina
Reslizumab (Cinqaero) je řazen do ATC skupiny s označením Léčiva k terapii onemocnění spojených s obstrukcí dýchacích cest, jiná systémová léčiva (R03DX08).
Indikace
Reslizumab je indikován jako přídatná léčba u dospělých pacientů s těžkým eozinofilním astmatem, nedostatečně kontrolovaným, se sklonem k těžkým exacerbacím i přes užívání vysokých dávek inhalačních kortikosteroidů a dalšího léčiva určeného pro kontrolu astmatu (zejména dlouhodobě působících ß2 agonistů ‒ long acting ß2 agonists, LABA). Bronchiální astma je heterogenní onemocnění dýchacích cest charakterizované zpravidla přítomným chronickým zánětem a remodelací průdušek, která je spojena s jejich hyperreaktivitou a variabilní, často reverzibilní obstrukcí. Těžká exacerbace je dále definována jako akutní zhoršení klinického průběhu základního onemocnění vyžadující zahájení terapie systémovými kortikosteroidy či navýšení jejich dávky na tři a více dní [1].
Základní pilíře terapie astmatu se opírají o léčbu zánětu a léčbu obstrukce, přičemž protizánětlivá léčba je jednoznačně dominující modalitou. Její kořeny v podobě systémové kortikoterapie sahají již do padesátých let 20. století [2]. Od sedmdesátých let byly postupně nahrazovány inhalační formou [3], čímž byla významně zvýšena jejich účinnost a bezpečnost. Naneštěstí se však časem ukázalo, že u jistého procenta astmatiků se onemocnění nedaří uvést pod kontrolu ani při využití vysokých dávek inhalačních kortikosteroidů s dalšími přídatnými medikamenty (zejména LABA), a je nutno zahájit léčbu kortikosteroidy i perorálně. Dle mezinárodních doporučení (zejména doporučení Světové iniciativy pro astma – Global Initiative for Asthma, GINA [4]) je však již u některých těchto nemocných indikováno zahájení léčby reslizumabem či dalšími biologiky ještě před začátkem trvalé systémové kortikoterapie s cílem omezit její nežádoucí dopad či se jí zcela vyhnout. Podmínkou však je detailní analýza příčinných mechanismů postižení dýchacích cest u daného pacienta.
Mechanismus účinku
Reslizumab je humanizovaná
monoklonální protilátka (IgG4κ) namířená proti
lidskému interleukinu 5 (IL 5), která svou specifickou vazbou
brání jeho interakci s příslušnými receptory na buněčném
povrchu. Interleukin 5 je klíčový cytokin zodpovědný
za diferenciaci, zrání, migraci a aktivaci lidských
eozinofilů. Omezením jeho působení je zkráceno přežívání
a snížena aktivita eozinofilů (obr. 1).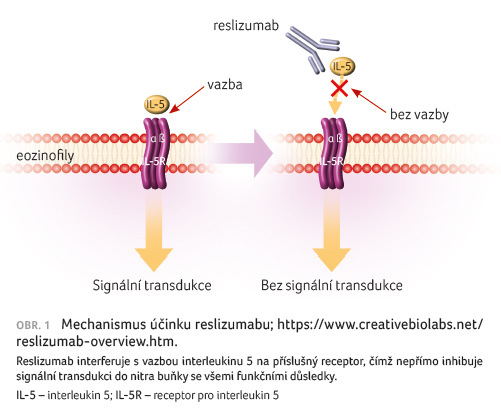
Role eozinofilů v imunopatologických procesech bronchiálního astmatu byla předmětem výzkumu po desítky let. První zprávy o významu této buněčné populace v souvislosti s klinickým průběhem onemocnění a jeho citlivostí k terapii glukokortikoidy pocházejí již z roku 1958 [5]. Jejich přítomnost však není prokazatelná u všech astmatiků [6], nicméně jsou li ve zvýšené míře zastoupeny v periferní krvi, v indukovaném sputu či v histologických preparátech sliznic dýchacích cest, definují specifický subtyp bronchiálního astmatu s unikátními charakteristikami klinickými, funkčními i strukturálními ‒ tzv. eozinofilní fenotyp [7].
Hlubší porozumění podstatě těchto nálezů přineslo až objevení základů regulace zánětlivé odpovědi pomocnými T lymfocyty (zejména jejich subsetů Th1 a Th2 lišících se spektrem produkovaných cytokinů) a principů alergické reaktivity ke konci osmdesátých let 20. století. Ve světle těchto nových poznatků byl postupně navržen dichotomický model patogeneze bronchiálního astmatu: slizniční zánět je buď kontrolován subsetem Th1 (s dominujícím cytokinem interferonem gama, IFNγ) a vykazuje charakteristiky tzv. neutrofilního či paucigranulocytárního astmatu (astma zpravidla nealergické), nebo je řízen subsetem Th2 (s převládající produkcí IL 4, IL 5 a IL 13), jenž derivuje zánětlivé procesy směrem eozinofilním či buněčně smíšeným (astma často alergické). Celý obraz byl o několik let později doplněn popisem dalších subsetů pomocných T lymfocytů (zejména Th17) a objevením (nebo přesněji řečeno detailnějším popisem) nové populace tzv. přirozených lymfoidních buněk (ILC). Jejich druhý typ (ILC2) se ukázal být významným zdrojem interleukinů v plicní tkáni (zejm. IL 5 a IL 13) [8], a to ještě vydatnějším než samotné Th2 lymfocyty, i bez restriktivních omezení nutnosti jejich interakce s alergenem prostřednictvím specifického receptoru T lymfocytů (TcR). Aktivita těchto buněk je proto daleko rychlejší a de facto nezávislá na přítomnosti alergie jako takové [9,10]. Naneštěstí však na rozdíl od Th2 lymfocytů ILC2 buňky vykazují značnou míru rezistence vůči konvenční protizánětlivé léčbě a nezřídka zhoršují průběh bronchiálního astmatu směrem ke kortikorezistenci (či kortikodependenci) doprovázené progresivní ztrátou plicních funkcí.
Zjednodušeně se tak schematické dělení zánětlivých fenotypů bronchiálního astmatu ustálilo na fenotypu non eozinofilním (nověji type 2 low) a eozinofilním (tedy type 2 high), u kterého je pak následně možné odlišit subfenotyp eozinofilní alergický (tedy Th2 high), resp. eozinofilní nealergický (ILC2 high). Tento přístup má velmi významné praktické konsekvence a je nezbytné takovou klasifikaci onemocnění provádět u všech astmatiků, a zejména pak u těch nemocných, jejichž onemocnění nelze uvést pod kontrolu konvenční terapií. U těchto pacientů je díky současným možnostem totiž nesmírně užitečné a vhodné zahájit fenotypově specifickou biologickou terapii ovlivňující imunopatologické procesy v dýchacích cestách ještě dříve, než dojde k jejich nevratnému poškození a potažmo i k rozvoji komplikací spojených zejména s opakovanou, či dokonce s trvalou systémovou kortikoterapií, která byla a je u těchto nemocných často nezbytná jako „ultimum refugium“.
Fenotypická klasifikace dovede do značné míry definovat pacienty trpící takovým typem bronchiálního astmatu, jenž může být citlivý vůči biologické terapii, která je dostupná v současné době a je namířena buď proti IL 5 (reslizumab, mepolizumab či benralizumab, většinou ILC2 high, eozinofilní nealergické astma), nebo proti imunoglobulinu E (omalizumab, zpravidla Th2 high, alergické eozinofilní astma). Tato léčba má obecně potenciál zvrátit zánětlivé procesy v plicní tkáni ovlivněním signalizace příslušných molekul a docílit tím omezení imunopatologického působení eozinofilů či alergických procesů závislých na přítomnosti imunoglobulinu E (IgE) ve sliznici dýchacích cest za současné redukce systémové kortikoterapie. To vede ke zmírnění jejich hyperreaktivity a s tím i souvisejícího výskytu těžkých exacerbací (definice viz výše) a potažmo ke zvýšení kvality života nemocných s minimem nežádoucích účinků. Dokladován byl i částečný efekt na zlepšení plicních funkcí. Přínos biologické léčby (ať už namířené proti IL 5, nebo proti IgE) na přirozený průběh onemocnění je stále nejasný.
Reslizumab byl registrován ke klinickému použití u pacientů s eozinofilním fenotypem bronchiálního astmatu jak ve Spojených státech amerických (Food and Drug Administration), tak v Evropě (European Medicines Agency) v roce 2016, podmínky úhrady z veřejného zdravotního pojištění doposud nebyly stanoveny.
Farmakodynamické účinky
Účinek na eozinofily ve sputu
Účinek reslizumabu u pacientů s astmatem a zvýšeným počtem eozinofilů ve sputu (nejméně 3 %) byl hodnocen v 15týdenní randomizované, dvojitě zaslepené, placebem kontrolované klinické studii fáze II s reslizumabem v dávce 3 mg/kg. Eozinofily ve sputu byly měřeny u podskupiny 38 dospělých pacientů na konci léčby. V této studii se ve skupině užívající reslizumab podíl eozinofilů ve sputu snížil oproti střední hodnotě výchozího stavu o 82 % na konci léčby [11,12].
Účinek na eozinofily v krvi
V klinických studiích s reslizumabem (fáze I a II) v dávce 3 mg/kg byl zjištěn pokles počtu eozinofilů v krvi po první dávce a udržel se po celou 52týdenní dobu léčby beze známek tachyfylaxe. Ve sloučených datech byly ve skupinách léčených placebem a reslizumabem výchozí střední hodnoty počtů eozinofilů 655/μl (n = 476) a 654/μl (n = 477) a v 52. týdnu 514/μl (n = 405) a 61/μl (n = 407). U pacientů léčených reslizumabem, kteří absolvovali následné sledování s vyhodnocením po 90 dnech, se eozinofily začaly vracet k výchozím hodnotám (394/μl, n = 36). Pokles počtu eozinofilů v krvi souvisel s koncentrací reslizumabu v krvi [11–13].
Farmakokinetické vlastnosti (farmakokinetika u zvláštních populací)
Maximální koncentrace reslizumabu v séru přibližně 80 μg/ml jsou typicky zjišťovány na konci infuze. Po podání dávek v rozmezí 0,3–3 mg/kg nebyla zjištěna žádná zjevná odchylka od farmakokinetiky přímé úměry k dávce reslizumabu. Variabilita maximální koncentrace a celkové expozice mezi jednotlivci je přibližně 20‒30 %. Na základě analýzy farmakokinetiky populací se zdá, že systémová expozice reslizumabu není ovlivněna cirkulujícími protilátkami proti reslizumabu [13,14]. Reslizumab má distribuční objem přibližně 5 l, což svědčí o minimální distribuci do extravaskulárních tkání. Stejně jako u jiných monoklonálních protilátek se předpokládá, že reslizumab je odbouráván enzymovou proteolýzou na malé peptidy a aminokyseliny. Protože se reslizumab váže na rozpustný nosič, předpokládá se lineární clearance nezprostředkovaná nosičem. Clearance reslizumabu je přibližně 7 ml/h. Poločas eliminace reslizumabu je přibližně 24 dní [12–14].
Starší pacienti a pediatrická populace
Farmakokinetika reslizumabu byla podobná u dospělých (18‒65 let, n = 759) i u starších pacientů (věk více než 65 let, n = 30). Rozsah systémové expozice u pacientů ve věkovém rozmezí od 12 do méně než 18 let (n = 15) se překrýval s rozsahem systémové expozice u jiných skupin, i když hodnota mediánu byla mírně nižší než u dospělých pacientů (18‒65 let, n = 759) a starších pacientů (věk více než 65 let, n = 30) [15].
Porucha funkce jater
Reslizumab nebyl studován u pacientů s poruchou funkce jater, nicméně přímý vliv funkce jater na farmakokinetiku reslizumabu je nepravděpodobný, protože eliminace protilátek probíhá formou katabolismu. Při analýze farmakokinetiky populací byli pacienti klasifikováni podle výchozí úrovně funkce jater. Většina pacientů měla testy funkce jater normální (n = 766, přibližně 95 %) nebo mírně zvýšené [15].
Porucha funkce ledvin
Reslizumab je protilátka s molekulovou hmotností 147 kDa, a proto se nepředpokládá jeho vylučování do moči. Většina pacientů zahrnutých do analýzy farmakokinetiky populací měla normální funkci ledvin, mírnou poruchu funkce ledvin nebo středně závažnou poruchu funkce ledvin. Mezi těmito skupinami nebyly ve farmakokinetice reslizumabu zjištěny žádné významné rozdíly [12].
Klinické zkušenosti
V rozsáhlých kontrolovaných studiích (tab. 1) byl prokázán příznivý účinek na snížení četnosti těžkých exacerbací i na plicní funkce, a to zejména u pacientů, kteří trpěli jak eozinofilním bronchiálním astmatem (definovaným absolutním počtem eozinofilů v periferní krvi ≥ 400/μl [14,16] nebo zvýšením zastoupení eozinofilů v indukovaném sputu ≥ 3 % [11]), tak konkomitantní chronickou rinosinusitidou s nosními polypy [15]. Ukázalo se, že u pacientů dobře reagujících na léčbu dochází ke zvýšení kvality života i k redukci spotřeby systémově užívaných kortikosteroidů a s kortikoterapií spojených nežádoucích účinků, současně při velmi vysoké bezpečnosti [17,18]. Účinek reslizumabu modifikující chorobu jako takovou či ovlivňující případnou remodelaci dýchacích cest je však doposud nejasný [6]. Z časového hlediska lze předpokládat, že se bude jednat o léčbu trvalou.
Zařazení do současné palety léčiv
Terapie bronchiálního astmatu se opírá o dva základní pilíře – léčbu zánětu dýchacích cest a léčbu bronchiální obstrukce, přičemž protizánětlivá terapie je nadřazenou modalitou. Základním kamenem léčby zánětu jsou již téměř 50 let inhalační kortikosteroidy, které jsou spolu s dalšími medikamenty podávány podle eskalačního schématu s ohledem na tíži bronchiálního astmatu [4]. K průlomové změně ve strategii péče o pacienty s nejtěžšími formami choroby (těžké refrakterní astma ‒ astma, které je refrakterní ke konvenční protizánětlivé terapii) došlo v roce 2015, kdy mezinárodní doporučení na podkladě revize výsledků kontrolovaných studií doporučila zahájení biologické terapie (namířené proti molekule IgE ‒ omalizumab; a později i proti IL 5 ‒ mepolizumab, reslizumab; či proti receptoru pro IL 5 [IL 5Rα, CD125] ‒ benralizumab) ještě před jinak nutným začátkem dlouhodobé systémové kortikoterapie. Všechny doposud registrované biologické přípravky jsou určeny pouze pro pacienty s bronchiálním astmatem eozinofilního fenotypu (alergickým nebo nealergickým).
Jak vyplývá z epidemiologických dat, tímto fenotypem trpí přibližně polovina pacientů s těžkým refrakterním astmatem (v České republice je přibližně 5 000 astmatiků s těžkým refrakterním astmatem eozinofilního fenotypu, což představuje zhruba 1 % ze všech nemocných léčených pro bronchiální astma). Pokud by jen čtvrtina z nich naplňovala zároveň i indikační kritéria pro zahájení biologické terapie, mohlo by být v našich podmínkách léčeno tímto způsobem asi 1 200 nemocných.
Z teoretických patogenetických mechanismů eozinofilních fenotypů astmatu „type 2 high“ (alergického – Th2 high; i nealergického – ILC2 high) i z praktických zkušeností klinických studií vyplývá, že musí nepochybně existovat nemalá kohorta pacientů, která by mohla a měla mít prospěch jak z léčby namířené proti IgE, tak proti IL 5 [19]. Podle observační studie IDEAL analyzující 502 těžkých astmatiků (při dodržení indikačních kritérií platných v Evropské unii pro zahájení léčby omalizumabem, mepolizumabem či reslizumabem) jich 381 (76 %) nebylo vhodných k jakékoliv biologické léčbě. Ze zbylých 121 pacientů jich však 22 (4 %) splňovalo podmínky jak pro užívání mepolizumabu, tak omalizumabu, 13 (3 %) jich mohlo být léčeno mepolizumabem i reslizumabem a 5 (< 1 %) pacientů dokonce naplnilo indikační kritéria pro všechny tři přípravky [20]. Ještě větší vzájemné průniky vyplývají z bližší analýzy charakteristik pacientů zařazených do jednotlivých studií testujících účinky mepolizumabu, reslizumabu či benralizumabu (přípravky namířené proti působení IL 5), mezi nimiž lze nalézt 46‒80 % alergiků (na podkladě znalosti pozitivity jejich prick testů, specifických IgE či přítomnosti alergické rinitidy) [21].
Z dostupných rozsáhlých populačních analýz pacientů zařazených do provedených kontrolovaných studií s jednotlivými přípravky je patrné, že terapie namířená proti IL 5 by měla být obecně tím účinnější, čím vyšší je vstupní hodnota eozinofilů a četnost těžkých exacerbací v předchozím roce. Oproti tomu terapie anti IgE by měla být zvolena u těch nemocných, kteří mají alergické astma, vstupně horší plicní funkce (usilovný výdechový proud za jednu sekundu, FEV1) a vyšší koncentraci IgE [22]. Je dále užitečné zmínit, že léčba monoklonálními protilátkami proti IL 5 by měla být zvážena i u těch nemocných s alergickým astmatem, kde nejsou splněna indikační kritéria zejména z důvodu vysokých hodnot celkového IgE (jako tomu bývá např. u nemocných s alergickou bronchopulmonální aspergilózou [ABPA], resp. mykózou [ABPM], nebo u nemocných trpících těžkým astmatem se senzibilizací na plísně [SAFS] apod.). Zajímavou výzvou do budoucnosti pak bude pravděpodobně léčba pacientů trpících jak těžkým astmatem, tak těžkou formou atopického ekzému, kde se nabízí volba přípravků namířených proti IL 4 a IL 13 (monoklonální protilátka dupilumab, t.č. registrována pouze v indikaci atopický ekzém). Pro rozhodnutí, jak postupovat v případě překryvu, neexistují doposud platná doporučení postavená na důkazech, neboť nebyla stále provedena přímá srovnávací kontrolovaná studie [21].
Otázkou, jak přistupovat k případné ztrátě efektu biologické terapie, se nepřímo zabývala post hoc analýza dat ze studií MENSA a SIRIUS (registrační studie přípravku mepolizumab, anti IL 5). Tato studie si dala za cíl zjistit, zda byl přítomen účinek mepolizumabu na redukci exacerbací s ohledem na to, jestli zařazení pacienti byli, či nebyli v dřívější době léčeni omalizumabem (monoklonální protilátka anti IgE), jehož podávání bylo ukončeno z důvodu neúčinnosti. Ukázalo se, že tato situace nastala u 13 %, resp. 33 % nemocných a u všech bylo dosaženo významného zlepšení jejich stavu, stejně tak jako u subjektů, u nichž byla léčba mepolizumabem zahájena jako první [23]. Zdá se být tudíž racionální uvažovat o zahájení terapie anti IL 5 v případě selhání efektu anti IgE. Analogická studie zabývající se účinkem léčby v opačném pořadí nebyla zatím provedena.
Díky možnosti adjustace dávek reslizumabu podle hmotnosti pacientů je relevantní otázka, zda právě tento fakt nemůže přispět ke zlepšení účinku léčby namířené proti IL 5 v případě, kdy léčba mepolizumabem s fixním dávkovacím schématem nevede ke zlepšení stavu. V lednu 2018 byla publikována malá studie deseti pacientů s kortikosteroid dependentním astmatem léčených minimálně jeden rok mepolizumabem (100 mg 1× za 4 týdny), u nichž byla následně zahájena léčba reslizumabem (3 mg/kg hmotnosti i.v.). Tento postup vedl k výraznějšímu snížení počtu eozinofilů v indukovaném sputu a ke zlepšení kontroly astmatu hodnocené testem kontroly astmatu (AKT) [24].
Pro alternativu kombinace více terapeutických modalit u zvláště komplikovaných stavů neexistují zatím žádná data.
Kontraindikace a nežádoucí účinky
Léčba reslizumabem dle provedených kontrolovaných studií vykazuje velmi příznivý bezpečnostní profil s vysokou tolerancí a s minimem kontraindikací podání, mezi něž prakticky patří pouze hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou složku [12].
Nejčastěji hlášeným nežádoucím účinkem během léčby, který se vyskytl asi u 2 % pacientů, byla zvýšená hodnota kreatinfosfokinázy v krvi. Anafylaktická reakce se projevila u méně než 1 % pacientů. Během kontrolovaných klinických studií byl podíl nemocných, jejichž účast byla předčasně ukončena z důvodu nežádoucí příhody, 5 % ve skupině užívající reslizumab v dávce 3 mg/kg i ve skupině užívající placebo [12,14–16].
Anafylaktická reakce
Anafylaktická reakce, která je závažným nežádoucím účinkem, byla během placebem kontrolovaných, nezaslepených studií astmatu hlášena a považována za související s reslizumabem u tří pacientů (0,19 %). Tyto reakce byly pozorovány během infuze reslizumabu nebo do 20 minut po jejím dokončení a byly hlášeny již u druhé dávky reslizumabu. Zcela vymizely po standardní léčbě bez reziduálních účinků. Projevy zahrnovaly postižení kůže nebo sliznic, dušnost, hvízdavý dech, gastrointestinální symptomy a třesavku. Tyto případy vedly k ukončení léčby. Vzhledem k překrývání známek a příznaků nebylo ve všech případech možné rozlišit mezi anafylaktickou reakcí, jinou hypersenzitivní reakcí a reakcí související s infuzí [12].
Myalgie
Myalgie byla hlášena u 0,97 % pacientů (10 z 1 028) ve skupině s 3 mg/kg reslizumabu v placebem kontrolovaných studiích astmatu ve srovnání s 0,55 % pacientů (4 ze 730) ve skupině s placebem.
Zvýšená aktivita kreatinfosfokinázy
Zvýšení hodnoty kreatinfosfokinázy v krvi bylo přechodné a asymptomatické a nevedlo k předčasnému ukončení léčby.
Malignity
V placebem kontrolovaných klinických studiích byl u šesti z 1 028 pacientů (0,6 %), jimž byl podáván reslizumab v dávce 3 mg/kg, hlášen nejméně jeden maligní novotvar ve srovnání se dvěma ze 730 pacientů (0,3 %) ve skupině užívající placebo. Malignity zjištěné u pacientů léčených reslizumabem byly různého charakteru a nesouvisely s žádným konkrétním typem tkáně [14–16].
Lékové interakce
S reslizumabem nebyly provedeny žádné formální klinické studie lékových interakcí. Údaje in vitro naznačují, že není pravděpodobné, že by reslizumab ovlivňoval aktivitu cytochromu P450 1A2, 3A4 nebo 2B6. Na základě vlastností reslizumabu se neočekávají mezilékové interakce. Výsledky farmakokinetické analýzy populací potvrzují, že současné použití buď leukotrienových antagonistů, nebo systémových kortikosteroidů neovlivňuje farmakokinetiku reslizumabu.
Reslizumab nebyl studován u pacientů současně užívajících jiné imunosupresivní léčivé přípravky než perorální kortikosteroidy, proto je profil bezpečnosti a účinnosti reslizumabu u těchto pacientů neznámý. Stejně tak nebyl studován u nemocných, jimž byly podány živé vakcíny. Nejsou však k dispozici žádné údaje o sekundárním přenosu infekce z osob, jimž byly podány živé vakcíny, na pacienty užívající reslizumab, ani o odpovědi pacientů užívajících reslizumab po provedení nové imunizace [12,25].
Těhotenství a kojení
Údaje o podávání reslizumabu těhotným ženám jsou omezené (méně než 300 ukončených těhotenství) nebo nejsou k dispozici. Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky. Podávání reslizumabu během těhotenství se z preventivních důvodů nedoporučuje.
Není známo, zda se reslizumab vylučuje do lidského mateřského mléka. Dostupné farmakodynamické/toxikologické údaje u zvířat prokázaly vylučování reslizumabu do mléka. U člověka se během několika prvních dnů po porodu mohou předávat protilátky novorozencům mateřským mlékem. V tomto krátkém období nelze vyloučit riziko pro kojence.
Dávkování a léková forma podání
Reslizumab se podává v intravenózní infuzi jednou za čtyři týdny v dávce 3 mg/kg tělesné hmotnosti. Vypočítaná dávka se následně aplikuje v 50 ml fyziologického roztoku v krátké infuzi (20‒50 minut) přes jednorázový infuzní filtr s nízkou vazbou proteinů (0,2 μm). Reslizumab se nesmí podávat jako bolusová injekce ani jako neředěný koncentrát. Pokud se u pacienta objeví jakákoliv nežádoucí reakce, musí být infuze okamžitě ukončena [12].
V současné době probíhá analýza dat ze dvou již ukončených kontrolovaných studií fáze III (NCT02501629, n = 177; NCT02452190, n = 468) testujících fixní podávání 110 mg reslizumabu subkutánně [26].
Závěr
Diagnostické a léčebné možnosti bronchiálního astmatu prodělaly za posledních několik let velmi významný vývoj. Dnes se již nemůžeme spokojit pouze s klasifikací tíže onemocnění, ale je nezbytné ho přesně popsat i fenotypově podle charakteristik probíhajícího zánětu dýchacích cest. Pokud se onemocnění nedaří uvést pod úplnou kontrolu ani při vysokých dávkách dostupné konvenční inhalační léčby a pacient je nadále symptomatický se sklonem k těžkým exacerbacím, je indikováno zahájení fenotypově specifické biologické terapie ještě před případným zahájením trvalé systémové kortikoterapie. Tento přístup významným způsobem zlepší klinický průběh onemocnění a zároveň sníží negativní dopad kortikoterapie se všemi jejími komplikacemi.
Seznam použité literatury
- [1] Teřl M, Čáp P, Dvořáková R, et al. Doporučený postup diagnostiky a léčby bronchiálního astmatu. 1st ed. Geum; 2015.
- [2] McCombs RP. Serial courses of corticotrophin or cortisone in chronic bronchial asthma. N Engl J Med 1952; 247: 1–6.
- [3] Morrow Brown H, Storey G, George WHS, et al. Beclomethasone Dipropionate: A New Steroid Aerosol for the Treatment of Allergic Asthma. Br Med J 1972; 1: 585–590.
- [4] Pedersen S, Bateman ED, Boulet L‑P, Cruz AA. Global Initiative For Asthma (GINA). Global strategy for asthma management and prevention, 2017. Dostupné na: http://www.ginasthma.org
- [5] Morrow Brown H. Treatment of chronic asthma with prednisolone. Significance of eosinophils in the sputum. Lancet 1958; 358: 1245–1247.
- [6] Fahy JV. Type 2 inflammation in asthma ‒ present in most, absent in many. Nat Rev Immunol 2015; 15: 57–65.
- [7] Wenzel SE, Schwartz LB, Langmack EL, et al. Evidence that severe asthma can be divided pathologically into two inflammatory subtypes with distinct physiologic and clinical characteristics. Am J Respir Crit Care Med 1999; 160: 1001–1008.
- [8] Elemam NM, Hannawi S, Maghazachi AA. Innate lymphoid cells (ILCs) as mediators of inflammation, release of cytokines and lytic molecules. Toxins (Basel) 2017; 9: 398.
- [9] Kabata H, Moro K, Koyasu S, Asano K. Group 2 innate lymphoid cells and asthma. Allergol Int 2015; 64: 227–234.
- [10] Smith SG, Chen R, Kjarsgaard M, et al. Increased numbers of activated group 2 innate lymphoid cells in the airways of patients with severe asthma and persistent airway eosinophilia. J Allergy Clin Immunol 2016; 137: 75–86.
- [11] Castro M, Mathur S, Hargreave F, et al. Reslizumab for poorly controlled, eosinophilic asthma: A randomized, placebo‑controlled study. Am J Respir Crit Care Med 2011; 184: 1125–1132.
- [12] Souhrn údajů o přípravku Cinqaero 10 mg/ml, Státní ústav pro kontrolu léčiv, 2016. Dostupné na: http://www.sukl.cz
- [13] Kips JC, O’Connor BJ, Langley SJ, et al. Effect of SCH55700, a humanized anti‑human interleukin‑5 antibody, in severe persistent asthma: A pilot study. Am J Respir Crit Care Med 2003; 167: 1655–1659.
- [14] Bjermer L, Lemiere C, Maspero J, et al. Reslizumab for Inadequately Controlled Asthma With Elevated Blood Eosinophil Levels: A Randomized Phase 3 Study. Chest 2016; 150: 789–798.
- [15] Castro M, Zangrilli J, Wechsler ME, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: Results from two multicentre, parallel, double‑blind, randomised, placebo‑controlled, phase 3 trials. Lancet Respir Med 2015; 3: 355–366.
- [16] Corren J, Weinstein S, Janka L, et al. Phase 3 Study of Reslizumab in Patients With Poorly Controlled Asthma: Effects Across a Broad Range of Eosinophil Counts. Chest 2016; 150: 799–810.
- [17] Maselli DJ, Velez MI, Rogers L. Reslizumab in the management of poorly controlled asthma: the data so far. J Asthma Allergy 2016; 9: 155–162.
- [18] Sahota J, Robinson DS. Update on new biologics for intractable eosinophilic asthma: Impact of reslizumab. Drug Des Devel Ther 2018; 12: 1173–1181.
- [19] Domingo C. Overlapping Effects of New Monoclonal Antibodies for Severe Asthma. Drugs 2017; 77: 1769–1787.
- [20] Albers FC, Müllerová H, Gunsoy NB, et al. Biologic treatment eligibility for real‑world patients with severe asthma: The IDEAL study. J Asthma 2018; 55: 152–160.
- [21] Zervas E, Samitas K, Papaioannou AI, et al. An algorithmic approach for the treatment of severe uncontrolled asthma. ERJ Open Res 2018; 4: pii: 00125‑2017.
- [22] Papathanassiou E, Loukides S, Bakakos P. Severe asthma: anti‑IgE or anti‑IL‑5? Eur Clin Respir J 2016; 3: 31813.
- [23] Magnan A, Bourdin A, Prazma CM, et al. Treatment response with mepolizumab in severe eosinophilic asthma patients with previous omalizumab treatment. Allergy Eur J Allergy Clin Immunol 2016; 71: 1335–1344.
- [24] Mukherjee M, Paramo FA, Kjarsgaard M, et al. Weight‑adjusted intravenous reslizumab in severe asthma with inadequate response to fixed‑dose subcutaneous mepolizumab. Am J Respir Crit Care Med 2018; 197: 38–46.
- [25] Doddapaneni S. Reslizumab (Cinqair). Canadian Agency for Drugs and Technologies in Health, 2017. Dostupné na: http://www.fda.gov
- [26] http://www.clinicaltrials.gov