Retigabin - antiepileptikum s novým mechanismem účinku
Retigabin je nové antiepileptikum s unikátním mechanismem účinku, stabilizující neuronální membránu prostřednictvím zvýšení aktivity napěťově řízených kaliových kanálů. Je registrován a indikován k přídatné léčbě fokální epilepsie u dospělých pacientů, v udržovací dávce 600–1200 mg/den. V článku jsou prezentovány základní farmakologické a klinické údaje o léčbě retigabinem.
Farmakologická skupina
Retigabin, retigabinum (RTG), patří do farmakologické skupiny antiepileptik. ATC kód: N03AX21 [1].Chemické a fyzikální vlastnosti
Chemicky je retigabin ethylester kyseliny N-[2-amino-4-(4-fluorobenzylamino)- phenyl] karbamové (obr. 1).
![Obr. 1 Strukturní vzorec retigabinu; podle [2] – Plosker, et al., 2006](https://www.remedia.cz/photo-a-28910---.jpg) Sumární vzorec: C16H18FN3O2
Sumární vzorec: C16H18FN3O2 Molekulová hmotnost: 303,331
Mechanismy účinku, farmakodynamika
Mechanismus antikonvulzivních účinků RTG je zcela unikátní, odlišný od ostatních dosud známých antiepileptik [1–4]. Experimentálně bylo prokázáno, že RTG účinkuje primárně prostřednictvím selektivního otevření neuronálních napěťově řízených draslíkových kanálů (KCNQ2 [Kv7.2] a KCNQ3 [Kv7.3]). Dochází k extracelulárnímu přesunu kalia a k hyperpolarizaci buněčné membrány. Tímto RTG stabilizuje klidový membránový potenciál, snižuje excitabilitu neuronů a brání vzniku epileptických výbojů ![Obr. 2 Mechanismus působení retigabinu (RTG) zprostředkovaný selektivním zvýšením aktivity napěťově řízených kaliových kanálů KCNQ 2–3 (Kv7.2/7.3). RTG potencuje extracelulární přesun kalia a hyperpolarizaci, stabilizuje membránový potenciál a brání vzniku epileptických výbojů; volně podle [17] – Yue, Yaari, 2004.](https://www.remedia.cz/photo-a-28911---.jpg) (obr. 2). Mechanismus účinku RTG na draslíkové kanály byl velmi dobře zdokumentován, případné další mechanismy antikonvulzivních účinků RTG však nebyly dosud plně objasněny. RTG s novým mechanismem účinku je tedy vhodný do kombinované léčby s jakýmkoli jiným antiepileptikem [2–4]. Antikonvulzivní (protizáchvatové) účinky RTG byly prokázány v řadě obvyklých experimentálních modelů epileptických záchvatů: u záchvatů vyvolaných maximálními elektrošoky, pentylenetrazolem, pikrotoxinem a N-methyl- D-aspartátem (NMDA). RTG rovněž vykazoval účinnost v modelech rozněcování (kindling, model fokální epilepsie a progresivní epileptogeneze), a to při plně vybuzeném stavu (fully kindled state) i v průběhu jeho progresivního rozvoje. RTG byl navíc účinný v prevenci záchvatů status epilepticus u hlodavců s epileptogenními lézemi indukovanými kobaltem a v inhibici tonických extenzorových záchvatů u geneticky vnímavých myší [1–4]. Z uvedených experimentálních nálezů lze odvodit pro klinickou praxi potenciální účinnost RTG ve spektru záchvatů fokálních i generalizovaných. Ovlivnění vlastní epileptogeneze, tedy antiepileptický účinek v užším slova smyslu (ovlivnění nemoci samé), je pak stálou a klinicky zatím nenaplněnou ambicí dosud známých antiepileptik.
(obr. 2). Mechanismus účinku RTG na draslíkové kanály byl velmi dobře zdokumentován, případné další mechanismy antikonvulzivních účinků RTG však nebyly dosud plně objasněny. RTG s novým mechanismem účinku je tedy vhodný do kombinované léčby s jakýmkoli jiným antiepileptikem [2–4]. Antikonvulzivní (protizáchvatové) účinky RTG byly prokázány v řadě obvyklých experimentálních modelů epileptických záchvatů: u záchvatů vyvolaných maximálními elektrošoky, pentylenetrazolem, pikrotoxinem a N-methyl- D-aspartátem (NMDA). RTG rovněž vykazoval účinnost v modelech rozněcování (kindling, model fokální epilepsie a progresivní epileptogeneze), a to při plně vybuzeném stavu (fully kindled state) i v průběhu jeho progresivního rozvoje. RTG byl navíc účinný v prevenci záchvatů status epilepticus u hlodavců s epileptogenními lézemi indukovanými kobaltem a v inhibici tonických extenzorových záchvatů u geneticky vnímavých myší [1–4]. Z uvedených experimentálních nálezů lze odvodit pro klinickou praxi potenciální účinnost RTG ve spektru záchvatů fokálních i generalizovaných. Ovlivnění vlastní epileptogeneze, tedy antiepileptický účinek v užším slova smyslu (ovlivnění nemoci samé), je pak stálou a klinicky zatím nenaplněnou ambicí dosud známých antiepileptik.
Farmakokinetické vlastnosti
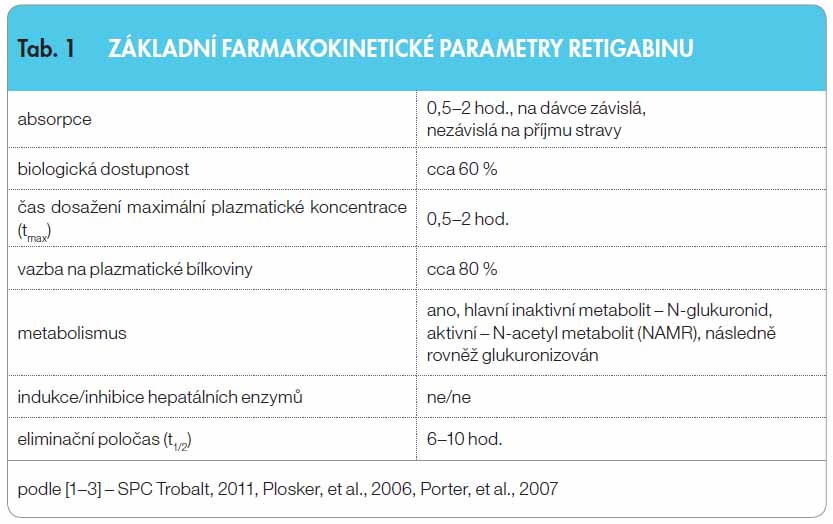 Po perorálním podání je RTG nezávisle na jídle rychle absorbován, maximální plazmatické koncentrace je dosaženo za 0,5–2 hodiny, biologická dostupnost dosahuje přibližně 60 %, farmakokinetika je lineární, vazba na plazmatické bílkoviny vyšší, okolo 80 % (tab. 1)
Po perorálním podání je RTG nezávisle na jídle rychle absorbován, maximální plazmatické koncentrace je dosaženo za 0,5–2 hodiny, biologická dostupnost dosahuje přibližně 60 %, farmakokinetika je lineární, vazba na plazmatické bílkoviny vyšší, okolo 80 % (tab. 1)
Retigabin je extenzivně metabolizován, hlavní metabolickou cestou je glukuronidace a přeměna na inaktivní N- -glukuronidy. RTG je dále metabolizován na N-acetyl metabolit (NAMR), který je následně rovněž glukuronizován. NAMR má antiepileptickou aktivitu, ale je méně účinný než RTG [1–4]. Retigabin není významným induktorem ani inhibitorem hepatálních enzymů P450, je tedy nepravděpodobné, že by společné podávání s inhibitory nebo induktory enzymů cytochromu P450 ovlivnilo farmakokinetiku RTG nebo NAMR. Eliminace RTG a jeho metabolitů probíhá hlavně prostřednictvím kombinace hepatálního metabolismu a renální exkrece, pouze 14 % RTG je vylučováno stolicí. Úprava dávek je tak doporučována při středně těžkém a těžkém poškození renálních a hepatálních funkcí, eventuálně u starších pacientů [1].
Klinické zkušenosti
Randomizované studie kontrolované placebem
Klinická účinnost a bezpečnost RTG v přídatné léčbě parciálních (fokálních) záchvatů se sekundární generalizací nebo bez ní byla hodnocena v registračních multicentrických, randomizovaných, dvojitě zaslepených, placebem kontrolovaných studiích (RCT) u celkem 1239 dospělých pacientů (tab. 2). Uspořádání studií bylo v základních rysech o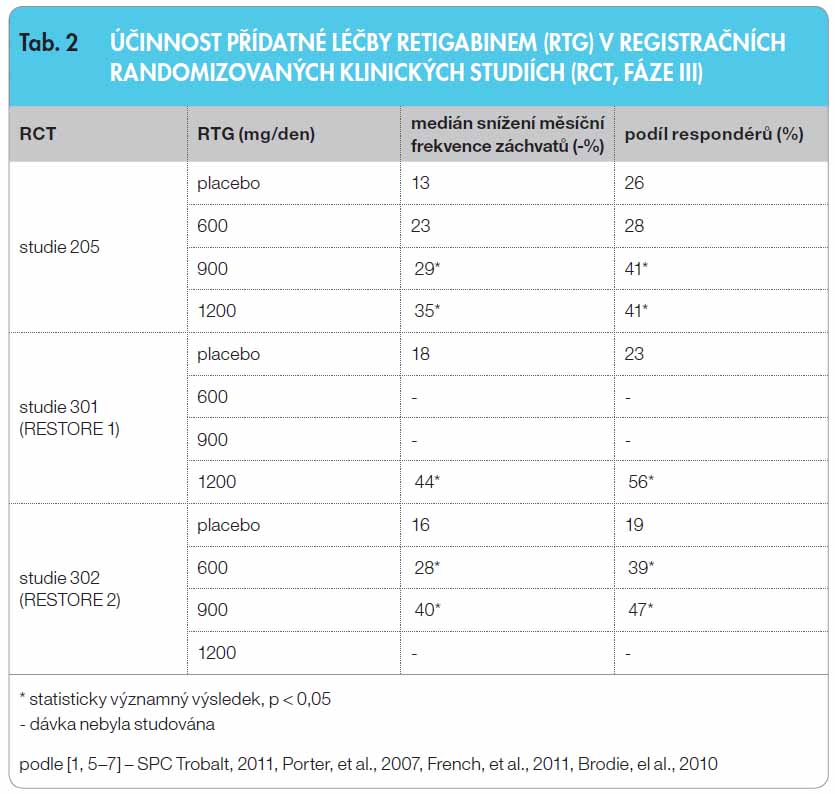 bdobné, což umožňuje souhrnné hodnocení a porovnání výsledků, ne v každé studii však byly užity všechny tři uvedené cílové dávky RTG [5–7]. Nekompenzovaní pacienti zařazení do studií byli léčeni jedním až třemi současně podávanými antiepileptiky, přičemž více než 75 % z nich užívalo současně dvě antiepileptika nebo více. Průměrná délka trvání epilepsie ve studiích byla 22 let a medián výchozí frekvence záchvatů se pohyboval v rozmezí 8–12 záchvatů za 28 dnů. Pacienti byli randomizováni do skupiny s placebem nebo s RTG v dávce 600, 900 nebo 1200 mg denně [1, 5–7]. V průběhu 8týdenní vstupní fáze museli pacienti prodělat 4 nebo více parciálních záchvatů za 28 dní, období bez záchvatů nesmělo překročit 21 dnů. Z uvedeného vyplývá, že do studie byla zařazena populace těžších pacientů, s dlouhodobě trvající aktivní epilepsií, s vysokým podílem pacientů s polyterapií, a tedy s vysokou mírou farmakorezistence. Po fázi titrace, trvající v závislosti na dávce RTG 4 až 6 týdnů, následovala udržovací léčebná fáze v délce 12 týdnů.
bdobné, což umožňuje souhrnné hodnocení a porovnání výsledků, ne v každé studii však byly užity všechny tři uvedené cílové dávky RTG [5–7]. Nekompenzovaní pacienti zařazení do studií byli léčeni jedním až třemi současně podávanými antiepileptiky, přičemž více než 75 % z nich užívalo současně dvě antiepileptika nebo více. Průměrná délka trvání epilepsie ve studiích byla 22 let a medián výchozí frekvence záchvatů se pohyboval v rozmezí 8–12 záchvatů za 28 dnů. Pacienti byli randomizováni do skupiny s placebem nebo s RTG v dávce 600, 900 nebo 1200 mg denně [1, 5–7]. V průběhu 8týdenní vstupní fáze museli pacienti prodělat 4 nebo více parciálních záchvatů za 28 dní, období bez záchvatů nesmělo překročit 21 dnů. Z uvedeného vyplývá, že do studie byla zařazena populace těžších pacientů, s dlouhodobě trvající aktivní epilepsií, s vysokým podílem pacientů s polyterapií, a tedy s vysokou mírou farmakorezistence. Po fázi titrace, trvající v závislosti na dávce RTG 4 až 6 týdnů, následovala udržovací léčebná fáze v délce 12 týdnů.
Účinnost léčby RTG byla hodnocena ve dvou parametrech:
- procentuální změna celkové „měsíční“ frekvence parciálních záchvatů za 28 dnů od vstupu do fáze dvojitého zaslepení (kombinace fází titrace a udržovací léčby) ve všech třech studiích;
- podíl respondérů definovaný jako procento pacientů s ? 50% snížením celkové frekvence parciálních záchvatů za 28 dnů od vstupu do udržovací fáze (pouze studie 301 a 302).
Výsledky účinnosti RTG v přídatné léčbě dospělých pacientů s fokální epilepsií ve třech klinických studiích jsou souhrnně uvedeny v tab. 2. Oproti placebu byl RTG signifikantně účinnější v dávkách 600 mg/den (jedna studie), 900 mg/den (dvě studie) a 1200 mg/den (dvě studie), účinnost byla na dávce závislá [1, 5–7].
Otevřené studie
Uvedené randomizované kontrolované registrační studie jsou nezbytné k průkazu účinnosti a bezpečnosti léku z hlediska současné medicíny založené na vědeckých důkazech
Pouze tímto způsobem lze získat důkazy o schopnosti studovaného léku signifikantně ovlivnit sledované parametry. Tyto studie však mají i řadu omezení, která je odlišují od běžné klinické praxe, zejména fixní dávkování a poměrně krátké trvání. V tomto ohledu jsou pak velmi významné navazující dlouhodobé otevřené studie. Ty jsou již relativně „méně vědecké“, o to více však odpovídají běžné klinické praxi a z tohoto pohledu hodnotí i „skutečný přínos“ léku pro praxi. Hodnotícími parametry jsou zde dlouhodobá účinnost a snášenlivost léčby, dále tzv. retention- rate, tedy procento pacientů setrvávajících na léčbě ve sledovaném období. Právě tento parametr v sobě shrnuje skutečný přínos léčby z hlediska pacienta, a to účinnost i toleranci. Rovněž v případě RTG navázaly na původní klinické studie (301 = RESTORE 1, 302 = RESTORE 2) dvě dlouhodobé otevřené studie (303 a 304) [8–10]. Výsledky těchto studií jsou průběžně prezentovány a publikovány, obvykle v obdobích 6, 12, 24 a více měsíců [8–11]. Nových dat je řada, souhrnně je parametr retention- -rate po roce léčby okolo 66 %, průměrné dávky RTG 860 a 1050 mg/den. Účinnost léč![Graf 1 Porovnání výskytu SUDEP (Sudden Unexpected Death in Epilepsy) u pacientů léčených retigabinem (RTG) oproti pacientům, kteří dostávali placebo nebo jinou antiepileptickou léčbu; podle [13] – Brickel et al., 2011.](https://www.remedia.cz/photo-a-28914---.jpg) by RTG byla závislá na dávce a stabilní. Po roce došlo v uvedených dvou studiích k redukci měsíční frekvence záchvatů o 53–57 %, podíl respondérů byl 54–57 %. Po dvou letech dosahovala redukce měsíční frekvence záchvatů 63–66 %, podíl respondérů byl 68–69 %. Při dlouhodobé léčbě byl ve studiích relativně vysoký podíl plně kompenzovaných pacientů, po dobu nejméně 6 měsíců okolo 8–10 %, po dobu nejméně roku 4–5 % [8–11]. Z hlediska bezpečnosti byl profil nežádoucích účinků obdobný jako v původních studiích. Zvláštní pozornost byla věnována zejména funkčním poruchám močení a bezpečnosti léčby z hlediska kardiální toxicity, jak je popsáno níže [1, 12, 13]. Z kardiologického hlediska se výskyt nežádoucích účinků nelišil od placeba, bezpečnost léčby RTG je navíc pozitivně podložena i analýzou výskytu „náhlého, neočekávaného úmrtí“ (Sudden Unexpected Death in Epilepsy, SUDEP). Jeho výskyt byl při léčbě RTG v porovnání s jinými pacienty s epilepsií nižší [13], viz graf 1.
by RTG byla závislá na dávce a stabilní. Po roce došlo v uvedených dvou studiích k redukci měsíční frekvence záchvatů o 53–57 %, podíl respondérů byl 54–57 %. Po dvou letech dosahovala redukce měsíční frekvence záchvatů 63–66 %, podíl respondérů byl 68–69 %. Při dlouhodobé léčbě byl ve studiích relativně vysoký podíl plně kompenzovaných pacientů, po dobu nejméně 6 měsíců okolo 8–10 %, po dobu nejméně roku 4–5 % [8–11]. Z hlediska bezpečnosti byl profil nežádoucích účinků obdobný jako v původních studiích. Zvláštní pozornost byla věnována zejména funkčním poruchám močení a bezpečnosti léčby z hlediska kardiální toxicity, jak je popsáno níže [1, 12, 13]. Z kardiologického hlediska se výskyt nežádoucích účinků nelišil od placeba, bezpečnost léčby RTG je navíc pozitivně podložena i analýzou výskytu „náhlého, neočekávaného úmrtí“ (Sudden Unexpected Death in Epilepsy, SUDEP). Jeho výskyt byl při léčbě RTG v porovnání s jinými pacienty s epilepsií nižší [13], viz graf 1.
Současné postavení retigabinu v léčbě epilepsie
Epilepsie patří k nejčastějším chronickým neurologickým onemocněním, postihuje 0,5–1 % populace [14] a v ČR se dlouhodobá léčba týká až 100 000 obyvatel [15]. Léčba epilepsie dnes patří v neurologii k optimistickým terapeutickým tématům, a to ze dvou důvodů, kterými jsou: současné široké možnosti léčby a počet pacientů, jimž můžeme úspěšně pomoci [15]
Zlepšení efektivity léčby souvisí s příchodem nových antiepileptik a nových možností invazivní léčby epilepsie (epileptochirurgie, stimulační léčba). Z hlediska účinnosti se dnes daří dosáhnout kompenzace záchvatů až u tří čtvrtin pacientů. Tím se může pochlubit málokterá oblast medicíny. Přes široké terapeutické možnosti však nadále zůstává čtvrtina až třetina pacientů neuspokojivě kompenzována [14–16]. To představuje výzvu k hledání nových léčebných možností, ke kterým patří i hledání nových antiepileptik. Od nového antiepileptika očekáváme vždy jasně definované spektrum účinnosti podle typu záchvatu (záchvaty fokální, sekundárně generalizované, případně primárně generalizované), dostatečnou účinnost, dobrou toleranci (somatickou, psychickou), dobrý farmakokinetický profil včetně lékových interakcí (s antiepileptiky i jinými léky), za potenciálně přínosný se dnes považuje i nový mechanismus jejich působení. V řadě těchto aspektů je RTG atraktivním novým antiepileptikem v léčbě fokální epilepsie. Prokázány byly dobrá a dlouhodobá účinnost, bezpečnost i dobrá snášenlivost léčby. Jak bylo uvedeno, syndrom náhlého neočekávaného úmrtí (SUDEP) se u pacientů léčených RTG nevyskytoval častěji [13]. Jistou nevýhodou může být pro některé pacienty větší náročnost na compliance při podávání léku ve třech denních dávkách. Nicméně úspěšná léčba RTG tuto nevýhodu jistě překlene. Pro polyterapii je z hlediska farmakokinetiky naopak výhodou absence významných lékových interakcí s ostatními antiepileptiky, případně s dalšími léky. Unikátní mechanismus účinku zprostředkovaný přes napěťově řízené draslíkové kanály představuje zcela nový strategický cíl v léčbě epilepsie. Otevírá se tak nový prostor v kombinované léčbě (polyterapii), eventuálně i v sekvenční monoterapii. V kombinaci s ostatními současnými antiepileptiky, která působí odlišnými mechanismy účinku, tak můžeme očekávat významné posílení účinnosti léčby, případně účinnost léčby tam, kde jsme dosud byli neúspěšní. RTG s novým mechanismem účinku je vhodný do kombinované léčby s jakýmkoli jiným antiepileptikem. Při současné dostupnosti nových antiepileptik s odlišnými mechanismy účinku pak vždy zvažujeme i „včasnou“ kombinovanou léčbu, např. již po první přínosné monoterapii, která je významně, byť jen částečně účinná. I zde je prostor pro včasné využití RTG. Z hlediska spektra účinnosti je v současné době RTG určen k léčbě výhradně fokální epilepsie, širší spektrum účinnosti nebylo v klinické praxi zatím ověřeno.Terapeutické indikace
RTG je indikovaný jako přídatná léčba parciálních záchvatů se sekundární generalizací nebo bez ní u dospělých pacientů s epilepsií ve věku 18 let a starších [1].
Kontraindikace
Kontraindikací léčby RTG je hypersenzitivita na léčivou látku (RTG) nebo na kteroukoli pomocnou látku dostupného přípravku [1].
Nežádoucí účinky
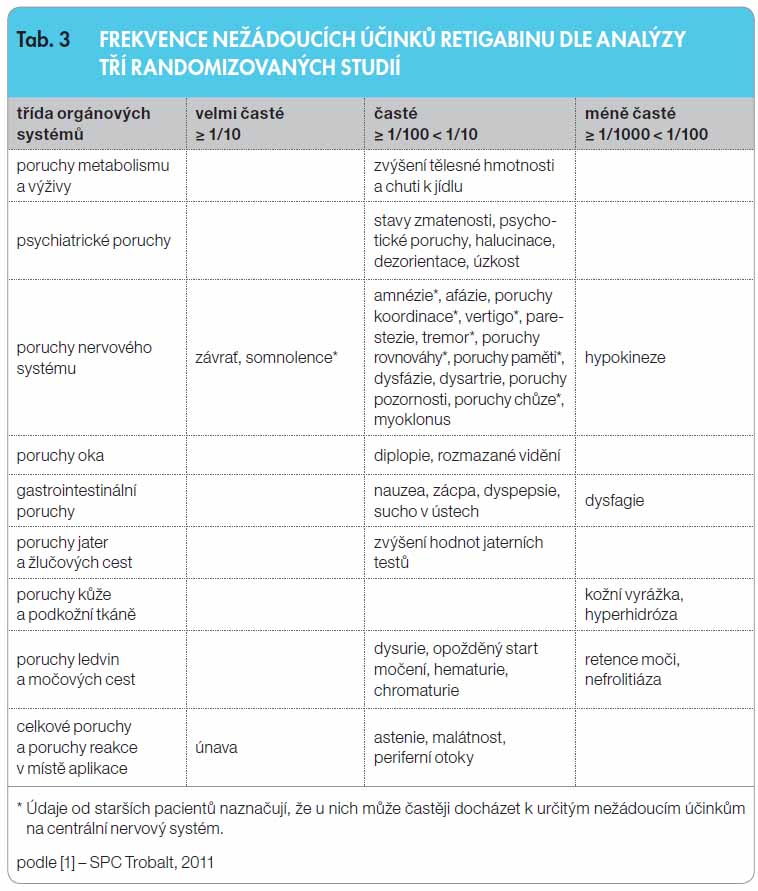 Dle souhrnných dat předregistračních kontrolovaných studií (RCT) má RTG příznivý profil snášenlivosti. Nežádoucí účinky byly obvykle mírné a střední intenzity, nejčastěji se vyskytovaly v průběhu prvních 8 týdnů léčby, tedy během titrace. K těm, které vedly nejčastěji k přerušení léčby, patřily závrať, somnolence, únava a stavy zmatenosti. Závislost na dávce léku byla prokázána u pacientů se závratí, somnolencí, u stavů zmatenosti, afázie, poruch koordinace, tremoru, poruch rovnováhy, poruch paměti, poruch chůze, rozmazaného vidění a u zácpy [1–11], tab. 3.
Dle souhrnných dat předregistračních kontrolovaných studií (RCT) má RTG příznivý profil snášenlivosti. Nežádoucí účinky byly obvykle mírné a střední intenzity, nejčastěji se vyskytovaly v průběhu prvních 8 týdnů léčby, tedy během titrace. K těm, které vedly nejčastěji k přerušení léčby, patřily závrať, somnolence, únava a stavy zmatenosti. Závislost na dávce léku byla prokázána u pacientů se závratí, somnolencí, u stavů zmatenosti, afázie, poruch koordinace, tremoru, poruch rovnováhy, poruch paměti, poruch chůze, rozmazaného vidění a u zácpy [1–11], tab. 3.
Popis vybraných nežádoucích účinků
Nežádoucí účinky související s funkční poruchou močení byly hlášeny u 5 % pacientů léčených RTG, šlo o retenci moči, dysurie a obtížný start močení. Většina těchto účinků se objevila v průběhu prvních 8 týdnů léčby a nebyla u nich zřejmá souvislost s dávkou. U pacientů s rizikem retence moči je nutno RTG podávat s opatrností a doporučuje se poučit pacienty o možném riziku těchto nežádoucích účinků [1, 12].
Studie u zdravých subjektů ukázala, že RTG titrovaný na dávku 1200 mg/den může vést k prodloužení QT intervalu. Při léčbě RTG je nutno postupovat opatrně při současném podávání přípravků, o nichž je známo, že prodlužují QT interval, při léčbě pacientů, u kterých bylo diagnostikováno prodloužení QT intervalu, pacientů s městnavým srdečním selháním, ventrikulární hypertrofií, hypokalemií nebo hypomagnezemií a při zahájení léčby u pacientů ve věku 65 let a starších. U těchto pacientů se doporučuje provést před zahájením léčby RTG elektrokardiografické vyšetření (EKG). Pacientům s korigovaným QT intervalem > 440 ms před zahájením léčby je pak třeba provést EKG vyšetření po dosažení udržovací dávky [1, 13]
U pacientů v kontrolovaných klinických studiích s RTG se vyskytovaly některé psychické poruchy, stavy zmatenosti (u 9 % pacientů), halucinace (u 2 % pacientů) a psychotické poruchy (u 1 % pacientů), obvykle v průběhu prvních 8 týdnů léčby. Často vedly k ukončení léčby. Závislost na dávce byla pozorována pouze u stavů zmatenosti. Doporučuje se, aby pacienti byli poučeni o možném riziku těchto nežádoucích účinků [1]
Sebevražedné myšlenky a chování byly hlášeny u pacientů léčených různými antiepileptiky v různých indikacích. Pacienty léčené RTG je v tomto ohledu třeba poučit a pečlivě sledovat, tak jako při léčbě jinými antiepileptiky [1].
U starších pacientů (65 let a více) je potenciálně zvýšené riziko nežádoucích účinků na centrální nervový systém, retence moči a fibrilace síní. Těmto pacientům je nutné podávat RTG s opatrností a doporučuje se zde snížit úvodní i udržovací dávku, jak je uvedeno v části o dávkování léčby [1]. Náhlé, případně rychlé vysazení RTG může vést obdobně jako u jiných antiepileptik k relapsu záchvatů. Zkušenosti s předávkováním jsou ze studií omezené, při dávkách vyšších než 2500 mg/den byly kromě uváděných nežádoucích účinků pozorovány agitovanost, agresivní chování, podrážděnost a srdeční arytmie. Obtíže odezněly bez následků. Doporučována je podpůrná léčba podle klinických příznaků, včetně monitorování EKG.
Lékové interakce
Studie lékových interakcí byly provedeny experimentálně a pouze u dospělých. Experimentální a klinické nálezy prokázaly nízký potenciál RTG k lékovým interakcím s ostatními antiepileptiky. RTG významně neovlivňoval plazmatické koncentrace karbamazepinu, klobazamu, klonazepamu, gabapentinu, lamotriginu, levetiracetamu, oxkarbazepinu, fenobarbitalu, fenytoinu, pregabalinu, topiramátu, valproátu a zonisamidu. Hladiny RTG nebyly významně ovlivněny lamotriginem, levetiracetamem, oxkarbazepinem, topiramátem ani valproátem. Některé nálezy z menších studií ukazují na možnost snížení hladiny RTG při léčbě fenytoinem a karbamazepinem [1]. RTG může potenciálně zvyšovat sérové koncentrace digoxinu, prodlužovat trvání anestezie (thiopental) a v kombinaci s alkoholem působit rozmazané vidění.
Těhotenství a kojení
Údaje o podávání RTG těhotným ženám nejsou k dispozici. Jeho podávání v těhotenství a u žen ve fertilním věku, které neužívají antikoncepci, se nedoporučuje [1]. Platí zde obecná doporučení o podrobném přehodnocení nutnosti a volby léčby u žen, které otěhotní, případně plánují otěhotnět. Náhlé vysazení antiepileptické léčby v těhotenství však může vést k relapsu záchvatů a k poškození nenarozeného dítěte či matky. Není známo, zda se RTG a jeho metabolity vylučují u člověka do mateřského mléka. Studie na zvířatech to však prokázaly. I zde je nutno individuálně vážit prospěch z kojení pro dítě a z léčby pro matku [1].
Ovlivnění pozornosti
V kontrolovaných klinických studiích, zvláště při titrování dávky, se vyskytovaly relativně časté nežádoucí účinky, které mohou negativně ovlivnit schopnost řízení a obsluhy strojů. Patří k nim poruchy koordinace, vertigo, parestezie, tremor, poruchy rovnováhy, poruchy paměti, poruchy pozornosti, závrať, somnolence, diplopie a rozmazané vidění. Odpověď na léčbu a výskyt těchto nežádoucích účinků jsou však individuální. Doporučuje se, aby pacienti byli poučeni o možném riziku výskytu těchto nežádoucích účinků při zahájení léčby a při každém dalším kroku titrace dávky a aby byli rovněž poučeni, že nemají řídit dopravní prostředky ani obsluhovat stroje, dokud nezjistí, jak je léčba RTG ovlivňuje. Tyto specifické záležitosti by pak měly být vyhodnoceny společně s ošetřujícím, předepisujícím lékařem [1]
Dávkování a způsob podání
RTG je přidáván k již zavedené antiepileptické léčbě. Vždy je titrován podle individuální odpovědi pacienta, s cílem dosáhnout optimálního poměru mezi účinností a snášenlivostí léčby. RTG je užíván perorálně, denně, ve třech dílčích dávkách. Lze jej užívat s jídlem i bez jídla, tablety je třeba spolknout celé, nesmí se žvýkat, drtit ani dělit. Maximální úvodní celková denní dávka je 300 mg (3 × 100 mg). Poté se celková denní dávka postupně zvyšuje o maximálně 150 mg každý týden, podle individuální odpovědi a snášenlivosti léčby. Předpokládá se, že se účinná udržovací dávka pohybuje mezi 600–1200 mg/den [1]. Bezpečnost a účinnost vyšších dávek nebyly stanoveny. U pacientů se středně těžkou nebo těžkou poruchou renálních funkcí (clearance kreatininu < 50 ml/min) a u pacientů se středně těžkou nebo těžkou poruchou jaterních funkcí (Childovo-Pughovo skóre ? 7) se doporučuje 50% snížení úvodní i udržovací dávky RTG, s úvodní dávkou 150 mg/den, zvyšováním dávky o 50 mg každý týden do maximální dávky 600 mg/den. U pacientů s mírnou poruchou renálních a hepatálních funkcí není nutná úprava dávky RTG [1]. U starších pacientů se doporučuje snížit úvodní i udržovací dávky RTG. Celková denní úvodní dávka je 150 mg/den a dávku lze zvyšovat maximálně o 150 mg každý týden, podle individuální odpovědi a snášenlivosti. Nedoporučuje se podávat dávky vyšší než 900 mg/den [1]. Bezpečnost a účinnost retigabinu u dětí mladších 18 let nebyla dosud stanovena. Stejně jako léčbu ostatními antiepileptiky je nutné léčbu RTG ukončovat postupně, s ohledem na individuální riziko relapsu záchvatů. Obvykle v průběhu alespoň 3 týdnů, pokud z důvodu bezpečnosti není nutné přípravek vysadit okamžitě.
Seznam použité literatury
- [1] SPC. Souhrn údajù o pøípravku. Trobalt (retigabinum), GSK, revize textu 27. 10. 2011.
- [2] Plosker GL, Scott LJ. Retigabine in Partial Seizures. CNS Drugs 2006; 20: 601–608.
- [3] Porter JR, Nohria V, Rundfeldt C. Retigabine. Neurotherapeutics 2007; 4: 149–154.
- [4] Deeks ED. Retigabine (Ezogabine) In Partial- -Onset Seizures in Adults with Epilepsy. CNS Drugs 2011; 25: 887–900.
- [5] Porter RJ, Partiot A, Sachdeo R, et al., on behalf of the 205 Study Group. Randomized, multicenter, dose-ranging trial of retigabine for partial-onset seizures. Neurology 2007; 68: 1197–1204.
- [6] French JA, Abou-Khalil BW, Leroy RF, et al. On behalf of the RESTORE 1/Study 301 Investigators. Randomized, double-blind, placebo-controlled trial of ezogabine (retigabine) in partial epilepsy. Neurology 2011; 76: 1555–1563.
- [7] Brodie MJ, Lerche H, Gil-Nagel A, et al. On behalf of the RESTORE 2 Study Group. Efficacy and safety of adjunctive ezogabine (retigabine) in refractory partial epilepsy. Neurology 2010; 75: 1817–1824.
- [8] Leroy RF, Rosenfeld WE, Hall ST, et al. Long- -Term Maintenance of Efficacy with Retigabine 600–1200 mg/day in adult Patients with Refractory Epilepsy: Extension Study of RESTORE 1. 62nd Annual Meeting of American Academy of Neurology; Toronto, ON, Canada, April 10–17: 2010; Poster 193.
- [9] Lerche H, Leroy RF, Hall ST, et al. Long-Term Maintenance of Efficacy with Retigabine 600– 1200 mg/day in adult Patients with Refractory Epilepsy: Extension Study of RESTORE 2. 62nd Annual Meeting of American Academy of Neurology; Toronto, ON, Canada, April 10–17: 2010; Poster 194.
- [10] Elger CE, Brodie M, Lee WJ, et al. Long-Term Maintenance of Efficacy and Tolerability with Retigabine (Ezogabine) 600–1200 mg/day Over 24 Months. 29th International Epilepsy Congress; Rome, Italy, 28 August–1 September 2011; Poster 359.
- [11] Brodie M, Elger CH, Gil-Nagel A, et al. Seizure- -Free Rates in Patients Receiving ? 6, ? 12 and ? 24 Months of Open-Label Retigabine (Ezogabine). 15th Congress of the European Federation of Neurological Societies; Budapest, Hungary, 10–13 September 2011: Poster 237.
- [12] Sarah E, DeRossett SE, Brickel N, Hall ST. Pharmacological Ef fects of Retigabine (Ezogabine) on Bladder Function. 29th International Epilepsy Congress; Rome, Italy, 28 August–1 September 2011: Poster 360.
- [13] Brickel N, Hall ST, DeRossett SE. Cardiac Safety and Rates of Sudden Unexplained Death in Patients with Epilepsy Treated with Retigabine (Ezogabine). 29th International Epilepsy Congress; Rome, Italy, 28 August–1 September 2011: Poster 828.
- [14] Hauser WA, Annegers JF, Kurland LT. Incidence of epilepsy and unprovoked seizures in Rochester, Minnesota: 1935–1984. Epilepsia 1993; 34: 453–468.
- [15] Hovorka J. Farmakologická léèba epilepsie. Cesk Slov Neurol N 2010; 4: 351–373.
- [16] Kwan P, Brodie MJ. Early identification of refractory epilepsy. B Engl J Med 2000; 342: 314–319. [17] Yue C, Yaari Y. KCNQ/M channels control spike afterdepolarization and burst generation in hippocampal neurons. Neurosci 2004; 24: 4614–4624.
- [17] Yue C, Yaari Y. KCNQ/M channels control spike afterdepolarization and burst generation in hippocampal eurons. Neurosci 2004; 24:4614–4624.