Sacituzumab govitekan
Souhrn:
Tesařová P. Sacituzumab govitekan. Remedia 2022; 32: 215–219.
Sacituzumab govitekan je konjugátem protilátky a léku složeným z aktivního metabolitu irinotekanu SN‑38 navázaného na humanizovanou monoklonální protilátku zacílenou na trofoblastický buněčný povrchový antigen 2 (Trop‑2). Trop‑2 je vysoce exprimován na povrchu buněk triple negativního karcinomu prsu (TNBC), což z něj činí atraktivní cíl. Jak doložila studie ASCENT, sacituzumab govitekan prodlužuje přežití u pacientů s dříve léčeným metastatickým TNBC. Mezi časté nežádoucí účinky patří neutropenie, průjem a nauzea, jsou však zvládnutelné podpůrnou péčí.
Summary:
Tesarova P. Sacituzumab govitecan. Remedia 2022; 32: 215–219.
Sacituzumab govitecan is an antibody‑drug conjugate comprised of an active metabolite of irinotecan SN‑38 bound to a humanized monoclonal antibody targeting trophoblastic cell‑surface antigen 2 (Trop‑2). Trop‑2 is highly expressed on the surface of triple‑negative breast cancer (TNBC) cells, making it an attractive target. Sacituzumab govitecan has promising survival benefits in patients with previously treated metastatic TNBC based on data from the ASCENT trial. Common adverse effects were neutropenia, diarrhea, and nausea; however, these effects were manageable with supportive care.
Key words: sacituzumab govitecan, triple negative breast cancer, metastatic disease
Pacientky s metastatickým triple
negativním karcinomem prsu (metastatic triple negative breast
cancer, mTNBC) mají špatnou prognózu. Ještě donedávna také
nebylo k dispozici mnoho léčebných možností oddalujících
progresi onemocnění, nebo dokonce prodlužujících život.
Sacituzumab govitekan je konjugátem
protilátky a léku (antibody drug conjugate, ADC) složeným
z protilátky zacílené na lidský trofoblastový buněčný
povrchový antigen 2 (trophoblast cell surface antigen 2,
Trop 2), který je exprimován u většiny karcinomů prsu,
spojený se SN 38 (inhibitorem topoizomerázy I) prostřednictvím
hydrolyzovatelného linkeru. SN 38 interaguje s topoizomerázou
I a brání opakované ligaci jednořetězcových zlomů
vyvolaných topoizomerázou I. Výsledné poškození DNA vede
k apoptóze (obr. 1) [1].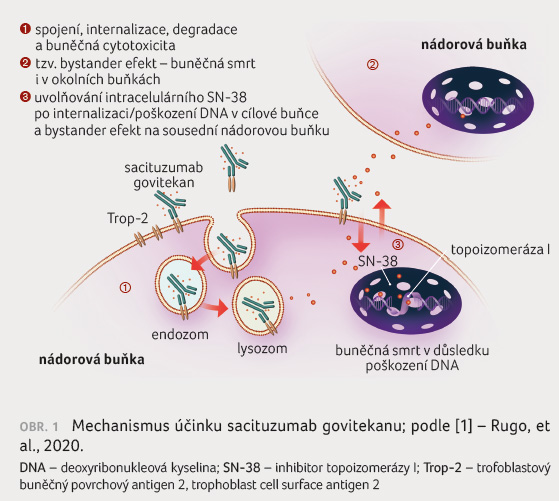
Sacituzumab govitekan je indikován k léčbě dospělých pacientů s neresekovatelným lokálně pokročilým TNBC nebo mTNBC, kteří podstoupili alespoň dvě předchozí terapie, minimálně jednu z nich pro metastatické onemocnění [1].
Farmakokinetika
Farmakokinetika sacituzumab govitekanu
v séru a SN 38 byla hodnocena v populaci
pacientů s mTNBC, kteří dostávali sacituzumab govitekan
v monoterapii v dávce 10 mg/kg tělesné hmotnosti.
Farmakokinetické parametry sacituzumab govitekanu a volného
SN 38 jsou uvedeny v tabulce 1 [2].
Dle farmakokinetických analýz populace byl centrální distribuční objem sacituzumab govitekanu 2,96 litru. Průměrný poločas sacituzumab govitekanu a volného SN 38 činil 15,3 hodiny, resp. 19,7 hodiny. Na základě farmakokinetických analýz populace byla clearance sacituzumab govitekanu 0,14 l/h. SN 38 je metabolizován pomocí UDP glukuronosyltransferázy 1A1 (UGT1A1).
Údaje o farmakokinetice sacituzumab govitekanu u pacientů s poruchou funkce ledvin nejsou k dispozici. Ani farmakokinetika sacituzumab govitekanu u pacientů se středně těžkou nebo těžkou poruchou funkce jater není známa. Expozice SN 38 může být u takových pacientů zvýšená vzhledem ke snížené hepatální aktivitě UGT1A1 [3].
Klinické studie
Účinnost a bezpečnost
sacituzumab govitekanu byly hodnoceny v mezinárodní
multicentrické, otevřené randomizované studii fáze III ASCENT
u 529 pacientů s neresekovatelným, lokálně pokročilým
TNBC nebo mTNBC, u nichž došlo k recidivě po nejméně
dvou předchozích chemoterapiích. Předchozí adjuvantní nebo
neoadjuvantní terapie podávaná pro časný karcinom prsu byla
započítána jako jeden z předchozích režimů, pokud došlo
k návratu lokálně pokročilého nebo metastazujícího
onemocnění do 12 měsíců od ukončení této léčby.
Další prerekvizitou byla terapie taxany. Jako jedna ze dvou
předchozích chemoterapií u pacientů s dokumentovanou
hereditární mutací genu BRCA1/BRCA2 byly povoleny inhibitory
poly ADP ribóza polymerázy (PARP). Pacienti byli
randomizováni v poměru 1 : 1 k terapii sacituzumab
govitekanem v dávce 10 mg/kg podávané v intravenózní
infuzi první den a osmý den 21denního léčebného cyklu,
nebo k léčbě dle výběru lékaře (treatment
physician’s choice, TPC): eribulin (n = 139),
kapecitabin (n = 33), gemcitabin (n = 38) nebo
vinorelbin (n = 52). Rovněž nemocní se stabilními
metastázami v mozku mohli vstoupit do této studie.
Pacienti byli léčeni do progrese onemocnění nebo do neúnosné
toxicity. Primárním cílovým ukazatelem účinnosti bylo přežití
bez progrese (progression free survival, PFS), sekundární cílové
ukazatele účinnosti představovaly: celkové přežití (overall
survival, OS), dosažení objektivní odpovědi (objective response
rate, ORR) a doba trvání odpovědi (duration of response,
DOR), tabulka 2 [2]. Primární analýza zahrnovala
235 pacientů ve skupině se sacituzumab govitekanem
a 233 pacientů ve skupině TPC. Analýza celkové
populace se týkala 267 nemocných ve skupině se sacituzumab
govitekanem a 262 nemocných ve skupině TPC.
Demografické charakteristiky celkové populace (n = 529)
zahrnovaly medián věku 54 let (rozmezí 27–82 let) a 81 %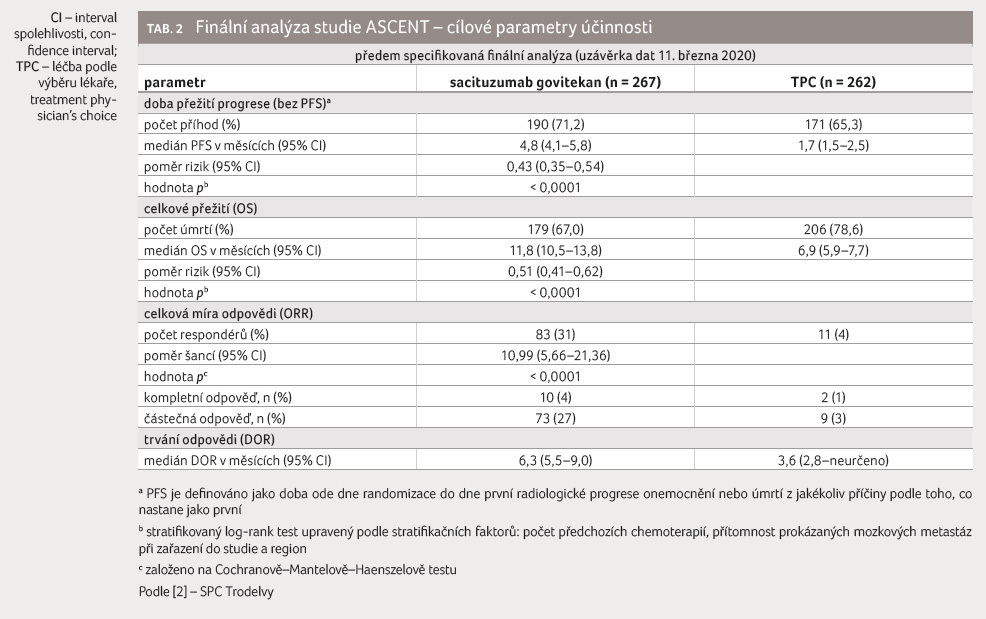 osob mladších 65 let; podíl žen 99,6 %; podíl
bělochů 79 %, podíl černochů 12 %; medián počtu
předchozích systémových terapií 4 – 69 % osob již dříve
absolvovalo 2–3 předchozí chemoterapie, 31 % již dříve
podstoupilo více než 3 předchozí chemoterapie, 42 %
mělo jaterní metastázy, 12 % mělo v současnosti nebo
v anamnéze mozkové metastázy. Celkem 8 % pacientů
bylo pozitivních na mutační stav BRCA1/BRCA2, status BRCA byl
zjištěn pro 339 osob. Při zařazení do studie měli všichni
pacienti stav výkonnosti dle Eastern Cooperative Oncology Group
(ECOG) 0 (43 %) nebo 1 (57 %). Medián doby od diagnózy
generalizace do zařazení do studie činil 16,2 měsíce
(rozmezí –0,4 až 202,9 měsíce) [4].
osob mladších 65 let; podíl žen 99,6 %; podíl
bělochů 79 %, podíl černochů 12 %; medián počtu
předchozích systémových terapií 4 – 69 % osob již dříve
absolvovalo 2–3 předchozí chemoterapie, 31 % již dříve
podstoupilo více než 3 předchozí chemoterapie, 42 %
mělo jaterní metastázy, 12 % mělo v současnosti nebo
v anamnéze mozkové metastázy. Celkem 8 % pacientů
bylo pozitivních na mutační stav BRCA1/BRCA2, status BRCA byl
zjištěn pro 339 osob. Při zařazení do studie měli všichni
pacienti stav výkonnosti dle Eastern Cooperative Oncology Group
(ECOG) 0 (43 %) nebo 1 (57 %). Medián doby od diagnózy
generalizace do zařazení do studie činil 16,2 měsíce
(rozmezí –0,4 až 202,9 měsíce) [4].
V aktualizované analýze
účinnosti byly výsledky v souladu s předem
specifikovanou finální analýzou. Medián PFS činil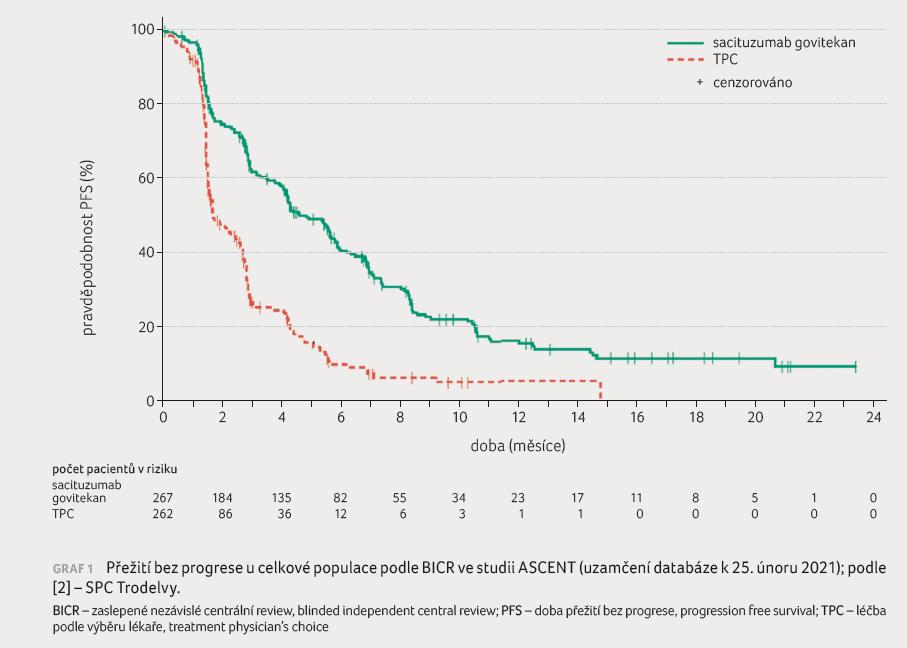 4,8 měsíce
oproti 1,7 měsíce u pacientů léčených sacituzumab
govitekanem, resp. TPC (poměr rizik [HR] 0,41; 95% interval
spolehlivosti [CI] 0,33–0,52), graf 1. Medián OS činil
11,8 měsíce oproti 6,9 měsíce (HR 0,51; 95% CI 0,42–0,63),
graf 2 [2].
4,8 měsíce
oproti 1,7 měsíce u pacientů léčených sacituzumab
govitekanem, resp. TPC (poměr rizik [HR] 0,41; 95% interval
spolehlivosti [CI] 0,33–0,52), graf 1. Medián OS činil
11,8 měsíce oproti 6,9 měsíce (HR 0,51; 95% CI 0,42–0,63),
graf 2 [2].
V analýzách podskupin bylo
zlepšení PFS a OS u pacientů léčených sacituzumab
govitekanem v porovnání s TPC konzistentní ve všech
podskupinách pacientů bez ohledu na věk, rasu, status BRCA,
celkový počet předchozích systémových terapií a při
léčbě metastazujícího onemocnění bez ohledu na předchozí
léčbu antracyklinem nebo na expresi ligandu receptoru
programované buněčné smrti 1 (PD L1) a jaterní
metastázy. Analýza PFS a OS u pacientů s dříve
léčenými, stabilními mozkovými metastázami prokázala
stratifikovaný HR 0,65 (n = 61; 95% CI 0,35–1,22), resp.
HR 0,87 (n = 61; 95% CI 0,47–1,63). Medián PFS
činil 2,8 měsíce oproti 1,6 měsíce, medián OS pak 6,8 měsíce
oproti 7,5 měsíce u pacientů léčených sacituzumab
govitekanem, resp. TPC.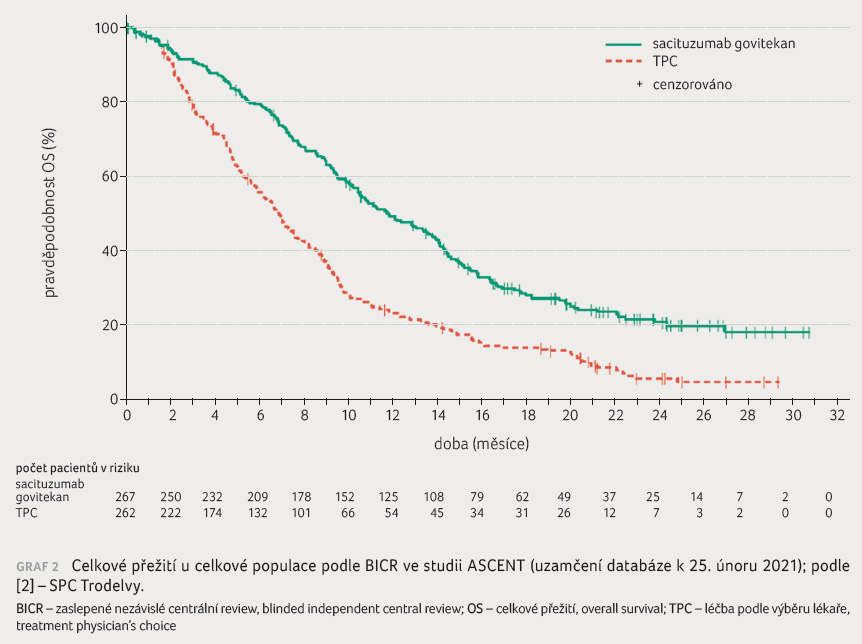
Byly provedeny další analýzy podskupin s cílem vyhodnotit účinnost podle úrovně nádorové exprese Trop 2 a výsledky byly shodné bez ohledu na míru této exprese. U pacientů s nízkými koncentracemi Trop 2 za využití membránového H skóre podle kvartilů byl prokázán přínos sacituzumab govitekanu vůči TPC jak u PFS (HR 0,64; 95% CI 0,37–1,11), tak u OS (HR 0,71; 95% CI 0,42–1,21) [5].
Klinické využití
Sacituzumab govitekan je v monoterapii indikován k léčbě dospělých pacientů s neresekovatelným TNBC nebo mTNBC, kteří podstoupili dvě nebo více předchozích systémových terapií, z nichž alespoň jedna byla cílena na pokročilé onemocnění. Doporučená dávka sacituzumab govitekanu je 10 mg/kg tělesné hmotnosti podávaných ve formě intravenózní infuze jednou týdně první den a osmý den 21denních léčebných cyklů. V léčbě je nutné pokračovat až do progrese onemocnění nebo do nepřijatelné toxicity. Před podáním sacituzumab govitekanu se doporučuje preventivní podávání protialergické terapie a léků na prevenci nauzey a zvracení vyvolaných chemoterapií. Sacituzumab govitekan je určen pouze k intravenóznímu podání. První aplikace formou infuze je doporučeno podávat po dobu tří hodin, při dobré toleranci pak další infuze 1–2 hodiny [6].
Nežádoucí účinky
Bezpečnostní profil sacituzumab govitekanu byl sestaven na základě dat ze dvou klinických studií zahrnujících 366 pacientů, kteří dostávali sacituzumab govitekan v dávce 10 mg/kg tělesné hmotnosti pro léčbu TNBC. Medián expozice sacituzumab govitekanu byl 4,9 měsíce. Nejčastějšími závažnými nežádoucími účinky hlášenými u pacientů léčených sacituzumab govitekanem byly febrilní neutropenie (4,5 %) a průjem (3,6 %). Nejčastějšími nežádoucími účinky všech stupňů závažnosti byly průjem (64,5 %), nauzea (64,2 %), neutropenie (64,2 %), únava (52,5 %), alopecie (44,3 %), anémie (43,2 %), zvracení (38,0 %), zácpa (36,3 %), snížená chuť k jídlu (28,1 %), kašel (22,7 %) a bolest břicha (20,8 %) [6].
Kontraindikace
Kontraindikací podání léku je hypersenzitivita na léčivou látku nebo na kteroukoliv pomocnou látku. Sacituzumab govitekan může způsobit závažnou nebo život ohrožující neutropenii. Nemá být podáván, jestliže absolutní počet neutrofilů je nižší než 1 500/mm3 první den kteréhokoliv cyklu nebo nižší než 1 000/mm3 osmý den kteréhokoliv cyklu. Proto se doporučuje během léčby sledovat krevní obraz pacientů, jak je klinicky indikováno [7].
Sacituzumab govitekan nemá být podáván v případě febrilní neutropenie. Mohou být nutné léčba faktorem stimulujícím kolonie granulocytů a úprava dávky. Lék může rovněž způsobit závažný průjem. Sacituzumab govitekan nemá být podáván v případě výskytu průjmu stupně 3–4 v době plánované léčby a léčba má pokračovat teprve po zlepšení na stupeň 1 nebo nižší. Při nástupu průjmu a v případě, že nelze identifikovat žádnou příčinu infekce, je nutné zahájit léčbu loperamidem. Lze také uplatnit další podpůrná opatření (např. substituce tekutin a elektrolytů), jak je klinicky indikováno [7].
Lékové interakce
U pacientů léčených irinotekanem byl genotyp UGT1A1*28 spojen se závažnějšími toxicitami a homozygoti UGT1A1*28 měli často závažnou neutropenii. Ve studii s tzv. basket uspořádáním (jeden lék napříč diagnózami) fáze I/II analýza tří haplotypů UGT1A1 (*1*1, *1*28 a *28*28) zjistila, že u homozygotů UGT1A1*28 byla numericky častější neutropenie všech stupňů, ale nebyl nalezen signifikantní vztah mezi expresí alely a průjmem u pacientů léčených sacituzumab govitekanem. V současné době neexistují žádná doporučení k testování tohoto genotypu u pacientů, kteří zahajují léčbu sacituzumab govitekanem. Pacienti, u nichž je známa homozygotnost UGT1A1, by však měli být pečlivě sledováni z hlediska neutropenie. Mezi léky, které není vhodné užívat současně se sacituzumab govitekanem, patří inhibitory UGT1A1 (amitriptylin, ketokonazol, ketoprofen, atazanavir) a induktory UGT1A1 (klofibrát, kortizol, fenobarbital, spironolakton, streptozotocin, rifampicin, třezalka tečkovaná) [7].
Seznam použité literatury
- [2] SPC Trodelvy. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/trodelvy‑epar‑product‑information_cs.pdf
- [3] Bardia A, Hurvitz SA, Tolaney SM, et al.; ASCENT Clinical Trial Investigators. Sacituzumab Govitecan in Metastatic Triple‑Negative Breast Cancer. N Engl J Med 2021; 384: 1529–1541.
- [4] Bardia A, Tolaney SM, Punie K, et al. Biomarker analyses in the phase III ASCENT study of sacituzumab govitecan versus chemotherapy in patients with metastatic triple‑negative breast cancer. Ann Oncol 2021; 32: 1148–1156.
- [5] Bardia A, Hurvitz SA, Rugo HS, et al. A plain language summary of the ASCENT study: Sacituzumab Govitecan for metastatic triple‑negative breast cancer. Future Oncol 2021; 17: 3911–3924.
- [6] O’Shaughnessy J, Brufsky A, Rugo HS, et al. Analysis of patients without and with an initial triple‑negative breast cancer diagnosis in the phase 3 randomized ASCENT study of sacituzumab govitecan in metastatic triple‑negative breast cancer. Breast Cancer Res Treat 2022; https://doi.org/10.1007/s10549‑022‑06602‑7.
- [7] Schreiber AR, Andress M, Diamond JR. Tackling metastatic triple‑negative breast cancer with sacituzumab govitecan. Expert Rev Anticancer Ther 2021; 21: 1303–1311.