Sarilumab – nový blokátor receptoru pro IL‑6 v léčbě revmatoidní artritidy
Souhrn:
Pavelka K. Sarilumab – nový blokátor receptoru pro IL‑6 v léčbě revmatoidní artritidy. Remedia 2020; 30: 321–327.
Interleukin 6 (IL‑6) představuje pleomorfní cytokin, který hraje významnou roli v imunopatogenezi revmatoidní artritidy (RA). Svědčí o tom zvýšené koncentrace IL‑6 v synoviální tekutině a v séru nemocných s RA a korelace s aktivitou RA. Sarilumab (Kevzara) je plně humánní IgG1 monoklonální protilátka, která se specificky váže na solubilní i membránově vázaný receptor pro IL‑6 (sIL‑6Rα a mIL‑6Rα) a tímto mechanismem blokuje signalizaci uvedených receptorů. Přípravek byl testován u širokého spektra pacientů s RA, tzn. pacientů selhávajících při léčbě metotrexátem (MTX), konvenčními syntetickými chorobu modifikujícími antirevmatickými léky a přípravky anti‑TNF (tumor nekrotizující faktor). Fáze III klinického zkoušení obsahovala celkem sedm klinických studií. Zásadní byly tři studie: MOBILITY u pacientů se selháním léčby MTX, TARGET u pacientů selhávajících při anti‑TNF terapii a MONARCH. Ve všech sledováních bylo dosaženo primárního cílového ukazatele, když přípravek prokázal výbornou účinnost na aktivitu onemocnění, a to jak klinickou, tak laboratorní, a zpomaloval rentgenovou progresi choroby. Studie MONARCH doložila větší účinnost sarilumabu v monoterapii v porovnání s adalimumabem (Disease Activity Score 28: –3,28 vs. –2,2; p < 0,001). Bezpečnost sarilumabu odpovídá bezpečnostnímu profilu inhibitoru IL‑6. Zaznamenán byl mírně zvýšený výskyt závažných infekcí, dále pak neutropenie, elevace hodnot jaterních testů a hypercholesterolemie. Přípravek se podává formou subkutánních injekcí v dávce 200 mg po dvou týdnech a při zjištěných laboratorních odchylkách je vhodné snížení na dávku 150 mg subkutánně po dvou týdnech. Pro léčbu sarilumabem jsou indikováni pacienti, kteří musejí podstupovat vynucenou monoterapii, nemocní s vysokými hodnotami C‑reaktivního proteinu a osoby s komorbiditami (bolest, únavnost, anémie aj.). Výhodou oproti léčbě tocilizumabem je to, že se jedná o plně humánní protilátku s menší imunogenicitou, dále pak možnost podávání ve dvoutýdenních intervalech, flexibilita dávkování a snadná aplikace pomocí předplněné stříkačky či předplněného pera.
Summary:
Pavelka K. Sarilumab – new IL‑6 receptor blocker in the treatment of rheumatoid arthritis. Remedia 2020; 30: 321–327.
Interleukine 6 (IL‑6) represents a pleomorphic cytokine that plays an important role in the immunopathogenesis of rheumatoid arthritis (RA), as evidenced by increased concentrations of IL‑6 in the synovial fluid and serum of patients with RA and correlation with disease activity. Sarilumab (Kevzara) is a fully humane IgG monoclonal antibody that specifically binds soluble and membrane‑bound IL‑6 receptor (sIL‑6Rα and mIL‑6Rα) and blocks their signalization. The medicinal product was tested in a wide spectrum of patients with RA, i.e., patients failing on metotrexate (MTX), conventional synthetic disease‑modifying antirheumatic drugs and anti‑TNF (tumor necrosis factor). Phase III of clinical evaluation contained seven clinical studies. Three studies were crucial: MOBILITY in MTX‑failing patients, TARGET in anti‑TNF‑failing patients and MONARCH. Primary endpoint was reached in all evaluations; the medicinal product proved to be highly efficacious in both clinical and laboratory disease activity and it slowed down X‑ray progression of the disease. Evidence from the MONARCH study showed increased efficacy of sarilumab in monotherapy in comparison with adalimumab (Disease Activity Score 28: ‒3.28 vs. ‒2.2; p < 0.001). The safety of sarilumab corresponds with the safety profile of IL‑6 inhibitor. Minor increase in serious infections, neutropenia, liver test elevation and hypercholesterolemia has been noted. The medicinal product is administered in subcutaneous injections of 200 mg every 3 weeks, with a decrease to 150 mg subcutaneously every 2 weeks if laboratory abnormalities are recorded. Patients undergoing forced monotherapy, patients with high levels of C‑reactive protein and patients with comorbidities (pain, fatigue, anemia, etc.) are indicated for sarilumab treatment. Compared with tocilizumab treatment, the advantage is that it is a fully humane antibody with lower immunogenicity. Furthermore, it can be administered every 2 weeks, with flexible dose and easy application with a pre‑loaded injection or pen.
Key words: rheumatoid arthritis, interleukine 6 inhibitor, sarilumab.
Úvod
Revmatoidní artritida (RA) je
zánětlivé autoimunitní onemocnění charakterizované chronickou
zvýšenou aktivací zánětlivého systému a destrukcí
kloubů. Kloubní příznaky při RA vznikají následkem
perzistujícího zánětu synoviální membrány, která vyvolává
destrukci kloubní chrupavky a přilehlé kosti, jež může
vést ke zhoršené funkci a disabilitě [1]. Revmatoidní
artritida představuje systémové onemocnění, takže kromě
postižení kloubních struktur jsou velmi často přítomny
i systémové projevy. Nejčastějšími jsou únava (80 %),
plicní projevy (až 60 %), anémie (33–60 %), osteoporóza
(30 %), deprese (15 %) a kardiovaskulární projevy (13 %),
obrázek 1 [2].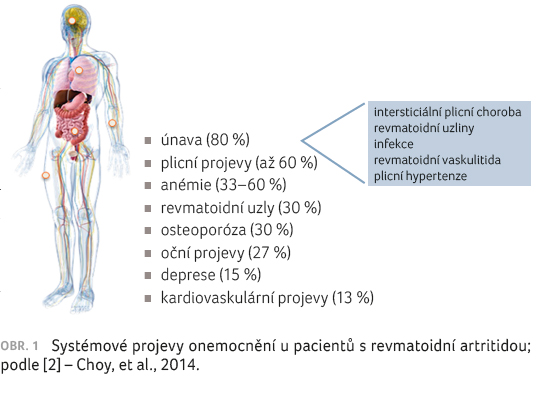
Úloha interleukinu 6
Imunopatogeneze RA je složitý děj, do kterého jsou zahrnuty jak procesy vrozené, tak i adaptivní imunity. Výraznou roli hraje aktivace některých prozánětlivých cytokinů. Jedním z nejdůležitějších je interleukin 6 (IL 6). Jde o pleomorfní cytokin, který ovlivňuje četné buňky uvnitř imunitního systému, ale i mimo něj (obr. 2) [3–7]. O jeho významu pro RA svědčí i fakt, že koncentrace IL 6 jsou v synoviální tekutině a v séru nemocných s RA v poměru ke zdravým kontrolám relativně zvýšené [8] a korelují s aktivitou onemocnění [9]. Zvýšené koncentrace IL 6 v kloubu potencují zánět a přispívají k tvorbě zánětlivého pannu (obr. 3) [10,11]. Interleukin 6 má v organismu dvě signální dráhy zprostředkované svými receptory – membránově vázaným a solubilním (sIL 6Rα a mIL 6Rα). Za normálních okolností dochází k vazbě receptoru pro IL 6 (IL 6R) a IL 6 na buněčný povrch zprostředkované transdukčním proteinem gp130. Signální dráha gp130 aktivovaná IL 6 funguje i na buněčných površích, které neexprimují membránově vázaný receptor IL 6 [10]. Kromě buněk imunitního systému IL 6 aktivuje synoviální fibroblasty a dále pak formování osteoklastů, jež v kombinaci s redukovanou kostní formací zvyšuje kostní resorpci, tedy charakteristický rys RA [12]. Studie in vitro a na zvířecích modelech prokázaly zásadní úlohu IL 6 při indukci jak kostních resorptivních faktorů (ligand pro receptor aktivátoru nukleárního faktoru kappa B, RANKL), tak destruktivních faktorů chrupavky (matrixové metaloproteinázy, MMP) revmatoidními synoviálními fibroblasty [13]. Kromě imunokompetentních buněk ovlivňuje IL 6 např. syntézu C reaktivního proteinu (CRP) v játrech, stimulací hepcidinu pak vznik anémie a další systémové projevy RA, jako jsou horečka, únava a systémová osteoporóza [14]. Jiný inhibitor IL 6 tocilizumab je humanizovaná monoklonální protilátka proti IL 6R, která prokázala účinnost u RA, a to v monoterapii i v kombinaci s konvenčními syntetickými chorobu modifikujícími antirevmatickými léky (csDMARDs) [15]. Kromě symptomatického efektu inhiboval tocilizumab rovněž strukturální progresi [16]. V přímé srovnávací studii byl tocilizumab účinnější než blokátor tumor nekrotizujícího faktoru (TNF) [17].
Sarilumab
Sarilumab (Kevzara) je plně humánní IgG1 monoklonální protilátka, která se specificky váže na sIL 6Rα a mIL 6Rα a tímto mechanismem blokuje signalizaci uvedených receptorů. Na experimentálních zvířecích modelech potlačoval sarilumab humorální imunitní odpověď. Účinky během léčby byly konzistentní s farmakologickou inhibicí signalizace IL 6, včetně sarilumabem indukované neutropenie a redukce hodnoty CRP. Ve studii s jednou dávkou 150 mg nebo 200 mg sarilumabu byly pozorovány podobné farmakologické účinky v průběhu prvního týdne léčby jako po intravenózní aplikaci tocilizumabu v dávce 4 a 8 mg/kg. Čas návratu k původním hodnotám (CRP, neutropenie) byl konzistentní s 2–4týdenním dávkovým intervalem obou těchto inhibitorů IL 6 [18].
Farmakokinetika sarilumabu byla zkoušena u pacientů s RA, kterým byl přípravek podáván subkutánně v dávkách 150 mg a 200 mg každé dva týdny po dobu 52 týdnů. Maximální koncentrace sarilumabu bylo docíleno za 2–4 dny s ustáleným stavem (steady state) za 14–16 týdnů. Expozice sarilumabu ve dvoutýdenních intervalech byla dvakrát vyšší při dávce 200 mg ve srovnání se 150 mg. Metabolická cesta sarilumabu není známa. Iniciální eliminační poločas činí 8–10 dní a terminální eliminační poločas 2–4 dny. Monoklonální protilátky nejsou eliminovány ani renálními, ani hepatálními mechanismy. Pohlaví, rasa ani tělesná hmotnost nemají vliv na farmakokinetiku. Farmakokinetická data naznačují, že mírné až střední poškození renální funkce farmakokinetiku neovlivňuje, pacienti s těžkým poškozením funkce ledvin nebyli hodnoceni [19].
Účinnost
v klinických studiích
Po ukončení preklinického
testování a studií fáze I a II bylo přistoupeno
k fázi III klinického hodnocení sarilumabu. Přípravek byl
zkoušen u širokého spektra pacientů s RA, tzn. pacientů
selhávajících při léčbě metotrexátem (MTX), csDMARDs
a anti TNF (tab. 1)
[20–22]. Fáze III klinického sledování obsahovala celkem sedm
klinických studií. Zásadní pak byly tři studie popsané
podrobněji níže.
Nejdůležitější studií se
sarilumabem, někdy také označovanou za pivotní, je MOBILITY,
do níž byli zařazováni pacienti se středně a silně
aktivní RA. Uspořádání studie nebylo zcela obvyklé, neboť šlo
o kombinované sledování fáze II a III
(MOBILITY A a MOBILITY B). Studie A byla
dávková, do studie B byli zařazováni pacienti, kteří již
byli ve fázi A léčeni dávkami 150 mg a 200 mg
sarilumabu s.c. každý druhý týden. Ve fázi B byli tedy
nemocní randomizováni do skupin podle výše zmíněných
dávek sarilumabu v kombinaci s MTX nebo s placebem
v kombinaci s MTX. Pokud u pacientů nebyla
do 16. týdne zaznamenána odpověď na léčbu
ve smyslu zlepšení o 20 % v počtu citlivých
a oteklých kloubů, byli převedeni k tzv. záchranné
medikaci sarilumabem v dávce 200 mg s.c. každé dva týdny.
Studie sledovala tři primární cílové ukazatele: odpověď ACR20
(20% zlepšení podle American College of Rheumatology) ve 24. týdnu,
zlepšení fyzické funkce v 16. týdnu (Health Assessment
Questionnaire Disability Index, HAQ DI) a změnu
v rentgenové progresi v 52. týdnu. Do studie
bylo zařazeno celkem 1 369 pacientů s průměrným
věkem 50 let, s průměrným trváním nemoci devět let,
s hodnotou DAS28 (Disease Activity Score) CRP 6,0 a CRP
20 mg/l. Přibližně 20 % pacientů mělo v anamnéze léčbu
biologickým DMARD (bDMARD). Všechny primární, ale i sekundární
cílové ukazatele byly splněny. Odpověď ACR20 ve 24. týdnu
byla signifikantně vyšší po obou dávkách sarilumabu oproti
placebu (58 %, resp. 66,4 %, resp. 33,45 %; p < 0,0001),
hodnoty HAQ DI v 16. týdnu činily –0,53, resp.
–0,55, resp. –0,29; p < 0,0001)
a průměrná změna Sharpova skóre v 52. týdnu
0,90, resp. 0,25, resp. 2,78;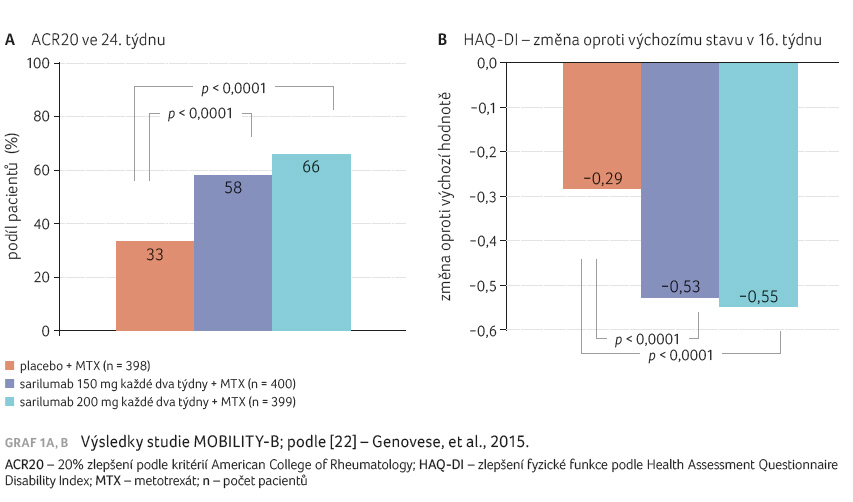 p < 0,001
(graf 1A, B).
Signifikantně lepší výsledky sarilumabu v kombinaci s MTX
oproti placebu s MTX byly zaznamenány rovněž u všech
sekundárních cílových ukazatelů [22]. V separátní
publikaci byly analyzovány tzv. pacientem hodnocené ukazatele,
konkrétně HAQ DI, pacientovo hodnocení (Patient Global
Assessment, PtGA), bolest (vizuální analogová škála, VAS),
kvalita života (SF 36, Short Form Health Survey) a únavnost
(Functional Assessment of Chronic Illness Therapy, FACIT).
Po obou dávkách sarilumabu v kombinaci s MTX oproti
placebu s MTX bylo docíleno signifikantního zlepšení
(p < 0,0001)
ve 24. týdnu a toto zlepšení přetrvávalo
do 52. týdne [23].
p < 0,001
(graf 1A, B).
Signifikantně lepší výsledky sarilumabu v kombinaci s MTX
oproti placebu s MTX byly zaznamenány rovněž u všech
sekundárních cílových ukazatelů [22]. V separátní
publikaci byly analyzovány tzv. pacientem hodnocené ukazatele,
konkrétně HAQ DI, pacientovo hodnocení (Patient Global
Assessment, PtGA), bolest (vizuální analogová škála, VAS),
kvalita života (SF 36, Short Form Health Survey) a únavnost
(Functional Assessment of Chronic Illness Therapy, FACIT).
Po obou dávkách sarilumabu v kombinaci s MTX oproti
placebu s MTX bylo docíleno signifikantního zlepšení
(p < 0,0001)
ve 24. týdnu a toto zlepšení přetrvávalo
do 52. týdne [23].
Druhou zásadní studií se sarilumabem
byla TARGET [24]. Cílem této studie bylo ověřit účinnost
sarilumabu u pacientů, u kterých v minulosti léčba
anti TNF selhala. Do studie byli zařazováni pacienti se
středně a silně aktivní RA a byli randomizováni
do skupin s dávkou 150 mg a 200 mg sarilumabu
podávaného s.c. po dvou týdnech nebo do skupiny
s placebem. Studijní léčba byla podávána v kombinaci
s csDMARD, které pacient užíval před vstupem do hodnocení.
Primární cílové ukazatele představovaly odpověď ACR20
ve 24. týdnu a změna funkce hodnocená
prostřednictvím HAQ DI ve 12. týdnu. Hodnocena byla
rovněž řada sekundárních cílových ukazatelů. Do sledování
bylo zařazeno celkem 546 pacientů. Průměrná délka trvání RA
činila 12,1 roku. Metotrexát v monoterapii nebo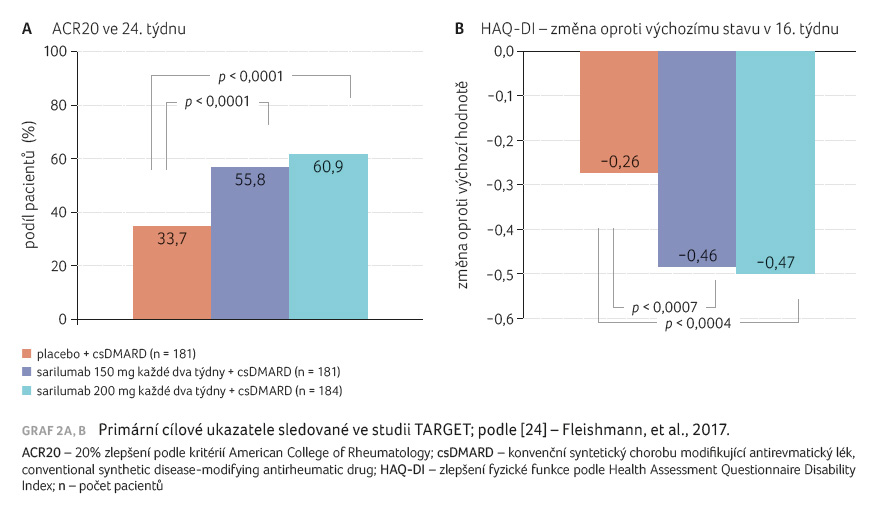 s jinými
csDMARDs byl nejčastějším lékem užívaným v kombinaci.
Většina pacientů (74,6–79,4 %) užívala v minulosti
jeden anti TNF přípravek. Průměrná hodnota DAS28 CRP
činila 6,2 a průměrná hodnota CRP 26 mg/l. Ve studii
bylo dosaženo obou primárních cílových ukazatelů (graf 2A, B). Konkrétně v odpovědi ACR20 byly výsledky
následující: sarilumab v dávce 150 mg a 200 mg
55 %, resp. 60,9 % vs. 33,7 % u placeba (p < 0,0001).
Průměrná změna HAQ DI byla významnější po obou
dávkách sarilumabu ve srovnání s placebem (150 mg:
–0,46, p = 0,0007;
200 mg: –0,47, p = 0,0004
vs. placebo: –0,26). Statisticky významné rozdíly u dávek
150 mg a 200 mg sarilumabu oproti placebu byly nalezeny
i ve všech sekundárních cílových ukazatelích. Studie
neměla statistickou sílu k porovnání dávek 150 mg
a 200 mg sarilumabu.
s jinými
csDMARDs byl nejčastějším lékem užívaným v kombinaci.
Většina pacientů (74,6–79,4 %) užívala v minulosti
jeden anti TNF přípravek. Průměrná hodnota DAS28 CRP
činila 6,2 a průměrná hodnota CRP 26 mg/l. Ve studii
bylo dosaženo obou primárních cílových ukazatelů (graf 2A, B). Konkrétně v odpovědi ACR20 byly výsledky
následující: sarilumab v dávce 150 mg a 200 mg
55 %, resp. 60,9 % vs. 33,7 % u placeba (p < 0,0001).
Průměrná změna HAQ DI byla významnější po obou
dávkách sarilumabu ve srovnání s placebem (150 mg:
–0,46, p = 0,0007;
200 mg: –0,47, p = 0,0004
vs. placebo: –0,26). Statisticky významné rozdíly u dávek
150 mg a 200 mg sarilumabu oproti placebu byly nalezeny
i ve všech sekundárních cílových ukazatelích. Studie
neměla statistickou sílu k porovnání dávek 150 mg
a 200 mg sarilumabu.
Třetí zásadní studií je projekt
MONARCH. Cílem klinického hodnocení bylo porovnat účinnost
a bezpečnost sarilumabu v monoterapii ve srovnání
s adalimumabem [25]. Do studie byli zařazováni pacienti,
kteří nemohli pokračovat v léčbě MTX z důvodů
netolerance nebo nedostatečné účinnosti MTX. Nemocní byli
randomizováni do větve, která dostávala sarilumab v dávce
200 mg každý druhý týden s.c. a adalimumab v dávce
40 mg s.c. každý druhý týden. Primární cílový ukazatel
představovala změna oproti výchozí hodnotě DAS28 ESR
(rychlost sedimentace erytrocytů) ve 24. týdnu.
V primárním kritériu byl sarilumab účinnější než
adalimumab (–3,28 vs. –2,2; p < 0,001), graf 3. Při hodnocení
odpovědí ACR20/50/70 byly výsledky ve prospěch sarilumabu
rovněž signifikantně lepší: ACR20/50/70 pro sarilumab 71,7 %,
45,7 %, 23,4 %; ACR20/50/70 pro adalimumab 58,4 %, 29,7 %,
11,9 % (p = 0,0074).
Signifikantní rozdíly byly zaznamenány i ve všech
dalších sekundárních ukazatelích.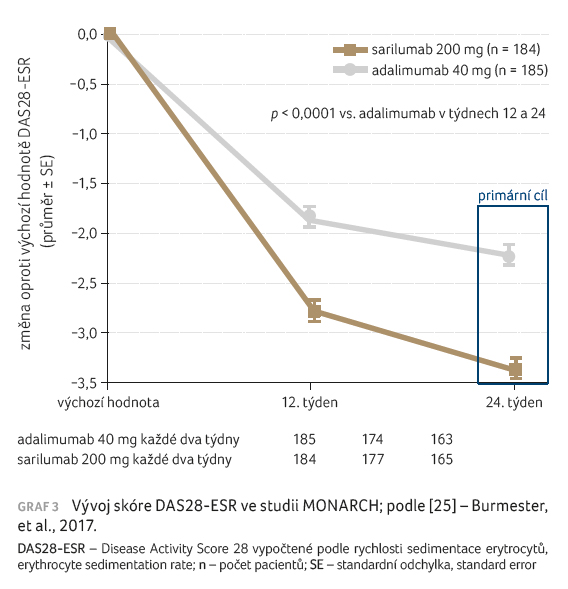
Bezpečnost sarilumabu
Bezpečnostní data byla získána ze sedmi zmíněných randomizovaných klinických studií a z jejich otevřených extenzí. Souhrnně lze říci, že bezpečnostní profil sarilumabu je srovnatelný s ostatními bDMARDs a velmi se blíží především jinému inhibitoru IL 6 tocilizumabu.
Výskyt infekcí
Infekce představovaly ve všech studiích nejčastější nežádoucí účinek. Důležité jsou především závažné infekce. Ve studii MOBILITY činila frekvence výskytu závažných infekcí po dávkách sarilumabu 150 mg, 200 mg a po placebu 2,6 %, 4,0 % a 2,3 %. Oportunní infekce se vyskytly při podávání sarilumabu v dávce 150 mg v 0,7 %, při dávce 200 mg pak v 0,9 % a v případě placeba v 0,5 % [22]. Nevyskytly se žádné případy tuberkulózy a bylo zachyceno celkem šest případů lokalizovaného herpes zoster při léčbě sarilumabem a dva případy ve skupině s placebem. Studie MONARCH umožnila vyhodnotit výskyt infekcí při monoterapii sarilumabem v dávce 200 mg ve srovnání s adalimumabem v dávce 40 mg [25]. Výskyt všech infekcí byl téměř identický (sarilumab 28,8 %, adalimumab 27,7 %). K nejčastějším nežádoucím reakcím patřily bronchitida a onemocnění horního dýchacího traktu. Závažné infekce byly vzácné a stejně časté v obou skupinách (1,1 %). Ve studii ASCERTAIN byla srovnávána bezpečnost sarilumabu v dávce 200 mg s intravenózně aplikovaným tocilizumabem. Závažné infekce se vyskytly ve 2 % při léčbě tocilizumabem, v 0 % při léčbě sarilumabem v dávce 150 mg a ve 2 % při léčbě sarilumabem v dávce 200 mg [26].
Další
klinické nežádoucí účinky
Z dalších klinických nežádoucích účinků s větší frekvencí než 3 % je nutné zmínit lokální bolestivé reakce v místě vpichu. Ve studii TARGET se vyskytly v 7,2 % po sarilumabu v dávce 150 mg, v 8,2 % po sarilumabu v dávce 200 mg a v 1,1 % po placebu. Tyto reakce byly většinou mírné intenzity a nevedly k přerušení léčby. Hypersenzitivní projevy se vyskytly v 6 % po sarilumabu a v 3,9 % po placebu [24]. Nebyl zaznamenán vyšší výskyt malignit, divertikulitid, autoimunitních onemocnění a demyelinizačních onemocnění.
Laboratorní nežádoucí účinky
Neutropenie se vyskytly napříč klinickými studiemi. Ve studii TARGET se neutropenie mezi limitem pod dolní hranicí normy a hodnotou 1,0 × 109/litr vyskytly při léčbě sarilumabem v dávce 150 mg ve 24,9 %, při léčbě sarilumabem v dávce 200 mg ve 29,5 % a v placebové skupině ve 3,3 %. Výskyt závažného poklesu počtu neutrofilů na méně než 1,0 × 109/l byl pozorován u pacientů léčených sarilumabem v dávce 150 mg v 7,7 %, po léčbě sarilumabem 200 mg v 9,8 % a po podávání placeba v 0,6 %. Poklesy v absolutním počtu neutrofilů se vyskytly většinou na počátku léčby s tendencí k pozdější normalizaci. Ani u pacientů s výraznou neutropenií nenastal vyšší výskyt závažných infekcí. K normalizaci hodnoty alaninaminotransferázy (ALT) také často vedla redukce dávek z 200 mg na 150 mg s.c. každé dva týdny. Výrazně vzácněji byly zjišťovány trombocytopenie.
Elevace hodnoty ALT trojnásobně nad normu se ve studii TARGET vyskytly v případě sarilumabu v dávce 150 mg ve 2,2 %, u sarilumabu v dávce 200 mg ve 4,3 % a po placebu v 1,1 %. Většinou bylo zvýšení ALT asymptomatické. Snížení dávek sarilumabu z 200 mg na 150 mg často vedlo k normalizaci hodnoty ALT.
Podobně jako při léčbě jiným inhibitorem IL 6 tocilizumabem [26] docházelo při léčbě sarilumabem ke zvýšení koncentrací LDL cholesterolu. Konkrétně ve studii TARGET to bylo ve skupině sarilumabu v dávce 150 mg ve 46 %, ve skupině sarilumabu v dávce 200 mg ve 44,5 % a ve skupině s placebem u 24 % pacientů [24]. Protože však docházelo i ke zvýšení hodnot HDL cholesterolu, neměnil se index HDL/LDL. Léčba statiny byla indikována ve skupině sarilumabu v dávce 150 mg pouze ve 4 % a ve skupině sarilumabu v dávce 200 mg pak ve 4,3 %. V celé databázi pacientů léčených sarilumabem nebyl zaregistrován vyšší výskyt velkých kardiovaskulárních komplikací (tzv. MACE, major cardiovascular events) [17].
Na začátku léčby sarilumabem ve studii TARGET měli pacienti zvýšené hodnoty CRP a snížené koncentrace albuminu, hemoglobinu a cholesterolu, což jsou nálezy konzistentní se zjištěními u pacientů se středně a silně aktivní RA. Terapie sarilumabem vedla k příznivým změnám těchto parametrů, což je dáváno do souvislosti s blokádou IL 6 signalizace a s protizánětlivou odpovědí.
V hodnoceních byl rovněž sledován výskyt protilátek proti sarilumabu, který činil 4,9–6,1 % [24]. Nebyl pozorován žádný vztah tvorby protilátek proti léku s poklesem účinnosti nebo s výskytem hypersenzitivních reakcí.
Způsob podávání a indikace
Sarilumab se podává formou subkutánních injekcí v dávce 200 mg po dvou týdnech. Při zjištěných laboratorních odchylkách je vhodné snížení dávky na 150 mg s.c. každé dva týdny. Sarilumab je indikován k léčbě dospělých pacientů s RA, u nichž došlo k selhání léčby MTX nebo jiným csDMARD. Při netoleranci nebo nevhodnosti léčby MTX a při vynucené monoterapii je pak inhibitor IL 6 indikován k léčbě jako vhodnější alternativa než monoterapie anti TNF (podpořeno výsledky studií MONARCH a ADACTA). Toto je i znění doporučení EULAR [27] a České revmatologické společnosti ČLS JEP [28].
Kteří
pacienti jsou vhodní k léčbě sarilumabem
Definitivně nejvhodnějšími jsou pacienti, kteří musejí podstupovat monoterapii bDMARD, neboť csDMARD netolerují. Dle evropských kohortových studií to může být až 30 % pacientů. Tato léčba je vhodná i pro nemocné s vysokými hodnotami reaktantů akutní fáze, protože je známo, že inhibice IL 6 velmi rychle a efektivně snižuje např. hodnotu CRP. Sarilumab je vhodný i pro pacienty s komorbiditami – například s anémií, únavou či s depresí –, které ovlivňuje inhibice IL 6 více než anti TNF.
Sarilumab může mít také dílčí výhody oproti tocilizumabu. Na rozdíl od tocilizumabu je plně humánní protilátkou a má až 20× vyšší afinitu k IL 6R. Sarilumab se rovněž podává ve dvoutýdenních intervalech a je dostupný ve dvou efektivních dávkách, tocilizumab se podává jednou týdně. Sarilumab je k dispozici ve formě předplněné injekce nebo předplněného pera, které jsou designově výborně řešené a představují komfort i pro pacienty s deformitami rukou.
Závěr
Sarilumab je novým biologickým lékem, jehož mechanismem účinku je blokáda IL 6R. V procesu klinického zkoušení prokázal velmi dobrý poměr účinnost/riziko a určitě rozšíří armamentarium léků pro léčbu aktivní RA. Blokáda IL 6 může být vhodná i u dalších systémových onemocnění pojiva, ale je nutné v tomto směru provést randomizované kontrolované studie.
Seznam použité literatury
- [1] Scott DL, Wolfe W, Huizinga TW. Rheumatoid arthritis. Lancet 2010; 376: 1094–1108.
- [2] Choy E, Ganeshalingam K, Semb AG, et al. Cardiovascular risk in rheumatoid arthritis: recent advances in the understanding of the pivotal role of inflammation, risk predictors and the impact of treatment. Rheumatology (Oxford) 2014; 53: 2143–2154.
- [3] Chomarat P, Banchereau J, Davoust J, Palucka AK. IL‑6 switches the differentiation of monocytes from dendritic cells to macrophages. Nat Immunol 2000; 1: 510–514.
- [4] Choy E. Understanding the dynamics: pathways involved in the pathogenesis of rheumatoid arthritis. Rheumatology (Oxford) 2012; 51: v3–v11.
- [5] Castell JV, Gómez‑Léchon MJ, David M, et al. Recombinant human interleukin‐6 (IL‐6/BSF‐2/HSF) regulates the synthesis of acute phase proteins in human hepatocytes. FEBS Lett 1988; 232: 347–350.
- [6] Imai T, Koike K, Kubo T, et al. Interleukin‑6 supports human megakaryocytic proliferation and differentiation in vitro. Blood 1991; 78: 1969–1974.
- [7] Scheller J, Garbers C, Rose‑John S. Interleukin‑6: From basic biology to selective blockade of pro‑inflammatory activities. Semin Immunol 2014; 26: 2–12.
- [8] Houssiau FA, Devogelaer JP, Van Damm J, et al. Interleukin‑6 in synovial fluid and serum of patients with rheumatoid arthritis and other inflammatory arthritides. Arthritis Rheum 1988; 31: 784–788.
- [9] Sritangan S, Choy EH. The role of interleukin‑6 in the pathophysiology of rheumatoid arthritis. Ther Adv Musculoscelet Dis 2010; 2: 247–256.
- [10] Dayer JM, Choy E. Therapeutic targets in rheumatoid arthritis. The interleukin 6‑ receptor. Rheumatology (Oxford) 2010; 49: 115–224.
- [11] McInnes IB, Schett G. Cytokines in the pathogenesis of rheumatoid arthritis. Nat Rev Immunol 2007; 7: 429–442.
- [12] Kotake S, Sato K, Kim KJ, et al. Interleukin‑6 and soluble interleukin 6‑receptors in the synovial fluids from rheumatoid arthritis patients are responsible for osteoclast‑like cell formation. J Bone Miner Res 1996; 11: 88–95.
- [13] Hashizume M, Hayakawa N, Mihara M, et al. IL‑6 trans‑signaling directly induces RANKL on fibroblast‑like synovial cells and is involved in RANKL induction by TNFα and IL‑17. Rheumatology (Oxford) 2008; 47: 1635–1640.
- [14] Weiss G, Schett G. Anaemia in inflammatory rheumatic diseases. Nat Rev Rheumatol 2013; 9: 205–215.
- [15] Schoels MM, van der Heijde D, Breedveld FC, et al. Blocking the effects of interleukin 6 in rheumatoid arthritis and other inflammatory rheumatic diseases: systematic literature review and metaanalysis informing a consensus statement. Ann Rheum Dis 2013; 72: 583–589.
- [16] Smolen JS, Avila JC, Aletaha D, et al. Tocilizumab inhibits progression of joint damage in rheumatoid arthritis irrespective of its anti‑inflammatory effects. Dissociation of the link between inflammation and destruction. Ann Rheum Dis 2012; 71: 687–693.
- [17] Giles JT, Sattar N, Gabriel SE, et al. Comparative cardiovascular safety of tocilizumab vs etanercept in rheumatoid arthritis: results of a randomized, parallel group, multicenter, noninferiority, phase 4 clinical trial. Arthritis Rheumatol 2016; 68(Suppl 10): 4357–4359.
- [18] Mangan EK, Parrino J, Wu R, et al. Pharmacodynamic effect and safety of single‑dose administration of subcutaneous sarilumab or intravenous tocilizumab in patients with rheumatoid arthritis. Int J Rheum Dis 2016; 19(Suppl 2): 196.
- [19] SPC KevzaraTM. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/kevzara‑epar‑product‑information_cs.pdf [Accessed 6 Mar 2017].
- [20] Huizinga TW, Fleischmann RM, Jasson M, et al. Sarilumab, a fully human monoclonal antibody against IL‑6Rα in patients with rheumatoid arthritis and an inadequate response to methotrexate: efficacy and safety results from the randomised SARIL‑RA‑MOBILITY Part A trial. Ann Rheum Dis 2014; 73: 1626–1634.
- [21] https://clinicaltrials.gov
- [22] Genovese MC, Fleischmann R, Kivitz AJ, et al. Sarilumab plus MTX in patients with active rheumatoid arthritis and inadequate response to MTX. Arthritis Rheumatol 2015; 67: 1424–1437.
- [23] Strand V, Kosinski M, Chiech‑I Chen, et al. Sarilumab plus MTX improves patient reported outcomes in patients with active rheumatoid arthritis and inadequate responses to MTX: results of a phase III. trial. Arthritis Res Ther 2016; 18: 198.
- [24] Fleishmann R, Adelsberg J, Yong L, et al. Sarilumab and non‑biologic DMARD in patients with active rheumatoid arthritis and inadequate response or intolerance to tumor necrosis factor inhibitors. Arthritis Rheumatol 2017; 69: 277–290.
- [25] Burmester G, Yong Lin, Patel R, et al. Efficacy and safety of sarilumab monotherapy versus adalimumab monotherapy for the treatment of patients with active rheumatoid arthritis (MONARCH): a randomised, double blind, parallel‑group phase III trial. Ann Rheum Dis 2017; 76: 840–847.
- [26] Emery P, Rondon J, Garg A, et al. Safety and Tolerability of Subcutaneous Sarilumab and intravenous Tocilizumab in patents with RA. Abstr 971; ACR 2015, November 2015, San Francisco.
- [27] Smolen J, Landewé R, Bijlsma J, et al. EULAR recommendations for the management of rheumatoid arthritis with synthetic and biological disease‑modifying antirheumatic drugs: 2016 update. Ann Rheum Dis 2016; 75: 3–15.
- [28] Šenolt L, Mann H, Závada J, Pavelka K, Vencovský J. Doporučení České revmatologické společnosti pro farmakoterapii revmatoidní artritidy 2017. Česká revmatologie 2017; 1: 8–24.