Satralizumab
Souhrn:
Nytrová P. Satralizumab. Remedia 2021; 31: 360–366.
Satralizumab je humanizovaná monoklonální protilátka proti receptoru pro interleukin 6, která redukuje riziko relapsu u pacientů s neuromyelitis optica a onemocněními jejího širšího spektra (NMOSD). NMOSD patří mezi vzácná chronická autoimunitní onemocnění centrálního nervového systému, která se odlišují od roztroušené sklerózy a jsou asociována s protilátkami proti akvaporinu 4 (AQP4‑IgG) u více než dvou třetin pacientů. Interleukin 6 hraje významnou roli v patogenezi těchto poruch. Mezi typické klinické projevy patří ataky optických neuritid, myelitid, syndromu area postrema (singultus, nauzea, zvracení). Ataky onemocnění způsobují výraznou invaliditu pacienta, která přetrvává i přes akutní terapii. Prevence rozvoje a zmínění tíže atak je hlavním cílem chronické léčby.
Summary:
Nytrova P. Satralizumab. Remedia 2021; 31: 360–366.
Satralizumab, a humanized monoclonal antibody targeting the interleukin‑6 receptor, reduced the risk of relapse in patients with neuromyelitis optica spectrum disorder (NMOSD). NMOSD are rare chronic inflammatory central nervous system diseases distinct from multiple sclerosis and are associated with autoantibodies to aquaporin‑4 (AQP4‑IgG) in approximately two thirds of patients. Interleukin‑6 is involved in the pathogenesis of the disorders. In NMOSD, most common symptoms are optic neuritis, acute myelitis or signs of brainstem involvement like persistent hiccup, nausea or vomiting (area postrema syndrome). Attacks in NMOSD are often characterized by severe neurologic deficits with poor recovery. Frequently, a significant disability persists after an attack. Therefore, attack occurrence and severity prevention is the key issue of chronic treatment strategy.
Key words: aquaporin‑4 autoantibodies, neuromyelitis optica spectrum disorders, satralizumab
Farmakologická skupina a indikace
Satralizumab (Enspryng) je řazen do farmakologické skupiny imunosupresiv a inhibitorů interleukinů. ATC kód je L04AC19. Indikací léčby satralizumabem je neuromyelitis optica a onemocnění jejího širšího spektra (neuromyelitis optica spectrum disorders, NMOSD) s pozitivitou protilátek proti akvaporinu 4 (AQP4 IgG) v monoterapii nebo v kombinaci s imunosupresivní terapií (kortikosteroidy, azathioprinem nebo mykofenolát mofetilem) u dospělých a adolescentů starších 12 let [1,2].
Dávkování
Zahájení terapie satralizumabem zahrnuje tři dávky 120 mg subkutánně v rozmezí 14 dnů (tedy v 0., 2. a 4. týdnu vždy jedna předplněná injekce 120 mg s.c.). Standardní dávkování pak pokračuje 120 mg satralizumabu jedenkrát za čtyři týdny (s.c. do oblasti břicha nebo stehen). Pokud je pacient zaučen, jak léčivý přípravek správně aplikovat, není při dalších podáních vázán na zdravotnická zařízení.
Před zahájením léčby je vždy nutno provést screeningová vyšetření vylučující zejména aktivní virové hepatitidy a jiná jaterní onemocnění, latentní či aktivní tuberkulózu, popř. jiná akutní infekční onemocnění. Je potřeba také znát hodnoty aktuálního krevního obrazu s diferenciálním rozpočtem včetně absolutních hodnot. Monitoruje se rovněž lipidogram.
Pokud dojde ke vzestupu hodnot alaninaminotransferázy (ALT) a aspartátaminotransferázy (AST) nad pětinásobek hranice normy doprovázené vzestupem bilirubinu, léčbu musíme přerušit. Léčba se může opakovaně začít dávkou 120 mg 1 za čtyři týdny, pokud se normalizují hodnoty bilirubinu a ALT a AST a přetrvává přínos terapie pro pacienta. Dojde-li však k dalším elevacím AST/ALT a/nebo bilirubinu, pak musí být terapie ukončena zcela.
Při terapii satralizumabem může dojít také k rozvoji neutropenie. Pokud je počet neutrofilů opakovaně nižší než 1,0 109/l, je doporučováno léčbu přerušit a počkat, než se zvýší počet neutrofilních granulocytů nad tuto hodnotu.
Podobně postupujeme při poklesu počtu trombocytů pod 75 109/l potvrzeného i v kontrolním odběru, kdy opět přerušíme terapii satralizumabem do doby, než dojde ke zvýšení jejich počtu nad tuto hodnotu.
Bezpečnost léčby u pediatrické populace s hmotností nižší než 40 kg nebyla zkoumána. Úprava dávky není potřeba ani u seniorů starších 65 let.
Kontrolní krevní testy jsou doporučeny jednou za čtyři týdny v prvních třech měsících léčby a poté jednou za tři měsíce, jestliže to zdravotní stav pacienta nevyžaduje jinak [1,2].
Pacient musí být poučen, že je potřeba včasné odhalení jakýchkoliv infekcí včetně zahájení jejich adekvátní terapie. Nelze také spoléhat na hodnoty C-reaktivního proteinu jako adekvátního markeru bakteriálních infekcí, protože jeho syntéza v jaterním parenchymu je snížena v důsledku blokády signalizace interleukinu 6 (IL 6). U pacienta, u kterého se rozvine jakákoliv závažná infekce, musí být léčba satralizumabem odložena či přerušena. Nemocný musí v případě projevů a příznaků infekcí neprodleně vyhledat lékařskou pomoc.
Neuromyelitis optica a možnosti
chronické léčby
Neuromyelitis optica a onemocnění jejího širšího spektra jsou imunitně zprostředkovaná onemocnění centrálního nervového systému (CNS), nejčastěji s relabujícím remitujícím průběhem, která se manifestují optickými neuritidami, myelitidami a méně často i kmenovými či cerebrálními příznaky. I jediný relaps může vést k těžké invaliditě pacienta (slepota, těžká kvadruparéza či paraparéza a další). První manifestace onemocnění se může projevit v kterékoliv dekádě života [3−5].
Termín neuromyelitis optica (NMO) ukotvil na konci 19. století profesor Eugène Devic jako monofázický syndrom charakterizovaný bilaterální optickou neuritidou a transverzální myelitidou [6]. Řadu desetiletí byla NMO považována za podtyp roztroušené sklerózy s těžkým remitujícím průběhem, nicméně průlom v pohledu na toto onemocnění nastal v roce 2004, kdy byly objeveny vysoce specifické autoprotilátky pro toto onemocnění, tzv. NMO imunoglobulin G (NMO IgG). O rok později byl popsán cílový antigen těchto protilátek – akvaporin 4 (což vedlo k úpravě názvu na AQP4 IgG) [7,8]. AQP4 IgG jsou autoprotilátky patogenní a po navázání na AQP4 exprimovaný astrocyty spouští celou kaskádu zánětlivé odpovědi, která může vést až k rozsáhlým nekrózám se sekundární demyelinizací. Tyto protilátky nacházíme až u 80 % pacientů a mluvíme o AQP4 IgGpozNMOSD. Uvedené autoprotilátky s jistotou odliší NMOSD od roztroušené sklerózy. Na podkladě nových poznatků došlo také k revizi Wingerchukových diagnostických kritérií pro NMO v roce 2006 a k zavedení termínu neuromyelitis optica spectrum disorders (NMOSD) o rok později [1,9]. Tato kritéria byla později uplatňována i v rámci klinických studií. Přibližně u 20 % pacientů tyto protilátky nenacházíme, i když klinickým obrazem a pomocnými vyšetřeními stanovíme diagnózu NMOSD.
Vzhledem k často těžkým průběhům této nemoci, které mohou pacienty ohrožovat i na životě během atak myelitid s neurogenně podmíněným respiračním selháním, bylo nutné kromě akutní terapie hledat též terapii chronickou, jež by zabránila rozvoji atak a/nebo zmírnila jejich tíži a tím i invaliditu pacienta. Ještě do roku 2020 jsme v chronické terapii prakticky vycházeli z retrospektivních či observačních studií, kazuistik a názoru expertů. Mezi nejčastěji používané léky v off label indikaci u NMOSD patří azathioprin, rituximab, mykofenolát mofetil a tocilizumab v monoterapiích nebo v kombinaci s perorálními kortikosteroidy [10]. Na základě výsledků multicentrických, dvojitě zaslepených, placebem kontrolovaných studií máme nově on label chronickou terapii pro AQP4 IgGpozNMOSD. Jedním z těchto léčivých přípravků je satralizumab. Ten je již registrován pro terapii AQP4 IgGpozNMOSD, ačkoliv v tuto chvíli zatím nemá v České republice úhradu. Vzhledem k prokázanému efektu i u pacientů po jediné atace tohoto onemocnění a dobrému bezpečnostnímu profilu předpokládáme jeho využití v první linii léčby. Prevence relapsů má i zásadní ekonomický dopad, protože kromě nákladů na akutní terapii (pulzy kortikosteroidů, vysokodávkované intravenózní imunoglobuliny a plazmaferézy) může jediný relaps nemoci způsobit zásadní invaliditu omezující práceschopnost jedince včetně nutnosti péče druhé osoby.
V klinické praxi je také zcela zásadní odlišení NMOSD od roztroušené sklerózy, protože řada léčivých přípravků používaných v chronické terapii u pacientů s roztroušenou sklerózou může zhoršit průběh NMOSD (např. natalizumab, fingolimod, interferon beta).
Mechanismus účinku
Satralizumab je rekombinantní humanizovaná monoklonální protilátka podtřídy imunoglobulinu G2 (IgG2), která se váže na solubilní i membránový receptor pro IL 6 (IL 6R) a tím blokuje signální dráhu IL 6 [11].
Koncentrace IL 6 jsou u pacientů
s NMOSD zvýšené v séru i mozkomíšním moku během
relapsu onemocnění. Tento interleukin zasahuje do patogeneze
AQP4-
IgGpozNMOSD v několika
úrovních. Potencuje zrání naivních T lymfocytů
v prozánětlivou subpopulaci Th17, která spolu s IL 6
podporuje diferenciaci B lymfocytů v AQP4 IgG produkující
plazmablasty. Interleukin 6 rovněž ovlivňuje funkci
hematoencefalické bariéry a zvyšuje její propustnost
(obr. 1) [12-16].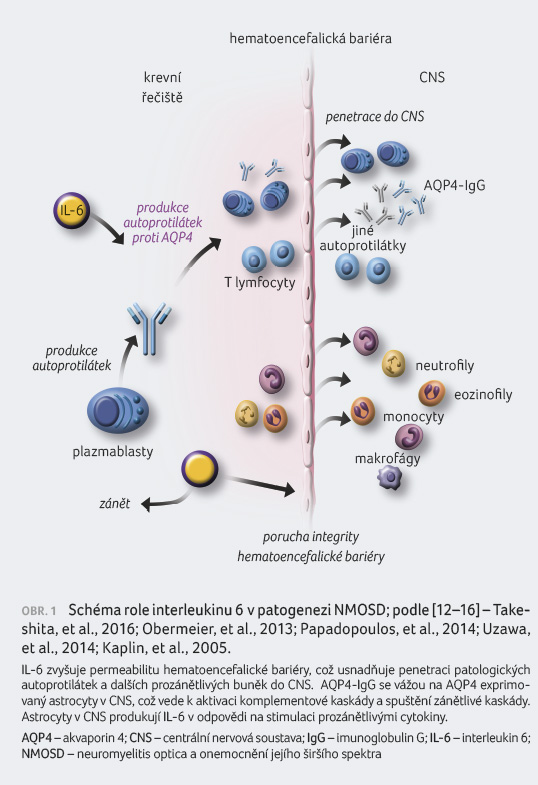
Satralizumab není první monoklonální protilátkou blokující IL 6R, nicméně díky moderní technologii recyklace protilátek se prodloužil jeho poločas eliminace. Satralizumab totiž disociuje od svého navázaného antigenu v kyselém prostředí buňky a uvolňuje se zpět do krevního řečiště, a může tedy opět navázat další receptory pro IL 6 [11].
Farmakokinetické vlastnosti
Farmakokinetika satralizumabu byla charakterizována u zdravých dobrovolníků japonského a indoevropského původu (kavkazského), dále u pacientů s NMO a NMOSD.
Parametry clearance a distribučního objemu satralizumabu byly alometricky škálovány podle tělesné hmotnosti (prostřednictvím funkce výkonu s fixním koeficientem výkonu rovným 0,75 pro parametry clearance a 1 pro parametry distribučního objemu). Prokázalo se, že tělesná hmotnost je významným kovariátem, přičemž u pacientů vážících 123 kg (97,5. percentil distribuce podle tělesné hmotnosti) v porovnání s pacientem o hmotnosti 60 kg byla clearance zvýšena o 71,3 % a distribuční objem o 105 %.
Rovnovážných hodnot bylo dosaženo po období podávání nasycovací dávky (8 týdnů) a pro minimální plazmatickou koncentraci, maximální plazmatickou koncentraci a plochu pod křivkou plazmatické koncentrace v rovnovážném stavu byly získány tyto hodnoty: (průměr; ± SD): cmin 19,7 (12,2) μg/ml; cmax 31,5 (14,9) μg/ml a AUC 737 (386) μg.ml/den.
Rychlostní konstanta absorpce satralizumabu činila 0,0104/h a odpovídala poločasu absorpce přibližně tři dny (66 h) při podání doporučené dávky. Biologická dostupnost byla 85,4 %. Satralizumab podléhá dvojfázové distribuci. Distribuční objem v centrálním kompartmentu činil 3,46 l a distribuční objem v periferním kompartmentu 2,07 l. Clearance mezi kompartmenty byla 14 ml/h.
Protože protilátky, a tedy i satralizumab, podléhají výlučně katabolismu, nebyl metabolismus (biotransformace) přímo zkoumán. U biologické léčby založené na podávání protilátek je často otázkou její imunogenicita. Ve studii fáze III BN40898 (kombinace s imunosupresivní terapií) a BN40900 (v monoterapii) byly protilátky proti léku (anti drug antibodies, ADA) zjištěny u 41 % a 71 % pacientů, kteří dostávali satralizumab ve dvojitě zaslepené fázi. Schopnost ADA neutralizovat vazbu satralizumabu k IL 6R není známa. Nezjistil se žádný vliv ADA na bezpečnost a žádný zřetelný vliv na účinnost či na farmakodynamické markery svědčící o interakci mezi léčivem a cílovou molekulou.
Celková clearance satralizumabu je závislá na koncentraci. Lineární clearance (představující přibližně polovinu z celkové clearance v rovnovážném stavu při podávaní doporučené dávky pacientům s NMO a s NMOSD) je odhadována na 2,50 ml/h. Související biologický poločas t1/2 je asi 30 dní (rozmezí 22–37 dní) na základě údajů ze studií fáze III. Věk ani etnicita výrazně neovlivňují farmakokinetiku satralizumabu. I když tělesná hmotnost ovlivňuje farmakokinetiku satralizumabu, nedoporučují se žádné úpravy dávky v souvislosti s těmito demografickými charakteristikami. Úprava dávek není potřeba ani u pacientů s renální insuficiencí. Ve studiích fáze III byli zařazeni pacienti s mírnou poruchou funkce ledvin (clearance kreatininu ≥ 50 ml/min a < 80 ml/min) [1].
Klinické zkušenosti
Satralizumab byl zkoušen ve dvou klinických studiích fáze III. Do studií byli zařazeni pacienti s NMO/NMOSD, s pozitivitou AQP4 IgG i bez ní.
První studie (SAkuraSKY, BN40898) byla uspořádána dle konceptu „time to event“ (doba do relapsu). Pacienti (n = 83) byli randomizováni v poměru 1 : 1 (účinná látka satralizumab vs. placebo) dle roční frekvence relapsů = 1 a > 1 a geografické oblasti. U pacientů bylo možné ponechat povolenou imunosupresivní terapii ve stabilní dávce (kortikosteroidy, azathioprin nebo mykofenolát mofetil). Do studie byli zařazeni také adolescenti ve věku od 12 let. Satralizumab 120 mg byl podáván subkutánně v týdnu 0, 2, 4 a pak každé čtyři týdny. Primárním cílovým ukazatelem studie byla doba do prvního relapsu. Klíčové sekundární cílové ukazatele představovaly změny: 1. bolesti hodnocené v týdnu 0 a 24 pomocí vizuální analogové škály (VAS, 0-100) a 2. únavy hodnocené v týdnu 0 a 24 pomocí testu Functional Assessment of Chronic Illness Therapy Fatigue (FACIT F, 0-52 bodů).
Dvojitě zaslepená perioda trvala
do doby 26. relapsu naplňujícího kritéria pro relaps
dle protokolu studie, který byl uznán panelem odborníků. Medián
setrvání pacienta v zaslepené části studie činil 107,4
týdne. Poté mohli nemocní pokračovat v terapii v otevřené
fázi studie. Osm ze 41 pacientů (20 %) léčených
satralizumabem vyvinulo relaps. V placebové větvi byla ataka
zaznamenána u 18 ze 42 pacientů (43 %). Osmdesát devět
procent pacientů léčených satralizumabem bylo po 48 týdnech
terapie bez relapsu v porovnání s 66 % v placebové
větvi (62% redukce rizika relapsu; graf 1). U pacientů
s pozitivitou AQP4 IgG se snížila roční frekvence
relapsů o 88 %. Nebyl zaznamenán signifikantní rozdíl mezi
léčenými pacienty a pacienty v placebové skupině
ve změně skóre VAS a FACIT F.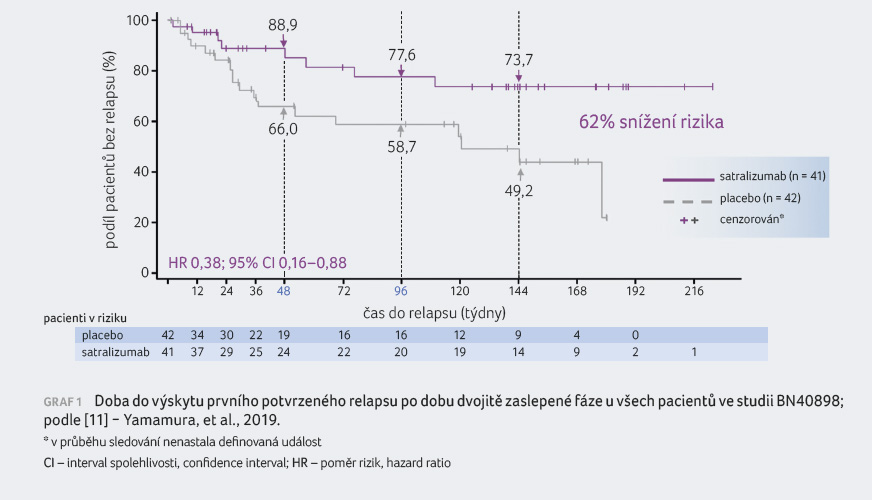
Ještě výraznější byl efekt satralizumabu na redukci rizika relapsu, pokud byli hodnoceni pouze pacienti s pozitivitou AQP4 IgG. Zde byl zaznamenán relaps pouze u 11 % léčených pacientů v porovnání se 43 % v placebové skupině. Naopak nebyl zaznamenán signifikantní vliv terapie na redukci rizika relapsů u pacientů AQP4 IgG séronegativních.
Pokud se podíváme na nežádoucí účinky a závažné nežádoucí účinky v obou skupinách, není mezi nimi signifikantní rozdíl. Nedošlo k žádnému úmrtí nebo anafylaktické reakci během studie. Injekční reakce byly častější ve skupině léčené satralizumabem, ale u žádného z pacientů nevedly k ukončení terapie. Devět procent osob ukončilo terapii satralizumabem pro nežádoucí účinky ve dvojitě zaslepené nebo pokračovací fázi studie. Výše uvedená data vztahující se k této studii byla publikována Yamamurou a kol. v roce 2019 [11].
Druhou studií zkoušející satralizumab u pacientů s NMO/NMOSD byla SAkuraSTAR (BN40900), opět v konceptu time to event, ale nebyla zde povolena další imunosuprese. Do studie bylo zařazeno 95 pacientů randomizovaných v poměru účinná látka versus placebo v poměru 2 : 1 dle předchozí léčby. Hodnocení bylo určeno pro dospělé pacienty s minimálně jedním relapsem v posledních 12 měsících před vstupem do studie. Primární cílový ukazatel představovala opět doba do prvního relapsu definovaného dle protokolu. Sedmdesát šest procent pacientů léčených satralizumabem bylo po 48 týdnech terapie bez relapsu v porovnání s 61,9 % osob v placebové větvi (55% redukce rizika relapsu; graf 2). V rámci sekundárních cílových ukazatelů, jež byly definovány stejně
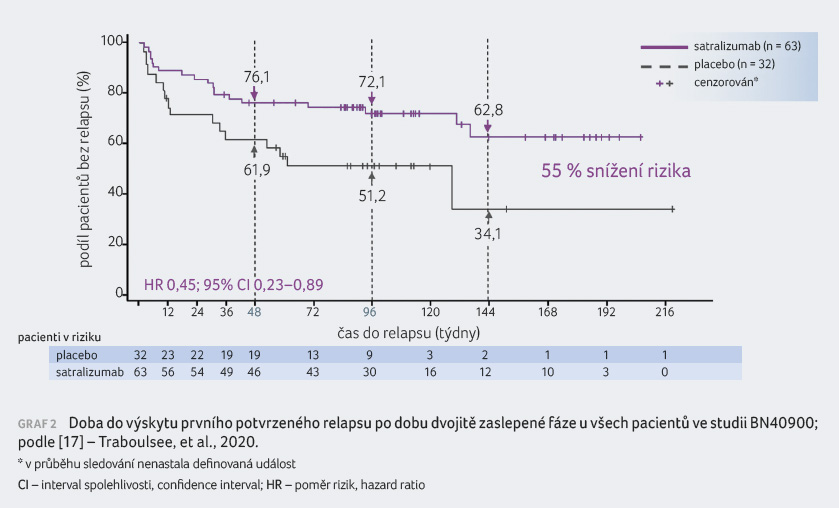
jako ve studii SAkuraSKY, nebyly zjištěny signifikantní rozdíly ve změně bolesti či únavy ve skupině léčené satralizumabem nebo placebem. Rovněž zde byl potvrzen dobrý bezpečnostní profil léku. Mezi nejčastější nežádoucí účinky patřily bolesti hlavy nebo končetin, infekce horních cest dýchacích, artralgie a další [17]. Subanalýzy týkající se efektu u skupiny pacientů AQP4 IgGnegNMOSD nebylo možné provést pro malý počet pacientů.
Kontraindikace
Podávání satralizumabu není možné v případě výskytu aktivních virových hepatitid a jiných závažných jaterních onemocnění, latentní či aktivní tuberkulózy, popř. jiných závažných akutních či chronických infekčních onemocnění. Dále nelze léčivý přípravek podávat u pacientů s elevacemi jaterních testů, neutropenií a trombocytopenií nad/pod horní či dolní hranicí normy, jak je uvedeno výše v odstavci Dávkování.
Lékové a další interakce
V populačních farmakokinetických analýzách nebyl zjištěn žádný vliv na clearance satralizumabu. Nicméně cytokiny včetně IL 6 potlačují expresi specifických jaterních enzymů cytochromu P450 (CYP450): CYP1A2, CYP2C9, CYP2C19 a CYP3A4. Proto je třeba obezřetnosti v okamžiku zahájení nebo ukončení terapie satralizumabem u pacientů, kteří jsou léčeni také substráty CYP3A4, CYP1A2, CYP2C9 nebo CYP2C19, zejména substráty s úzkým terapeutickým indexem (například warfarin, karbamazepin, fenytoin a teofylin). V případě potřeby je pak nutno upravit dávky těchto léčiv. Účinek satralizumabu může přetrvávat několik týdnů po ukončení terapie [2].
Reprodukční toxicita a fertilita
Podávání satralizumabu v prenatálním i postnatálním období u gravidních opic nevedlo k rozvoji nežádoucích účinků na matku, vývoj plodu či výsledek gravidity ani na přežívání a vývoj mláďat. U opic také nebyly zjištěny žádné účinky satralizumabu na reprodukční orgány samic a samců. Nejsou dostupná data o efektu satralizumabu na fertilitu, graviditu a vývoj plodu u lidí [1].
Kojení
Nejsou k dispozici údaje o vylučování satralizumabu do lidského mléka. Je známo, že lidský IgG se vylučuje do mateřského mléka během prvních dnů po porodu a následně v krátkém čase klesá na nízké koncentrace. Riziko pro kojené dítě proto nemůže být vyloučeno po dobu tohoto krátkého období. Po jeho uplynutí se použití satralizumau během kojení může zvážit v případě, že se předpokládá výrazný klinický prospěch pro matku [1].
Vakcinace
Vakcinace živými nebo atenuovanými vakcínami není během léčby satralizumabem doporučována, proto je v případě očkování těmito vakcínami třeba dodržet minimální časový odstup čtyř týdnů před zahájením terapie. V případě neživých vakcín je minimální doporučovaný odstup dva týdny [1].
Seznam použité literatury
- [1] SPC Enspryng. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/enspryng‑epar‑product‑information_cs.pdf
- [2] SPC Enspryng. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/enspryng‑epar‑product‑information_sk.pdf
- [3] Wingerchuk DM, Lennon VA, Lucchinetti CF, et al. The spectrum of neuromyelitis optica. Lancet Neurol 2007; 6: 805−815.
- [4] Wingerchuk D, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015; 85: 177–189.
- [5] Nytrova P, Kleinova J, Preiningerova Lizrova J, et al. Neuromyelitis optica a poruchy jejího širšího spektra – Retrospektivní analýza klinických a paraklinických nálezů. Cesk Slov Neurol N 2015; 78/111: 72−77.
- [6] Devic E. Myélite aiguë dorso‑lombaire avec névrite optique. − Autopsie. In Congrès français de médecine (Premiere Session; Lyon, 1894; procès‑verbaux, mémoires et discussions; publiés par M. le Dr L. Bard). Paris: Lyon: Asselin et Houzeau, Louis Savy; 1895: 434–439.
- [7] Lennon VA, Wingerchuk DM, Kryzer TJ, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 2004; 364: 2106−2112.
- [8] Lennon VA, Kryzer TJ, Pittock SJ, et al. IgG marker of optic‑spinal multiple sclerosis binds to the aquaporin‑4 water channel. J Exp Med 2005; 202: 473−477.
- [9] Wingerchuk DM, Lennon VA, Pittock SJ, et al. Revised diagnostic criteria for neuromyelitis optica. Neurology 2006; 66: 1485−1489.
- [10] Vachová M. Chronická a symptomatická léčba neuromyelitis optica a onemocnění jejího širšího spektra. Cesk Slov Neurol N 2020; 83/116(Suppl 1): 62−67.
- [11] Yamamura T, Kleiter I, Fujihara K, et al. Trial of Satralizumab in Neuromyelitis Optica Spectrum Disorder. N Engl J Med 2019; 381: 2114−2124.
- [12] Takeshita Y, Obermeier B, Cotleur AC, et al. Effects of neuromyelitis optica‑IgG at the blood‑brain barrier in vitro. Neurol Neuroimmunol Neuroinflamm 2016; 4: e311.
- [13] Obermeier B, Daneman R, Ransohoff RM. Development, maintenance and disruption of the blood‑brain barrier. Nat Med 2013; 19: 1584−1596.
- [14] Papadopoulos MC, Bennett JL, Verkman AS. Treatment of neuromyelitis optica: state‑of‑the‑art and emerging therapies. Nat Rev Neurol 2014; 10: 493−506.
- [15] Uzawa A, Mori M, Kuwabara S. Cytokines and chemokines in neuromyelitis optica: pathogenetic and therapeutic implications. Brain Pathol 2014; 24: 67−73. Erratum in: Brain Pathol 2014; 24: 428. Masahiro, Mori [corrected to Mori, Masahiro].
- [16] Kaplin AI, Deshpande DM, Scott E, et al. IL‑6 induces regionally selective spinal cord injury in patients with the neuroinflammatory disorder transverse myelitis. J Clin Invest 2005; 115: 2731−2741.
- [17] Traboulsee A, Greenberg BM, Bennett JL, et al. Safety and efficacy of satralizumab monotherapy in neuromyelitis optica spectrum disorder: a randomised, double‑blind, multicentre, placebo‑controlled phase 3 trial. Lancet Neurol 2020; 19: 402−412.