Sugammadex
Sugammadex je modifikovaný g-cyklodextrin, který je schopen vázat svalová relaxancia aminosteroidního typu a tím antagonizovat jejich účinek. Jedná se o zcela jinou koncepci antagonizace svalových relaxancií než s běžně používanými inhibitory acetylcholinesterázy (AChE). Molekula g-cyklodextrinu je schopna pevně vázat rokuronium nebo vekuronium (chelace) a tím rychle ukončit jejich účinek na nikotinových receptorech nervosvalové ploténky. Možností kontrolovat délku bloku se zařadila steroidní relaxancia do skupiny tzv. soft drugs – farmak s velmi dobře řiditelným účinkem. Pokusy na zvířatech, zejména primátech, a klinické studie na dobrovolnících prokázaly jasnou závislost vztahu dávky sugammadexu a jeho účinku. Při mělké blokádě (druhá odpověď při TOF stimulaci) je doporučena dávka 4 mg/kg, při hluboké blokádě (bez odpovědi při TOF stimulaci) se doporučuje dávka 8 mg/kg a při bezprostředním antagonizování vysokých dávek rokuronia se podává 12–16 mg/kg sugammadexu.
Klasické inhibitory AChE mají velké množství nežádoucích účinků. Po podání vysoké dávky neostigminu se může vyskytnout paradoxní svalová slabost při již téměř úplném zotavení neuromuskulárních funkcí. Hluboký neuromuskulární blok nemůže neostigmin antagonizovat ani ve vysoké dávce, protože již nemůže dále zvýšit dostupnost acetylcholinu. Přednosti použití sugammadexu spočívají v možnosti udržování hlubokého neuromuskulárního bloku až do konce chirurgického výkonu a v přesné kontrole délky bloku vyvolaného rokuroniem. Vyhneme se nežádoucím účinkům v důsledku farmakologické antagonizace inhibitory AChE. Antagonizování sugammadexem je také 5krát rychlejší než antagonizace neostigminem. Anesteziologické techniky nemají vliv na rychlost účinku. Hlavním nežádoucím účinkem u dobrovolníků byl slabý kašel a porušené vnímání chuti, u některých se vyskytly známky hypersenzitivity v podobě kožních reakcí. Podání sugammadexu může ovlivňovat hormonální antikoncepci. Při poddávkování může dojít k opětovnému výskytu blokády.
Farmakologická skupina
Sugamma-dex je antagonista steroidních myorelaxancií. Je schopen selektivně vázat svalová relaxancia aminosteroidního typu (Selective Relaxant Binding Agent – SRBA) a tvořit s nimi pevné komplexy. Název pochází ze slov sugar (cukr) a gamma-dex (vztahující se k molekule gamma-cyklodextrinu). ATC kód je V03AB35.
Chemické a fyzikální vlastnosti
Sugamma-dex je modifikovaný gamma-cyklodextrin (obr. 1), který tvoří jasné a bezbarvé nebo slabě žluté roztoky o ![Obr. 1 Struktura sugammadexu – syntetického g-cyklodextrinu. Průměr vnitřního a vnějšího kruhu neupraveného g-cyklodextrinu je přibližně 0,75 a 0,85 nm. Úprava molekuly zahrnuje zvětšení dutiny přibližně na 1,1 nm. K tomu slouží připojení postranních řetězců, které jsou zakončeny negativně nabitými skupinami k zesílení vazby; podle [2] – Booij, 2009.](https://www.remedia.cz/photo-a-27714---.jpg) pH 7–8 a osmolalitě 300–500 mOsm/kg.
pH 7–8 a osmolalitě 300–500 mOsm/kg.
Sumární vzorec sodné soli: C72H104Na8O48S8
Molekulová hmotnost sodné soli: 2178
Cyklodextriny jsou cyklické oligosacharidy sestávající ze šesti nebo více α-1,4-D-glukopyranózových jednotek s velkým množstvím hydroxylových skupin. Cyklická struktura umožňuje tvorbu dutiny s hydrofobním vnitřkem a hydrofilním povrchem, který zajišťuje rozpustnost ve vodě. Cyklodextriny jsou schopny tvořit komplexy s mnohými hydrofobními organickými molekulami. Počet glukopyranózových jednotek určuje velikost dutiny. Spojením 6 jednotek vznikají a-cyklodextriny, při 7 jednotkách β-cyklodextriny a při 8 jednotkách gammα-cyklodextriny (obr. 2) [1, 2]. Vzhledem k prostorovým překážkám nelze inkorporovat méně než 6 ![Obr. 2 Chemická struktura cyklodextrinů; podle [2] – Booij, 2009.](https://www.remedia.cz/photo-a-27715---.jpg) jednotek. Cyklodextriny s 9 nebo více jednotkami jsou nestabilní. Jejich dutina často kolabuje a pojme pouze malé molekuly. Alfa-cyklodextriny mají dutinu o průměru 4,7–5,3 A°, β-cyklodextriny 6–6,5 A° a gamma-cyklodextriny 7,5–8,3 A° . Velikost dutiny limituje velikost molekul, které mohou být enkapsulovány. Hloubka dutiny určuje sílu vazby [1, 2].
jednotek. Cyklodextriny s 9 nebo více jednotkami jsou nestabilní. Jejich dutina často kolabuje a pojme pouze malé molekuly. Alfa-cyklodextriny mají dutinu o průměru 4,7–5,3 A°, β-cyklodextriny 6–6,5 A° a gamma-cyklodextriny 7,5–8,3 A° . Velikost dutiny limituje velikost molekul, které mohou být enkapsulovány. Hloubka dutiny určuje sílu vazby [1, 2].
Mechanismus účinku a farmakodynamika
Sugamma-dex vytváří spolu s látkou blokující neuromuskulární přenos komplexy v plazmě a tím snižuje množství svalových relaxancií schopných vázat se na nikotinové receptory neuromuskulární ploténky. Výsledkem je antagonizování neuromuskulární blokády. Jedná se vlastně o molekulární kondom pro steroidní svalová relaxancia, jak vtipně napsal Willighagen [1].
Největší účinek má sugamma-dex na rokuronium, menší na vekuronium a nejmenší na pankuronium. Ačkoliv má nemodifikovaný gamma-cyklodextrin větší lipofilní dutinu než jiné cyklodextriny, není dostatečně hluboká, aby se přizpůsobila velké rigidní struktuře molekuly rokuronia (čtyři hydrofobní steroidní kruhy). Proto je cyklodextrin modifikován osmi postranními řetězci. Negativně nabité karboxylové skupiny na konci řetězců zesilují elektrostatickou vazbu k pozitivně nabitému kvarternímu dusíku rokuronia. Díky těmto úpravám tvoří sugamma-dex komplexy vysoce rozpustné ve vodě. Dutina je dostatečně velká k enkapsulaci (obalení) steroidních relaxancií, zvláště pak rokuronia. Stabilita komplexu rokuronium-sugamma-dex je výsledkem intermolekulárních van der Waalsových sil, které zahrnují termodynamické interakce (vodíkové vazby) a hydrofobní interakce [1, 2].
Sugamma-dex je v dávkovém rozmezí 0,5–16 mg/kg schopen antagonizovat blokádu vyvolanou rokuroniem v dávkách 0,6–1,2 mg/kg nebo vekuroniem v dávce 0,1 mg/kg. Účinkuje v rozdílných obdobích a při různé hloubce blokády. V experimentálních a klinických studiích byla pozorována jasná souvislost mezi dávkou a účinkem. Sugamma-dex se váže s rokuroniem nebo vekuroniem v poměru 1 : 1 (obr. 3) [1–3]. Pro účinnou antagonizaci však není zapotřebí, aby všechny molekuly těchto svalových relaxancií vytvořily komplex se sugamma-dexem. Terapeutická šíře je taková, že k nervosvalovému přenosu stačí pouze 20–25 % volných postsynaptických receptorů. Pokles obsazení těchto receptorů ze 100 % na 70 % tedy stačí k úplnému antagonizování účinku relaxancia. Pokud byla u anestezovaných morčat blokáda rokuroniem plně antagonizována sugamma-dexem, způsobilo následné podání cisatrakuria ![Obr. 3 Enkapsulace molekuly rokuronia (modře) molekulou sugammadexu v poměru 1 : 1; přetištěno z [1] – Hess, 2008.](https://www.remedia.cz/photo-a-27716---.jpg) intenzivnější blok s nástupem účinku rychlejším, než je běžné [1–3]. Sugamma-dex je první látkou, která selektivně váže svalové relaxans (SRBA). Možnost vazby jiných farmak nebo anestetik je malá. Koncentrace sugamma-dexu by musela být 120–700krát vyšší, než jaká je používána ke zrušení účinku rokuronia nebo vekuronia.
intenzivnější blok s nástupem účinku rychlejším, než je běžné [1–3]. Sugamma-dex je první látkou, která selektivně váže svalové relaxans (SRBA). Možnost vazby jiných farmak nebo anestetik je malá. Koncentrace sugamma-dexu by musela být 120–700krát vyšší, než jaká je používána ke zrušení účinku rokuronia nebo vekuronia.
Farmakokinetické vlastnosti
Během neuromuskulární blokády vyvolané rokuroniem vede intravenózní aplikace sugamma-dexu k rychlému odstranění volných molekul rokuronia z plazmy. Koncentrační gradient urychluje pohyb zbývajících molekul rokuronia z neuromuskulární ploténky zpět do plazmy, kde jsou enkapsulovány volnými molekulami sugamma-dexu. Některé molekuly sugamma-dexu vstupují také do tkání a tvoří komplex s rokuroniem, proto je blokáda rychle ukončena difuzí rokuronia z neuromuskulární ploténky zpět do plazmy. Výsledkem je zvýšení plazmatické koncentrace rokuronia (volného a vázaného na sugamma-dex). Vzhledem k nízkému stupni disociace komplexu nebyla u člověka pozorována svalová slabost. Sugamma-dex působí jako vazebná látka a nemá vliv na acetylcholinesterázu (AChE) nebo jiný receptorový komplex organismu.
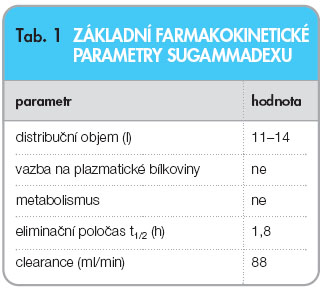 Enkapsulační proces je extrémně rychlý a srovnatelný s difuzí. U člověka nejsou cyklodextriny vzhledem k chybění příslušných enzymů metabolizovány a jsou vylučovány ledvinami. V pokusech na zvířatech byla pozorována po velmi vysokých dávkách retence sugamma-dexu v kostech a zubech. To je pravděpodobně výsledkem reverzibilní vazby sugamma-dexu s hydroxyapatitem anorganické matrix těchto tkání. Základní farmakokinetické parametry sugamma-dexu jsou shrnuty v tab. 1.
Enkapsulační proces je extrémně rychlý a srovnatelný s difuzí. U člověka nejsou cyklodextriny vzhledem k chybění příslušných enzymů metabolizovány a jsou vylučovány ledvinami. V pokusech na zvířatech byla pozorována po velmi vysokých dávkách retence sugamma-dexu v kostech a zubech. To je pravděpodobně výsledkem reverzibilní vazby sugamma-dexu s hydroxyapatitem anorganické matrix těchto tkání. Základní farmakokinetické parametry sugamma-dexu jsou shrnuty v tab. 1.
Klinické zkušenosti
V roce 2005 provedli Gijsenbergh a kol. [4] první klinickou studii. U 29 mužských dobrovolníků byla aplikována intubační dávka rokuronia 0,6 mg/kg. Za 3 minuty od aplikace byl podán sugamma-dex v dávce 0,1–8 mg/kg. Neuromuskulární blokáda byla měřena akceleromyografem. Po aplikaci dávky 2–4 mg/kg došlo k obnovení TOF* na 0,9 za 2–3 minuty. Při nejvyšší dávce bylo dosaženo zotavení dokonce během jedné minuty. U neanestezovaných dobrovolníků byl po aplikaci sugamma-dexu výskyt nežádoucích účinků nízký. Vyskytl se mírný pokles krevního tlaku, nauzea, parestezie, změna chuti (kovová pachuť) po dobu 30 minut od aplikace a sucho v ústech, které trvalo 1–2 hodiny.
Zajímavou studii provedli Cammu a kol. v roce 2008 [5]. Aplikovali současně sugamma-dex s rokuroniem nebo vekuroniem a měřili plazmatické hladiny sugamma-dexu a obou svalových relaxancií. Blokáda vyvolaná svalovými relaxancii byla rychle eliminována sugamma-dexem i u neanestezovaných dobrovolníků, takže nebyl patrný reziduální neuromuskulární blok.
Účinek u různých věkových skupin
V současné době je k dispozici pouze několik studií, které se zabývají účinkem sugamma-dexu u dětí a starých osob. Většina klinických studií byla provedena u dospělých středního věku. Pouze jedna studie u dětí ve věku 2–11 let ukazuje pokles času k získání TOF 0,9 s rostoucí dávkou sugamma-dexu. Získané hodnoty doby zotavení se v podstatě nelišily od dospělých [6]. U dětí mladších 2 let jsou v současnosti k dispozici pouze malé soubory.
Naopak u nejstarších subjektů (> 75 let) je k dosažení TOF 0,9 zapotřebí významně delšího času, v průměru 3–4 minuty, ve srovnání s dospělými ve věku 18–64 let, kde průměrný čas činí 2–3 minuty. Ačkoliv je čas potřebný k zotavení u nejstarších osob významně delší než u mladých dospělých, je stále relativně krátký, podstatně kratší než po podání neostigminu [7]. Zdá se, že dávkování sugamma-dexu dostatečné k antagonizování mělkého bloku je podobné u všech věkových skupin. Je však třeba dalších studií, které by stanovily minimální účinné dávky, a to zvláště u nejmladších dětí.
Zařazení do současné palety léčiv
Sugamma-dex představuje zcela nový princip antagonizování účinku aminosteroidních svalových relaxancií. Probíhá na principu chelace – těsné vazby mezi relaxanciem a sugamma-dexem. Použitím sugamma-dexu se stává účinek aminosteroidních relaxancií rokuronia a vekuronia plně kontrolovatelným. Tím se tato relaxancia zařadila do skupiny tzv. soft drugs – farmak s velmi dobře řiditelným účinkem [8].
Svalová relaxancia a anesteziologie
Svalová relaxancia jsou běžnou součástí celkové anestezie. Váží se na nikotinové receptory na nervosvalové ploténce a způsobují tak svalovou relaxaci. Kromě toho vykazují interakce také s jinými nikotinovými receptory, které se nacházejí ve vegetativních gangliích a v chemoreceptorech karotických tělísek, právě tak jako s muskarinovými receptory v srdci. Tyto mechanismy vedou k celé řadě nežádoucích účinků. Jedním z nejzávažnějších je poměrně častý výskyt pooperační reziduální kurarizace (PORC) a hypersenzitivních reakcí.
Po mnoho let bylo hodnoceno odeznění nervosvalové blokády čistě klinicky. Schopnost zvednout hlavu po dobu pěti sekund, schopnost sevřít ruku v pěst a stisknout ruku, vypláznout jazyk, právě tak jako návrat normálního svalového tonu horních očních víček a tonu čelisti byly považovány za kritérium úspěšného odeznění účinku. Ukázalo se, že ani TOF 0,7 nezaručuje dostatečné neuromuskulární zotavení, a tak v současné době panuje všeobecné mínění, že je možno vyloučit významnou PORC teprve při TOF ≥ 0,9. Klinické studie na zdravých bdělých dobrovolnících ukázaly, že mnohé známky a symptomy parciální kurarizace mohou být zaměněny s reziduálními účinky anestetik a opioidů v pooperační péči. Ve skutečnosti však přetrvává reziduální blok nikotinových receptorů kosterních svalů nebo karotických tělísek. Překvapivě při TOF ≥ 0,9–1,0 měřeném na m. adductor pollicis měly některé osoby stále zhoršené faryngeální nebo respirační funkce. Reziduální účinky anestetik a opioidů navíc zesilují PORC a zvyšují rizika respiračních komplikací, morbidity a mortality [9].
![Graf 1 Vliv sugammadexu (1 mg/kg) na rychlost zotavení po aplikaci aminosteroidních relaxancií; podle [27] – Booij, et al., 2009.](https://www.remedia.cz/photo-a-27718---.jpg) V běžné klinické praxi se používají ke zrušení účinku nedepolarizačních svalových relaxancií jejich antagonisté. Nejvýznamnější skupinou jsou inhibitory AChE, zejména neostigmin. K prevenci jeho nežádoucích cholinergních účinků se společně s ním podává atropin. Neostigmin s atropinem (nebo glykopyrroniem) však může vyvolat arytmie, bronchospasmus nebo suchost v dutině ústní. V některých případech může vzniknout výrazná bradykardie i při současném podání anticholinergního farmaka. Po podání neostigminu stoupá napětí ve střevní anastomóze a dochází ke zvýšení intraluminálního tlaku a propulzivní aktivity v tlustém střevě a v rektu až ke 200 %. Samotný neostigmin podaný v nepřítomnosti neuromuskulárního bloku může zhoršit průchodnost horních dýchacích cest, funkci m. genioglossus i funkci bránice [10]. Objektivní neuromuskulární monitorace se však dosud zdaleka nepoužívá ve všech případech, a proto je velmi obtížné zjistit, zda přetrvává parciální neuromuskulární blokáda. Je také třeba zmínit, že při hodnotě TOF blížící se 0,5 může neostigmin v dávce 0,04 mg/kg neuromuskulární funkci spíše zhoršit než zlepšit. Dávka neostigminu vyšší než 0,07 mg/kg již nemůže dále zvýšit dostupnost acetylcholinu. Jestliže je koncentrace rokuronia dostatečně vysoká, nemohou ani vysoké dávky neostigminu blok
V běžné klinické praxi se používají ke zrušení účinku nedepolarizačních svalových relaxancií jejich antagonisté. Nejvýznamnější skupinou jsou inhibitory AChE, zejména neostigmin. K prevenci jeho nežádoucích cholinergních účinků se společně s ním podává atropin. Neostigmin s atropinem (nebo glykopyrroniem) však může vyvolat arytmie, bronchospasmus nebo suchost v dutině ústní. V některých případech může vzniknout výrazná bradykardie i při současném podání anticholinergního farmaka. Po podání neostigminu stoupá napětí ve střevní anastomóze a dochází ke zvýšení intraluminálního tlaku a propulzivní aktivity v tlustém střevě a v rektu až ke 200 %. Samotný neostigmin podaný v nepřítomnosti neuromuskulárního bloku může zhoršit průchodnost horních dýchacích cest, funkci m. genioglossus i funkci bránice [10]. Objektivní neuromuskulární monitorace se však dosud zdaleka nepoužívá ve všech případech, a proto je velmi obtížné zjistit, zda přetrvává parciální neuromuskulární blokáda. Je také třeba zmínit, že při hodnotě TOF blížící se 0,5 může neostigmin v dávce 0,04 mg/kg neuromuskulární funkci spíše zhoršit než zlepšit. Dávka neostigminu vyšší než 0,07 mg/kg již nemůže dále zvýšit dostupnost acetylcholinu. Jestliže je koncentrace rokuronia dostatečně vysoká, nemohou ani vysoké dávky neostigminu blok ![Graf 2 Průběh zotavení z nervosvalového bloku navozeného rokuroniem. Srovnání rychlosti spontánního zotavení po aplikaci klasických antagonistů a sugammadexu; podle [27] – Booij, et al., 2009.](https://www.remedia.cz/photo-a-27719---.jpg) antagonizovat. V praxi to znamená, že maximální hloubka bloku, který může být promptně antagonizován inhibitory AChE, přibližně odpovídá zpětnému objevení se čtvrté odezvy při TOF stimulaci a hodnota T1 představuje okolo 30 % kontroly* [11]. Z těchto důvodů není v Evropě neostigmin běžně používán k antagonizování účinku nedepolarizačních myorelaxancií [12]. Zcela nový koncept proto představuje syntéza sugamma-dexu, modifikovaného cyklodextrinu, který vytváří s nedepolarizačním relaxanciem aminosteroidního typu komplex a tím znemožní jeho vazbu na nikotinový receptor (graf 1 a 2).
antagonizovat. V praxi to znamená, že maximální hloubka bloku, který může být promptně antagonizován inhibitory AChE, přibližně odpovídá zpětnému objevení se čtvrté odezvy při TOF stimulaci a hodnota T1 představuje okolo 30 % kontroly* [11]. Z těchto důvodů není v Evropě neostigmin běžně používán k antagonizování účinku nedepolarizačních myorelaxancií [12]. Zcela nový koncept proto představuje syntéza sugamma-dexu, modifikovaného cyklodextrinu, který vytváří s nedepolarizačním relaxanciem aminosteroidního typu komplex a tím znemožní jeho vazbu na nikotinový receptor (graf 1 a 2).
Zrození myšlenky
V laboratořích firmy Organon v Newhouse ve Skotsku se výzkumníci zabývali syntézou nových anticholinergních inhibitorů. Tyto nové sloučeniny si však zachovaly nežádoucí muskarinové účinky tradičních inhibitorů cholinesterázy. Anton Bom [13] v té době hledal nové rozpouštědlo pro rokuronium bromid. Kromě jiného pracoval také s cyklodextriny a zjistil, že vedle výborné rozpustnosti dochází ke snížení účinku a změnám ve farmakodynamice rokuronia. Vysvětloval tyto změny vazbou rokuronia na cyklodextrin. Tím začalo hledání více specifické vazby rokuronia s cyklodextriny umožňující vytvořit komplex podle principu klíč–zámek. Z chemické literatury je známo, že dutina a-cyklodextrinu je příliš malá pro vazbu steroidního jádra, a proto byly k tomuto účelu testovány β- a gamma-cyklodextriny.
Myšlenka chemického antagonizování účinků svalových relaxancií je však staršího data. Již v roce 1924 Petrov v Rusku zjistil, že kongo-červeň inaktivuje surové kurare u psa. Navrhl mechanismus účinku spočívající ve vazbě kurare na micely koloidní kongo-červeně. V roce 1948 studoval Kensler [14] interakci kongo-červeně s tubokurarinem detailněji. Pozorováním in vitro a in vivo zjistil, že účinek není způsoben inhibicí cholinesterázy. Prokázal závislost děje na interakci mezi kongo-červení a kurare v molárním poměru 1 : 1 (vazba mezi sulfurickými skupinami kongo-červeně a dusíky tubokurarinu). Brücke a kol. [15] ukázali v roce 1955, že kongo-červeň antagonizuje také blokádu způsobenou dekametoniem, a to jak in vitro, tak in vivo. Studovali rovněž germanin, látku, která byla také dlouhou dobu používána k léčení spavé nemoci. Její antagonizující účinky na kurare však byly nižší než u kongo-červeně. Linssen [16] pak v roce 1961 ve své disertační práci popsal své studie s germaninem (antagonistou účinků galaminu, d-tubokurarinu a suxamethonia). Napsal: „Chemickým antagonismem nebo antagonismem neutralizací míníme antagonismus, při kterém je farmakologicky aktivní substance odstraněna z okolí receptoru jinou, možná farmakologicky inaktivní substancí. Účinná koncentrace farmakologicky aktivní substance v biofázi proto klesá.“ Tento způsob antagonismu patří mezi tzv. chelace. Látka, která se váže na aktivní substanci, je nazývána hostitelem aktivní látky. Aktivní sloučenina se nazývá host. Vzájemnou interakcí dochází k tvorbě komplexu hostitel–host. Mechanismus účinku chemického antagonismu spočívá v tom, že hostitel ani komplex hostitel–host nemá vnitřní aktivitu (intrinsic activity); jsou tedy farmakologicky inaktivní. Chemický antagonismus (chelace, komplexace nebo enkapsulace) má dlouhou historii v klinickém užití např. při antagonizování účinku heparinu protaminem.
Historie cyklodextrinů
Cyklodextriny byly poprvé popsány ve Francii Villiersem v roce 1891 a nazvány cellulosiny. Jsou to produkty trávení škrobu bakterií Bacillus amylobacter. Název cyklodextrin pochází od rakouského mikrobiologa Schardingera z roku 1903. Tyto látky jsou od roku 1953 používány jako rozpouštědla mnohých lipofilních farmak, např. prostaglandinů, dexamethasonu, nitroglycerinu, cefalosporinu, nikotinu a diklofenaku. Stejně tak jsou cyklodextriny používány jako rozpouštědla a stabilizátory v potravinářském a kosmetickém průmyslu. Je odhadováno, že denní příjem gamma-cyklodextrinu potravou je 4 g. Toto množství nezpůsobuje žádné nežádoucí účinky a svědčí o tom, že cyklodextriny jsou bezpečné a vykazují nízkou toxicitu. Některé deriváty β-cyklodextrinů byly použity k enkapsulování anestetik, jako je etomidát, propofol, sufentanil nebo ropivakain [2].
Přednosti použití
Zavedením sugamma-dexu do klinické anesteziologické praxe se mění strategie použití svalových relaxancií směrem k relaxanciím aminosteroidního typu. Hluboký nervosvalový blok navozený rokuroniem může být udržován až do samého konce chirurgického výkonu. Délka účinku rokuronia se změnila z intermediální k ultrakrátké, protože jeho účinky mohou být rychle antagonizovány sugamma-dexem během 3–5 minut i po podání vysoké dávky tohoto relaxancia. Účinek sugamma-dexu nespočívá v zásahu do cholinergní transmise, a proto odpadá velké množství nežádoucích účinků, které způsobují inhibitory cholinesterázy.
Udržování hlubokého bloku až do konce chirurgického výkonu
Je známou skutečností, že svaly bránice a hrtanu jsou více rezistentní k účinkům svalových relaxancií než ostatní svaly. Je možné, že svalová paralýza měřená na m. adductor pollicis je zcela dostatečná, ale chirurg může mít obtíže s nadměrným svalovým tonem nebo pohyby bránice. Pacient také může kašlat po podráždění tracheální rourkou v nevhodný okamžik. Tato situace již nepředstavuje problém, protože můžeme použít sugamma-dex.
Přesná kontrola délky bloku navozeného rokuroniem
V současnosti můžeme rokuronium použít i pro krátké chirurgické výkony. K tracheální intubaci se dříve používala např. kombinace propofolu s krátkodobě účinným opioidem. Pacient byl vystaven zvýšenému riziku výskytu hypotenze nebo poškození trachey. Používaly se rovněž nízké dávky rokuronia (0,3–0,5 mg/kg). Kvalita intubace však byla snížena a byl prodloužen čas k jejímu úspěšnému provedení. Kromě toho bylo zapotřebí antagonizování farmaky. Při užití sugamma-dexu můžeme použít standardní intubační dávku rokuronia. Rychlé antagonizování účinku rokuronia můžeme využít při obtížích s tracheální intubací nebo se zajištěním dýchacích cest. Nastává rychlý návrat spontánní respirace – tzv. rescue antagonizování. Délka účinku rokuronia může být nyní pečlivě regulována.
Výhody neuromuskulární blokády bez potřeby farmakologické antagonizace
Inhibitory AChE se váží nejen na nikotinové, ale také na muskarinové receptory. Výsledkem podání neostigminu může být výrazná bradykardie, zvýšená sekrece v dýchacích cestách, zvýšení gastrointestinální motility a bronchospasmus. Podání atropinu nebo glykopyrronia vede ke zhoršení parasympatické kontroly srdeční frekvence s poklesem baroreflexní senzitivity a ke zvýšení srdeční nestability. Neostigmin zvyšuje riziko pooperační nauzey a zvracení. Kromě toho může dojít k poškození sutury střev. Současné podání dvou zcela rozdílných farmak je také méně vhodné. Zvyšuje se riziko omylu. Samotný neostigmin může způsobit „paradoxní slabost“, tj. snížení napětí kosterních svalů. U potkanů po úplném zotavení z neuromuskulárního bloku vede neostigmin k poklesu tonu m. genioglossus a ke snížení funkce bránice. Paradoxní svalová slabost se vyskytuje zejména v situacích, kdy podáváme vysoké dávky neostigminu při již téměř úplném zotavení neuromuskulárních funkcí. Za normální klinické situace, kdy je v čase aplikace neostigminu ještě přítomen výrazný neuromuskulární blok, se paradoxní slabost nevyskytuje.
Budou anesteziologové podávat rokuronium častěji?
Možnost přesné kontroly délky účinku aminosteroidních relaxancií je velkou výhodou oproti skupině derivátů benzylizochinolinu, do které patří atrakurium, cisatrakurium a mivakurium. Ve srovnání s kombinací cisatrakurium/neostigmin je antagonizování kombinací rokuronium/sugamma-dex téměř 5krát rychlejší. Do budoucna je otázkou, zda i vzhledem k vysoké ekonomické náročnosti užití sugamma-dexu převáží použití aminosteroidních relaxancií, zejména rokuronia.
Je suxamethonium stále nezbytné?
Suxamethonium je unikátní rychlým nástupem a krátkým trváním účinku. Žádné jiné svalové relaxans nezajistí lepší podmínky pro tracheální intubaci, alternativou je pouze rokuronium ve vysokých dávkách. Dávkování suxamethonia je velmi flexibilní a prodloužení účinku můžeme dosáhnout podáním dalších dávek. U některých pacientů však může být účinek suxamethonia prodloužen farmakologicky. Sugamma-dex umožňuje podat rokuronium i ve vysoké dávce 1,2 mg/kg bez obav o délku neuromuskulárního bloku. Ve vzácných případech je potřeba pacienta po antagonizování bloku sugamma-dexem znovu intubovat. Účinek suxamethonia je velmi málo ovlivněn sugamma-dexem. V situacích, kdy potřebujeme krátkodobě obnovit neuromuskulární blok, lze tedy použít suxamethonium.
Stane se sugamma-dex rutinním farmakem, nebo bude užíván pouze při „rescue terapii“?
Rozsah použití sugamma-dexu na jednotlivých pracovištích bude záviset na dominantní filozofii jednotlivých institucí. Je nepochybné, že sugamma-dex výrazně zlepšuje řiditelnost účinku některých svalových relaxancií. Přispěje jistě ke zkrácení doby pobytu pacienta na operačním sále nebo na pooperačním pokoji, umožní lepší operační podmínky pro chirurga a rychlejší a úplnější zotavení z neuromuskulárního bloku s velmi nízkým výskytem nežádoucích účinků [6].
Indikace
Sugamma-dex může být použit k antagonizování různého stupně neuromuskulární blokády navozené rokuroniem nebo vekuroniem. Antagonizuje také účinky pankuronia, bližší data však v současnosti nejsou k dispozici.
Antagonizování mírného stupně blokády
Mírný (mělký) stupeň neuromuskulární blokády odpovídá zpětnému výskytu druhé odezvy při TOF stimulaci nebo 30 minutám po podání standardní intubační dávky rokuronia 0,6 mg/kg nebo vekuronia v dávce 0,1 mg/kg. Sorgenfrei a kol. [17] podávali sugamma-dex v dávce 0,5–4,0 mg/kg. Dávka rokuronia byla 0,6 mg/kg a antagonizování bylo provedeno při dvou odezvách na TOF. Pokles doby nutné ke zotavení z neuromuskulárního bloku k TOF 0,9 byl závislý na dávce. Po podání sugamma-dexu 0,5 mg/kg byl průměrný čas 4,3 minuty, při dávce 4,0 mg/kg byl průměrný čas 1,1 minuty. Průměrný čas v placebové skupině činil 21 minut. Z této studie vyplývá, že účinná dávka sugamma-dexu se při mělkém bloku pohybuje okolo 2 mg/kg.
Antagonizování hluboké blokády
Hluboký nervosvalový blok odpovídá situaci, při které nepozorujeme žádnou odezvu při TOF stimulaci, ale objeví se 1–2 odezvy po tetanické stimulaci. Tento stupeň bloku je přítomen přibližně 10–15 minut po podání rokuronia nebo vekuronia. V této situaci bylo provedeno několik klinických studií [18, 19]. Koncentrace rokuronia při antagonizování hlubokého bloku je samozřejmě vyšší než při povrchním bloku, a tak je nutná i vyšší dávka sugamma-dexu. První studie na dobrovolnících ukázaly, že dávka 4 mg/kg antagonizuje hluboký blok během 3 minut od podání.
Bezprostřední antagonizování účinku rokuronia
V anesteziologii se setkáváme se situacemi, kdy je nutné velmi rychle antagonizovat neuromuskulární blok způsobený nedepolarizačními relaxancii. Dochází k tomu např. při obtížné tracheální intubaci nebo při nemožnosti provést účinnou ventilaci. Z klinických studií vyplynulo, že k antagonizování tohoto bloku je zapotřebí sugamma-dex v dávce 12–16 mg/kg, dávky 8 mg/kg jsou spojeny s vysokou variabilitou při odeznívání účinku svalových relaxancií [20].
Antagonizování účinku vekuronia
Ačkoliv byl sugamma-dex původně vyvinut jako specifický antagonista pro rokuronium, časné experimenty ukázaly, že je téměř stejně účinný při antagonizování účinků dalšího aminosteroidního relaxancia – vekuronia. V tomto případě je sugamma-dex účinný rovněž při mělkém i hlubokém bloku, opět v závislosti na dávce. Sugamma-dex v dávce 2 mg/kg antagonizuje mělkou blokádu navozenou vekuroniem v průměrném čase 3,4 minuty. Pro hlubokou blokádu je doporučován v dávce 4 mg/kg a adekvátní antagonizování na TOF 0,9 přesahuje 3 minuty. Zrušení bloku navozeného vekuroniem je tedy o něco pomalejší než po podání rokuronia při nervosvalové blokádě srovnatelné hloubky [21]. Anesteziologové navrhují poněkud vyšší dávku sugamma-dexu po vekuroniu. Rozdíl oproti rokuroniu je však velmi malý, výrobce proto doporučuje stejnou dávku při srovnatelné hloubce [22]. Klinická data týkající se zotavení z hlubokého nervosvalového bloku po vekuroniu při „rescue terapii“ zatím nejsou k dispozici.
Vliv anesteziologické techniky na rychlost antagonizace
Při užití potentních těkavých anestetik, jako je sevofluran, dochází k prodloužení účinku rokuronia. Bylo však prokázáno [23], že po aplikaci rokuronia se rychlost antagonizování bloku sugamma-dexem (2 mg/kg) nelišila při anestezii sevofluranem, nebo intravenózním anestetikem propofolem. Antagonizování účinku bylo provedeno při výskytu druhé odezvy při TOF stimulaci. Průměrný zotavovací čas činil 1,8 minuty pro obě anesteziologické techniky.
Obnovení bloku po antagonizaci sugamma-dexem
Ačkoliv to není běžné, pacient může potřebovat celkovou anestezii a tracheální intubaci v bezprostřední pooperační době nebo během několika hodin po antagonizování nervosvalového bloku. Jak již bylo uvedeno, tento blok můžeme antagonizovat inhibitory AChE nebo v případě aminosteroidních svalových relaxancií také sugamma-dexem. Inhibitory AChE, jako je neostigmin, však mohou způsobit výraznou inhibici aktivity plazmatické cholinesterázy. To může vést k prodloužení účinku suxamethonia. Sugamma-dex pochopitelně nemá takové účinky. Zůstává však otázkou, zda je možné po antagonizaci bloku sugamma-dexem užít opět rokuronium a za jak dlouho.
Studie na zvířatech ukázaly, že zatímco rokuronium podané bezprostředně po užití sugamma-dexu může způsobit nervosvalový blok různého stupně, účinek suxamethonia nebo cisatrakuria není ovlivněn. Bom a kol. [24] prokázali v pokusech na morčatech, že rokuronium může být aplikováno za 30 minut po podání sugamma-dexu. V klinické situaci záleží na dávce sugamma-dexu a na době, která uplynula od jeho podání. Obecně řečeno, účinek rokuronia v bezprostřední pooperační době může být v této situaci snížen. De Boer a kol. [25] provedli teoretický výpočet dávky rokuronia požadované k dosažení dostatečného bloku po antagonizování předchozího bloku navozeného rokuroniem. Navrhují dávku 1–1,5 mg/kg, pokud byl podán sugamma-dex v dávce 2–4 mg/kg k antagonizování bloku navozeného rokuroniem v dávce 0,6 mg/kg. Pokud byl podán sugamma-dex v dávce 8 mg/kg, bylo by zapotřebí podat rokuronium v dávce vyšší než 2 mg/kg. Protože však účinek nesteroidních svalových relaxancií zůstává neovlivněn, může být výhodnější použít suxamethonium nebo deriváty benzylizochinolinu v období bezprostředně po podání sugamma-dexu k antagonizování bloku způsobeného rokuroniem.
Kontraindikace a nežádoucí účinky
Cyklodextriny jsou dobře tolerovány; jsou přijímány rovněž s potravou. V pokusech na zvířatech neprokázal sugamma-dex přímý ani nepřímý vliv na komponenty cholinergní transmise. U opic makak rhesus nevedl ke změnám srdeční frekvence nebo krevního tlaku a nevykazoval nežádoucí účinky, jako je zvracení, regurgitace či kýchání. V klinických studiích na dobrovolnících a 640 pacientech byl výskyt nežádoucích účinků velmi nízký. Nejčastěji se jednalo o slabý kašel, pohyby a porušené vnímání chuti. U některých dobrovolníků se vyskytly známky hypersenzitivity v podobě kožních reakcí, které spontánně odezněly a nevyžadovaly léčení.
Interakce
Zachycení
Po podání sugamma-dexu může být snížena účinnost některých farmak snížením jejich plazmatické koncentrace. Jedná se zejména o hormonální antikoncepci. Byla testována interakce mezi sugamma-dexem v dávce 4 mg/kg a složkami antikoncepčních přípravků. Plazmatická hladina progesteronu se snížila, u estrogenů byl tento účinek nižší. Pokles koncentrace progesteronu je obdobný jako při vynechání jedné denní dávky perorální antikoncepce [26], podání bolusu sugamma-dexu je tedy ekvivalentní vynechání jedné dávky perorálních antikoncepčních prostředků. Pokud je sugamma-dex podáván ve stejný den jako perorální anikoncepce, postupujeme jako při vynechání dávky kontraceptiva.
Vytěsnění
Podáním některých farmak po aplikaci sugamma-dexu může být rokuronium nebo vekuronium vytěsněno z vazby na sugamma-dex. Výsledkem je opětovný výskyt neuromuskulární blokády. V tomto případě musí být pacient ventilován. V situacích, kdy hrozí vytěsňovací interakce, musí být pacienti pečlivě monitorováni, aby se včas zjistily případné známky zpětného vzniku blokády. Vytěsňovací interakce připadají v úvahu u toremifenu, flukloxacilinu a kyseliny fusidové.
Těhotenství a laktace
Studie prováděné na zvířatech neprokázaly škodlivé účinky s ohledem na těhotenství, vývoj plodu, porod a poporodní vývoj. Sugamma-dex by měl být podáván těhotným ženám s opatrností. Není známo, zda se sugamma-dex vylučuje do mateřského mléka. Studie na zvířatech však prokázaly, že sugamma-dex je vylučován do mléka. Vstřebávání cyklodextrinů je však po perorálním podání celkově nízké, a neočekává se žádný vliv na kojené dítě po podání jedné dávky kojící ženě.
Dávkování a způsob podání
Sugamma-dex podáváme výhradně intravenózně jako bolus. Injekce má být aplikována rychle – během 10 sekund. Sugamma-dex je podle hloubky neuromuskulárního bloku podáván v dávkách 2–16 mg/kg.
Seznam použité literatury
- [1] Hess L. Sugammadex – nová koncepce antagonizování steroidních svalových relaxancií. Remedia 2008; 18: 454–456.
- [2] Booij LHDJ. Cyclodextrins and the emergence of sugammadex. Anaesthesia 2009; 64 (Suppl. 1): 31–37.
- [3] Mirakhur RK. Sugammadex in clinical practice. Anaesthesia 2009; 64 (Suppl. 1): 45–54.
- [4] Gijsenbergh F, Ramael S, Houwing N, Iersel van T. First Human Exposure of Org 25969, a Novel Agent to Reverse the Action of Rocuronium Bromide. Anesthesiology 2005; 103: 695–703.
- [5] Cammu G, De Kam PJ, Demeyer I, et al. Safety and tolerability of single intravenous doses of sugammadex administered simultaneously with rocuronium or vecuronium in healthy volunteers. Br J Anaesth 2008; 100: 373–379.
- [6] Plaud B, Meretoja O, Pohl B, et al. Reversal of rocuronium-induced neuromuscular blockade with sugammadex in paediatric and adult patients. Eur J Anaesthesiol 2007; 24 (Suppl. 39): 124.
- [7] McDonagh DL, Benedict BE, Kovac AL, et al. Efficacy and safety of sugammadex for reversal of rocuronium induced blockade in elderly patients. Anesthesiology 2007; 107: 1583.
- [8] Naguib M. Sugammadex: Another Milestone in Clinical Neruomuscular Pharmacology. Anesth Analg 2007; 104: 575–581.
- [9] Claudius C, Garvey LH, Viby-Mogensen J. The undesirable effects of neuromuscular blocking drugs. Anaesthesia 2009; 64 (Suppl. 1): 10–21.
- [10] Eikermann M, Fassbender P, Malhotra A, et al. Unwarranted administration of acetylcholinesterase inhibitors can impair genioglossus and diaphragm muscle function. Anesthesiology 2007; 107: 621–629.
- [11] Beemer GH, Bjorksten AR, Dawson PJ, et al. Determinants of the reversal time of competitive neuromuscular block by anticholinesterases. Br J Anaesth 1991; 66: 469–475.
- [12] Kopman AF, Eikermann M. Antagonism of non-depolarising neuromuscular block: current practice. Anaesthesia 2009; 64 (Suppl. 1): 20–30.
- [13] Bom A, Epemolu O, Hope F, et al. Selective relaxant binding agents for reversal of neuromuscular blockade. Curr Opin Pharmacol 2007; 7: 298–302.
- [14] Kensler CJ. The antagonism of curare by congo red and related compounds. J Pharmacol Exp Ther 1948; 95: 28–44.
- [15] Brücke F, Kobinger W. Kraupp O. Über den Antagonismus von Kongorot und anderen Substanzen gegenüber quartaren Ammoniumbasen. Arch Exp Path Pharm 1955: 224: 123–136.
- [16] Linssen GH. Curariform Drugs. The Action of the Different Types and Their Combinations on the Neuromuscular Transmission. PhD thesis, Nijmegen, The Netherlands 1961, 104–113.
- [17] Sorgenfrei IF, Norril DK, Larsen BV, et al. The reversal of rocuronium induced neuromuscular block by the selective relaxant binding agent sugammadex. Anaesthesiology 2006; 104: 667–674.
- [18] Sparr HJ, Vermeyen KM, Beaufort AM, et al. Early reversal of profound rocornium-induced neuromuscular blockade by sugammadex in a randomised multi-centre study. Anesthesiology 2007; 106: 935–943.
- [19] Duvaldestin P, Kuizenga K, Kjaer CC, et al. Sugammadex achieves fast recovery from profound neuromuscular blockade induced by rocuronium or vecuronium: a dose response study. Eur J Anaesthesiol 2007; 24 (Suppl. 39): 123.
- [20] Pühringer FK, Rex C, Sielenkamber AW, et al. Reversal of profound, high dose rocuronium-induced neuromuscular blockade by sugammadex at two different time points. An international multicenter, randomised, dose finding, safety assessor-blinded, phase 2 trial. Anaesthesiology 2008; 109: 188–197.
- [21] Suy K, Morias K, Cammu G, et al. Effective Reversal of Moderate Rocuronium- or Vecuronium-induced Neuromuscular Block with Sugammadex, a Selective Relaxant Binding Agent. Anesthesiology 2007; 106: 283–288.
- [22] Pühringer F, Blaszyk M, Gammu G, et al. Sugammadex achieves fast recovery from shallow neuromuscular blockade induced by rocuronium or vecuronium: dose-response studies. Eur J Anaesthesiol 2007; 24 (Suppl. 39): 111.
- [23] Vanacker BV, Vermeyen KM, Struys MRF, et al. Reversal of rocuronium induced neuromuscular block with the novel drug sugammadex is equally effective under maintenance anaesthesia with propofol or sevoflurane. Anesth Analg 2007; 104: 563–568.
- [24] Bom A, Hope F. Neuromuscular block induced by rocuronium and reversed by the encapsulating agent Org 25969 can be reestablished using the non-sterodial neuromuscular blockers succinylcholine and cis-atracurium. Eur J Anaesthesiol 2005; 22 (Suppl. 34): 120.
- [25] Boer de HD, Driessen JJ, Egmond van J, Booij LHDJ. Nonsteroidal neuromuscular blocking agents to re-establish paralysis after reversal of rocuronium-induced neuromuscular block with sugammadex. Can J Anaesth 2008; 55: 124–125.
- [26] Caldwell JE, Miller RD. Clinical implications of sugammadex. Anaesthesia 2009; 64 (Suppl. 1): 66–72.
- [27] Booij LH, van Egmond J, Driessen JJ, de Boer HD. In vivo animal studies with sugammadex. Anaesthesia 2009; 64 (Suppl. 1): 38–44.