Tildrakizumab
Souhrn
Rob F. Tildrakizumab. Remedia 2023; 33: 275–280.
Možnosti moderní terapie středně závažné a závažné psoriázy se stále rozrůstají o nové přípravky. Mezi nejúčinnější skupiny léčiv v současnosti patří inhibitory interleukinu (IL) 17 a IL‑23. Tildrakizumab je humanizovaná monoklonální protilátka, která inhibuje signalizaci přes klíčový IL‑23 a tím účinně blokuje patologický imunitní zánět při psoriáze. V klinických studiích i běžné praxi prokázal tildrakizumab dobrou účinnost i velmi dobrý bezpečnostní profil. Výhodou tildrakizumabu je nutnost aplikace udržovací léčby pouze jednou za 12 týdnů a také možnost případného navýšení dávky u pacientů, kteří mají vyšší hmotnost či závažnou formu onemocnění.
Klíčová slova: psoriáza – tildrakizumab – IL‑23 – účinnost – bezpečnostní profil.
Summary
Rob F. Tildrakizumab. Remedia 2023; 33: 275–280.
The possibilities of modern therapy for moderate and severe psoriasis are constantly expanding with new treatment options. Currently, the most effective drug groups include interleukin (IL)‑17 and IL‑23 inhibitors. Tildrakizumab is a humanized monoclonal antibody that inhibits signaling through the key IL‑23 and thereby effectively blocks pathological immune inflammation in psoriasis. In clinical studies and in real‑world practice, tildrakizumab has demonstrated good efficacy and a very good safety profile. The advantage of tildrakizumab consists of the fact that maintenance treatment has to be applied only once every 12 weeks, as well as of the possibility to increase the dosage in patients with higher weight or a severe form of the disease.
Key words: psoriasis – tildrakizumab – IL‑23 – efficacy – safety profile.
Úvod
V léčbě psoriázy se s nástupem nových moderních biologických léčiv výrazně zvýšila účinnost terapie i těžkých forem onemocnění, a tím se rovněž signifikantně zlepšila kvalita života pacientů. V současnosti se mezi nejúčinnější skupiny léčiv řadí inhibitory interleukinu (IL) 17 a IL‑23. Díky této léčbě dnes již nahlížíme na zlepšení psoriázy alespoň o 90 % oproti výchozímu stavu jako na standard, kterého bychom měli u našich pacientů dosáhnout [1]. Takto vysoká účinnost nových léčiv nám umožňuje dosáhnout remise onemocnění i v obtížně léčitelných lokalizacích, jako jsou například kštice, nehty nebo genitál. Současně drobné rozdíly mezi jednotlivými léčivy a skupinami léčiv nám dovolují personalizaci terapie dle komorbidit pacienta, rychlosti nástupu účinku či celkového bezpečnostního profilu [2].
Tildrakizumab (Ilumetri) je jedním z těchto nových moderních biologických léčiv, které inhibuje signalizaci klíčového regulačního IL‑23 a tím efektivně blokuje patologickou imunitní reakci při psoriáze. V klinických studiích i běžné praxi prokázal tildrakizumab dobrou účinnost i velmi dobrý bezpečnostní profil. Výhodou tildrakizumabu je nutnost aplikace udržovací léčby pouze jednou za 12 týdnů a také možnost případného navýšení dávky u pacientů, kteří mají vyšší hmotnost či závažnou formu onemocnění.
Farmakologická skupina
Tildrakizumab je humanizovaná monoklonální protilátka IgG1/κ, která inhibuje signalizaci IL‑23. Dle Anatomicko‑terapeuticko‑chemické (ATC) klasifikace je tildrakizumab řazen mezi Imunosupresiva – Inhibitory interleukinu (L04AC17).
Indikace
Tildrakizumab je indikován k léčbě dospělých se středně závažnou až závažnou ložiskovou (plakovou) psoriázou, kteří jsou kandidáty na systémovou léčbu.
Dávkování
Doporučená dávka tildrakizumabu je 100 mg v týdnu 0 a 4 a poté již probíhají aplikace pouze každých 12 týdnů. Tildrakizumab tak nabízí pacientům velmi příjemný aplikační interval, kdy po zahajovacích dávkách jsou nutné pouze čtyři aplikace v průběhu roku.
Při léčbě tildrakizumabem je možné navýšit dávku při každé aplikaci na 200 mg, což je možné využít hlavně u pacientů s velmi těžkou psoriázou nebo u pacientů s tělesnou hmotností 90 kg a více [3]. V České republice zatím této možnosti nelze využít, poněvadž nebyla stanovena cena pro tuto sílu a schválena úhrada zdravotní pojišťovnou.
Léčba u starších pacientů nevyžaduje úpravu dávkování. Populační farmakokinetická analýza ukázala, že věk neměl u dospělých nemocných s plakovou psoriázou klinicky významný vliv na clearance tildrakizumabu. Bezpečnost a účinnost tildrakizumabu u pediatrických pacientů zatím nebyly stanoveny, klinické studie však již probíhají. V rámci klinického hodnocení léčiva nebylo provedeno hodnocení vlivu poruchy funkce ledvin nebo jater na farmakokinetiku tildrakizumabu. Léčivo je však katabolizováno na aminokyseliny v běžném procesu odbourávání proteinů a není eliminováno renální ani hepatální cestou [3].
Způsob podání
Tildrakizumab se podává ve formě subkutánní injekce, obvykle do stehna, břicha nebo do horní části paže. Při aplikaci předplněné injekce je nutné se nejen vyhnout oblastem kůže postiženým ložiskovou psoriázou, ale také místům, kde se vyskytují podlitiny, zarudnutí nebo indurace podkoží. Místa vpichu je proto vhodné střídat. Každá předplněná stříkačka je určena pouze k jednorázovému použití a před samotnou aplikací se s injekční stříkačkou nesmí třepat. Po provedení nácviku správné techniky podání léčiva si mohou pacienti aplikovat injekce sami, pokud lékař rozhodne, že je to vhodné [3].
Vyšetření před zahájením léčby
Před zahájením terapie tildrakizumabem by měly být vyloučeny klinicky významné aktivní infekce. Standardně je prováděno vyšetření na přítomnost tuberkulózy, hepatitidy B i C a viru lidské imunodeficience (HIV). V případě pozitivity některé z těchto infekcí je vhodná konzultace s infekčním specialistou o dalším postupu před zahájením léčby. Standardně je také doporučováno před léčbou vyšetření krevního obrazu, hodnoty C‑reaktivního proteinu (CRP), jaterních a renálních parametrů [4].
Monitoring v průběhu léčby
Většina současných doporučení se shoduje na vyšetřování krevního obrazu a základních biochemických parametrů (jaterní funkce, renální parametry, glykemie, lipidogram) každých šest měsíců, hlavně pro včasný záchyt komorbidit. Opakování vyšetření na závažné infekce, jako je například tuberkulóza, je vhodné provádět pouze u rizikových pacientů [4].
Zařazení do současné palety léčiv
Tildrakizumab je v současnosti v České republice hrazen pouze ve druhé linii léčby u pacientů s psoriázou, u nichž selhala, nebyla tolerována či je kontraindikována terapie inhibitory tumor nekrotizujícího faktoru alfa (TNFα). Dle současných evropských doporučení však tildrakizumab, obdobně jako další léky skupiny blokátorů IL‑23, patří do první linie terapie plakové psoriázy [4].
Mechanismus účinku
Tildrakizumab je humanizovaná monoklonální protilátka IgG1/κ. Tato protilátka se selektivně váže na podjednotku p19, čímž inhibuje interakci IL‑23 s jeho receptorem a následné uvolňování prozánětlivých cytokinů zprostředkovaných IL‑23. Podání tildrakizumabu tak blokuje osu IL‑23/IL‑17, která má klíčovou roli v etiopatogenezi psoriázy [5].
Interleukin 23 je heterodimerní cytokin skládající se z podjednotek p19 a p40. Podjednotka IL‑23 p40 je sdílena s IL‑12. Interleukin 12, jak ukazují studie, může mít pro organismus prospěšný význam a podílet se na jeho ochraně před působením intracelulárních patogenů, ale také se pravděpodobně podílí i na imunitním dozoru při vzniku nádorových onemocnění. Současné vědecké poznání tak naznačuje, že selektivní inhibice aktivity podjednotky p19 je bezpečnější, mimo jiné kvůli stále nedostatečným znalostem o fungování imunologických drah a o funkcích specifických interleukinů v lidském těle [6].
Interleukin 23 se podílí na stimulaci tvorby a navíc fungování Th17 lymfocytů, které hrají důležitou roli v patogenezi psoriázy. Nedostatek IL‑23 je spojen s útlumem tvorby Th17 buněk v časném stadiu aktivace, a tedy se snížením koncentrace prozánětlivého IL‑17 produkovaného stimulovanými Th17 lymfocyty. Nedostatek IL‑23 je rovněž spojen s menší zásobou Th17 lymfocytů lokalizovaných v lymfatických uzlinách [6].
Farmakokinetické vlastnosti
Subkutánní aplikace tildrakizumabu má absolutní biologickou dostupnost v rozmezí 73–80 %. Maximální koncentrace je dosahováno šest dní po aplikaci léčby. Farmakokinetika tildrakizumabu je přímo úměrná dávce. Z populačního farmakokinetického modelu vyplynulo, že expozice klesá se zvyšující se tělesnou hmotností. Geometrický průměr expozice u dospělých pacientů s tělesnou hmotností ≥ 90 kg po podání dávky 100 mg nebo 200 mg subkutánně byl odhadován zhruba o 30 % nižší než u dospělých pacientů s tělesnou hmotností nepřesahující 90 kg. Proto u těchto pacientů je možné podávat vyšší dávku léčiva. V organismu je tildrakizumab katabolizován na aminokyseliny v běžném procesu odbourávání proteinů. Metabolické dráhy malých molekul (např. enzymy cytochromu P450, CYP450) se na jeho clearance nepodílejí [3].
Klinické zkušenosti
Studie reSURFACE 1 a reSURFACE 2
Hlavní část fáze III klinického hodnocení tildrakizumabu byla provedena v rámci dvou multicentrických randomizovaných, dvojitě zaslepených, placebem kontrolovaných studií reSURFACE 1 a reSURFACE 2. Tyto dvě studie zahrnovaly celkem 1 862 dospělých pacientů s ložiskovou psoriázou, kteří měli minimálně 10% postižení tělesného povrchu, jejich skóre indexu plochy postižení a závažnosti psoriázy (Psoriasis Area and Severity Index, PASI) bylo ≥ 12 a současně byli kandidáty na fototerapii nebo systémovou léčbu. V rámci studie reSURFACE 1 byl tildrakizumab porovnáván s placebem po dobu 64 týdnů, a to jak v dávkování 100 mg, tak 200 mg. Ve studii reSURFACE 2 byl přidán i aktivní komparátor etanercept (ve standardním dávkování 50 mg dvakrát týdně po dobu 12 týdnů a poté jednou týdně po dobu 28 týdnů).
Demografické a výchozí charakteristiky pacientů v obou skupinách byly velmi obdobné, s průměrným věkem nemocných 46 let a průměrnou výchozí hodnotou PASI ve všech skupinách v rozmezí 17,7–18,4. Ze všech pacientů jich v minulosti 35,8 % podstoupilo fototerapii, 41,1 % předchozí konvenční systémovou terapii a 16,7 % předchozí biologickou terapii. Celkem 15,4 % pacientů v těchto studiích mělo v anamnéze psoriatickou artritidu. Kvalita života dle dermatologického indexu kvality života (Dermatology Life Quality Index, DLQI) pacientů vstupujících do studie byla výrazně snížena s průměrnými hodnotami v rozmezí od 13,0 do 14,8.
Ve studii reSURFACE 1 dosáhlo PASI 75 (75% zlepšení dle PASI) po 12 týdnech (dvě dávky) 5,8 % pacientů s placebem, 63,8 % pacientů s dávkou tildrakizumabu 100 mg a 62,3 % s dávkou 200 mg. Po 28 týdnech léčby (tři dávky) dosáhlo PASI 75 celkem 80,4 % pacientů se 100 mg tildrakizumabu a 81,9 % pacientů s dvojnásobnou dávkou. Přísnějšího kritéria PASI 90 (90% zlepšení dle PASI) dosáhlo po 12 týdnech 2,6 % pacientů s placebem, 13,9 % pacientů s dávkou tildrakizumabu 100 mg a 14,0 % s dávkou 200 mg; po 28 týdnech léčby (tři dávky) pak PASI 90 dosáhlo 51,6 % pacientů se 100 mg tildrakizumabu a 59,0 % pacientů s dvojnásobnou dávkou.
![GRAF 1A, B Dosažení terapeutické odpovědi PASI 75 ve studiích reSURFACE 1 a reSURFACE 2; podle [7] – Reich, et al., 2017. PASI 75 – 75% zlepšení podle Psoriasis Area and Severity Index GRAF 1A, B Dosažení terapeutické odpovědi PASI 75 ve studiích reSURFACE 1 a reSURFACE 2; podle [7] – Reich, et al., 2017. PASI 75 – 75% zlepšení podle Psoriasis Area and Severity Index](https://www.remedia.cz/photo-pg-1117---.jpg) Ve studii reSURFACE 2 dosáhlo PASI 75 po 12 týdnech 48,2 % pacientů s léčbou etanerceptem, 61,2 % pacientů s dávkou tildrakizumabu 100 mg a 65,6 % s dávkou 200 mg. Po 28 týdnech léčby tento rozdíl narostl, PASI 75 dosáhlo 53,6 % pacientů s léčbou etanerceptem, 73,5 % s léčbou tildrakizumabem 100 mg a 72,6 % s dávkou 200 mg. Pro PASI 90 byl tento rozdíl ještě výraznější, po 28 týdnech dosáhlo tohoto kritéria 29,4 % pacientů v rameni s etanerceptem, 55,5 % pacientů s tildrakizumabem 100 mg a 57,7 % pacientů s dvojnásobnou dávkou tildrakizumabu (graf 1A, B) [7].
Ve studii reSURFACE 2 dosáhlo PASI 75 po 12 týdnech 48,2 % pacientů s léčbou etanerceptem, 61,2 % pacientů s dávkou tildrakizumabu 100 mg a 65,6 % s dávkou 200 mg. Po 28 týdnech léčby tento rozdíl narostl, PASI 75 dosáhlo 53,6 % pacientů s léčbou etanerceptem, 73,5 % s léčbou tildrakizumabem 100 mg a 72,6 % s dávkou 200 mg. Pro PASI 90 byl tento rozdíl ještě výraznější, po 28 týdnech dosáhlo tohoto kritéria 29,4 % pacientů v rameni s etanerceptem, 55,5 % pacientů s tildrakizumabem 100 mg a 57,7 % pacientů s dvojnásobnou dávkou tildrakizumabu (graf 1A, B) [7].
Dlouhodobá účinnost
Důležitým parametrem každé léčby je i dlouhodobá účinnost a udržení terapeutické odpovědi. V rámci studie reSURFACE 1 udrželo terapeutickou odpověď PASI 90 po 64 týdnech 58,0 % pacientů se 100 mg tildrakizumabu a 74,6 % s dvojnásobnou dávkou léku. Obdobně ve studii reSURFACE 2 udrželo PASI 90 po 52 týdnech 78,4 % pacientů se 100 mg tildrakizumabu a 81,9 % s dávkou 200 mg [7].
![GRAF 2A−C Dlouhodobá účinnost léčby tildrakizumabem ve studiích reSURFACE 1 a reSURFACE 2; podle [8] – Thaçi, et al., 2021. n – počet pacientů; PASI 75/90/100 – 75%/90%/100% zlepšení podle Psoriasis Area and Severity Index GRAF 2A−C Dlouhodobá účinnost léčby tildrakizumabem ve studiích reSURFACE 1 a reSURFACE 2; podle [8] – Thaçi, et al., 2021. n – počet pacientů; PASI 75/90/100 – 75%/90%/100% zlepšení podle Psoriasis Area and Severity Index](https://www.remedia.cz/photo-pg-1118---.jpg) V současnosti máme u respondérů na léčbu tildrakizumabem k dispozici již pětiletá data, která demonstrují dobrou dlouhodobou účinnost. Při dávce 100 mg každých 12 týdnů udrželo odpověď PASI 75/90/100 celkem 88,7 %, 65,9 %, resp. 32,8 % pacientů. Obdobně při dávkování 200 mg každých 12 týdnů odpověď PASI 75/90/100 udrželo 92,5 %, 69,5 %, resp. 40,8 % pacientů (graf 2A–C) [8].
V současnosti máme u respondérů na léčbu tildrakizumabem k dispozici již pětiletá data, která demonstrují dobrou dlouhodobou účinnost. Při dávce 100 mg každých 12 týdnů udrželo odpověď PASI 75/90/100 celkem 88,7 %, 65,9 %, resp. 32,8 % pacientů. Obdobně při dávkování 200 mg každých 12 týdnů odpověď PASI 75/90/100 udrželo 92,5 %, 69,5 %, resp. 40,8 % pacientů (graf 2A–C) [8].
Vliv léčby na kvalitu života
Ve 12. týdnu bylo ve všech studijních skupinách s tildrakizumabem pozorováno statisticky významné zlepšení kvality života hodnocené dle DLQI. Toto zlepšení kvality života se v průběhu času udrželo, přičemž v 52. týdnu mělo 63,7 % (100 mg) a 73,3 % (200 mg) pacientů ve studii reSURFACE 1 a 68,8 % (100 mg) a 72,4 % (200 mg) pacientů ve studii reSURFACE 2, kteří byli respondéry PASI 75 v týdnu 28, DLQI 0 nebo 1, což odpovídá hodnocení žádný negativní vliv na kvalitu života [7].
Data z reálné praxe
![GRAF 3A, B Vývoj skóre PASI v průběhu léčby tildrakizumabem (studie TILOT); podle [9] – Tsianakas, et al., 2023. LOCF – poslední provedené sledování, Last Observation Carried Forward; OC – sledované případy, observed cases; PASI – Psoriasis Area and Severity Index GRAF 3A, B Vývoj skóre PASI v průběhu léčby tildrakizumabem (studie TILOT); podle [9] – Tsianakas, et al., 2023. LOCF – poslední provedené sledování, Last Observation Carried Forward; OC – sledované případy, observed cases; PASI – Psoriasis Area and Severity Index](https://www.remedia.cz/photo-pg-1119---.jpg) V současnosti máme k dispozici i data prospektivních studií z běžné klinické praxe. V práci hodnotící účinnost u více než 400 pacientů léčených tildrakizumabem po 52 týdnech terapie pokleslo průměrné absolutní PASI z hodnoty 16 na 3,6 (dle hodnocení Last Observation Carried Forward). Absolutního PASI menšího než 3 (tedy dle kritérií mírné psoriázy) dosáhlo za stejné období 79,1 % pacientů (graf 3A, B). V průběhu sledování se u nemocných taktéž výrazně zlepšila kvalita života dle hodnocení DLQI z počátečních průměrných 13,0 na 2,0 po roce léčby [9].
V současnosti máme k dispozici i data prospektivních studií z běžné klinické praxe. V práci hodnotící účinnost u více než 400 pacientů léčených tildrakizumabem po 52 týdnech terapie pokleslo průměrné absolutní PASI z hodnoty 16 na 3,6 (dle hodnocení Last Observation Carried Forward). Absolutního PASI menšího než 3 (tedy dle kritérií mírné psoriázy) dosáhlo za stejné období 79,1 % pacientů (graf 3A, B). V průběhu sledování se u nemocných taktéž výrazně zlepšila kvalita života dle hodnocení DLQI z počátečních průměrných 13,0 na 2,0 po roce léčby [9].
V recentně publikované studii z klinické praxe, které se účastnilo 177 pacientů, dosáhlo po 24 týdnech léčby 74 % pacientů PASI 90, taktéž se výrazně zmírnila bolestivost a svědění kůže. Současně byl v této studii prokázán výrazně pozitivní vliv tildrakizumabu na kvalitu života pacientů s psoriázou, včetně pracovních aktivit a kvality spánku [10].
Kontraindikace
Tildrakizumab je kontraindikován pouze u pacientů s hypersenzitivitou na léčivou látku nebo na kteroukoliv pomocnou látku a u pacientů s klinicky významnou aktivní infekcí. Závažnost infekce a možnost pokračování léčby je vždy v těchto případech vhodné konzultovat s infekčním specialistou.
Nežádoucí účinky
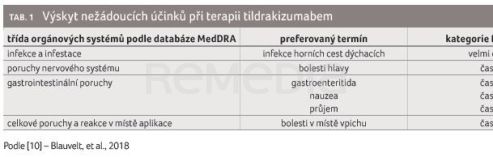 Tildrakizumab během klinického hodnocení, v dlouhodobých extenzích těchto studií i v reálné praxi prokázal velmi dobrý bezpečnostní profil. Během placebem kontrolované fáze klinických studií byl výskyt všech typů infekcí nízký a shodný s placebem. Mezi nejčastější nežádoucí účinky patří infekce horních cest dýchacích (12,6 %), bolesti hlavy (4,0 %), střevní obtíže (1,6 %) a bolesti v místě aplikace injekce (1,3 %), tabulka 1 [11]. Téměř tříletá data z této kohorty nezaznamenala ve sledovaném období zvýšenou míru výskytu závažných infekcí, malignit, závažných kardiovaskulárních příhod nebo hypersenzitivních reakcí [12]. Rozsáhlá analýza 1 800 pacientů léčených tildrakizumabem po dobu až pěti let potvrdila velmi dobrý dlouhodobý bezpečnostní profil bez výskytu nových neočekávaných nežádoucích účinků [8]. Data z prospektivní studie z reálné praxe u více než 440 pacientů prokázala během jednoho roku léčby nízký výskyt (15 % pacientů) nežádoucích účinků, a to převážně běžných respiračních infekcí. Významné nežádoucí účinky související s léčbou se objevily pouze u 3 % ze všech léčených pacientů [9].
Tildrakizumab během klinického hodnocení, v dlouhodobých extenzích těchto studií i v reálné praxi prokázal velmi dobrý bezpečnostní profil. Během placebem kontrolované fáze klinických studií byl výskyt všech typů infekcí nízký a shodný s placebem. Mezi nejčastější nežádoucí účinky patří infekce horních cest dýchacích (12,6 %), bolesti hlavy (4,0 %), střevní obtíže (1,6 %) a bolesti v místě aplikace injekce (1,3 %), tabulka 1 [11]. Téměř tříletá data z této kohorty nezaznamenala ve sledovaném období zvýšenou míru výskytu závažných infekcí, malignit, závažných kardiovaskulárních příhod nebo hypersenzitivních reakcí [12]. Rozsáhlá analýza 1 800 pacientů léčených tildrakizumabem po dobu až pěti let potvrdila velmi dobrý dlouhodobý bezpečnostní profil bez výskytu nových neočekávaných nežádoucích účinků [8]. Data z prospektivní studie z reálné praxe u více než 440 pacientů prokázala během jednoho roku léčby nízký výskyt (15 % pacientů) nežádoucích účinků, a to převážně běžných respiračních infekcí. Významné nežádoucí účinky související s léčbou se objevily pouze u 3 % ze všech léčených pacientů [9].
Lékové interakce
Nepředpokládá se souběžné podávání léčivých přípravků ovlivňujících farmakokinetiku tildrakizumabu, neboť je odstraňován z těla obecnými procesy proteinového katabolismu bez přispění enzymů CYP450 a není eliminován renální ani hepatální cestou. Dle provedených studií lékových interakcí se neprokázalo, že by tildrakizumab měl vliv na farmakokinetiku souběžně podávaných léčivých přípravků metabolizovaných enzymy ze skupiny cytochromů.
V rámci hodnocení tildrakizumabu nebyly zkoumány bezpečnost a účinnost v kombinaci s jinými imunosupresivy nebo fototerapií. Taktéž v současnosti nemáme údaje o odpovědi na podání živé či inaktivované vakcíny u pacientů užívajících tildrakizumab, z toho důvodu se živé vakcíny nemají podávat současně s tildrakizumabem [3].
Těhotenství a kojení
Těhotenství
Studie reprodukční toxicity na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky léčby. Nicméně údaje o podávání tildrakizumabu těhotným ženám nejsou k dispozici. Proto se podávání přípravku v těhotenství z preventivních důvodů nedoporučuje. Ženám ve fertilním věku je doporučeno během léčby a minimálně 17 týdnů po ukončení léčby užívat účinnou metodu antikoncepce [3].
Kojení
Není známo, zda se tildrakizumab vylučuje do lidského mateřského mléka. Dostupné toxikologické údaje u makaků ukázaly zanedbatelné koncentrace přípravku v mléce osmý den po narození. U člověka mohou být během několika prvních dní po narození protilátky přeneseny mateřským mlékem do těla novorozence, proto riziko pro kojené novorozence nelze za toto krátké období vyloučit. U kojících žen je proto nutno vždy postupovat individuálně na základě posouzení prospěšnosti kojení pro dítě a prospěšnosti léčby pro matku [3].
Fertilita
Vliv přípravku na lidskou fertilitu nebyl hodnocen. Studie na zvířatech nenaznačují přímé nebo nepřímé škodlivé účinky.
Závěr
Tildrakizumab v léčbě pacientů se středně závažnou a závažnou psoriázou prokázal v klinických studiích i v běžné praxi dobrou účinnost a velmi dobrý bezpečnostní profil. Výhodou tohoto léku je aplikace udržovací léčby ve formě subkutánní injekce jednou za 12 týdnů. Na základě současných evropských doporučení by bylo v budoucnu vhodné zařazení tohoto blokátoru IL‑23 do léčby první linie také v ČR.
Literatura
[1] Puig L. PASI 90 response: the new standard in therapeutic efficacy for psoriasis. J Eur Acad Dermatol Venereol 2015; 29: 645–648.
[2] Puig L, Thom H, Mollon P, et al. Clear or almost clear skin improves the quality of life in patients with moderate‐to‐severe psoriasis: a systematic review and meta‐analysis. J Eur Acad Dermatol Venereol 2017; 31: 213–220.
[3] Souhrn údajů o přípravku Ilumetri. Dostupné na: https://www.sukl.cz/ (navštíveno 5. 7. 2023)
[4] Nast A, Smith C, Spuls PI, et al. EuroGuiDerm Guideline on the systemic treatment of Psoriasis vulgaris–Part 1: treatment and monitoring recommendations. J Eur Acad Dermatol Venereol 2020; 34: 2461–2498.
[5] Rendon A, Schäkel K. Psoriasis pathogenesis and treatment. Int J Mol Sci 2019; 20: 1475.
[6] Banaszczyk K. Tildrakizumab in the treatment of psoriasis – literature review. Reumatologia 2019; 57: 234–238.
[7] Reich K, Papp KA, Blauvelt A, et al. Tildrakizumab versus placebo or etanercept for chronic plaque psoriasis (reSURFACE 1 and reSURFACE 2): results from two randomised controlled, phase 3 trials. Lancet 2017; 390: 276–288.
[8] Thaçi D, Piaserico S, Warren RB, et al. Five‐year efficacy and safety of tildrakizumab in patients with moderate‐to‐severe psoriasis who respond at week 28: pooled analyses of two randomized phase III clinical trials (reSURFACE 1 and reSURFACE 2). Br J Dermatol 2021; 185: 323–334.
[9] Tsianakas A, Schwichtenberg U, Pierchalla P, et al. Real‐world effectiveness and safety of tildrakizumab in long‐term treatment of plaque psoriasis: Results from the non‐interventional, prospective, multicentre study TILOT. J Eur Acad Dermatol Venereol 2023; 37: 85–92.
[10] Costanzo A, Llamas‑Velasco M, Fabbrocini G, et al. Tildrakizumab improves high burden skin symptoms, impaired sleep and quality of life of moderate‐to‐severe plaque psoriasis patients in conditions close to clinical practice. J Eur Acad Dermatol 2023, May 29; doi: 10.1111/jdv.19229. Online ahead of print.
[11] Blauvelt A, Reich K, Papp KA, et al. Safety of tildrakizumab for moderate‐to‐severe plaque psoriasis: pooled analysis of three randomized controlled trials. Br J Dermatol 2018; 179: 615–622.
[12] Reich K, Warren RB, Iversen L, et al. Long‐term efficacy and safety of tildrakizumab for moderate‐to‐severe psoriasis: pooled analyses of two randomized phase III clinical trials (reSURFACE 1 and reSURFACE 2) through 148 weeks. Br J Dermatol 2020; 18: 605–617.