Vinflunin
Vinflunin je semisyntetický vinka-alkaloid třetí generace. Studie fáze III srovnávající vinflunin v kombinaci s nejlepší podpůrnou léčbou (best supportive care, BSC) versus BSC samotná prokázala na základě sekundární analýzy přínos vinfluninu pro celkové přežití nemocných s invazivním lokálně pokročilým nebo metastatickým karcinomem močového měchýře po předchozí léčbě platinovým derivátem. Vinflunin je indikován pro léčbu druhé linie uroteliálního karcinomu močového měchýře.
Farmakologická skupina
Vinflunin patří mezi vinka-alkaloidy, poprvé získané z barvínku lékařského (Vinca rosea), ATC kód: L01CA05
Chemické a fyzikální vlastnosti
Z původních látek, jako jsou vinkristin a vinblastin, jsou odvozena analoga jako vinorelbin a vinflunin, což je v podstatě hydrogenovaný (poloha 4 a 5) a difluorovaný (1,1-difluorethyl v poloze 4 catharantinu) derivát vinorelbinu (obr. 1). 
Molekulová hmotnost: 816
Mechanismus účinku, farmakodynamika
Vinflunin se pevně váže na buněčné mikrotubuly a tím blokuje jejich funkci (obr. 2). Místem vazby je mikrotubulární protein tubulin, specificky se váže na jeho podjednotky během S fáze buněčného cyklu, ukončuje formaci mikrotubulů, vyvolává jejich depolymerizaci, následně rozpuštění mitotického vřeténka a výsledkem je i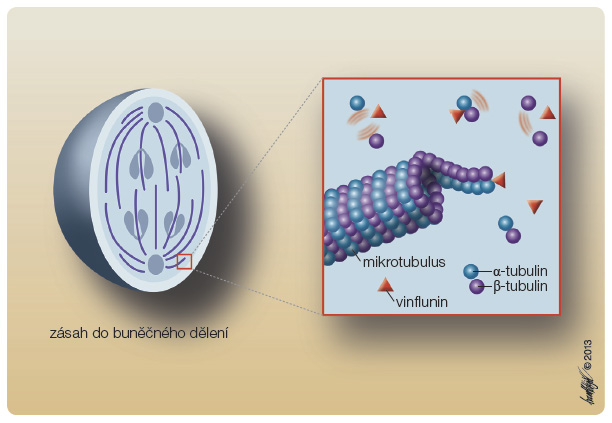 nhibice mitózy.
nhibice mitózy.
Kromě toho může ovlivňovat další buněčné systémy, jako je syntéza RNA a DNA, cyklický adenosinmonofosfát (cAMP), lipidová biosyntéza a kalmodulin-dependentní Ca2+ transportní ATPáza [1]. V preklinických studiích in vitro u nemalobuněčného karcinomu plic (NSCLC) vinflunin demonstroval synergický účinek s cisplatinou, mitomycinem C, doxorubicinem a 5-fluorouracilem. Vinflunin in vitro také synchronizoval buňky v G2/M fázi buněčného cyklu a prokázal následný radiosenzibilizační efekt u různých druhů nádorových onemocnění [2]. Vinflunin v preklinických studiích prokázal in vivo vyšší protinádorovou aktivitu než ostatní inhibitory mikrotubulů. Na základě dat o aktivitě a účinnosti z preklinických hodnocení byl následně hodnocen jak v monoterapii, tak v kombinačních režimech u nádorů prsu, NSCLC, malobuněčného karcinomu plic (SCLC), karcinomu prostaty, žaludku, maligního pleurálního mezoteliomu a karcinomu ledviny.
Farmakokinetické vlastnosti
Vinflunin se u lidí středně váže na plazmatické bílkoviny (67,2 % ± 1,1 %) s poměrem mezi plazmou a celkovými krevními koncentracemi 0,80 ± 0,12. Vazba na bílkoviny zahrnuje především lipoproteiny s vysokou hustotou a sérový albumin. Vazba na α1-kyselý glykoprotein a krevní destičky je zanedbatelná (< 5 %). Konečný distribuční objem je velký (asi 35 l/kg). Všechny identifikovatelné metabolity se tvoří izoenzymem cytochromu CYP3A4, s výjimkou 4-O-deacetylvinfluninu (DVFL), jediného aktivního metabolitu a hlavního metabolitu v krvi, který se tvoří mnohočetnými esterázami. Vinflunin se eliminuje multiexponenciálním koncentračním poklesem, s terminálním poločasem (t1/2) téměř 40 hodin. DVFL se tvoří pomalu a eliminuje se pomaleji než vinflunin, s t1/2 přibližně 120 hodin. Vinflunin a jeho metabolity se vylučují ze dvou třetin stolicí a z jedné třetiny močí [8].
Klinické zkušenosti
Bennouna hodnotil vinflunin ve studii fáze I u 31 nemocných s pokročilými karcinomy [3]. Pacienti byli léčeni eskalujícími dávkami v rozmezí 30–400 mg/m2 vinfluninu podávaného i.v. v 21denním intervalu a jako maximálně tolerovatelná dávka bylo autory studie stanoveno 400 mg/m2.
Jako nežádoucí účinky byly hodnoceny mukozitida, zácpa a neutropenie, ale velmi krátkého trvání. U tří hodnocených nemocných bylo dosaženo parciální remise. Pro další hodnocení byla stanovena doporučená dávka vinfluninu 350 mg/m2 podávaná i.v. každé tři týdny.
V roce 2006 představil Johnson s kolektivem výsledky studie fáze I, do níž bylo zařazeno 16 nemocných s pokročilými solidními tumory, jimž byl vinflunin podáván v den 1 a 8 v intervalu 21 dní jako 10minutová infuze [4]. Na základě zácpy a neutropenie, u nichž byla prokázána závislost na podané dávce, byla maximálně tolerovatelná dávka vinfluninu stanovena na 190 mg/m2. Z hlediska hodnocení účinku nebyly zaznamenány žádné objektivní odpovědi. Autoři doporučili pro další podání dávku vinfluninu 190 mg/m2 v den 1 a 8 v intervalu 3 týdnů.
Na základě dobrého bezpečnostního profilu ze studií fáze I a prokázané kompletní remise u pacientů s uroteliálním karcinomem močového měchýře byly s vinfluninem zahájeny studie fáze II právě u uroteliálního karcinomu. Culine a kol. provedli otevřenou multicentrickou nekomparativní studii fáze II (vinflunine 202) u 51 nemocných s uroteliálním karcinomem močového měchýře po předchozí léčbě cisplatinou v první linii v 16 evropských centrech [5]. Nemocní byli léčeni dávkou 320 mg/m2 v intervalu tří týdnů.
Jako primární cíl bylo stanoveno měření odpovědi tumoru, sekundárním cílem byla doba trvání odpovědi, přežití bez progrese, celkové přežití a toxicita léčby. Objektivní odpovědi bylo dosaženo u 24 % nemocných předtím léčených pro pokročilé onemocnění a u 6 % nemocných předléčených neoadjuvantní nebo adjuvantní terapií. Medián doby trvání odpovědi byl 9,1 měsíce (95% interval spolehlivosti – CI: 4,2–15,0) a přežití bez progrese onemocnění 3 měsíce (95% CI: 2,4–3,8). Medián celkového přežití představoval 6,6 měsíce (95% CI: 4,8–7,6). Hematologická toxicita stupně 3–4 zahrnovala leukopenii u 45 % nemocných, neutropenii u 67 % a febrilní neutropenie byla zaznamenána u 10 % pacientů. Pokud jde o nehematologickou toxicitu, nebyly zaznamenány neuropatie nebo renální poškození stupně 3–4 (95% CI: 4,2–15,0).
V roce 2009 provedli Vaughn a kol. ve Spojených státech studii (CA 001), která hodnotila bezpečnost a účinnost u nemocných s uroteliálním karcinomem močového měchýře s progresí během 12 měsíců po chemoterapii založené na cisplatině [6]. Pacienti byli léčeni iniciální dávkou vinfluninu 280 mg/m2, která byla následně po dvou cyklech při dobré toleranci eskalována na 320 mg/m2. Dávka byla upravována podle věku nemocných (> 75 let), Karnofského indexu (> 80), radioterapie na oblast pánve a renálních funkcí. Celkem bylo hodnoceno 151 ze 175 nemocných. Parciální remise bylo dosaženo u 15 % nemocných (95 % CI: 9–21 %), stabilizace onemocnění ve 42 % a celkem bylo odpovědi dosaženo u 14,6 % léčených. Medián doby trvání odpovědi byl 6,0 měsíců (95% CI: 5,4–9,5 měsíce), medián trvání stabilizace onemocnění 4,0 měsíce (95% CI: 3,5–4,7 měsíce). Medián doby do progrese byl 2,8 měsíce a medián celkového přežití 8,2 měsíce. Z hlediska hodnocení bezpečnosti přípravku byla z hematologické toxicity stupně 3–4 nejvíce zaznamenána neutropenie – u 58 % nemocných, leukopenie u 49 %, febrilní neutropenie u 7 % a anémie u 26 % léčených. Nehematologická toxicita stupně 3–4 zahrnovala zácpu (17 %), únavu (13
%), ileus (5 %) a bolesti břicha (5 %). Při podávání vinfluninu nebyl zaznamenán vliv na zhoršení renálních funkcí.
Na základě výsledků dvou studií fáze II provedli Bellmunt a kol. [7] randomizovanou mezinárodní studii fáze III sledující vinflunin v kombinaci s nejlepší podpůrnou léčbou (BSC, best supportive care) oproti BSC samotné jako léčbu druhé linie u pacientů, u nichž došlo k progresi onemocnění po absolvování chemoterapeutického režimu s platinou. Studie se zúčastnilo 370 nemocných, 253 bylo zařazeno do ramene s kombinací vinflunin a BSC a 117 do ramene s BSC. Vstupní kritéria byla stejná jako ve studiích fáze II. Pacienti s performance status 0 (stav výkonnosti) podle kritérií ECOG byli léčeni dávkou 320 mg/m2 a nemocní s performance status 1 nebo nemocní s performance status 0, ale po předchozí radioterapii zaměřené na oblast pánve, byli léčeni dávkou 280 mg/m2 s následným navýšením dávky na 320 mg/m2, pokud to jejich stav dovolil. Celkem 40 % nemocných bylo léčeno pro uzlinové postižení, tzv. bulky disease, 74 % zařazených mělo viscerální metastázy a u 80 % pacientů došlo k relapsu nebo progresi onemocnění během 6 měsíců od ukončení první linie léčby platinovým derivátem. V rameni s vinfluninem byla zaznamenána vysoká frekvence neutropenií (50 %), ale pouze 6 % z těchto pacientů mělo febrilní neutropenii. Statistická hypotéza této studie stanovila přínos pro prodloužení celkového přežití pro skupinu nemocných léčenou vinfluninem na 2 měsíce (6 měsíců vs. 4 měsíce). Při zhodnocení studie byla sice zaznamenána výhoda dvouměsíčního přežití v rameni s vinfluninem, ale nejednalo se o statisticky signifikantní rozdíl (p = 0,29).
Následná multivariantní analýza pracující s prognostickými faktory ukázala statisticky signifikantní efekt vinfluninu na celkové přežití (p = 0,04), také faktory jako hladina hemoglobinu, metastatické postižení viscerálních orgánů nebo performance status mají výrazný vliv na přežití při léčbě vinfluninem. V rameni s vinfluninem bylo zaznamenáno 8,6 % objektivních odpovědí, což je méně než v předchozích studiích fáze II. Kontroly onemocnění bylo dosaženo ve 41,1 %, doba do progrese onemocnění byla tři měsíce. Medián trvání odpovědi byl 7,4 měsíce, doba trvání kontroly onemocnění 5,7 měsíce. U nemocných léčených vinfluninem probíhala terapie 9,5 měsíce.
Indikace
Studie fáze III srovnávající kombinaci vinfluninu a BSC s BSC samotnou prokázala na základě sekundární analýzy přínos kombinované terapie pro celkové přežití u nemocných s invazivním lokálně pokročilým nebo metastatickým karcinomem močového měchýře po předchozí léčbě platinovým derivátem [7].
Vinflunin byl na základě dat z této studie dne 21. září 2009 schválen Evropskou lékovou agenturou (EMA, European Medicines Agency) jako léčba druhé linie u nemocných s uroteliálním karcinomem močového měchýře po první linii léčby platinovým derivátem pro pokročilé nebo metastatické onemocnění [8].
Zařazení do současné palety léčiv
Léčba metastatického uroteliálního karcinomu prošla několikaletým vývojem. Režim M-VAC (methotrexát, vinblastin, doxorubicin, cisplatina) v nerandomizované klinické studii prokázal regresi tumoru u 72 % nemocných, z toho v 36 % bylo dosaženo kompletní remise [10]. Po dobu tří let přežívalo 55 % léčených, kteří této kompletní remise dosáhli.
Randomizovaná studie fáze III, do níž bylo zařazeno 405 pacientů, srovnávala čtyřkombinaci M-VAC s dvojkombinací gemcitabin/cisplatina [11]. Počet odpovědí (49 % vs. 46 %), doba do progrese onemocnění (7,4 vs. 7,4 měsíce) i celkové přežití (13,8 vs. 14,8 měsíce) byly v obou ramenech stejné. Bezpečnostní profil se ale prokázal jako jednoznačně lepší v rameni s gemcitabinem. Tyto výsledky posunuly kombinaci gemcitabin/cisplatina
na místo standardního režimu určeného pro léčbu pokročilého uroteliálního karcinomu močového měchýře.
U metastatického karcinomu močového měchýře se uskutečnila celá řada studií s taxany. Ve studii EORTC fáze III (protokol #30987) byl ke kombinaci gemcitabin/cisplatina přidán paklitaxel. V tripletu bylo sice dosaženo vyššího počtu objektivních odpovědí (57 % vs. 46 %) a kompletních remisí (15 % vs. 10 %), ale statisticky signifikantního rozdílu v celkovém přežití dosaženo nebylo (15,7 vs. 12,8 měsíce) [12].
Řadě studií byla podrobena i druhá linie léčby. Německá studie fáze III srovnávala krátkodobou terapii (maximálně 6 cyklů chemoterapie po 21 dnech) a dlouhodobou terapii (léčba do progrese onemocnění) kombinací paklitaxel/gemcitabin ve druhé linii léčby metastatického uroteliálního karcinomu po selhání terapie první linie založené na cisplatině [13]. Výsledky neprokázaly rozdíl v celkovém přežití (7,8 vs. 8,0 měsíce), době do progrese (4 vs. 3,1 měsíce) ani v počtu objektivních odpovědí (37,5 % vs. 41,5 %). Vyšší výskyt anémií (26 % vs. 6,7 %) byl zjištěn v rameni s dlouhodobou léčbou.
Studií Hoosier Oncology Group byla hodnocena účinnost pemetrexedu ve druhé linii léčby [14]. Objektivních odpovědí bylo dosaženo ve 27,7 %, doba do progrese představovala 2,9 měsíce a doba celkového přežití 9,6 měsíce.
Pokud se podíváme na statisticky signifikantní efekt na celkové přežití, redukci rizika úmrtí, procento objektivních odpovědí, procento kontroly nemoci a dobu do progrese onemocnění u vinfluninu ve srovnání s ostatními cytostatiky ve druhé linii léčby metastatického uroteliálního karcinomu močového měchýře a pokud vezmeme v úvahu ještě dobrý bezpečnostní profil vinfluninu, můžeme toto léčivo doporučit pro druhou linii léčby uroteliálního karcinomu po selhání nebo intoleranci cisplatiny v první linii.
Kontraindikace
Léčba vinfluninen je kontraindikována u nemocných s přecitlivělostí na léčivo, jiné alkaloidy z rodu Vinca rosea a u nemocných s nedávno proběhlou (v předchozích dvou týdnech) nebo současnou závažnou infekcí. Léčba je dále kontraindikována u nemocných s výchozím počtem neutrofilů < 1500/mm3nebo s počtem krevních destiček < 100 000/mm3. Kontraindikací je rovněž laktace.
Nežádoucí účinky
Nejčastějšími nežádoucími reakcemi souvisejícími s léčbou vinfluninem byly hematologické poruchy jako neutropenie, anémie, dále gastrointestinální poruchy, především zácpa, anorexie, nauzea, stomatitida/mukozitida, zvracení, bolest břicha, průjem a astenie. Neutropenie je častým nežádoucím účinkem léčby vinfluninem, febrilní neutropenie se objevila ve studii fáze III u 6 % nemocných.
U 15,3 % léčených pacientů se objevila závažná zácpa, která je však reverzibilní a nezhoršuje se. Od 1. do 5. nebo 7. dne léčebného cyklu je potřeba dodržovat speciální dietní opatření, jako je perorální hydratace a podání laxativ. U nemocných s vysokým rizikem zácpy (např. současná léčba opiáty, metastatická infiltrace peritonea, chirurgický výkon v dutině břišní) se má před podáním vinfluninu podávat od 1. do 7. dne jedenkrát denně před snídaní polyethylenglykol. V případě zácpy 2. stupně trvající déle než 7 dní a při zácpě 3. stupně a vyššího bez ohledu na dobu trvání je potřeba dávku vinfluninu upravit. Při podání vinfluninu bylo zaznamenáno podráždění žil 1. stupně (22 % pacientů, 14,1 % cyklů), 2. stupně (11,0 % pacientů, 6,8 % cyklů) nebo 3. stupně (0,8 % pacientů, 0,2 % cyklů). Ve všech případech podráždění ustoupilo rychle bez nutnosti přerušení léčby. Po podání vinfluninu bylo pozorováno prodloužení intervalu QT [7].
Lékové interakce
Souběžnému podání vinfluninu a silných inhibitorů CYP3A4 (jako je ritonavir, ketokonazol, itrakonazol a grapefruitový džus) anebo silných induktorů (jako je rifampicin) je potřeba se vyhýbat, protože mohou zvyšovat nebo snižovat koncentrace vinfluninu a DVFL. Nedoporučuje se podání vinfluninu s léky, které prodlužují interval QT/QTc. Mezi vinfluninem a lipozomálním doxorubicinem byla pozorována farmakokinetická interakce, která vedla ke zvýšení expozice vinfluninu o 15–30 % a ke 2–3násobnému snížení AUC doxorubicinu, zatímco metabolity doxorubicinu nebyly ovlivněny.
Těhotenství a kojení
Nejsou k dispozici žádná data o používání vinfluninu u gravidních žen. Vinflunin se nemá používat během gravidity, pokud to není jednoznačně nevyhnutelné.
Dávkování
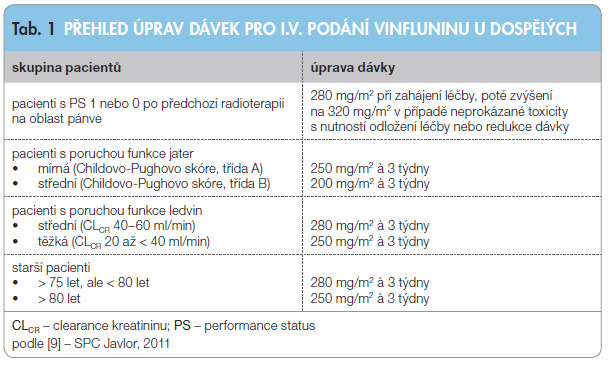 Doporučená dávka je 320 mg/m2 vinfluninu jedenkrát za 3 týdny ve formě intravenózní infuze po dobu trvání 20 minut, nesmí se podávat rychlým intravenózním bolusem. Přehled úprav dávek u jednotlivých podskupin nemocných uvádí tab. 1. Vinflunin se musí aplikovat pouze intravenózně, intratekální podání může být smrtelné. Objem koncentrátu, který odpovídá vypočítané dávce vinfluninu, se rozmíchá ve 100ml vaku s infuzním roztokem chloridu sodného 9 mg/ml (0,9 %). Může se použít také infuzní roztok glukózy 50 mg/ml (5 %) [9].
Doporučená dávka je 320 mg/m2 vinfluninu jedenkrát za 3 týdny ve formě intravenózní infuze po dobu trvání 20 minut, nesmí se podávat rychlým intravenózním bolusem. Přehled úprav dávek u jednotlivých podskupin nemocných uvádí tab. 1. Vinflunin se musí aplikovat pouze intravenózně, intratekální podání může být smrtelné. Objem koncentrátu, který odpovídá vypočítané dávce vinfluninu, se rozmíchá ve 100ml vaku s infuzním roztokem chloridu sodného 9 mg/ml (0,9 %). Může se použít také infuzní roztok glukózy 50 mg/ml (5 %) [9].
Seznam použité literatury
- [1] Oktábec Z, Jampílek J. Stručná historie chemoterapie. Chemické listy 2013; 107: 151–159.
- [2] Simoens C, Vermorken JB, Korst AE, et al. Cell cycle effects of vinflunine, the most recent promising Vinca Alkaloid, and its interaction with radiation, in vitro. Cancer Chemother Pharmacol 2006; 58: 210–218.
- [3] Bennouna J, Fumoleau P, Armand JP, et al. Phase I and pharmacokinetic study of the new vinca alkaloid vinflunine administered as a 10--min infusion every 3 weeks in patients with advanced solid tumors. Ann Oncol 2003; 14: 630–637.
- [4] Johnson P, Geldart T, Fumoleau P, et al. Phase I study of vinflunine administered as a 10-minutes infusion on days 1 and 8 every 3 weeks. Invest New Drugs 2006; 24: 223–231.
- [5] Culine S, Theodore C, De Santis M, et al. A phase II study of vinflunine in bladder cancer patients progressing after first-line platinum-containing regimen. Br J Cancer 2006; 94: 1395–1401.
- [6] Vaughn DJ, Srinivas S, Stadler WM, et al. Vinflunine in platinum-pretreated patients with locally advanced or metastatic urothelial carcinoma: results of a large phase 2 study. Cancer 2009; 115: 4110–4117.
- [7] Bellmunt J, Theodore C, Demkov T, et al. Phase III trial of vinflunine plus best supportive care compared with best supportive care alone after a platinum-containing regimen in patients with advanced transitional cell carcinoma of the urothelial tract. J Clin Oncol 2009; 27: 4454–4461.
- [8] Gerullis H, Ecke T, Eimer CH, et al. Vinflunine as second-line treatment in platin-resistant metastatic urothelial carcinoma: a review Anti-Cancer Drugs 2011; 22: 9–17.
- [9] Summary of product characteristics Javlor 25 mg/mL concentrate for solution for infusion (11/2011), dostupné na http://www.ema.europa.eu/, (navštíveno 10. 5. 2013).
- [10] Sternberg CN, Yagoda A, Scher HI, et al. Methotrexate, vinblastine, doxorubicin and cisplatin for advanced transitional cell carcinoma of the urothelium. Efficacy and patterns of response and relapse. Cancer 1989; 64: 2448–2458.
- [11] von der Maase H, Hansen SW, Roberts JT, et al. Gemcitabine and cisplatine versus metho-trexate, vinblastine, doxorubicin and cisplatin in advanced or metastatic bladder cancer: results of a large, randomized, multinational, multicenter, phase III study. J Clin Oncol 2000; 18: 3068–3077.
- [12] Bellmunt J, von der Maase H, Mead GM, et al. Randomized phase III study comparing paclitaxel/cisplatin/gemcitabine (PCG) and gemcitabine/cisplatin (GC) in patients with locally advanced (LA) or metastatic (M) urothelial cancer without prior systemic therapy. EORTC Intergroup Study 30987. J Clin Oncol 2012; 30: 1107–1113
- [13] Albers P, Park SI, Niegisch G, et al. Randomized phase III trial of 2nd line gemcitabine and paclitaxel chemotherapy in patients with advanced bladder cancer: short-term versus prolonged treatment (German Association of urological Oncology (AUO) trial AB 20/99. Ann Oncol 2011; 22: 288–294.
- [14] Sweeney CJ, Roth BJ, Kabbinavar FF, et al. Phase II study of pemetrexed for second-line treatment of transitional cell cancer of the urothelium. J Clin Oncol 2006; 24: 3451–3457.