Dlouhodobá účinnost léčby roztroušené sklerózy fingolimodem – deset let zkušeností z reálné klinické praxe
Souhrn
Tichá V. Dlouhodobá účinnost léčby roztroušené sklerózy fingolimodem – deset let zkušeností z reálné klinické praxe. Remedia 2024; 34: 63–68.
Fingolimod je lék s vysokou účinností určený k léčbě aktivní relabující‑remitující roztroušené sklerózy. Tato práce hodnotí retrospektivně klinickou účinnost fingolimodu u souboru 692 pacientů léčených po dobu až 10 let. Hodnoceny byly parametry aktivity nemoci pomocí změny roční četnosti relapsů a progrese neurologické disability prostřednictvím škály EDSS (Expanded Disability Status Scale). Roční četnost relapsů a stupeň EDSS během léčby byly porovnány se vstupními hodnotami a hodnotami jeden a dva roky před zahájením léčby. Průměrná doba sledování byla 4,75 roku. Roční četnost relapsů se snížila během prvního roku léčby o 71 % – z 1,21 na 0,35 relapsu za rok – a dále pozvolna klesala. Během celého sledovaného období zůstalo 41 % pacientů bez relapsu. Průměrné skóre EDSS kleslo ze vstupní hodnoty 3,04 na 2,82 za první rok léčby a do konce čtvrtého roku léčby, kdy bylo 3,14, se drželo na nižších hodnotách, než bylo vstupní EDSS. Od pátého roku skóre EDSS velmi pozvolna stoupalo na 3,48 na konci devátého roku léčby. Léčba fingolimodem vedla k významnému potlačení aktivity nemoci a ke zpomalení progrese neurologického postižení až po dobu 10 let. Po zhruba čtyřech letech léčby dochází i bez přítomnosti relapsů k velmi pomalému zhoršování neurologického deficitu, což je nejspíše způsobeno tzv. progresí nezávislou na relapsech, která nebyla léčbou dostatečně ovlivněna.
Klíčová slova: roztroušená skleróza – fingolimod – dlouhodobá léčba – roční četnost relapsů.
Summary
Ticha V. Long‑term effectiveness of multiple sclerosis treatment with fingolimod – ten years of real‑life clinical experience. Remedia 2024; 34: 63–68.
Fingolimod represents a high efficacy treatment for active relapsing‑remitting multiple sclerosis. The aim of this work is to assess retrospectively the clinical effectiveness of fingolimod therapy in a group of 692 patients so treated for up to 10 years. Disease activity was assessed by the change in annual relapse rate and the progression of neurological disability was assessed by the change in EDSS score. Both the annual relapse rate and EDSS during the treatment were compared with the baseline values and with values obtained one and two years preceding fingolimod initiation. Average follow‑up duration was 4.75 years. Annual relapse rate decreased by 71% in the first year of fingolimod treatment from 1.21 to 0.35 relapses per year and was continuously decreasing in the following years. 41% of patients remained relapse‑free for the whole follow‑up period. Mean EDSS score decreased from 3.04 at baseline to 2.82 after one year on fingolimod and the score remained lower compared to the baseline value for four years. Since the fifth year of the treatment, EDSS score was increasing slowly over the next years to 3.48 at the end of the ninth year. Treatment with fingolimod led to a significant suppression of clinical activity and slowing down of the neurological disability progression. After approximately four years of the treatment, even in the absence of relapses, very slow continuous worsening of disability was observed. This may be caused by so called progression independent on relapse activity, which was not suppressed sufficiently by fingolimod treatment.
Key words: multiple sclerosis – fingolimod – long‑term therapy – annual relapse rate.
Úvod
Roztroušená skleróza (RS) je chronické zánětlivé autoimunitní onemocnění centrálního nervového systému (CNS), které postihuje zejména mladé dospělé osoby [1]. Na patogenezi RS se podílejí všechny součásti imunitního systému, přičemž klíčovou roli hrají autoagresivní T lymfocyty a protilátky produkující B lymfocyty.
Toto onemocnění vzniká u geneticky vnímavých jedinců působením zevních a vnitřních faktorů. K nejdůležitějším zevním faktorům patří nákaza virem Epsteina–Barrové (EBV), nedostatek vitaminu D, kouření a stres, dále obezita a nedostatek pohybu, a důležitou roli hraje zřejmě také střevní mikrobiom. Současné poznatky ukazují, že onemocnění má dlouhé prodromální stadium, které je klinicky asymptomatické nebo se objevují jen nespecifické příznaky jako únava, bolesti hlavy a poruchy nálady, ale na magnetické rezonanci (MR) již lze pozorovat nálezy hyperintenzních plak, v séru a likvoru zvýšené hladiny lehkých řetězců neurofilament a vysoké hodnoty protilátek proti EBV [2].
Nejčastějším typem klinického průběhu je relabující‑remitující RS (RR‑RS), ve které se střídají různě dlouhá období remise s relapsy, tedy vzplanutím nemoci s novými neurologickými příznaky. Tato fáze RS přechází plynule do období tzv. sekundární progrese, které je charakterizováno vyhasínáním relapsů a pozvolným nárůstem neurologického postižení. Asi 10 % pacientů má průběh primárně progresivní, při němž se neurologické obtíže od počátku pomalu zhoršují bez přítomnosti relapsů. Tato klasifikace vychází z typického klinického obrazu nemoci, ale nezohledňuje dobře známý fakt, že degenerativní procesy spojené se zánětem probíhají již od samého počátku nemoci, resp. ještě předtím, než se nemoc klinicky projeví, mají za následek nevratné poškození mozkové a míšní tkáně se ztrátou neuronů a jejich axonů a jsou zodpovědné za pozvolné zhoršování neurologického stavu pacientů i v období, kdy jsou zdánlivě stabilizovaní a nemají relapsy. Diagnóza RS je založena na typickém klinickém obraze a nálezu hyperintenzních ložisek na T2 vážených nebo FLAIR (fluid attenuated inversion recovery) sekvencích na MR a přítomnosti tzv. oligoklonálních pásů v mozkomíšním moku. Diagnózu RS jsme dnes schopni stanovit ve velmi časném stadiu, tedy již v období prvních příznaků, a to nám umožňuje neprodleně zahájit léčbu ještě ve fázi málo rozvinuté nemoci.
Léčba roztroušené sklerózy
Léčba rs spočívá v modulaci nebo supresi imunitního systému s cílem potlačit poškozující zánět, ochránit CNS před nevratnou degenerací a umožnit regenerační procesy, které povedou k obnovení funkce nervové tkáně. Léčbu spočívající v přímém obnovení myelinových obalů nervových vláken nebo ochraně neuronů před degenerací či podporující přímo jejich regeneraci bez primárního působení na zánět zatím k dispozici nemáme.
Zásadní zlom v léčbě RS nastal v roce 1996, kdy vstoupil na náš trh první lék ze skupiny biologických léků s imunomodulačním účinkem, injekční, subkutánně aplikovaný interferon beta 1b (IFN‑1b). Krátce potom přišly na trh další přípravky obsahující IFNβ a glatiramer acetát, všechny aplikované podkožně nebo nitrosvalově. Tyto léky tzv. první linie dokáží zabránit zhruba 30 % relapsů, ale minimálně ovlivňují progresi neurologického deficitu. Vysokou účinnost v prevenci relapsů a zpomalení progrese nemoci má natalizumab uvedený na trh v roce 2007, který se aplikuje intravenózně nebo v podkožní injekci 1× za čtyři týdny. Další v řadě léků s vysokou účinností, ale první v perorální formě, byl agonista receptoru pro sfingosin‑1‑fosfát (S1P) fingolimod, komerčně dostupný v České republice od října 2012. Dále přicházely na trh léky s novým mechanismem účinku teriflunomid, dimetylfumarát a vysoce účinné léky, např. anti‑CD20 molekuly okrelizumab a ofatumumab, anti‑CD52 molekula alemtuzumab a kladribin působící selektivní rekonstituci imunitního systému, určené k eskalaci léčby při selhání léků první volby. Posledními novinkami jsou selektivní agonisté receptoru pro S1P siponimod, ponesimod a ozanimod.
Od září 2022 nastal další významný průlom v léčbě RS, a to možnost zahájit léčbu vysoce účinnými léky již po první atace u pacientů, kteří splňují kritéria nepříznivé prognózy vývoje nemoci. Strategie léčby, která byla dosud založena na principu zahájení léčby méně účinnými, ale bezpečnějšími léky první linie a při jejich selhání na eskalaci na vysoce účinné léky druhé linie, se zásadně změnila. Včasné zahájení léčby vysoce účinnými léky tak může významně zpomalit progresi a oddálit přechod do sekundárně progresivní RS.
Fingolimod
Fingolimod byl první perorální lék určený k léčbě aktivní RR‑RS. Mechanismem účinku patří k agonistům receptoru pro S1P [3]. Váže se zejména na podtypy receptoru 1 a 5, které se vyskytují na buňkách imunitního systému, glii a neuronech. Navázání fingolimodu na receptory pro S1P vede k jejich rychlé internalizaci a degradaci [2].
Léčebný účinek je zprostředkován především fingolimodem navozenou relativní lymfopenií při selektivním zablokování signálu pro výstup CCR7+ naivních a centrálních paměťových T lymfocytů a B lymfocytů z lymfatických uzlin. Ne zcela jasnou roli v klinickém efektu fingolimodu může hrát i přímý efekt na nervových buňkách CNS a glii, které také exprimují S1P receptor [4].
Klinická účinnost a bezpečnost léčby byly ověřeny dvěma klinickými hodnoceními fáze III – placebem kontrolovanou studií FREEDOMS [5] a studií TRANSFORMS [6] s intramuskulárním IFNβ jako aktivním komparátorem, které prokázaly signifikantní vliv fingolimodu na snížení roční četnosti relapsů a snížení rizika progrese. V Evropské unii je fingolimod indikován buď k eskalaci léčby při selhání léků první volby, nebo jako lék první volby pro pacienty s rychle progredující závažnou RR‑RS [7].
Současná úhradová kritéria požadují nejméně jednu ataku během jednoho roku nebo dvě ataky za dva roky na léčbě první volby nebo intoleranci této léčby. U pacientů s rychle progredující závažnou formou RR‑RS a se známkami aktivity nebo progrese na MR je fingolimod hrazen jako lék první volby. Při skóre EDSS (Expanded Disability Status Scale) 5,5 a vyšším již není fingolimod zdravotními pojišťovnami hrazen [8].
K nejzávažnějším nežádoucím účinkům patří riziko vzniku atrioventrikulární (AV) blokády prvního a vzácně i vyššího stupně při působení fingolimodu na S1P1 receptory na kardiálních myocytech po podání první dávky, primoinfekce virem varicella zoster (VZV) a reaktivace herpes simplex viru (HSV). Dále makulární edém, který se objevuje nejčastěji ve třetím měsíci léčby, častěji u pacientů s anamnézou uveitidy a u diabetiků, a většinou spontánně odezní po jejím vysazení. Elevace jaterních enzymů nad trojnásobek normálních hodnot byla pozorována u 8 % pacientů, nad pětinásobek u 1,5 % a zcela vzácně nad desetinásobek normy. V klinických studiích se vyskytl častěji ve skupině léčených fingolimodem bazocelulární karcinom a tři případy lymfomu [9].
Fingolimod se podává v monoterapii v dávce jedna tableta 0,5 mg 1× denně. Před zahájením léčby je nutné provést vyšetření krevního obrazu s diferenciálním rozpočtem, jaterní testy, změření krevního tlaku a pulzu, vstupní elektrokardiogram (EKG), vyšetření IgG protilátek proti VZV, screening na hepatitidy a vstupní vyšetření optickou koherentní tomografií (OCT) nebo očního pozadí k vyloučení makulárního edému. Hodnota lymfocytů a jaterních testů by měla být kontrolována pravidelně v průběhu léčby, nutné jsou kontroly krevního tlaku a pulzu a vhodné je kontrolní EKG a vyšetření očního pozadí nebo OCT po třech měsících léčby. Z důvodů rizika rozvoje bradykardie nebo AV blokády je při podání první dávky nutná šestihodinová kontinuální monitorace EKG a kontrola krevního tlaku a pulzu. Léčbu fingolimodem je třeba ukončit dva měsíce před plánovaným těhotenstvím [8].
Metody
Cílem práce je retrospektivní zhodnocení dlouhodobé klinické účinnosti léčby fingolimodem. Do souboru byli zařazeni všichni pacienti léčení fingolimodem v RS centru při Neurologické klinice 1. LF UK a VFN v Praze, kteří užívali lék alespoň šest měsíců. Zdrojem klinických dat byla databáze iMED (www.imed.org), do které jsou pravidelně zadávána strukturovaná data získaná z běžné klinické dokumentace, a pacienti podepsali se zařazením do databáze informovaný souhlas.
Retrospektivně byla hodnocena klinická účinnost léčby ve smyslu ovlivnění aktivity nemoci hodnocené roční četností relapsů a progrese neurologického postižení sledováním průměrného skóre EDSS a jeho změny v jednotlivých letech léčby. Klinické parametry jsme hodnotili 24 a 12 měsíců před zahájením léčby, v době zahájení léčby a dále na konci každého roku léčby.
Výsledky
Soubor tvoří 692 dospělých pacientů s aktivní RR‑RS, kteří byli léčeni fingolimodem od července 2011 do konce června 2021. Jsou tedy dostupná až desetiletá data. Pacienti, kteří zahájili léčbu před uvedením komerčního fingolimodu na náš trh, byli léčeni v rámci schválení mimořádné úhrady zdravotní pojišťovnou. Zahrnuti jsou jak pacienti, kteří přešli na léčbu fingolimodem po selhání účinnosti léků první linie (eskalace léčby), tak pacienti terapeuticky naivní, pro něž byl fingolimod lékem první volby pro vysoce aktivní RS s rizikem rychlé progrese nemoci.
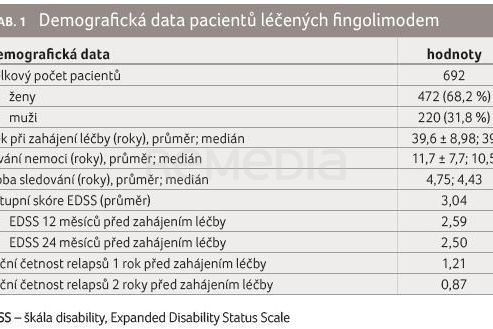 V souboru bylo 472 (68,2 %) žen a 220 (31,8 %) mužů, průměrný věk pacientů při zahájení léčby byl 39,6 ± 8,98 roku, medián 39 let a průměrné trvání nemoci v době zahájení léčby fingolimodem bylo 11,7 ± 7,7 roku, medián 10,5 roku. Průměrné EDSS při zahájení léčby fingolimodem bylo 3,04 a průměrná četnost relapsů v posledním roce před zahájením léčby 1,21 relapsu za rok (tab. 1).
V souboru bylo 472 (68,2 %) žen a 220 (31,8 %) mužů, průměrný věk pacientů při zahájení léčby byl 39,6 ± 8,98 roku, medián 39 let a průměrné trvání nemoci v době zahájení léčby fingolimodem bylo 11,7 ± 7,7 roku, medián 10,5 roku. Průměrné EDSS při zahájení léčby fingolimodem bylo 3,04 a průměrná četnost relapsů v posledním roce před zahájením léčby 1,21 relapsu za rok (tab. 1).
Roční četnost a celkový počet relapsů
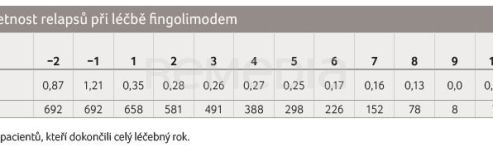 V prvním roce po zahájení léčby klesla roční četnost relapsů o 71 % – z 1,21 na 0,35 relapsu za rok oproti poslednímu roku. V dalších letech se roční četnost relapsů dále mírně snižovala až do devátého roku, kdy ve sledované skupině nebyl zaznamenán žádný relaps. V desátém roce léčby opět stoupla četnost relapsů na 0,29. Průměrná roční četnost relapsů po celou dobu léčby u celého souboru byla 0,37 relapsu za rok (tab. 2).
V prvním roce po zahájení léčby klesla roční četnost relapsů o 71 % – z 1,21 na 0,35 relapsu za rok oproti poslednímu roku. V dalších letech se roční četnost relapsů dále mírně snižovala až do devátého roku, kdy ve sledované skupině nebyl zaznamenán žádný relaps. V desátém roce léčby opět stoupla četnost relapsů na 0,29. Průměrná roční četnost relapsů po celou dobu léčby u celého souboru byla 0,37 relapsu za rok (tab. 2).
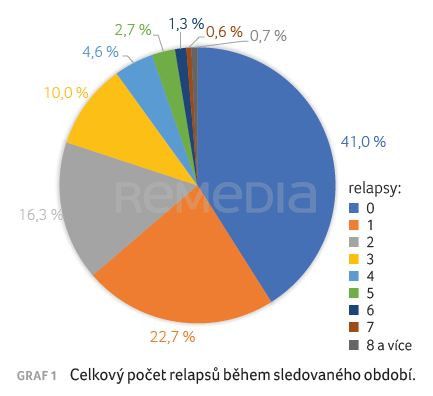 Během celého sledovaného období zůstalo 41 % pacientů bez relapsu. Celkem 22,7 % pacientů prodělalo během léčby jeden relaps, 16,3 % dva relapsy, 10 % pacientů tři relapsy a zbylých 10 % pacientů mělo čtyři a více relapsů (graf 1).
Během celého sledovaného období zůstalo 41 % pacientů bez relapsu. Celkem 22,7 % pacientů prodělalo během léčby jeden relaps, 16,3 % dva relapsy, 10 % pacientů tři relapsy a zbylých 10 % pacientů mělo čtyři a více relapsů (graf 1).
Změna skóre EDSS
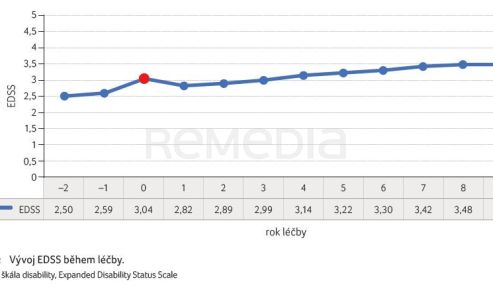
 Průměrné vstupní skóre EDSS celého souboru pacientů bylo 3,04. Během prvního roku léčby klesla hodnota průměrného EDSS na 2,82 a až do konce třetího roku léčby zůstala nižší, než byla hodnota vstupního EDSS (tab. 3). Do konce devátého roku léčby se zvýšilo průměrné EDSS na 3,48 bodu, tedy o necelý půlbod ve srovnání s průměrnou vstupní hodnotou. Průměrné skóre EDSS celé skupiny dva roky před zahájením léčby bylo 2,5 a jeden rok před léčbou 2,59 (graf 2).
Průměrné vstupní skóre EDSS celého souboru pacientů bylo 3,04. Během prvního roku léčby klesla hodnota průměrného EDSS na 2,82 a až do konce třetího roku léčby zůstala nižší, než byla hodnota vstupního EDSS (tab. 3). Do konce devátého roku léčby se zvýšilo průměrné EDSS na 3,48 bodu, tedy o necelý půlbod ve srovnání s průměrnou vstupní hodnotou. Průměrné skóre EDSS celé skupiny dva roky před zahájením léčby bylo 2,5 a jeden rok před léčbou 2,59 (graf 2).
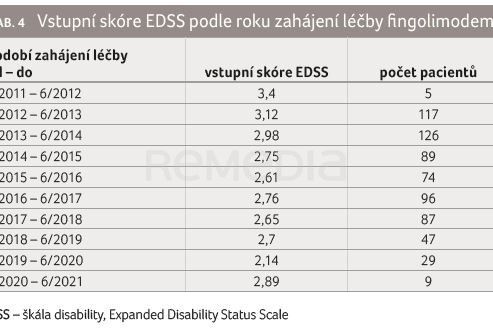
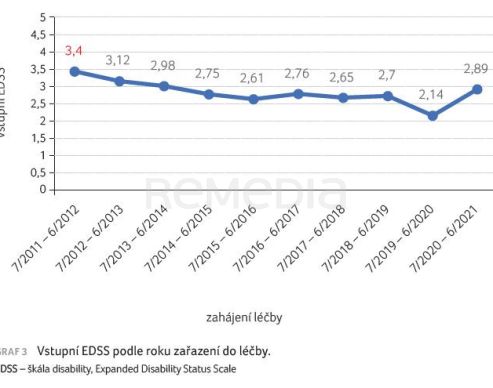
 V rámci analýzy jsme se zaměřili také na to, s jakým vstupním EDSS jsme zařazovali pacienty v jednotlivých letech léčby (tab. 4). Zatímco v prvního hodnoceném roce od července 2011 do června 2012 jsme zařadili pacienty s průměrným EDSS 3,4 a v následujícím roce s EDSS 3,12, dále už měli nemocní zahajující léčbu fingolimodem průměrné EDSS nižší než 3 s tendencí k nižším hodnotám v následujících letech (graf 3).
V rámci analýzy jsme se zaměřili také na to, s jakým vstupním EDSS jsme zařazovali pacienty v jednotlivých letech léčby (tab. 4). Zatímco v prvního hodnoceném roce od července 2011 do června 2012 jsme zařadili pacienty s průměrným EDSS 3,4 a v následujícím roce s EDSS 3,12, dále už měli nemocní zahajující léčbu fingolimodem průměrné EDSS nižší než 3 s tendencí k nižším hodnotám v následujících letech (graf 3).
Diskuse
 Dlouhodobá klinická účinnost fingolimodu v léčbě aktivní RR‑RS byla ověřena dvěma pilotními klinickými studiemi a dále mnoha studiemi z reálné klinické praxe. Naše studie zahrnovala pacienty z reálné klinické praxe, kteří zahájili léčbu na základě úhradových kritérií zdravotních pojišťoven. V době uvedení fingolimodu na náš trh byly podmínkou pro eskalaci z léků první linie nejméně dvě ataky, po čase se toto kritérium zmírnilo na pouze jednu ataku na původní léčbě. Tento fakt odráží demografická data pacientů z české národní studie GOLEMS a její extenze, jejichž vstupní četnost relapsů v posledním roce před zahájením léčby byla 1,6 (medián 2,0) a vstupní EDSS 3,4 (medián 3,5) [10]. Průměrná roční četnost relapsů poslední rok před zahájením léčby fingolimodem v naší skupině již byla nižší (1,21), což je dáno možností v posledních letech eskalovat pacienty po jedné atace na chorobu modifikující léčbě. Současně vstupní EDSS v naší skupině je 3,04, tedy nižší oproti souboru pacientů ze studie GOLEMS, kteří byli zařazováni podle starších úhradových kritérií.
Dlouhodobá klinická účinnost fingolimodu v léčbě aktivní RR‑RS byla ověřena dvěma pilotními klinickými studiemi a dále mnoha studiemi z reálné klinické praxe. Naše studie zahrnovala pacienty z reálné klinické praxe, kteří zahájili léčbu na základě úhradových kritérií zdravotních pojišťoven. V době uvedení fingolimodu na náš trh byly podmínkou pro eskalaci z léků první linie nejméně dvě ataky, po čase se toto kritérium zmírnilo na pouze jednu ataku na původní léčbě. Tento fakt odráží demografická data pacientů z české národní studie GOLEMS a její extenze, jejichž vstupní četnost relapsů v posledním roce před zahájením léčby byla 1,6 (medián 2,0) a vstupní EDSS 3,4 (medián 3,5) [10]. Průměrná roční četnost relapsů poslední rok před zahájením léčby fingolimodem v naší skupině již byla nižší (1,21), což je dáno možností v posledních letech eskalovat pacienty po jedné atace na chorobu modifikující léčbě. Současně vstupní EDSS v naší skupině je 3,04, tedy nižší oproti souboru pacientů ze studie GOLEMS, kteří byli zařazováni podle starších úhradových kritérií.
 Ve studii GOLEMS, resp. v její extenzi byly prokázány jako významné rizikové faktory relapsu věk, hodnota vstupního EDSS a počet relapsů v posledních dvou letech. S každým nárůstem o jeden bod ve vstupním EDSS klesala pravděpodobnost, že pacient nebude mít relaps, o 20 %, a pokud byl počet relapsů v předchozích dvou letech vyšší o jeden relaps, šance zůstat bez relapsu po čtyřech letech léčby klesla o 30 %. Z pacientů, kteří měli vstupní EDSS ≤ 3, zůstalo bez relapsu 41,7 %, z pacientů se vstupním EDSS > 3 jich nemělo za čtyři roky léčby relaps jen 25,9 %. V našem souboru bylo po celou dobu léčby bez relapsu 41 % pacientů (průměrná doba sledování 4,75 roku), což se při průměrném vstupním EDSS 3,04 zcela shoduje s výsledky studie GOLEMS.
Ve studii GOLEMS, resp. v její extenzi byly prokázány jako významné rizikové faktory relapsu věk, hodnota vstupního EDSS a počet relapsů v posledních dvou letech. S každým nárůstem o jeden bod ve vstupním EDSS klesala pravděpodobnost, že pacient nebude mít relaps, o 20 %, a pokud byl počet relapsů v předchozích dvou letech vyšší o jeden relaps, šance zůstat bez relapsu po čtyřech letech léčby klesla o 30 %. Z pacientů, kteří měli vstupní EDSS ≤ 3, zůstalo bez relapsu 41,7 %, z pacientů se vstupním EDSS > 3 jich nemělo za čtyři roky léčby relaps jen 25,9 %. V našem souboru bylo po celou dobu léčby bez relapsu 41 % pacientů (průměrná doba sledování 4,75 roku), což se při průměrném vstupním EDSS 3,04 zcela shoduje s výsledky studie GOLEMS.
Desetiletá data, stejně jako v naší studii, uvádí např. práce publikovaná v roce 2019 (studie LONGTERMS), jež hodnotila bezpečnost a účinnost léčby fingolimodem u pacientů léčených původně ve studii FREEDOMS, kteří pokračovali v léčbě až 14 let v extenzi tohoto klinického hodnocení [11]. Po dvou letech léčby ve studii FREEDOMS měli pacienti roční četnost relapsů 0,22 a tato dále klesla na 0,17 po 10 letech léčby. V desátém roce léčby zůstávalo stále 45,5 % pacientů bez relapsu. Průměrné skóre EDSS vzrostlo během 10 let sledování o 0,4 bodu.
Výsledky z pěti let prospektivního sledování v reálné klinické praxi poskytla studie PANGAEA německých autorů publikovaná v roce 2022 [12]. Průměrný věk 4 067 sledovaných pacientů byl 39 let při zahájení léčby, vstupní EDSS 3,0 a roční četnost relapsů v posledním roce 1,5. Průměrná délka sledování činila 3,3 roku. Roční četnost relapsů klesla na 0,42 po prvním roce léčby a na 0,21 v pátém roce léčby. Průměrné EDSS na konci sledování vzrostlo pouze o 0,1 bodu na 3,1.
Extenze pilotních studií i další dvě studie z reálné klinické praxe ve shodě s naším pozorováním ukazují, že léčba fingolimodem vede k dlouhodobému potlačení klinické aktivity nemoci a u 40 % pacientů se až po 10 let léčby nevyskytne žádný relaps. Současně studie PANGAEA a naše studie shodně ukazují, že první čtyři roky léčby zůstává hodnota průměrného EDSS stabilní, resp. s minimálním nárůstem o 0,1 bodu, v naší studii byl navíc v prvních třech letech pozorován pokles v průměrném EDSS, ale v dalších letech má tendenci k velmi pozvolnému nárůstu o celkově 0,4 bodu za 10 let (LONGTERMS a naše studie). V extenzi studie GOLEMS vidíme o něco větší nárůst 0,2–0,3 bodu během čtyř let sledování, což může být dáno vyšší hodnotou vstupního EDSS a vyšší vstupní roční četností relapsů. Pokud ale vezmeme v úvahu, že v průběhu posledních dvou let před zahájením léčby se průměrné EDSS zvýšilo o 0,54 bodu a o zhruba stejnou hodnotu se EDSS zvýšilo během léčby fingolimodem za 10 let, je zřejmé, že progresi neurologického deficitu se terapií podařilo výrazně zpomalit.
Pozvolný nárůst neurologického postižení i přes velmi nízkou četnost relapsů po čtvrtém roce léčby může být způsoben tzv. progresí nezávislou na relapsech (progression independent of relapse activity, PIRA), která není dostatečně ovlivněna dlouhodobou léčbou fingolimodem. Otázkou zůstává, zda by dřívější zahájení léčby fingolimodem při nižším skóre EDSS nebo hned v časné fázi nemoci při známkách nepříznivé prognózy choroby, jako jsou indikovány ostatní vysoce účinné léky, vedlo k lepší stabilizaci RS a k potlačení setrvalé progrese disability.
Významným limitem naší studie jsou chybějící data o bezpečnosti léčby, která však v době zahájení léčby fingolimodem nebyla prospektivně sbírána a ve zdrojové databázi nejsou k dispozici.
Závěr
Léčba fingolimodem vedla k dlouhodobému významnému potlačení aktivity nemoci a ke zpomalení progrese neurologického deficitu u dospělých pacientů s aktivní relabující‑remitující roztroušenou sklerózou až po dobu deseti let. I přes trvající nepřítomnost klinické aktivity dochází zhruba od pátého roku léčby k velmi pozvolnému nárůstu neurologického postižení, které může být zapříčiněno tzv. progresí nezávislou na relapsech, jež není léčbou fingolimodem dostatečně ovlivněna.
MUDr. Veronika Tichá, Ph.D.
Neurologická klinika a Centrum klinických neurověd 1. LF UK a VFN
Kateřinská 30, 120 00 Praha 2
e-mail: Veronika.Ticha@vfn.cz
Literatura
[1] Ward M, Goldman MD. Epidemiology and Pathophysiology of Multiple Sclerosis. Continuum (Minneap Minn) 2022; 28: 988–1005.
[2] Tremlett H, Munger KL, Makhani N. The Multiple Sclerosis Prodrome: Evidence to Action. Front Neurol 2022; 12: 761408.
[3] Cohen JA, Chun J. Mechanisms of fingolimod’s efficacy and adverse effects in multiple sclerosis. Ann Neurol 2011; 69: 759–777.
[4] Hla T, Brinkmann V. Sphingosine 1‑phosphate (S1P): Physiology and the effects of S1P receptor modulation. Neurology 2011; 76(8 Suppl 3): S3–8.
[5] Kappos L, Radue EW, O’Connor P, et al. A placebo‑controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387–401.
[6] Cohen JA, Barkhof F, Comi G, et al. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402–415.
[7] Community register of medicinal products for human use: Product information Gilenya. [online]. Dostupné na: http:// ec.europa.eu/health/documents/community‑register/html/ h677.htm
[8] Souhrn údajů o přípravku Gilenya 0,5mg. [online]. Dostupné na: http://www.sukl.cz/ modules/medication/detail.php?code=0168462&tab =prices
[9] Singer BA. Fingolimod for the treatment of relapsing multiple sclerosis. Expert Rev Neurother 2013; 13: 589–602.
[10] Tichá V, Počíková Z, Vytlačil J, Štěpánová R. Real‑world effectiveness and safety of fingolimod in patients with multiple sclerosis in the Czech Republic: results from core and extension parts of the GOLEMS study up to 48 months. BMC Neurol 2022; 22: 143.
[11] Cohen JA, Tenebaum N, Bhatt A, et al. Extended treatment with fingolimod for relapsing multiple sclerosis: the 14‑year LONGTERMS study results. Ther Adv Neurol Disord 2019; 12: 1756286419878324.
[12] Ziemssen T, Lang M, Schmidt S, et al.; PANGAEA study group. Long‑term real‑world effectiveness and safety of fingolimod over 5 years in Germany. Neurol 2022; 269: 3276–3285.