Efektivní léčba subkutánním biosimilárním infliximabem
Souhrn
Stumpfová A. Efektivní léčba subkutánním biosimilárním infliximabem. Remedia 2024; 34: 42–46.
Během posledních dvou desetiletí došlo k významnému posunu v léčebných možnostech středně a velmi závažných forem psoriázy. V návaznosti na hlubší vědecké poznatky o patofyziologii tohoto kožního onemocnění se rozvíjí biologická léčba. Prvním biologickým lékem zaměřeným proti jedné z nejdůležitějších molekul v psoriatickém zánětlivém stavu – tumor nekrotizujícímu faktoru alfa – je infliximab. Po vypršení patentové ochrany byla vyvinuta jeho biologicky podobná varianta – biosimilární infliximab. Tato kazuistika pojednává o mladém muži s psoriázou dlouhodobě léčeném dvojkombinací infliximabu a metotrexátu. Záměna originálního biologika za biosimilární přípravek a změna způsobu podávání vedly u pacienta ke zhojení reziduálních ložisek psoriázy rezistentních na léčbu a k vysazení metotrexátu.
Klíčová slova: biologická léčba – infliximab – biosimilární přípravek – subkutánní aplikace.
Summary
Stumpfova A. Effective treatment with subcutaneous biosimilar infliximab. Remedia 2024; 34: 42–46.
Over the last two decades, there has been a significant shift in the treatment options for moderate to severe forms of psoriasis. Biological therapies are being developed in response to deeper scientific knowledge of the pathophysiology of this skin disease. The first biologic drug to target one of the most important molecules in psoriatic inflammation, tumor necrosis factor alpha, is infliximab. After its patent protection expired, a biosimilar infliximab, was developed. This case report describes a young man with psoriasis, treated for a long time with a dual combination of infliximab and methotrexate, in whom substitution of the original biologic for its biosimilar led to healing of residual, treatment‑resistant psoriasis lesions and discontinuation of methotrexate.
Key words: biological treatment – infliximab – biosimilars – subcutaneous administration.
Úvod
Biologický lék (biologikum) je látka většinou bílkovinné povahy vyrobená biotechnologickými metodami [1], jejíž molekula je obvykle větší a složitější než u jiných typů léčivých přípravků. Svým imunomodulačním účinkem působí na konkrétní struktury v organismu. Biosimilární přípravek je také biologický léčivý přípravek, který ale ve vztahu k referenčnímu není jeho přesnou kopií, protože v případě biotechnologické výroby nelze zajistit úplnou shodu ve struktuře vyvíjené látky [1]. Jedná se o variantu originálního léčiva, která vykazuje určitou strukturální variabilitu. Příslušným testováním v preklinických a klinických studiích je prokázána dostatečná podobnost v biologické aktivitě, klinické účinnosti a bezpečnosti s přípravkem již schváleným autoritami [1,2]. Takový biosimilární přípravek proto může být následně schválen pro všechny již registrované indikace originálního léku. Výhodou biosimilárních přípravků jsou nižší ekonomické náklady na léčbu [1], a tudíž rozšíření terapeutických možností pro pacienty. V některých případech může biosimilární přípravek nabídnout jinou formu aplikace a poskytnout tak individuálnější přístup k léčbě.
Prvním biologickým lékem indikovaným nejen v terapii psoriázy, ale i psoriatické artritidy, dalších artritid a idiopatických střevních zánětů je chimérická (ze 75 % lidská, z 25 % myší) monoklonální protilátka IgG1 infliximab [2], která se s vysokou afinitou váže na rozpustné a transmembránové formy tumor nekrotizujícího faktoru alfa (TNFα) [3]. TNFα je klíčový prozánětlivý cytokin, který je uvolňován mnoha typy buněk včetně keratinocytů a podílí se na vzniku různých zánětlivých chorob včetně psoriázy [3]. Při zánětlivém procesu se TNFα váže na receptory TNFR1 a TNFR2 a stimuluje produkci prozánětlivých interleukinů (IL) – IL‑1β, IL‑6, IL‑8, faktoru stimulujícího kolonii granulocytů a makrofágů (GM‑CSF) a prostaglandinu E. Dále stimuluje expresi endoteliálních adhezních molekul na endotelu (ICAM‑1, VCAM‑1, E‑selektin) a uvolnění chemokinů (MCP‑1, MIP‑2, RANTES a MIP‑1 alfa). Dochází k migraci neutrofilů do cílového orgánu, ke stimulaci fagocytózy a ke zvýšení syntézy C‑reaktivního proteinu v játrech [4]. Infliximab se s vysokou afinitou a specificitou váže na TNFα, inhibuje jeho aktivitu a tlumí tak zánětlivý stav. Podává se pomalou infuzí, v indikaci psoriázy v dávce 5 mg/kg 1× za 8 týdnů, je možné jej podávat dlouhodobě.
Infliximabu (originální přípravek RemicadeÒ) vypršela jako první monoklonální protilátce v Evropské unii patentová ochrana. Evropskou lékovou agenturou byl v září 2013 schválen přípravek CT‑P13 společnosti Celltrion, biologicky podobná molekula, v České republice uvedená pod obchodním názvem RemsimaÒ. Registrován byl ve všech indikacích jako originální přípravek. V indikaci psoriázy se podává v dávce 5 mg/kg intravenózně (i.v.) 1× za 8 týdnů. V roce 2019 byla uvedena nová forma podávání přípravku RemsimaÒ. V současné době je možné jej aplikovat také subkutánně. Po indukční fázi intravenózní aplikace infliximabu 5 mg/kg v týdnu 0 a 2 se od 6. týdne může trvale pokračovat v podávání udržovací dávky 120 mg subkutánně (s.c.).
Popis případu
Pacient je muž, 36 let, u kterého se psoriáza objevila v jeho 15 letech, tj. v roce 2002, bez kloubního postižení. V rodinné anamnéze trpí stejným kožním onemocněním strýc z matčiny strany. Pacient neuvádí žádnou alergii, chronicky se s ničím neléčí, dlouhodobě je dispenzarizován na urologii pro mírnou mikroskopickou hematurii. Má také zvýšenou hodnotu antigliadinových protilátek bez klinické manifestace celiakie. V dětství prodělal adenotomii a později exstirpaci krčních lymfatických uzlin pro lymfadenopatii, bez nálezu malignity.
Projevy psoriázy byly v době prvních výsevů lokalizovány ve kštici, s rychlou generalizací během dalších dvou let. Nejdříve byl léčen u spádového dermatologa lokální léčbou, celotělovou fototerapií UVB 311 nm a od března 2007 tříměsíční celkovou léčbou acitretinem (dávkování si nepamatoval). Vše bylo bez efektu, při podávání acitretinu byla navíc zaznamenána elevace hodnot jaterních testů. Začátkem roku 2008 proběhlo první vyšetření na naší ambulanci (PASI [Psoriasis Area and Severity Index] 14,2, BSA [Body Surface Area] 25). Od února 2008 byla zahájena celková léčba cyklosporinem v dávce 2,5–3 mg/kg denně, ukončena po osmi měsících užívání pro nedostatečný účinek a kolísání hladin cyklosporinu v séru (v současné době se toto vyšetření běžně jako monitoring léčby nepoužívá).
V listopadu 2008 dostal pacient svou první biologickou léčbu – efalizumab v dávce 0,9 mg/kg s.c. 1× týdně. Z důvodu pozastavení registrace léčivého přípravku v Evropské unii byla v dubnu 2009 terapie efalizumabem ukončena. I přesto docházelo k progresi kožního nálezu s hodnotou PASI 19,8 při ukončení léčby. Od května 2009 byla zahájena léčba adalimumabem v udržovací dávce 40 mg s.c. 1× za 14 dní. Po šesti měsících pro pokles účinku (při PASI 15,6, BSA 20) byl do medikace přidán metotrexát (MTX) v dávce 7,5 mg týdně. Po přechodném zlepšení bylo při další progresi projevů psoriázy rozhodnuto o záměně adalimumabu za infliximab. Metotrexát byl vzhledem k tíži onemocnění a dobré toleranci ponechán.
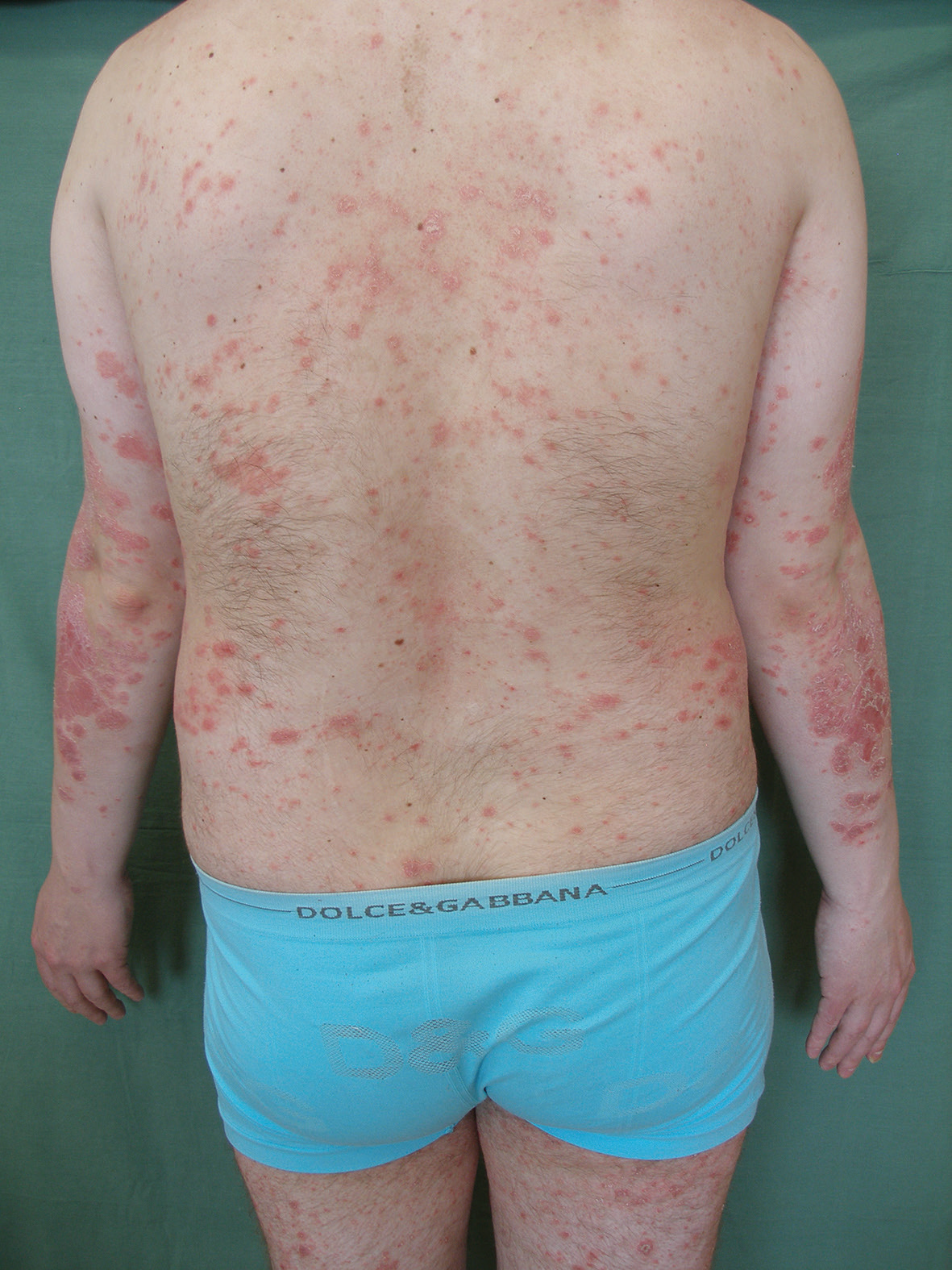
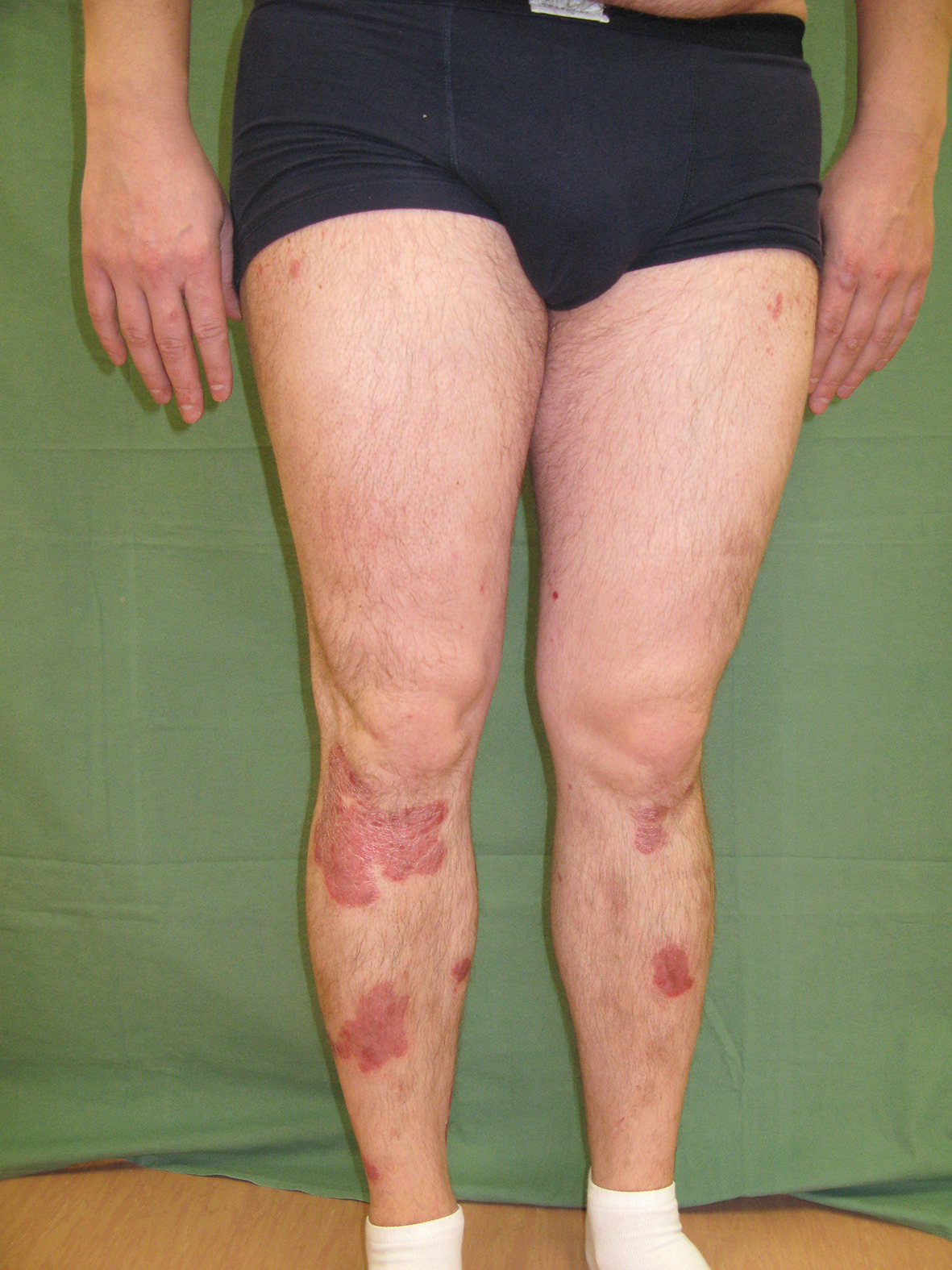
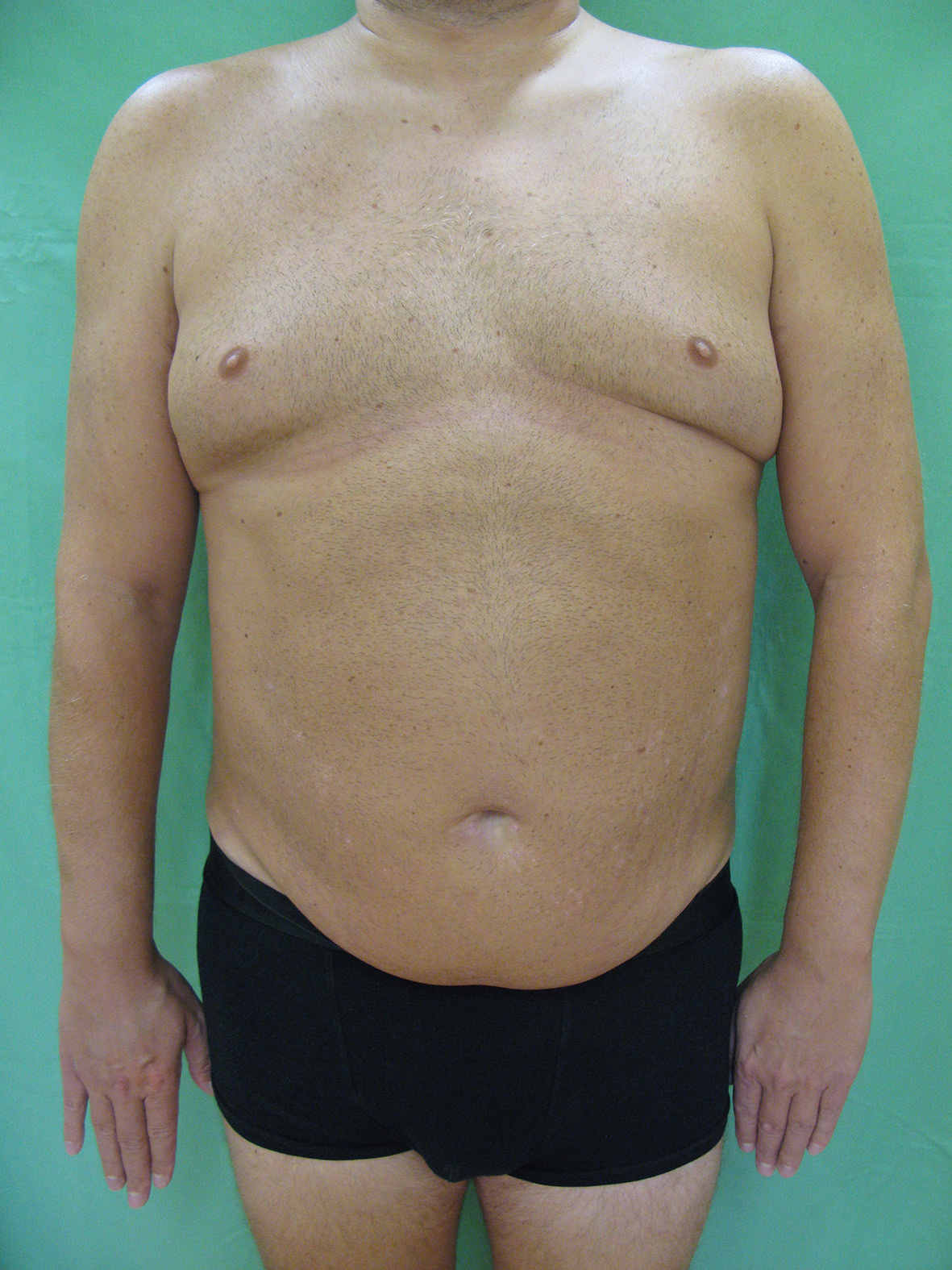
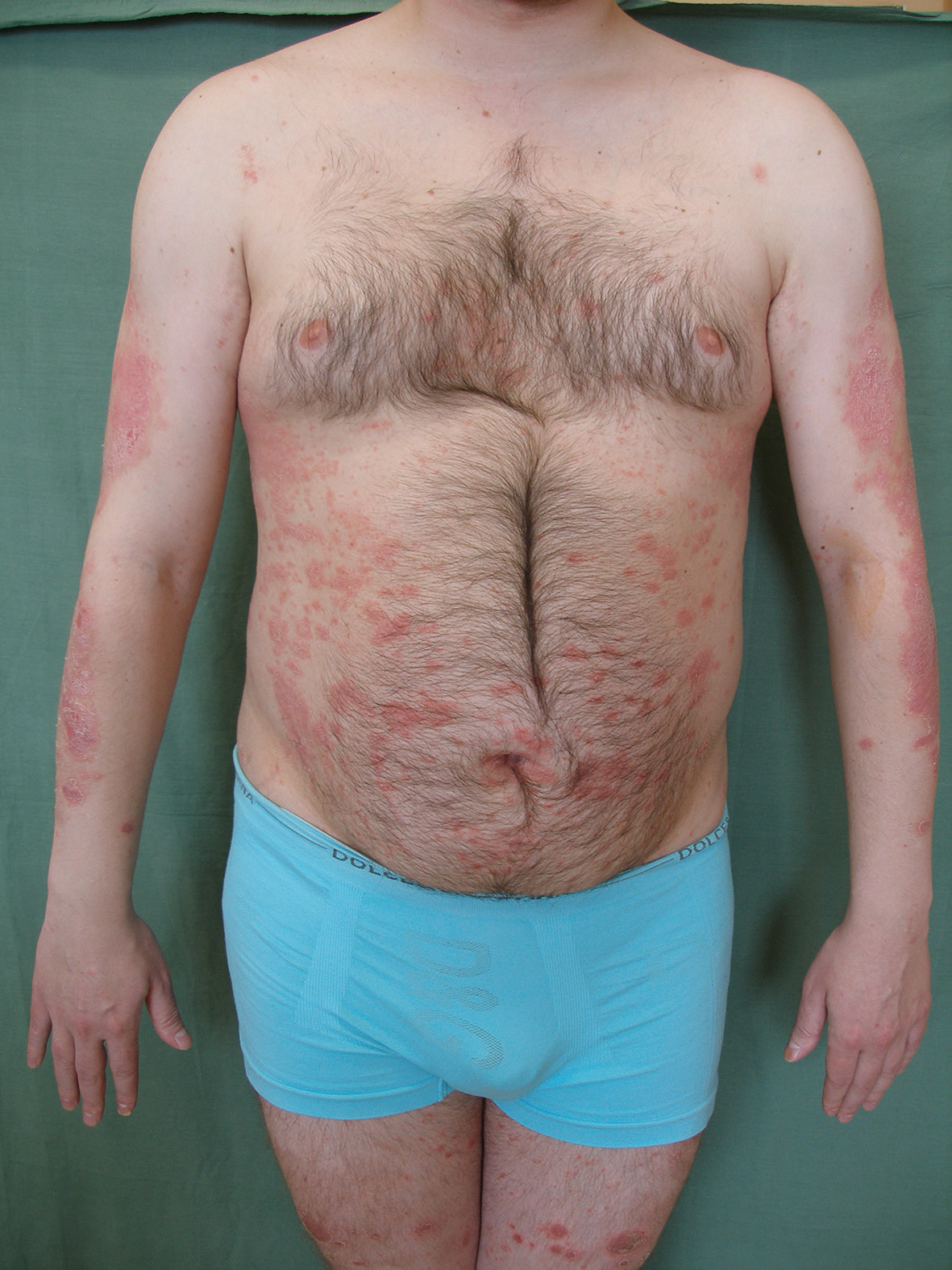 Dne 9. března 2010 byla podána první infuze infliximabu ve standardním dávkování. Jako premedikace byl před každou infuzí podán prednison 20 mg perorálně (p.o.) a desloratadin 5 mg p.o. k prevenci reakcí souvisejících s infuzí. Infuze byly nejdříve podávány za hospitalizace na lůžkové části, později v ambulantním sektoru při jednodenním pobytu na našem oddělení. Při zahájení léčby se psoriáza ve formě numulárních až mapovitých ložisek se střední intenzitou erytému, infiltrace i deskvamace vyskytovala na trupu, končetinách a ve kštici (PASI 10,2, obr. 1, 2). Léčbou dvojkombinací infliximabem a MTX se konečně podařilo dostat onemocnění pod kontrolu, i když kožní nález během dalších 12 let zcela zhojen nikdy nebyl. Intermitentně docházelo k výkyvům aktivity psoriázy, skóre PASI se pohybovalo v rozmezí 0,5–4,6 (tj. PASI 50–PASI 90, zhojení o 50–90 % oproti stavu před zahájením) za hodnot Dermatologického indexu kvality života (DLQI) < 5 (obr. 3, 4). Dávkování MTX se měnilo podle výskytu kožních projevů od 2,5 mg týdně při zlepšení až po maximální dávku 7,5 mg týdně při recidivách psoriázy. Infliximab tudíž nebylo zapotřebí vysazovat.
Dne 9. března 2010 byla podána první infuze infliximabu ve standardním dávkování. Jako premedikace byl před každou infuzí podán prednison 20 mg perorálně (p.o.) a desloratadin 5 mg p.o. k prevenci reakcí souvisejících s infuzí. Infuze byly nejdříve podávány za hospitalizace na lůžkové části, později v ambulantním sektoru při jednodenním pobytu na našem oddělení. Při zahájení léčby se psoriáza ve formě numulárních až mapovitých ložisek se střední intenzitou erytému, infiltrace i deskvamace vyskytovala na trupu, končetinách a ve kštici (PASI 10,2, obr. 1, 2). Léčbou dvojkombinací infliximabem a MTX se konečně podařilo dostat onemocnění pod kontrolu, i když kožní nález během dalších 12 let zcela zhojen nikdy nebyl. Intermitentně docházelo k výkyvům aktivity psoriázy, skóre PASI se pohybovalo v rozmezí 0,5–4,6 (tj. PASI 50–PASI 90, zhojení o 50–90 % oproti stavu před zahájením) za hodnot Dermatologického indexu kvality života (DLQI) < 5 (obr. 3, 4). Dávkování MTX se měnilo podle výskytu kožních projevů od 2,5 mg týdně při zlepšení až po maximální dávku 7,5 mg týdně při recidivách psoriázy. Infliximab tudíž nebylo zapotřebí vysazovat.
 Ačkoliv pacient celkovou léčbu snášel bez obtíží, byli jsme si vědomi možných nežádoucích účinků dlouhodobé léčby MTX. Při pokusu o úplné vysazení MTX v dobách ústupu psoriázy došlo vždy k rychlé progresi ložisek a k nutnosti opětovného nasazení MTX. Pravidelně byl při celkové léčbě pacient dispenzarizován na plicní a gastroenterologické ambulanci, bez průkazu patologie.
Ačkoliv pacient celkovou léčbu snášel bez obtíží, byli jsme si vědomi možných nežádoucích účinků dlouhodobé léčby MTX. Při pokusu o úplné vysazení MTX v dobách ústupu psoriázy došlo vždy k rychlé progresi ložisek a k nutnosti opětovného nasazení MTX. Pravidelně byl při celkové léčbě pacient dispenzarizován na plicní a gastroenterologické ambulanci, bez průkazu patologie.
 Od 12. července 2022 byla z důvodu rozhodnutí managementu nemocnice provedena záměna originálního infliximabu za jeho biosimilární přípravek RemsimaÒ (PASI 4,4 a DLQI 0, MTX 5 mg týdně). Pacient se záměnou přípravků souhlasil. V intravenózní aplikaci biosimilárního infliximabu se pokračovalo ve stejném dávkování. Od 1. listopadu 2022 bylo podávání po pacientově souhlasu změněno na subkutánní formu (v tento den PASI 3,4, DLQI 1). Biosimilární infliximab byl aplikován v dávce 120 mg s.c. a dále každých 14 dní. Aplikace injekcí po zaučení zvládá sám. Již ve 4. týdnu po změně formy aplikací bylo patrno zmírnění kožních projevů (PASI 2,8), v 16. týdnu (při PASI 1,0) pokračováno v terapii. V 19. týdnu pacient MTX pro minimální kožní nález zcela vysadil, dosud pokračuje pouze se subkutánním biosimilárním infliximabem. Ke kompletnímu zhojení psoriatických ložisek (PASI 0) došlo ve 40. týdnu (obr. 5), tento stav přetrvává i přes trvalé vysazení MTX. Switch i následnou biosimilární léčbu absolvuje bez obtíží, nežádoucí reakce se dosud neobjevily. Pacient se po celou dobu léčby na našem oddělení ke svému kožnímu onemocnění staví velmi statečně, převedení na subkutánní formu aplikací mu však umožnilo žít svůj život svobodněji než doposud. Významně se zredukoval počet užívaných systémových léků. Léčba MTX byla ukončena a již není potřeba každých osm týdnů podávat profylaktické dávky kortikosteroidů a antihistaminik. Kůže je při monoterapii biosimilárním infliximabem trvale zcela zhojena. Převedením na subkutánní podávání se také snížila četnost návštěv a délka kontrol na našem oddělení.
Od 12. července 2022 byla z důvodu rozhodnutí managementu nemocnice provedena záměna originálního infliximabu za jeho biosimilární přípravek RemsimaÒ (PASI 4,4 a DLQI 0, MTX 5 mg týdně). Pacient se záměnou přípravků souhlasil. V intravenózní aplikaci biosimilárního infliximabu se pokračovalo ve stejném dávkování. Od 1. listopadu 2022 bylo podávání po pacientově souhlasu změněno na subkutánní formu (v tento den PASI 3,4, DLQI 1). Biosimilární infliximab byl aplikován v dávce 120 mg s.c. a dále každých 14 dní. Aplikace injekcí po zaučení zvládá sám. Již ve 4. týdnu po změně formy aplikací bylo patrno zmírnění kožních projevů (PASI 2,8), v 16. týdnu (při PASI 1,0) pokračováno v terapii. V 19. týdnu pacient MTX pro minimální kožní nález zcela vysadil, dosud pokračuje pouze se subkutánním biosimilárním infliximabem. Ke kompletnímu zhojení psoriatických ložisek (PASI 0) došlo ve 40. týdnu (obr. 5), tento stav přetrvává i přes trvalé vysazení MTX. Switch i následnou biosimilární léčbu absolvuje bez obtíží, nežádoucí reakce se dosud neobjevily. Pacient se po celou dobu léčby na našem oddělení ke svému kožnímu onemocnění staví velmi statečně, převedení na subkutánní formu aplikací mu však umožnilo žít svůj život svobodněji než doposud. Významně se zredukoval počet užívaných systémových léků. Léčba MTX byla ukončena a již není potřeba každých osm týdnů podávat profylaktické dávky kortikosteroidů a antihistaminik. Kůže je při monoterapii biosimilárním infliximabem trvale zcela zhojena. Převedením na subkutánní podávání se také snížila četnost návštěv a délka kontrol na našem oddělení.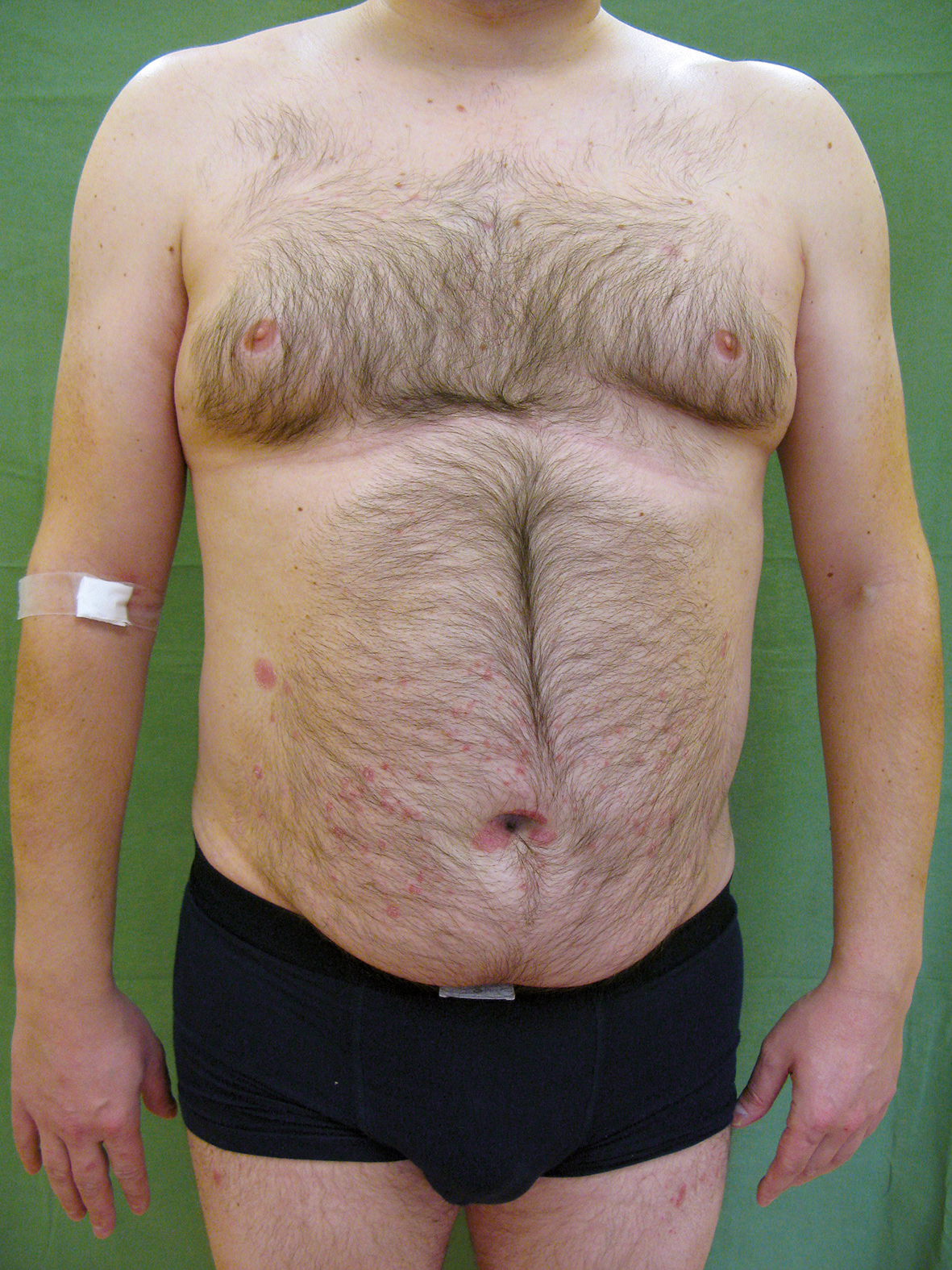
Diskuse
 Infliximab je možné podávat dlouhodobě intravenózně v osmitýdenních intervalech. Při zahájení, ale i kdykoliv jindy během léčby se mohou objevit tzv. infuzní reakce. Většinou jsou mírné nebo střední intenzity, pouze 1 % reakcí je závažných [3,4]. Reakce mohou být akutní s výskytem během podávání nebo opožděné (s latencí 1–14 dní po infuzi). U akutních se jedná jak o klasické alergické IgE mediované reakce anafylaktického typu (hypotenze, dušnost, dechové potíže, bronchospasmus, otok hrtanu, urtikarie, erytém obličeje), tak o častější, méně závažné tzv. anafylaktoidní reakce bez IgE mediace (flush, svědění, zimnice, bolest hlavy) [3,4]. Opožděné reakce nastupují s latencí 1–14 dní s možností vzniku imunokomplexů (3. typ imunopatologické reakce). Příznaky se podobají reakcím sérové nemoci (bolesti kloubů, myalgie, únava, febrilie, vyrážka, bolesti hlavy). Profylaktické podávání paracetamolu, antihistaminik nebo kortikosteroidů tlumí tyto nežádoucí účinky [3,4]. Současné užívání MTX nebo azathioprinu je také snižuje, nejspíše vlivem na imunogenitu léku. Až u jedné čtvrtiny pacientů se totiž mohou vytvořit protilátky (anti‑drug antibodies, ADA) proti infliximabu, které dvoj‑ až trojnásobně zvyšují riziko reakcí při léčbě [2] a mohou snižovat účinnost léku inaktivací protizánětlivého biologického efektu podávané terapie [4,5]. Intravenózní aplikace nezajišťuje standardně u všech nemocných stabilní sérovou koncentraci léku a kolísání hladiny infliximabu podporuje vznik ADA [5]. Nedostatek léčiva je také hlavní příčinou ztráty odpovědi na podávanou léčbu [5]. Ukazuje se, že při subkutánní aplikaci infliximabu došlo k významnému snížení tvorby ADA. Lepší imunogenita a farmakokinetika léku mají zásadní dopad na efekt léčby [5].
Infliximab je možné podávat dlouhodobě intravenózně v osmitýdenních intervalech. Při zahájení, ale i kdykoliv jindy během léčby se mohou objevit tzv. infuzní reakce. Většinou jsou mírné nebo střední intenzity, pouze 1 % reakcí je závažných [3,4]. Reakce mohou být akutní s výskytem během podávání nebo opožděné (s latencí 1–14 dní po infuzi). U akutních se jedná jak o klasické alergické IgE mediované reakce anafylaktického typu (hypotenze, dušnost, dechové potíže, bronchospasmus, otok hrtanu, urtikarie, erytém obličeje), tak o častější, méně závažné tzv. anafylaktoidní reakce bez IgE mediace (flush, svědění, zimnice, bolest hlavy) [3,4]. Opožděné reakce nastupují s latencí 1–14 dní s možností vzniku imunokomplexů (3. typ imunopatologické reakce). Příznaky se podobají reakcím sérové nemoci (bolesti kloubů, myalgie, únava, febrilie, vyrážka, bolesti hlavy). Profylaktické podávání paracetamolu, antihistaminik nebo kortikosteroidů tlumí tyto nežádoucí účinky [3,4]. Současné užívání MTX nebo azathioprinu je také snižuje, nejspíše vlivem na imunogenitu léku. Až u jedné čtvrtiny pacientů se totiž mohou vytvořit protilátky (anti‑drug antibodies, ADA) proti infliximabu, které dvoj‑ až trojnásobně zvyšují riziko reakcí při léčbě [2] a mohou snižovat účinnost léku inaktivací protizánětlivého biologického efektu podávané terapie [4,5]. Intravenózní aplikace nezajišťuje standardně u všech nemocných stabilní sérovou koncentraci léku a kolísání hladiny infliximabu podporuje vznik ADA [5]. Nedostatek léčiva je také hlavní příčinou ztráty odpovědi na podávanou léčbu [5]. Ukazuje se, že při subkutánní aplikaci infliximabu došlo k významnému snížení tvorby ADA. Lepší imunogenita a farmakokinetika léku mají zásadní dopad na efekt léčby [5].
Závěr
Biologická léčba svým cíleným působením na konkrétní struktury prokázala zásadní úspěchy v terapii nejen psoriázy, ale i jiných onemocnění. První monoklonální protilátkou cílenou proti TNFα a také prvním biologickým lékem středně až velmi závažné formy psoriázy je infliximab (RemicadeÒ). Jeho biosimilární přípravek (RemsimaÒ) je prvním biosimilárním anti‑TNFα přípravkem na světě. Zavedením biosimilárních přípravků došlo k významnému snížení nákladů spojených s biologickou léčbou a tím k rozšíření využití těchto vysoce účinných léků mezi širší spektrum pacientů. Záměna biologik a biosimilárních přípravků byla klinickými observačními a prospektivními studiemi, dosavadními publikovanými výsledky i letitou klinickou praxí potvrzena jako bezproblémová [1]. Případnou záměnu přípravků je však vhodné stanovit na základě pečlivého uvážení lékaře v souladu s informovanou diskusí s pacientem s cílem zajistit bezpečnou a účinnou léčbu. V případě našeho pacienta bylo po převedení na subkutánní formu biosimilárního přípravku dosaženo stabilní farmakokinetiky léčiva, což se v klinické praxi projevilo zhojením rezistentních ložisek psoriázy při dostačující monoterapii biosimilárním infliximabem.
MUDr. Alena Stumpfová
Kožní oddělení
Masarykova nemocnice Ústí nad Labem
Sociální péče 3316/12a, 400 11 Ústí nad Labem
e-mail: alena.stumpfova@kzcr.cz
Literatura
[1] Matalová P, Urbánek K. Biosimilární infliximab v pediatrii. Klin Farmakol Farm 2020; 34: 70–73.
[2] Urbánek K. Infliximab. Interní Med 2017; 19: 42–46.
[3] Cetkovská P, Kojanová M, Arenberger P, Fabiánová J. Současný stav moderní léčby psoriázy: aktualizovaná doporučení ČDS JEP k cílené léčbě závažné chronické psoriázy. Čes‑slov Derm 2019; 94: 133–188.
[4] Kirkham B. Tumor necrosis factor‑alpha inhibitors: An overview of adverse effects. UpToDate 2023. Dostupné na: https://www.uptodate.com/contents/tumor‑necrosis‑factor‑alpha‑inhibitors‑an‑overview‑of‑adverse‑effects [cit. 2023‑11‑25]
[5] Souhrn údajů o přípravku Remsima. Dostupné na: https://www.ema.europa.eu/en/documents/product‑information/remsimaepar‑product‑information_en.pdf